Журнал «Здоровье ребенка» 3 (24) 2010
Вернуться к номеру
Морфологические особенности слизистой оболочки желудка при функциональной диспепсии у детей
Авторы: Губина-Вакулик Г.И., Харьковский национальный медицинский университет; Волошин К.В., Харьковская медицинская академия последипломного образования
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье приведены результаты морфологического исследования биоптатов слизистой оболочки желудка у детей с функциональной диспепсией. Обнаружена микроскопическая картина повреждения эпителия и его регенерации; в более тяжелых случаях при снижении регенераторного потенциала появляются признаки интерстициального воспаления.
Дети, функциональная диспепсия, морфология, слизистая оболочка желудка.
Функциональная диспепсия (ФД) является одним из наиболее частых функциональных заболеваний пищеварительной системы в детском возрасте. Вопросами функциональной патологии органов желудочно-кишечного тракта занимается «Комитет по функциональным заболеваниям пищеварительной системы». Результатом работы комитета стали впервые изданные в 1989 году Римские критерии I (РК). В 1999 году были опубликованы РК II , а в 2006 году в результате работы 87 экспертов из 18 стран мира были изданы РК III . В РК рассматриваются вопросы этиологии, патогенеза, клиники, диагностики и терапии функциональных заболеваний пищеварительной системы как взрослых, так и детей [3, 4]. Однако некоторые аспекты функциональных заболеваний неоднозначно трактуются западными и отечественными авторами. Это касается и ФД у детей [1].
Согласно РК III , ФД определяется как комплекс симптомов, относящихся к гастродуоденальной области (чувство переполнения после обычного приема пищи, раннего насыщения, предшествующее завершению обычного приема еды; боль или изжога, локализованные в подложечной области и беспокоящие не меньше одного раза в неделю; отсутствие облегчения после дефекации или связи диспепсии с изменением частоты и формы испражнений) при отсутствии каких-либо органических, системных или метаболических заболеваний, которые могли бы объяснить эти проявления.
В РК III выделены два клинических варианта ФД: постпрандиальный дистресс-синдром (ПДС) ( meal - induced dyspeptic symptoms — PDS ) и синдром эпигастральной боли (СЭБ) ( epigastric pain ) [4, 5].
В соответствии с РК I , II и III к ФД относят эндоскопически определяемую слизистую оболочку желудка (СОЖ) без каких-либо изменений или с наличием поверхностных, преходящих изменений, которые обозначаются как эритематозная гастропатия.
Ключевым в трактовке диагноза ФД является отсутствие морфологических изменений, которые могли бы объяснить клинические проявления заболевания, а эндоскопическое исследование дает возможность лишь исключить деструктивные изменения СОЖ (при наличии которых воспалительный процесс не вызывает сомнений).
Эритематозная гастропатия может быть проявлением как повышенного кровенаполнения сосудов, так и воспалительного процесса в СОЖ. Подтвердить то или иное предположение может лишь морфологическое исследование биоптатов слизистой оболочки [1, 3].
Целью нашей работы было изучение клинико-морфологических особенностей ФД у детей.
Под наблюдением в детском гастроэнтерологическом отделении г. Харькова на базе ГДКБ № 19 находились 79 детей в возрасте 7–17 лет. Все дети были госпитализированы в стационар в периоде обострения заболевания с жалобами и объективными данными, характерными для патологии органов гастродуоденальной зоны. На первом этапе исследования всем детям было проведено эндоскопическое исследование желудка и двенадцатиперстной кишки (ДПК) с целью верификации диагноза и исключения деструктивных изменений верхних отделов желудочно-кишечного тракта. Критериями постановки диагноза ФД (в соответствии с РК) было либо полное отсутствие изменений СОЖ ( n = 20), либо наличие эритематозной гастропатии ( n = 59). При проведении эндоскопического исследования у всех больных были взяты биоптаты СО антрального отдела, тела желудка и ДПК.
После изучения жалоб и объективных данных, все дети были разделены на две клинические группы (в соответствии с РК III ) — ПДС ( n = 37) и СЭБ ( n = 42).
Результаты эндоскопического исследования при различных клинических вариантах ФД представлены в табл. 1.
Как видно из табл. 1, достоверно чаще неизмененная слизистая встречалась при ПДС; эритематозная гастропатия была характерна для СЭБ ( p < 0,05).

Морфологическое исследование биоптатов СОЖ и ДПК проводилось на кафедре патологической морфологии ХНМУ. Для микроскопического исследования были представлены биоптаты СО фундального и антрального отделов желудка, а также ДПК 79 детей. Биоптаты СО зафиксированы в 10% нейтральном формалине, залиты в парафин. Срезы толщиной 5 мкм окрашены гематоксилин-эозином. Микроскопический анализ осуществлен с использованием микроскопа Axiostar - plus ( Zeiss , ФРГ), фотографирование микропрепаратов производили с помощью цифровой фотокамеры
ProgRes C 10 plus .
У детей с эндоскопически неизмененной СО отмечались признаки усиленного повреждения эпителия СО и ускоренной его пролиферации с регенераторной целью. Масштабы повреждения эпителия варьируют: от минимального — повреждены апикальные части эпителиоцитов на верхушках валиков в СО желудка и верхушках ворсинок в СО ДПК — до выраженного — десквамированные эпителиоциты, группы эпителиоцитов обнаруживаются в глубине ямок и в просвете желез (рис. 1).
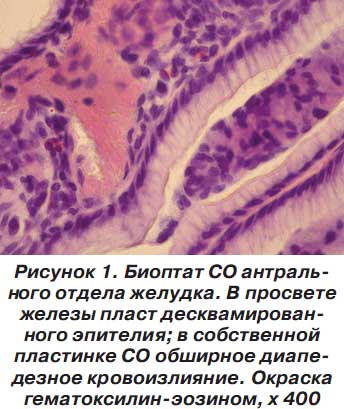
Гиперпролиферирующий эпителий выглядит узким, высоким. Обращаем внимание, что деэпителизированные участки в СО желудка в данной группе случаев отсутствуют. Субэпителиальная собственная пластинка СО отечна, местами с диапедезными кровоизлияниями. В более глубоких слоях собственная пластинка СО очагово или диффузно расширена, инфильтрирована макрофагами и лимфоцитами. В нескольких случаях наблюдался лимфоидный фолликул СО с признаками морфофункциональной активации — наличием крупного светлого центра. У детей с длительным анамнезом заболевания отмечается увеличение содержания фиброцитов в собственной пластинке СО, что можно объяснить завершением прошлых обострений путем постепенного «добавления» интерстициального склероза.
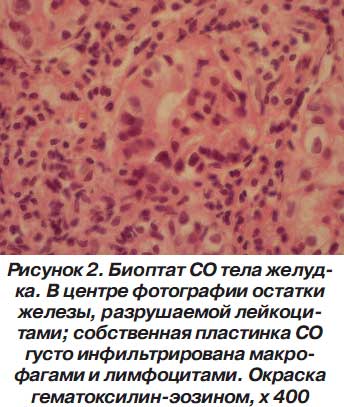
При эндоскопически определяемой эритематозной гастропатии наблюдаются признаки аналогичных процессов, но более выраженные. Эпителий на желудочных валиках и ворсинках ДПК местами уплощен или отсутствует, местами наблюдается его выраженная гиперпролиферация с псевдомногорядным расположением узких, длинных эпителиоцитов. Особое внимание привлекает факт обнаружения участков эпителиального покрова СО желудка и ДПК, лишенных базальной мембраны. Как известно, базальная мембрана эпителиального покрова формируется из белков, синтезируемых эпителиоцитами [2]. В данной ситуации фокальное отсутствие базальной мембраны эпителия СО может быть связано с незрелостью эпителиоцитов вследствие их ускоренной гибели и ускоренного обновления. Фокусы отсутствия базальной мембраны эпителия свидетельствуют о наличии прямого контакта между клетками — производными эктодермы и мезодермы. Формирование во многих органах гематотканевого барьера, обеспечивающего частичную изолированность клеток — производных эктодермы от внутренней среды организма, и последствия повреждения барьера хорошо известны (аутоиммунные органоспецифические заболевания). Можно предположить, что вышеописанная микроскопическая картина с отсутствием базальной мембраны в участках СО желудка и ДПК обеспечивает прямой контакт внутренней среды, иммунной системы с эпителиоцитами, в норме находящимися за «барьером». Субэпителиально в собственно пластинке СО отмечается не только отек, но и полнокровие сосудов микроциркуляторного русла, более объемные диапедезные кровоизлияния, плазматизация. Выраженность макрофагально-лимфоцитарной инфильтрации варьирует, но отчетливо просматривается положительная зависимость густоты макрофагально-лимфоцитарной инфильтрации собственной пластинки СО желудка и ДПК от выраженности феномена отсутствия базальной мембраны эпителия. В нескольких случаях на уровне желез имеется картина агрессии круглоядерных лейкоцитов на железистые эпителиоциты именно в участке отсутствия базальной мембраны (рис. 2).
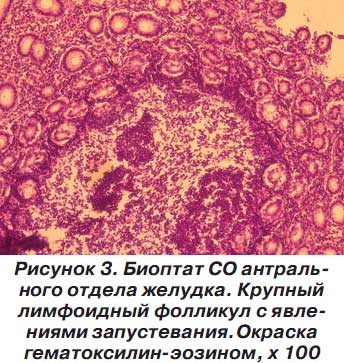
В биоптатах встречаются лимфоидные фолликулы, имеющие признаки морфофункциональной исчерпанности с запустеванием центра фолликула (рис. 3).
Количество фиброцитов и склероз собственной пластинки СО нарастают параллельно увеличению продолжительности заболевания ребенка, хотя, конечно, ни в одном случае нельзя говорить об атрофии СО.
Клеточный состав эпителия желез соответствует локализации взятого биоптата. Особое внимание уделено париетальным клеткам. Увеличенное количество париетальных клеток в СО тела желудка у исследованных больных встречается редко. Чаще можно видеть небольшое их количество, но клетки крупные, с увеличенным, часто эухромным ядром, расположенным по центру клетки. Компенсаторной гипертрофией париетальных клеток можно объяснить обнаруживаемую клинически повышенную кислотообразующую функцию желудка на фоне замедления моторной функции.
Бокаловидные клетки эпителиального покрова СО ДПК по мере нарастания процесса гибели эпителиоцитов встречаются все реже, т.е. слизеобразующая функция СО снижается.
Довольно часто отмечается увеличение количества клеток с прозрачной цитоплазмой, расположенных в слое железистого эпителия. Это клетки, синтезирующие индоламины и моноамины, так называемые апудоциты.
Описанные выше изменения, согласно международным представлениям (РКІІІ), считаются ФД, однако с точки зрения патоморфологии они свидетельствуют о начальных проявлениях хронического гастрита [2].
Выводы
1. Морфологическое исследование СО желудка при ФД у детей свидетельствует о том, что во всех без исключения случаях, вне зависимости от наличия или отсутствия эндоскопических изменений, имеют место морфологические изменения разной степени выраженности. Морфологическим критерием так называемой «функциональности» патологического состояния является ускоренная и достаточная для поддержания целостности покрова пролиферация эпителиоцитов.
2. Можно предположить, что именно морфологически определяемая условная «функциональность» нарушений СО, соответствующая обычно эндоскопически неизмененной СОЖ и проявляющаяся клинически преимущественно нарушением моторной функции желудка, характеризует группу больных ПДС.
3. С течением времени при отсутствии адекватной терапии морфологические изменения СО становятся более выраженными, способность к регенерации СО значительно снижается, становясь недостаточной в некоторые периоды, что клинически проявляется преимущественно болевым синдромом. Такие дети должны быть отнесены к группе СЭБ.
4. Дифференциальная диагностика ФД и хронического гастрита должна основываться исключительно на результатах морфологического исследования, так как эритематозная гастропатия, выявляемая эндоскопически, может встречаться как при ФД, так и при хроническом недеструктивном гастрите.
1. Белоусов Ю.В., Белоусова О.Ю. Функциональные заболевания пищеварительной системы у детей: Монография. — Харьков: ИД «ИНЖЭК», 2005. — 256 с.
2. Хэм Л., Кормак Д. Гистология: В 4 т. — Москва: Мир, 1982–1983. — Т. 4.
3. Пиманов С.И., Силивончик Н.Н. Римский III консенсус: Избранные разделы и комментарии. Пособие для врачей. — Витебск: Издательство ВГМУ, 2006. — 256 с.
4. Drossman D.A. The functional gastrointestinal disorders and the Rome III process // Gastroenterology. — 2006. — V. 130, № 5. — P. 1377-1378.
5. Tack J., Talley N.J., Camilleri M. et al. Functional gastroduodenual disorders // Сучасна гастроентерологія. — 2006. — № 6. — С. 73-81.
