Журнал «Здоровье ребенка» 3 (24) 2010
Вернуться к номеру
Удосконалення патогенетичної терапії бактеріальних менінгітів у дітей
Авторы: Свістільнік Р.В., Вінницький національний медичний університет ім. М.І. Пирогова, Хмельницька міська інфекційна лікарня
Рубрики: Педиатрия/Неонатология
Версия для печати
Проведене дослідження показало достатньо високу ефективність комплексної протизапальної та нейропротекторної терапії із застосуванням НПЗЗ ібупрофену і нейропротектора цитиколіну у дітей, хворих на гнійний менінгіт. При використанні комбінованої терапії із включенням ібупрофену та нейропротектора цитиколіну у хворих основної групи порівняно з контрольною вірогідно швидше наставало регресування клінічних проявів хвороби і лабораторних показників крові й ліквору: рівень TNF-a, нейронспецифічної енолази, продуктів окисної модифікації білків, білка й цитозу ліквору.
Менінгіт, діти, ібупрофен, цитиколін.
Вступ
Незважаючи на наявність ефективних антибактеріальних препаратів і схем їх використання в терапії гострого бактеріального менінгіту, смертність хворих із даною патологією продовжує залишатись достатньо високою як у країнах, що розвиваються, так і в економічно розвинутих країнах [1].
Нейрональне пошкодження при бактеріальному менінгіті є наслідком інвазії лейкоцитів у центральну нервову систему (ЦНС), залучення мікроглії в інфекційний процес, прямої токсичності бактеріальних компонентів на мозковий ендотелій і нейрони та розвитку вираженої системної запальної відповіді організму у відповідь на вторгнення інфекційного агента в організм [2]. Під впливом гіпоксії, бактеріальних токсинів відбувається вивільнення арахідонової кислоти, яка через циклооксигеназний шлях запускає активне утворення простагландинів, лейкотрієнів та інших медіаторів запалення, що, у свою чергу, беруть участь у розвитку запального процесу і пошкодженні нервових клітин [3, 4]. Серіями досліджень показано, що інгібіція ЦОГ-1 і ЦОГ-2 значно зменшує руйнування ГЕБ, запобігає нейрональному пошкодженню та зменшує експресію клітинами матричних металопротеїназ ММРs-3 і ММРs-9, які, як відомо, є тригерними факторами оксидативного й нітратного стресу, каспаза-опосередкованої клітинної смерті, ексайтотоксичності, що спостерігається при розвитку нейроінфекції [5–7]. Тому вплив і можливість контролю запальної відповіді організму при нейроінфекціях та попередження нейродеструкції є таким же значимим, як і антибіотикотерапія, що можна підтвердити цитатою Н.В. Скрипченко та ін. (2005): «Не виключено, що швидке пригнічення запального процесу в гострий період захворювання є сприятливою морфологічною основою нормалізації інтратектального нейрометаболізму, що попереджує формування неврологічного дефіциту».
Вищенаведені дані обумовлюють доцільність застосування нестероїдних протизапальних засобів (НПЗЗ) та нейропротекторів при гострих менінгітах.
Метою даного дослідження було оптимізувати патогенетичну терапію менінгітів із використанням НПЗЗ — ібупрофену та нейропротектора цитиколіну. Ібупрофен цілеспрямовано діє на конкретні ланцюги патогенезу розвитку запалення при нейроінфекціях: блокує в організмі ЦОГ-1 і ЦОГ-2, що запускають активне утворення простагландинів, лейкотрієнів та інших медіаторів запалення, що призводить до розвитку запалення мозкових оболонок і субарахноїдального простору, а також сприяють продукції вільних радикалів [8–10], зменшує фагоцитарну продукцію медіаторів гострої фази запалення та знижує активність і продукцію вільних радикалів [8], має подвійний (центральний і периферичний) знеболюючий ефект [10] та проявляє жарознижуючу дію. Всі ці ефекти ібупрофену сприяють зменшенню запального процесу в оболонках мозку та субарахноїдального простору, відновленню функції клітинних мембран.
У дослідженнях Н.В. Скрипченко і співавт. (2005) при застосуванні ібупрофену протягом двох тижнів із моменту захворювання було показано його високу ефективність у лікуванні серозних менінгітів у дітей, що проявлялось швидким пригніченням інтратектального запалення.
У своїй дії цитиколін (цитидин-5-дифосфохолін) поєднує: нейрометаболічні, нейромедіаторні, антиагрегантні властивості. Цитидин-5-дифосфохолін, ресинтезований у головному мозку, активує синтез фосфатидилхоліну і попереджає його деградацію в мембранах, зменшує активність фосфоліпази А 2 і попереджає її активацію [11], підвищує загальні рівні глутатіону та зменшує активність глутатіонредуктази. Глутатіон є первинною ендогенною захисною антиоксидантною системою, оскільки видаляє Н 2 О 2 і ліпідні пероксиди в мозку [11, 12].
Одним із нових механізмів дії цитиколіну є профілактика розвитку феномену ексайтотоксичності, що полягає у блокаді викликаного ішемією викиду глутамату, який відіграє ключову роль у деструкції нейрональних мембран [13].
Таким чином, цитиколін виявляє широкий спектр фармакологічної дії, забезпечуючи два доказових і важливих напрямки терапії: нейропротекцію — відновлення структури і функції нейронів та зв''язків між ними, тобто профілактику механізмів, що призводять до загибелі ішемізованої зони; а також судинні ефекти, завдяки яким поліпшуються реологічні властивості крові, мікрогемоциркуляція та церебральна перфузія ішемізованої ділянки мозку [14].
Матеріали та методи
Проведене комплексне діагностичне дослідження зразків крові 40 дітей, хворих на гнійні менінгіти, та 30 практично здорових осіб віком від 1 місяця до 14 років. Хворі діти були розподілені на дві групи по 20 осіб (основна і контрольна групи), що не відрізнялися між собою за віком, статтю, тяжкістю перебігу хвороби. Групи формувались методом випадкової вибірки. Діти контрольної групи отримували традиційну терапію, що грунтувалась на принципах Протоколу № 354 (від 9.07.2004 р.) і включала антибактеріальну терапію (пеніцилін, цефтріаксон у вигляді монотерапії або в комбінації з амікацином), короткий курс (2 доби) глюкокортикостероїдів, дезінтоксикаційну та симптоматичну терапію. Основна група отримувала в комплексі зі стандартним лікуванням НПЗЗ ібупрофен у суспензії у вікових дозах протягом 3–5 діб після відміни кортикостероїдів та нейропротектор із протинабряковою дією цитиколін по 1 мл тричі на день перорально протягом усього періоду захворювання.
Визначення прозапального цитокіну TNF-a як маркера запалення та нейронспецифічної енолази (НСЕ) як маркера нейродеструкції [15] проводилось методом ІФА з використанням тест-систем Human Tumor Necrosis Factor Alpha ELISA фірми DIACLONE (Франція) та NSE ELISA фірми DAI (США). Визначення продуктів окисної модифікації білків (ОМБ) — показника глибини оксидативного стресу — проводили за оптимізованим методом визначення рівня карбонільних похідних білків у сироватці крові, запропонованим В.Ю. Масловським та співавт. (2006), із використанням 2,4-динітрофенілгідразину (2,4-ДНФГ) фірми MERCK (Німеччина). Зразки крові отримували в 1-шу — 2-гу добу після госпіталізації та на 7–8-му добу лікування.
Результати та їх обговорення
У нашому дослідженні на початку розвитку захворювання гіпертермія виявлялась у всіх хворих як контрольної, так і основної груп і сягала високих значень. У процесі лікування динаміка температурної реакції у дітей обох груп вірогідно відрізнялась (р < 0,001), що відображено в табл. 1. У дітей контрольної групи на 7–8-му добу температура тіла ще не досягала нормальних значень, що свідчить про недостатній контроль запальної відповіді, на відміну від дітей основної групи, у яких у даний період хвороби визначалась нормотермія. Це свідчить про затухання інфекційного процесу та зменшення запальної відповіді організму.

Крім того, у хворих основної групи на фоні прийому ібупрофену значно швидше порівняно з контрольною групою дітей (р < 0,001) відбувалась нормалізація температури тіла (3,70 ± 0,55 доби та 10,10 ± 1,59 доби відповідно), що покращувало стан хворих. Саме завдяки дії ібупрофену можна пояснити позитивну динаміку та швидку нормалізацію температури тіла.
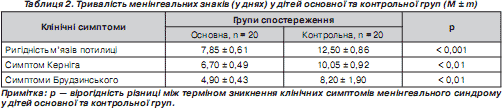
Як видно з табл. 2, зникнення ключових менінгеальних симптомів в основній групі дітей після проведеного лікування наставало вірогідно раніше, ніж у контрольній групі дітей, що можна пояснити зменшенням субарахноїдального запалення завдяки ібупрофену та протинабряковою дією цитиколіну за рахунок стабілізації клітинних мембран.
Вплив даної комбінації препаратів на показники лікворограми ми оцінювали за двома основними показниками, що відображають запальний процес у субарахноїдальному просторі, — умістом білка й загального цитозу.
На початку захворювання рівні білка ліквору у всіх хворих дітей як контрольної, так і основної групи вірогідно не відрізнялися між собою (р > 0,05). У процесі лікування на 7–8-му добу білок ліквору зменшувався в обох групах дітей, однак у дітей основної групи вміст його в лікворі вірогідно відрізнявся від дітей контрольної групи, хоча не досягав нормальних значень в обох групах, про що свідчать дані табл. 3.
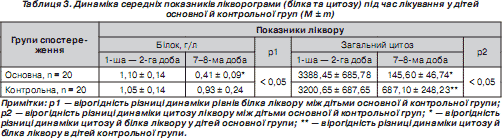
Рівні загального цитозу ліквору у хворих контрольної та основної груп на початку лікування також вірогідно не відрізнялися між собою (p > 0,05). У процесі лікування вони вірогідно знижувалися в обох групах, але в основній групі на 7–8-му добу лікування цитоз у лікворі був значно меншим, ніж у дітей контрольної групи (р < 0,05), хоча не досягав нормальних значень у дітей обох груп, що відображено в табл. 3.
У хворих дітей уміст TNF-a вірогідно (р < 0,001) був вищим, ніж у здорових дітей (19,56 ± 1,47 пг/мл проти 4,95 ± 0,17 пг/мл). У середньому рівень TNF-a у хворих дітей у 3,9 раза був вищим, ніж у здорових, а в деяких дітей його концентрація була більшою майже в 10 разів, що свідчить про значний запальний процес. Під час лікування рівень TNF-a у дітей основної групи вірогідно знижувався на 7–8-му добу, про що свідчать дані табл. 4, але ще в 1,6 раза був більшим, ніж у здорових дітей. У дітей контрольної групи також відбувалось зниження TNF-a на 7–8-му добу, але його рівень у 2,3 раза був вищим порівняно зі здоровими дітьми та вірогідно відрізнявся від рівня дітей основної групи (p < 0,01), що свідчить про більш ефективний контроль запальної відповіді даною комбінацією препаратів — ібупрофену і цитиколіну.
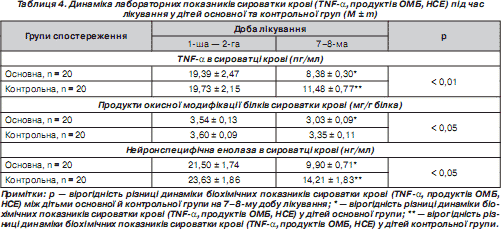
Уміст карбонільних похідних — продуктів окисної модифікації білків у хворих дітей був вірогідно (р < 0,001) вищим, ніж у здорових дітей (3,57 ± 0,07 мг/г проти 2,04 ± 0,02 мг/г білка), в 1,7 раза, що свідчить про недостатність антиоксидантної системи організму при менінгітах і значну роль в перебігу захворювання кисневих радикалів, що призводять до окислювальної модифікації білків із порушенням їх функції, деструкції мембран і навіть до нейрональної смерті.
Як видно з табл. 4, у дітей основної групи в процесі лікування рівень продуктів ОМБ вірогідно знижувався на 7– 8-му добу, але ще в 1,4 раза був вищим, ніж у здорових дітей. У дітей контрольної групи також відбувалось зниження ОМБ на 7–8-му добу лікування, але його рівень був вищим порівняно зі здоровими дітьми в 1,6 раза. Хоча вміст продуктів ОМБ вірогідно знижувався в обох групах хворих, їх динаміка в дітей основної групи вірогідно відрізнялась від осіб контрольної групи (р < 0,05), що є свідченням того, що контроль запальної відповіді може також зменшувати утворення активних форм кисню, що виникають переважно в процесі метаболізму арахідонової кислоти через циклооксигеназний шлях, який блокується ібупрофеном. Антиоксидантна активність підвищується також за рахунок цитиколіну, який зменшує активність фосфоліпази А 2 і підвищує рівень глутатіону [9].
Рівень НСЕ у хворих дітей був вірогідно (р < 0,001) вищим, ніж у здорових дітей (22,56 ± 1,14 нг/мл проти 2,95 ± ± 0,16 нг/мл, тобто в 7,6 раза). У дітей, у яких виникли ускладнення хвороби з боку ЦНС, рівень НСЕ був вищим, ніж у здорових дітей, у 12,5 раза і, відповідно, був вірогідно вищим, ніж у дітей, у яких ускладнень не було (р < 0,01). Отримані дані свідчать, що при менінгітах виникає значне руйнування нервових клітин ЦНС, що викликається багатьма факторами і вказує на те, що в більшості випадків менінгіт перебігає з ушкодженням речовини головного мозку.
Як видно з табл. 4, у дітей основної групи у процесі лікування рівень НСЕ вірогідно знижувався на 7–8-му добу, але ще у 3 рази був більшим, ніж у здорових дітей. У дітей контрольної групи також відбувалось зниження НСЕ на 7–8-му добу, але її рівень був вищим порівняно зі здоровими дітьми в 4,3 раза, що може свідчити про виражене нейрональне пошкодження, яке триває і за відсутності вогнищевої симптоматики з боку ЦНС і може давати хибне уявлення про інтактність мозкової речовини при менінгітах. Хоча НСЕ вірогідно знижувалася в обох групах хворих, її вміст у дітей основної групи вірогідно відрізнявся від осіб контрольної групи (р < 0,05). Отримані дані свідчать про необхідність раннього проведення нейропротекції, за допомогою якої можна зменшити вираженість нейронального пошкодження та попередити можливі ускладнення з боку ЦНС.
Слід відзначити також, що ускладнення з боку ЦНС (гідроцефалія, субдуральні гігроми, розвиток вогнищевої неврологічної симптоматики та ін.) у дітей, які приймали в комплексній терапії цитиколін та ібупрофен, порівняно з дітьми контрольної групи спостерігались у 2 рази рідше.
Висновки
Ураження нейронів при менінгітах виникає в більшості хворих, про що свідчить високий уміст у сироватці крові НСЕ, що диктує необхідність використання нейропротекторів уже на початку розвитку захворювання. Рівень НСЕ може використовуватись у хворих на гострі менінгіти як вірогідний маркер глибини нейронального пошкодження і як показник ефективності нейропротективного лікування.
Для підвищення ефективності патогенетичної терапії гнійних менінгітів (контролю субарахноїдального запалення та нейронального пошкодження, маркерами яких є рівні TNF-a, НСЕ, продуктів ОМБ) доцільно використовувати препарати ібупрофен і цитиколін, що покращують ефективність лікування, мають добру переносимість і значно зменшують можливість формування ускладнень хвороби з боку ЦНС при своєчасному їх призначенні.
1. Freedman S.B., Marocco A., Pirie J. et al. Predictor of bacterial meningitis in the era after Haemophylus influenzae // Arch. Pediatr. Adolesc. Med. — 2001. — Vol. 155. — P. 1301-1306.
2. Aktas O., Ullrich O., Infante-Duarte C. et al. Neuronal damage in brain inflammation // Arch. Neurol. — 2007. — Vol. 64. — P. 185-189.
3. Скрипченко Н.В., Иванова М.В., Иванова Г.П. и др. Актуальные проблемы инфекционных заболеваний у детей // Педиатрия. — 2007. — Т. 86, № 1. — С. 101-113.
4. Крамарєв С.О., Євтушенко В.В., Волошина О.О. та ін. Зміни спектру жирних кислот та церебральної гемодинаміки при набряку головного мозку у дітей з гнійними менінгітами // Перинатологія та педіатрія. — 2003. — № 1. — С. 27-31.
5. Zhao Y., Patzer A., Herdegen T. et al. Activation of cerebral peroxisome proliferator-activated receptors gamma promotes neuroprotection by attenuation of neuronal cyclooxygenase-2 overexpression after focal cerebral ischemia in rats // The FASEB Journal. — 2006. — Vol. 20. — P. 1162-1175.
6. Araki E., Forster C., Dubinsky J. et al. Cyclooxygenase-2 inhibitor NS-398 protects neuronal cultures from lipopolysaccharide-induced neurotoxicity // Stroke. — 2001. — Vol. 32. — P. 2370.
7. Muresanu D.F. Neuroprotection and neuroplastycity — A holistic approach and future perspectives // Journal of the Neurological Sciences. — 2007. — Vol. 257. — P. 38-43.
8. Зайцева О.В. Эффективность ибупрофена в терапии острой боли у детей // Педиатрия. — 2004. — № 2. — С. 37-40.
9. Скрипченко Н.В., Конев К.И., Росин Ю.А. и др. К вопросу о дифференцированном лечении серозных менингитов у детей // Педиатрия. — 2005. — № 6. — С. 37-44.
10. Казак С.С., Прокопенко И.Г. Сравнительная характеристика нестероидных противовоспалительных лекарственных препаратов и их применение в педиатрии // Перинатологія та педіатрія. — 2004. — № 3. — С. 28-30.
11. Adibhatla R.M., Hatcher J.F. Citicoline decreases phospholipase A2 stimulation and hydroxyl radical generation in transient cerebral ischemia // Journal of Neuroscience Research. — 2003. — Vol. 73. — Р. 308-315.
12. Adibhatla R.M. Hatcher J.F. Role of lipids in brain injury and diseases // Future Lipidol. — 2007. — Vol. 2, № 4. — Р. 403-422.
13. Hurtado O., Moro M.A., Cardenas A. et al. Neuroprotection afforded by prior citicoline administration in experimental brain ischemia: effects on glutamate transport // Neurobiology of Disease. — 2005. — Vol. 18. — P. 336-345.
14. Віничук С.М. Нейропротекція в гострий період мозкового інсульту: аналіз причин неефективності нейропротекторів при клінічних випробуваннях // Український медичний часопис. — 2008. — № 3 (65). — V/VI. — С. 4-11.
15. Lima J.E., Takayanagui O.M., Garcia L.V. et al. Use of neuron-specific enolase for assessing the severity and outcome in patients with neurological disorders // Braz. J. Med. Biol. Res. — 2004. — Vol. 37. — P. 19-26.
16. Масловський В.Ю. Ільченко О.В., Пентюк О.О. Метод визначення кількості карбонільних похідних білків сироватки крові // Вісник Вінницького національного медичного університету. — 2006. — № 10 (1). — С. 14-17.
