Журнал «Здоровье ребенка» 4 (25) 2010
Вернуться к номеру
Метаболическая коррекция изменений со стороны сердечно-сосудистой системы у экспериментальных животных с моделированной бронхиальной астмой
Авторы: Каладзе Н.Н., Загорулько А.К., Дмитриевская М.И., Крымский государственный медицинский университет им. С.И. Георгиевского
Рубрики: Педиатрия/Неонатология
Версия для печати
Проведено морфологическое исследование сердца 24 морских свинок с моделированной бронхиальной астмой, 6 из них получали метаболическую терапию. Стойкий характер морфологических изменений в условиях данного эксперимента свидетельствует о необходимости метаболической коррекции в период клинической ремиссии.
Бронхиальная астма, сердечно-сосудистая система, эксперимент, морские свинки, лечение
Для изучения механизмов аллергического воспаления и гиперреактивности дыхательных путей, лежащих в основе бронхиальной астмы (БА), проводятся эксперименты на животных [2, 4], которые позволяют глубже понять механизмы этих процессов у человека. Модели используются для изучения различных аспектов патогенеза и апробации новых способов лечения. Наиболее адекватной бронхиальной астме у человека и весьма информативной является модель аллергического воспаления легких у морских свинок. Основу этого аллергического процесса, индуцируемого аэрозольным введением антигена (овальбумина), составляет эозинофильное воспаление, характеризующееся инфильтрацией паренхимы легких эозинофилами, повышением цитоза в бронхоальвеолярном смыве (БАС), а также резким увеличением количества эозинофилов и нейтрофилов в бронхоальвеолярном лаваже [1].
В доступной литературе мы не обнаружили исследований, направленных на изучение состояния сердечно-сосудистой системы (ССС) при экспериментальной БА у животных.
Целью нашей работы было выявление и изучение изменений в миокарде и сосудах у лабораторных животных с моделированной БА на фоне базисной терапии и метаболической коррекции.
Материалы и методы исследования
Исследование проведено на 24 морских свинках половозрелого возраста со средней массой 500–700 г.
Животные были разделены на 4 группы, в каждой по 6 морских свинок:
1-я группа животных с моделированной БА, которым не проводилось лечение;
2-я группа животных с моделированной БА получала фликсотид;
3-я группа животных с моделированной БА получала фликсотид и кардонат;
4-я группа — интактные животные.
Для моделирования БА использовали модифицированную методику экспериментальной БА у морских свинок по J . J . Bie . Половозрелым морским свинкам через день в течение 20 суток вводили внутрибрюшинно овальбумин из расчета 10 мг на 100 г массы, растворенный в 0,5 мл стерильной апирогенной воды для инъекций. После чего в течение месяца морским свинкам моделировались приступы БА распылением овальбумина в дозе 4 мг на 1 мл дистиллированной воды в течение 10 минут один раз в два дня при помощи ультразвукового ингалятора «Муссон-2» [3]. После получения экспериментальной модели БА животным основной группы в течение 3 месяцев на фоне продолжающихся ингаляций аллергена (3 раза в неделю по 10–12 минут) проводилась ежедневная базисная терапия.
Забор материала проводили через 3 месяца с момента начала моделирования БА и лечения препаратами базисной терапии. Метаболическую коррекцию проводили препаратом кардонат в течение 21 дня.
Результаты и их обсуждение
Полученные при электронной микроскопии результаты свидетельствовали о том, что в ходе эксперимента удалось смоделировать хроническое аллергическое воспаление в ткани легкого, характерное для БА, а также выявить изменения в ССС у экспериментальных животных.
При БА в компонентах аэрогематического барьера (АГБ) происходил целый ряд существенных изменений. Прежде всего отмечались нарушения кровообращения в капиллярах межальвеолярных перегородок. При этом просвет сосудов часто выглядел расширенным, а в нем содержались форменные элементы крови, в первую очередь эритроциты (рис. 1).
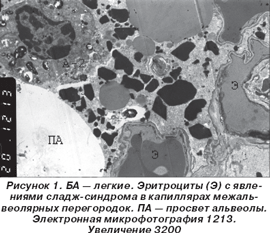
Часто отмечались явления сладж-синдрома в виде агрегации многочисленных эритроцитов в просвете капилляров. Со стороны эндотелиальных клеток обращало на себя внимание резкое увеличение количества микропиноцитозных везикул в цитоплазматических отростках. Межклеточные контакты между эндотелиальными клетками выглядели расширенными, становились рыхлыми и принимали вид каналов или щелей, свидетельствуя о более или менее резком повышении проницаемости сосудистой стенки. В ряде случаев центральная, ядросодержащая, часть эндотелиоцитов увеличивалась и выступала в просвет капилляра, суживая его просвет.
Интерстиций на значительном протяжении расширялся и принимал вид гомогенной средней электронной плотности ленты, что, по-видимому, являлось следствием нарушения транскапиллярного газообмена и отека эндотелиальной и эпителиальной базальных мембран.
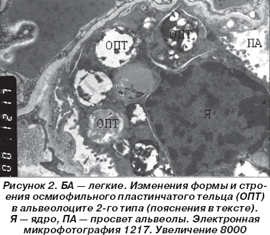
Особое внимание обращали на себя изменения со стороны осмиофильных пластинчатых телец (ОПТ), в части которых отмечались явления снижения осмиофильности бимембранных пластин с их гомогенизацией, фрагментацией и вакуолизацией (рис. 2), что, по-видимому, существенным образом отражалось на функции синтеза и секреции этими клетками легочного сурфактанта.
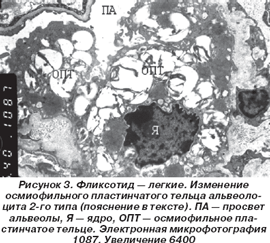
На фоне базисной терапии фликсотидом отмечались выраженные в значительно меньшей степени явления полнокровия капилляров межальвеолярных перегородок, расширения интерстициального пространства и признаков интрацеллюлярного отека в альвеолоцитах 2-го типа в первую очередь в виде вакуолизации ОПТ с разволокнением и фрагментацией осмиофильных пластин (рис. 3).
Применение кардоната смягчало описанные изменения и сопровождалось тенденцией к нормализации строения компонентов аэрогематического барьера, отмечалось восстановление высокой пиноцитозной активности в «рабочих» участках АГБ (рис. 4). Это обстоятельство говорило в пользу нормализации транскапиллярного газообмена.
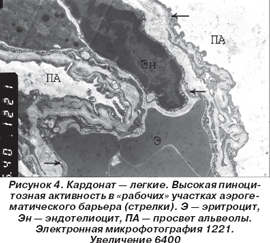
Большое количество ОПТ в цитоплазме альвеолоцитов 2-го типа и сохранение на апикальной поверхности клеток большого количества микроворсин свидетельствовало о сохраненной синтетически-секреторной активности клеток. Отсутствие существенных изменений со стороны альвеолоцитов 1-го типа сопровождалось сохранением целостности эпителиального покрова на внутриальвеолярной поверхности. Кроме того, обращало на себя внимание отсутствие в просвете альвеол отечной жидкости и снижение количества альвеолярных макрофагов (АМ), пул которых практически полностью состоял из нормально функционирующих клеток без признаков повышения фагоцитоза.
При моделированной БА в левом желудочке отмечались незначительные изменения, сводящиеся в основном к явлениям перимизиального отека с незначительными разрыхлениями в области вставочных дисков, частичной фрагментации миофибрилл на отдельных участках (рис. 5) и более или менее выраженным расширениям профилей канальцев цитоплазматической сети.

Митохондрии сохраняли характерную для них конфигурацию с плотно упакованными кристами, хотя во многих органеллах между кристами появлялись очаговые просветления, что свидетельствовало об их разрыхлении, также признаки дезориентации и дискомплексации крист. Со стороны ядер почти повсеместно отмечалось изменение формы с перераспределением хроматина и его последующая конденсация вблизи ядерной мембраны в виде глыбок. В сосудах микроциркуляторного русла отмечалось разрыхление межклеточных контактов с возникновением слабовыраженного периваскулярного отека.
В правом желудочке имели место сходные изменения. Однако следует отметить, что описанные явления перимизиального отека, нарушения целостности отдельных миофибрилл, изменения матрикса митохондрий с его просветлением и нарушением правильности ориентации крист и их организации носили более распространенный характер, что являлось следствием изменений, развивающихся в сосудах микроциркуляторного русла. В последних отмечалось нарушение целостности эндотелиальной выстилки базальной мембраны, которое сопровождалось резким расширением просвета сосудов и выраженным повышением проницаемости сосудистой стенки, что документировалось развитием периваскулярного отека (рис. 6).
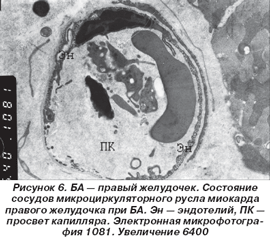
В цитоплазматических отростках эндотелиоцитов было выявлено большое количество микропиноцитозных везикул, местами сливающихся между собой в вакуоли различных размеров. Во множестве ядер миокардиоцитов было отмечено большое количество выростов и выпячиваний кариоплазмы с повсеместной конденсацией глыбок гетерохроматина в зоне ядерной мембраны. Почти повсеместно в таких участках имели место явления перинуклеарного отека.
Применение фликсотида сопровождалось следующими изменениями в миокарде левого желудочка. Общий план строения миокардиоцитов сохранялся. При этом по-прежнему отмечались явления нарушения кровообращения в сосудах микроциркуляторного русла: их просвет был умеренно расширен, ядросодержащая часть эндотелиоцитов выступала в просвет капилляров, а в самих ядрах эндотелиальных клеток происходило перераспределение хроматина с его конденсацией в виде глыбок вблизи кариолеммы (рис. 7).
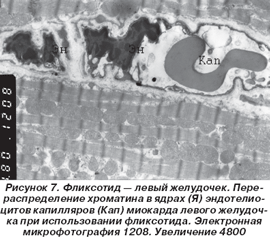
В ядрах самих кардиомиоцитов отмечалось сохраняющееся просветление центральной части за счет разрежения хроматина с его частичной конденсацией вблизи кариолеммы, а также появление в ядрах выростов и выпячиваний различной величины. Нарушения целостности миофибрилл практически не встречались, а такие изменения со стороны митохондрий, как просветление матрикса с дискомплексацией и дезориентацией крист с их частичной фрагментацией, встречались редко. Кое-где сохранялись слабо выраженные явления перимизиального отека без изменений со стороны М- и Z -линий.
В правом желудочке применение фликсотида сопровождалось сохранением разнонаправленных очаговых изменений. С одной стороны, общий план строения миофибрилл и миокардиоцитов в целом сохранялся, что выражалось в обычной структуре ядер, имеющих более или менее правильную вытянутую форму и содержащих большое количество как эу-, так и гетерохроматина, а также в сохранности ультраструктурной организации митохондрий с плотно упакованными кристами, плотным матриксом и без признаков деструкции мембран. С другой стороны, почти повсеместно встречались участки сохранившегося перимизиального отека с просветлениями матрикса митохондрий, а также разрыхлением зон М- и Z-дисков (рис. 8).

Применение кардоната не сопровождалось полным восстановлением структуры миокардиоцитов правого желудочка, но при этом строение вставочных дисков почти полностью нормализовалось (рис. 9), а структура миокардиоцитов выглядела нормальной на значительном протяжении мышечных волокон.

Полученные результаты свидетельствовали о стойких морфологических изменениях в легких, сохраняющихся на фоне 3-месячного лечения. Целесообразным является продолжение дальнейших исследований по изучению оптимальной длительности базисной терапии, а также патогенетически обоснованных методов метаболической коррекции в период ремиссии БА.
Выводы
1. Для воспроизведения бронхиальной астмы в эксперименте оптимальной моделью являются морские свинки.
2. Полученные при электронно-микроскопическом исследовании данные свидетельствуют о том, что значительные изменения, возникающие при БА в компонентах аэрогематического барьера, в значительной степени нивелируются применением фликсотида и кардоната, что способствует восстановлению нормального транскапиллярного газообмена в респираторном отделе легкого.
3. На основании электронно-микроскопических исследований можно сделать заключение, что возникающие в сердце при экспериментальной бронхиальной астме изменения более выражены в правом желудочке.
4. Отмечена положительная динамика от применения базисной терапии препаратом фликсотид и метаболической коррекции препаратом кардонат.
1. Ковалева В.Л. Методические указания по изучению фармакологических веществ, предназначенных для терапии бронхиальной астмы и других обструктивных заболеваний дыхательных путей // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. — Москва, 2000. — С. 242-249.
2. Митина Т.В., Регеда М.С. Показатели основного обмена при модели бронхиальной астмы и ее терапии церулоплазмином // Проблемы патологии в эксперименте и клинике. — Львов, 1986. — С. 35-36.
3. Каладзе Н.Н., Абугазлех Е.Н., Юрьева А.В. и др. Динамика морфологических признаков моделированной бронхиальной астмы под влиянием базисной терапии в условиях эксперимента // Таврический медико-биологический вестник. — 2006. — Том 9, № 6. — С. 151-156.
4. Sato Y., Kishi T., Umemura T. Histopathological and immunohistochemical studies on experimental asthmatic model induced by aerosolized ovalbumin inhalation in guinea pigs // J. Toxicol. Sci. — 1998. — 1. — Р. 69-75.
