Журнал «Здоровье ребенка» 5 (26) 2010
Вернуться к номеру
Возможности инфузионно-трансфузионной терапии в периоперационном периоде хирургической коррекции сколиотической деформации у детей и подростков
Авторы: Георгиянц М.А., Раскова Т.Ю., Хмызов А.А.*, Харьковская медицинская академия последипломного образования, *ГУ «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко АМН Украины», г. Харьков
Рубрики: Педиатрия/Неонатология
Версия для печати
На основании анализа показателей гемодинамики рассмотрены варианты инфузионно-трансфузионной терапии кровопотери у детей и подростков, оперируемых по поводу сколиотической деформации позвоночника. Полученные результаты свидетельствуют о принципиальной возможности снижения потребности в препаратах донорской крови.
Сколиоз, хирургическая коррекция, гемодинамика.
Введение
Инфузионно-трансфузионная терапия (ИТТ), сопровождающая современные хирургические вмешательства, выполняемые по поводу сколиотической деформации позвоночника у детей, имеет некоторые особенности [1]. Методики ИТТ, применимые в других областях хирургии и большой ортопедии и травматологии, например, при эндопротезировании тазобедренных суставов, не всегда приемлемы у рассматриваемой категории пациентов из-за анатомо-физиологических особенностей этих больных: выполнение тяжелого хирургического вмешательства с использованием торакотомии на фоне исходно имеющихся изменений со стороны сердечно-сосудистой и дыхательной систем организма может привести к усугублению нарушений функции последних в раннем послеоперационном периоде [6]. Реинфузия дренажной крови, позволяющая снизить потребность в препаратах донорской крови, проводимая без одновременного использования других методик, может подвергнуть больного неоправданному риску декомпенсации гемодинамики (ГД) [8]. По данным зарубежных авторов, в целях поддержания транспорта газов крови на приемлемом уровне нередко используются синтетические или полусинтетические кислородпереносящие среды. Наиболее часто используемыми препаратами для поддержания транспорта кислорода являются бычий полимеризованный гемоглобин (HBOC-201) [7] и эмульсия перфторуглерода [2, 5]. Однако исследований, изучающих состояние гемодинамики на фоне применения различных вариантов кровосберегающих техник у больных со сколиозом, нами не обнаружено.
Целью нашего исследования стало изучение влияния на состояние гемодинамики в периоперационном периоде хирургического лечения сколиоза у детей инфузионно-трансфузионной терапии, включающей наряду с кристаллоидными и коллоидными объемзамещающими растворами реинфузию дренажной крови и кислородпереносящий препарат.
Материалы и методы
Исследование проведено на базе отдела анестезиологии и ИТ ГУ «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко АМН Украины».
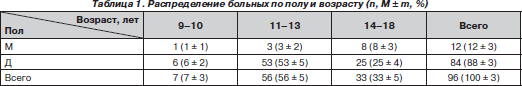
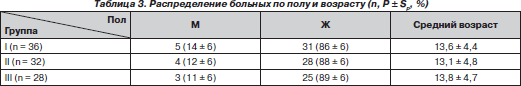
В исследование включены 96 больных, которым выполнялась оперативная коррекция сколиотической деформации. Больных с IV степенью деформации по Cobb [4] было 80 (83,3 %), с III степенью деформации — 16 (16,7 %). Большинство больных (88,5 %) были в возрасте от 11 до 16 лет, средний возраст — 13,5 ± 4,5 года (табл. 1). Преимущественное большинство составили девочки — 84 больных (88 ± 3 %).
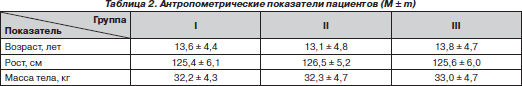
У исследуемых пациентов отмечено отставание в физическом развитии (табл. 2). При сопоставлении антропометрических данных с возрастной нормой отмечалось нарастание отставания в росте с 10 % в возрасте 9–11 лет до 20 % в возрасте 17–18 лет. Вес больных был ниже возрастной нормы от 10 % в 9–10 лет и до 19 % у пациентов 14–18 лет.
Пациенты были отнесены ко II–III степени риска по ASA в зависимости от наличия и выраженности сопутствующей соматической патологии.
У пациентов всех групп в периоперационном периоде использовались кристаллоидные и коллоидные растворы. Расчет потребности в жидкости проводился по алгоритму почасовой поддерживающей инфузионной терапии [1]. Почасовая инфузия рассчитывалась по правилу: 60 мл/первые 20 кг + 1 мл/кг/ч свыше 20 кг.
Раствор NaCl 0,9% и раствор Рингера вводили интраоперационно со скоростью 9 ± 1 мл/кг/час в среднем объеме 40 ± 10 мл/кг, а в послеоперационном периоде — в объеме 50–80 % от суточной потребности в жидкости.
В качестве коллоида использовались 4% раствор модифицированного желатина, вводившийся в объеме 17 ± 3 мл/кг интраоперационно и послеоперационно в объеме 20–40 % от суточной потребности в жидкости.
После операции всем пациентам для уменьшения потерь крови по дренажам назначался ингибитор фибринолиза 5% e-аминокапроновая кислота в объеме 1 мл/кг массы тела дважды — сразу после операции и через 5 часов. Для стимуляции образования тромбоцитов и их выхода из костного мозга назначался этамзилат 12,5% в дозе 250–500 мг внутривенно дважды с интервалом 4 часа.
В зависимости от тактики инфузионно-трансфузионной терапии обследуемые пациенты были разделены на 3 группы.
Пациентам I группы (36 больных) проводилась инфузия кристаллоидных растворов в объеме 9,3 ± 1,1 мл/кг/час и растворов модифицированного желатина (17,4 ± 2,9 мл/кг) в сочетании с интра- и послеоперационной инфузией донорской эритроцитарной массы (5,3 ± 0,7 мл/кг).
У пациентов II группы (32 больных) в периоперационном периоде использовалась инфузия кристаллоидных растворов в объеме 9,4 ± 1,3 мл/кг/час, растворов модифицированного желатина в объеме 17,1 ± 3,2 мл/кг и в послеоперационном периоде выполнялась реинфузия дренажной крови в объеме 8,6 ± 1,5 мл/кг, трансфузия донорской эритроцитарной массы проводилась по мере необходимости на основании данных доставки и потребления кислорода.
Пациентам III группы (28 больных) проводилась периоперационная инфузия кристаллоидных растворов в объеме 9,5 ± 1,1 мл/кг/час, растворов модифицированного желатина в объеме 16,9 ± 3,4 мл/кг и послеоперационная инфузия эмульсии перфторуглерода 3,5 ± 1,6 мл/кг/сут на протяжении первых трех суток после операции, а также послеоперационная реинфузия дренажной крови в объеме 8,49 ± 1,17 мл/кг. Гемотрансфузия донорской крови в этой группе не проводилась.
Группы были сопоставимы по полу и возрасту (табл. 3).
Объем интраоперационной кровопотери определялся гравиметрическим методом. В послеоперационном периоде измерялся объем крови, вытекшей по дренажам. Сбор крови для реинфузии проводился не позднее 12 часов после операции. Реинфузия дренажной крови выполнялась через фильтры, задерживающие жировые частицы, анафилотоксин С3а, микроагрегаты и лейкоциты из отмытой или неотмытой интра- или послеоперационной консервированной крови.
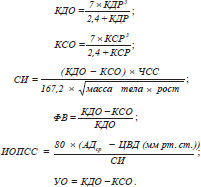
С помощью мониторной системы Utas UM-300 контролировались частота сердечніх сокращений (ЧСС) и артериальное давление (АД). Центральное венозное давление (ЦВД) определяли прямым методом Вальдмана. Центральная гемодинамика определялась эхокардиоскопически ультразвуковым сканером Siemens Sonoline G-50 (Германия). В М-режиме проводилось определение конечно-систолического размера (КСР) и конечно-диастолического размера (КДР) левого желудочка. На основании расчетов по L. Teicholz определялись конечно-систолический и конечно-диастолический объемы (КСО и КДО) с последующим расчетом сердечного индекса (СИ), ударного объема (УО), фракции выброса (ФВ), индекса общего периферического сосудистого сопротивления (ИОПСС) по формулам:
Исследование всех показателей проводилось до операции (1-й этап), сразу после ее окончания и перевода больных на самостоятельное дыхание (2-й этап) и на 3-и сутки (3-й этап).
Статистическая обработка полученных результатов производилась на ПЭВМ с использованием программы Microsoft Excel, достоверность отличий устанавливалась по t-критерию Стьюдента для множественных сравнений.
Результаты и их обсуждение
Объем кровопотери у исследуемых пациентов колебался от 600 до 1500 мл. Распределение объема кровопотери по этапам наблюдения было следующим: примерно 40–50 % объема кровопотери происходило интраоперационно, остальная часть — после операции, причем большая часть крови выделялась в дренаж в первые 4–6 часов после операции.
За норму объема циркулирующей крови (ОЦК) взято значение 6–8 % массы тела [3]. Средний объем кровопотери на протяжении исследования для всех групп составил 1060 ± 440 мл, а объем послеоперационной кровопотери — 583 ± 242 мл. Столь значительный диапазон значений объясняется тем, что у детей 9–10 лет абсолютный объем кровопотери значительно меньше, чем у детей 14–18 лет.
Учитывая значительные возрастные отличия в показателях ГД, мы также распределяли группы по возрастным категориям: 9–10 лет, 11–13 лет и 14–18 лет.
Достоверных различий в объеме кровопотери между исследуемыми группами пациентов не отмечалось. В I группе кровопотеря у всех больных составила 29,3 ± 2,3 мл/кг и была наибольшей у больных 9–10 лет (31,4 ± 1,4 мл/кг), наименьшей — у больных 11–13 лет (26,9 ± 1,3 мл/кг), а у больных 14–18 лет составила 29,2 ± 4,3 мл/кг. Потеря крови возмещалась эритроцитарной массой: у больных 9–10 лет в дозе 8,2 ± 0,5 мл/кг, 11–13 лет — 7,1 ± 0,5 мл/кг и у больных 14–18 лет — 6,2 ± 0,3 мл/кг. Такая разница объясняется тем, что при проведении трансфузии переливалось все содержимое контейнера без учета веса пациента, для создания у младших пациентов «запаса» на кровопотерю в дренажи, что в большинстве случаев оправдывалось, и необходимости в повторной гемотрансфузии не возникало. Все старшие пациенты в конце вторых — начале третьих суток нуждались в повторной трансфузии.
Кровопотеря во II и III группах составила 30,2 ± 2,9 мл/ кг и 28,6 ± 2,6 мл/кг соответственно. Относительный объем кровопотери в этих группах был схож с таковым в I группе: 31,9 ± 1,9 и 30,2 ± 1,6 мл/кг у больных 9–10 лет, 27,6 ± 2,0 и 26,9 ± 1,5 мл/кг у больных 11–13 лет и 31,1 ± 4,8 и 28,8 ± 4,6 мл/кг у больных 14–18 лет во II и III группах соответственно.
Средние дозы реинфузируемой крови рассчитывались для каждой возрастной подгруппы каждой группы отдельно и составляли для II и III групп соответственно 12,9 ± 0,7 и 11,4 ± 0,7 мл/кг у больных 9–10 лет, 10,9 ± 0,6 и 9,8 ± 0,5 мл/кг у больных 11–13 лет и 11,7 ± 1,7 и 10,3 ± 1,5 мл/кг у больных 14–18 лет. Как видно, объемы реинфузируемой крови пропорциональны кровопотере и составляют в среднем 38,0 ± 2,7 % от всей потери.
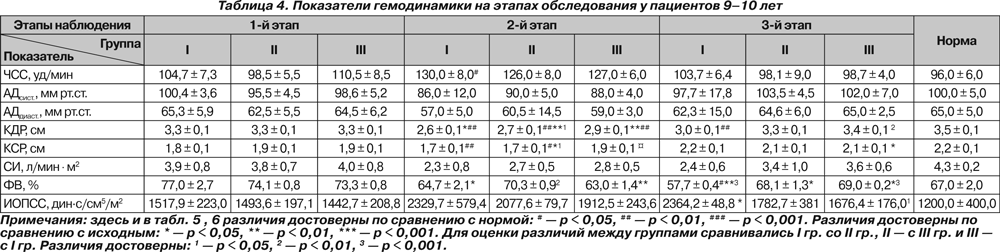
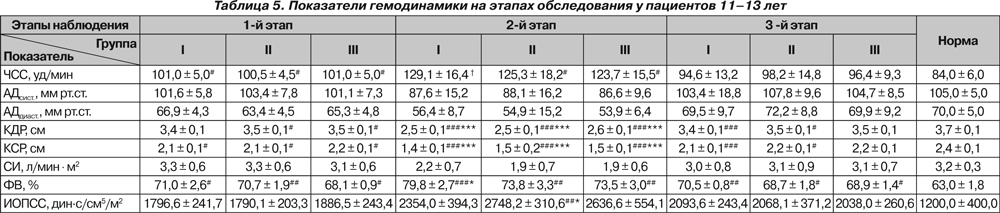
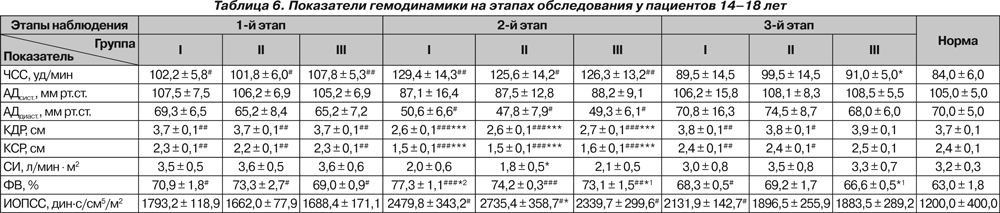
Полученные в ходе исследования гемодинамические показатели представлены в табл. 4–6.
У пациентов старше 10 лет исходно и на 2-м этапе отмечалась тахикардия (p < 0,05 и p < 0,01). У пациентов 9–10 лет тахикардия имелась в I группе только на 2-м этапе наблюдения (p < 0,05). У больных 14–18 лет III группы на 3-м этапе ЧСС была достоверно ниже исходной (p < 0,05).
Существенных колебаний АДсист. на протяжении всего исследования нами не отмечено. На 2-м этапе у больных 14–18 лет отмечено снижение АДдиаст. ниже нормы (p < 0,05).
Исходно отмечалось снижение КДР у больных II и III групп 11–13 лет и у больных 14–18 лет всех групп, что, по нашему мнению, свидетельствует не только о снижении преднагрузки, но и о влиянии деформации позвоночника на топографо-анатомические соотношения органов грудной клетки. На 2-м этапе у всех больных происходило значительное снижение КДР как по сравнению с нормой (p < 0,001), так и относительно исходного состояния (p < 0,001). На 3-м этапе отмечалось восстановление КДР у больных II и III группы 9–10 лет, III группы 11–13 лет и III группы 14–18 лет, тогда как у остальных пациентов данный показатель оставался сниженным (p < 0,05 и p < 0,01, p < 0,001). При этом снижение было более выраженным у больных I группы независимо от возраста (p < 0,01 и p < 0,001).
СИ не отличался от нормы ни в одной группе и был ниже исходного только у больных 14–18 лет II группы на 2-м этапе (p < 0,05).
У детей 9–10 лет I и III групп на 2-м этапе отмечалось снижение ФВ по сравнению с исходными значениями (p < 0,05 и p < 0,01), и в конце исследования ФВ была ниже исходной у больных всех групп (p < 0,05 и p < 0,01), а у пациентов I группы также и ниже нормы (p < 0,05). На 2-м этапе в группах 11–13 лет и 14–18 лет ФВ возрастала выше нормы у всех больных (p < 0,01 и p < 0,001), а у больных I группы — и выше исходной (p < 0,05). В конце исследования у всех больных 11–13 лет ФВ оставалась повышенной, и наиболее высокой — у больных I группы (p < 0,05 и p < 0,01). У больных 14–18 лет ФВ на 3-м этапе была повышена только у больных I группы (p < 0,05).
ИОПСС у больных 9–10 лет был выше исходного только у больных I группы на 3-м этапе (p < 0,05). У больных 11–13 лет во II группе на 2-м этапе отмечено повышение
ИОПСС как выше нормы (p < 0,01), так и выше исходного (p < 0,05). У больных 14–18 лет повышение ИОПСС на 2-м этапе отмечалось во всех группах (p < 0,05), у больных II группы оно также было выше исходного (p < 0,05), а у больных I группы сохранялось до конца исследования (p < 0,05).
Выводы
1. Пациенты, подвергающиеся хирургической коррекции сколиотической деформации позвоночника, имеют сопутствующую патологию со стороны сердечно-сосудистой системы, что усугубляет расстройства ее функции в периоперационном периоде и требует индивидуального выбора тактики инфузионно-трансфузионной терапии.
2. При подготовке к хирургическому вмешательству у пациентов со сколиотической деформацией необходимо проводить изучение центральной гемодинамики методом эхокардиоскопии для индивидуализации инфузионно-трансфузионной терапии.
3. Особенности оперативного вмешательства по исправлению деформации позвоночника у детей таковы, что наименьшее отношение кровопотери к массе тела имеется у больных в возрасте 11–13 лет, а наибольшее — у детей 9–10 лет.
4. Примененный нами метод реинфузии дренажной крови в сочетании с одновременным применением препаратов с газотранспортной функцией сопровождается менее выраженными гемодинамическими сдвигами в сравнении с методом возмещения кровопотери только донорскими эритроцитами и/или реинфузией дренажной крови.
1. Грегори Дж.А. Анестезия в педиатрии. — М.: Медицина, 2003. — 1178 c.
2. Клигуненко Е.Н., Кравец О.В., Новиков А.И. Перфторан в интенсивной терапии кровопотери: Метод. рекомендации. — Днепропетровск, 2003. — 32 с.
3. Корячкин В.А., Страшнов В.И., Чуфаров В.Н. Клинические функциональные и лабораторные тесты в анестезиологии и интенсивной терапии. — 2-е изд. — СПб.: Санкт-Петербургское медицинское издательство, 2004. — 303 с.
4. Маркс В.О. Ортопедическая диагностика (руководство-справочник). — Минск: Наука и техника, 1978. — 512 с.
5. Мороз В.В., Крылов Н.Л., Иваницкий Г.Р., Кайдаш А.Н. и др. Применение перфторана в клинической медицине // Анестезиология и реаниматология. — 1995. — № 6. — C. 12-17.
6. Таможанская А.В., Мезенцев А.А. Состояние кардиореспираторной системы детей, страдающих сколиотической болезнью IV степени, до и после оперативного лечения // Врачебная практика. — 2005. — № 1. — С. 25-31.
7. Rice J., Philbin N., McGwin G. et al. Bovine polymerized hemoglobin versus Hextend resuscitation in a swine model of severe controlled hemorrhagic shock with delay to definitive care // Shock. — Sep 2006. — Vol. 26(3). — P. 302-310.
8. Rosenblatt M.A. Strategies for minimizing the use of allogeneic blood during orthopedic surgery // Mt. Sinai J. Med. — Jan-Mar 2002. — Vol. 69(1–2). — P. 83-87.