Журнал «Здоровье ребенка» 6 (27) 2010
Вернуться к номеру
Синдром мальабсорбции у детей. Диагностика, дифференциальный диагноз, лечение Часть II
Авторы: Сенаторова А.С., Урываева М.К., Харьковский национальный медицинский университет
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье освещены этиология, патофизиологические изменения, клинические проявления, дифференциальный диагноз синдрома мальабсорбции у детей. Изложены современные взгляды на вопросы лечения.
Синдром мальабсорбции, дети, диагностика, лечение.
Диагностика
Заподозрить синдром мальабсорбции (СМА) можно у пациентов с хронической диареей, снижением массы тела и анемией.
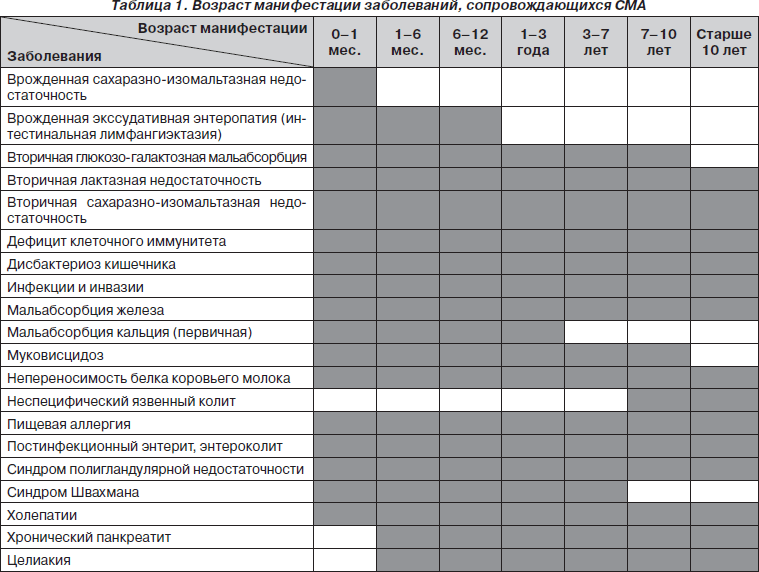
Для постановки диагноза важно учитывать возраст ребенка при манифестации СМА (табл. 1).
При уточнении анамнеза следует обратить внимание на характер начала заболевания, стойкость симптомов, связь с введением прикорма и т.д. Например, врожденные формы кишечной лимфангиэктазии регистрируются у детей 10–11 лет, приобретенная форма заболевания диагностируется у людей молодого возраста (средний возраст начала — 22,9 года). Целиакия манифестирует в детском возрасте (как правило, в 9–18 месяцев), однако может быть и более позднее начало болезни (у женщин — в 3–4-м; у мужчин — в 4–5-м десятилетиях жизни). Кроме того, при развитии синдрома мальабсорбции у женщин с целиакией оценивается связь начала заболевания с беременностью и родами.
Синдром короткой кишки возникает после операций, производимых у пациентов с болезнью Крона, заворотом и опухолями кишечника; радиационным энтеритом; тромбозом и эмболией мезентериальных сосудов; множественными кишечными свищами.
При уточнении анамнеза важно оценить начальные симптомы заболевания. Так, у большинства пациентов с болезнью Уиппла первая стадия болезни манифестирует симптомами поражения суставов. Может отмечаться повышение температуры тела. Появление синдрома мальабсорбции является второй стадией болезни Уиппла.
Основными начальными клиническими проявлениями первичной кишечной лимфангиэктазии являются массивные симметричные периферические отеки и диарея без примеси крови. Наблюдается задержка или отставание в росте.
Лабораторные методы диагностики
При клиническом исследовании анализа крови обращает на себя внимание анемия дефицитного генеза, которая возникает в результате нарушения всасывания железа и фолиевой кислоты. При дефиците железа развивается железодефицитная анемия. При вовлечении в патологический процесс подвздошной кишки нарушается абсорбция витамина В12, возникает мегалобластная анемия.
Лейкоцитоз с повышением СОЭ чаще всего наблюдаются при обострении очаговых инфекций или болезни Крона. Лейкоцитоз с палочкоядерным сдвигом характерен для лимфомы тонкой кишки.
Для диагностики синдрома мальабсорбции важное значение имеет содержание альбумина, кальция, щелочной фосфатазы. Так, гипоальбуминемия — проявление тяжелой мальабсорбции. Гипокальциемия и повышение активности щелочной фосфатазы — проявления остеомаляции. При синдроме мальабсорбции выявляются: гипокалиемия, гипохолестеринемия, гипоферремия.
Обязательным при СМА у детей является исследование кала. При СМА суточный объем кала увеличивается (более 500 г в сутки) и уменьшается на фоне голодания. При микроскопическом исследовании кала могут обнаруживаться мышечные волокна и крахмал. Может меняться рН кала. Так, например, при дисахаридазной недостаточности происходит сдвиг показателей рН в кислую сторону (рН менее 6,0).
Повышение содержания жира в кале (стеаторея) является одним из основных проявлений СМА. В норме всасывается 93–95 % поступившего с пищей жира, даже при высоком их содержании в пищевом рационе (150 г в сутки). При синдроме мальабсорбции средней степени тяжести эти значения снижаются до 60–80 %; тяжелой степени — до 50 %.
Содержание жира определяется в кале, собираемом в течение 72 часов. При синдроме мальабсорбции этот показатель превышает 7 г. Значительная потеря жиров с калом (более 14 г в сутки) свидетельствует о нарушении внешнесекреторной функции поджелудочной железы (ПЖ). При целиакии содержание жира в кале может повышаться до 50 г.
При стеаторее кал светлый, блестящий, с неприятным запахом и включениями жира. Его суточный объем увеличен. Такой стул плохо смывается со стенок унитаза после дефекации.
Нередко хроническая диарея характеризуется стеатореей 1-го или 2-го типа.
Стеаторея 1-го типа (с увеличением экскреции триглицеридов) характерна для патологии ПЖ:
— хронический панкреатит (ДД: данные ультразвукового исследования (УЗИ) ПЖ, исследования панкреатических ферментов в крови);
— врожденная изолированная недостаточность липазы (ДД: исследование липазы в дуоденальном содержимом при исключении других причин ее снижения, в том числе муковисцидоза);
— муковисцидоз (ДД: данные УЗИ ПЖ, повышение содержания хлора в потовой жидкости, натрия и хлора в ногтевых пластинках, результаты генетического исследования с целью выявления типичных мутаций);
— синдром Швахмана — Даймонда (ДД: врожденный синдром с аномалиями костной системы, нейтропенией, возможно, с анемией и тромбоцитопенией);
— синдром Иохансон — Бицарель;
— гормонопродуцирующие опухоли, в том числе синдром Золлингера — Эллисона (гастринома; ДД: желудочная гиперсекреция, язвы в луковице двенадцатиперстной кишки, повышенный уровень гастрина в крови), соматостатинома (особенно при сочетании стеатореи 1-го типа и признаков диабета), реже — нейробластома, РР-ома;
— мастоцитоз;
— редкая причина — холепатии (выраженный холестаз).
Стеаторея 2-го типа (с увеличением экскреции неэстерифицированных жирных кислот) характерна для патологии кишечника:
— постинфекционный энтерит;
— целиакия;
— герпетиформный дерматит;
— экссудативная энтеропатия;
— непереносимость белка коровьего молока;
— короткая тонкая кишка;
— аномалии кишечника;
— абеталипопротеинемия.
Оценка абсорбционной функции тонкой кишки производится с помощью D-ксилозного теста. Специфичность метода составляет 98 %; чувствительность — 91 %. Больной принимает внутрь натощак 25 г D-ксилозы и 200–300 мл воды, после чего, в течение 5 часов, собирает мочу. Забор венозной крови производится через 1 час. Если процессы всасывания в тонкой кишке не нарушены, то количество выделенной за это время D-ксилозы должно быть не менее 5 г, а уровень D-ксилозы в крови — не менее 20 мг/дл. У детей с массой тела менее 30 кг уровень D-ксилозы в крови должен быть не менее 25 мг/дл.
При синдроме мальабсорбции эти показатели уменьшаются. Однако при синдроме избыточного бактериального роста, у пациентов с нарушением функции почек, портальной гипертензией, асцитом выделение D-ксилозы с мочой происходит более медленно, что может вызывать затруднения в трактовке результатов теста.
Для оценки всасывания витамина В12 проводится тест Шиллинга. В норме после приема 1 мкг меченого цианокобаламина показатели его экскреции с мочой в течение суток составляют не менее 10 %. Показатели суточной экскреции витамина В12 с мочой менее 5–8 % свидетельствуют о нарушении его всасывания в тонкой кишке.
Тест Шиллинга выполняется повторно для уточнения причин этих патологических изменений. Так, если у пациента имеется недостаточность внутреннего фактора, который необходим для всасывания витамина В12 в подвздошной кишке, то после лечения мегалобластной анемии показатели суточной экскреции витамина В12 с мочой нормализуются.
Если причиной нарушенного всасывания витамина В12 стала недостаточность функции поджелудочной железы, то нормализация показателей суточной экскреции витамина В12 происходит после назначения ферментных препаратов.
При наличии синдрома избыточного бактериального роста нормализация показателей суточной экскреции витамина В12 происходит после назначения антибактериальных препаратов.
Всем детям с СМА необходимо исследование кала для выявления паразитов, простейших, грибов.
Исследование для выявления лямблиоза проводится у пациентов старше 2 лет, так как лямблиоз может вызывать синдром мальабсорбции.
В программу обследования детей с СМА входят инструментальные методы диагностики.
Выполняются обзорные снимки брюшной полости и энтероклизис (детям старшего возраста). Энтероклизис (высокая бариевая клизма с воздушным контрастированием) является рентгенологическим исследованием, при котором в тонкий кишечник помещаются бариевая взвесь и воздух. Эта процедура позволяет получить рентгенологическое изображение повреждений слизистой тонкого кишечника.
При синдроме мальабсорбции можно выявить: флокуляцию бариевой взвеси, слепые петли тонкой кишки, межкишечные анастомозы, множественные дивертикулы, фистулы, стриктуры и язвы; горизонтальные уровни жидкости и газа в отдельных петлях.
Характер изменений слизистой оболочки тонкого кишечника зависит от заболевания, которое привело к синдрому мальабсорбции. Так, можно обнаружить утолщение складок слизистой оболочки тонкой кишки при болезни Уиппла, лимфоме, амилоидозе, радиационном энтерите, синдроме Золлингера — Эллисона. При тяжелом течении целиакии визуализируется атрофия слизистой оболочки тощей, гипертрофия подвздошной кишок. Расширение тонкого кишечника характерно для целиакии и склеродермии. При тропической спру обнаруживается сглаженность рельефа слизистой оболочки.
С помощью компьютерной томографии органов брюшной полости можно обнаружить хронический панкреатит, панкреатолитиаз, увеличение мезентериальных лимфоузлов (при болезни Уиппла и лимфоме); расширение петель тонкой кишки.
При положительных результатах теста с D-ксилозой и выраженной стеаторее необходимо эндоскопическое исследование тонкой кишки. Этот метод диагностики является информативным у детей с целиакией, болезнью Уиппла, кишечной лимфангиэктазией и амилоидозом. В ходе исследования производится забор биопсийного материала.
Эндоскопическая ретроградная холангиогепатография выполняется, если есть подозрения, что синдром мальабсорбции — результат заболеваний печени или поджелудочной железы.
Аспирация содержимого двенадцатиперстной кишки производится в ходе эндоскопического исследования.
Бактериологический посев содержимого — информативный способ обнаружения избыточного роста бактерий в тонкой кишке. Диагноз подтверждается при концентрации микроорганизмов более 105/мл.
Биопсия тонкой кишки проводится для подтверждения диагноза и для оценки эффективности проводимой терапии. Исследуются биоптаты слизистой оболочки дистальных отделов двенадцатиперстной или тощей кишки. В них определяется наличие и концентрация ферментов, расположенных на щеточной кайме слизистой оболочки кишки (лактазы, сукразы, изомальтазы, трехалозы); проводится гистологическое исследование препарата.
Патологические изменения, обнаруживаемые в биоптатах тонкой кишки, определяются тем заболеванием, которое привело к развитию синдрома мальабсорбции.
Субтотальная атрофия ворсин у взрослых почти всегда связана с целиакией. У пациентов с целиакией обнаруживается также разрастание крипт и воспалительная инфильтрация собственного слоя слизистой оболочки.
Очаговая атрофия ворсин может быть следствием таких заболеваний, как: энтериты, лямблиоз, синдром избыточного бактериального роста, гипогаммаглобулинемия, лимфома, болезнь Уиппла, ВИЧ-энтеропатия, голодание.
Для болезни Уиппла характерно наличие ШИК-положительных макрофагов, инфильтрирующих собственную пластинку слизистой оболочки.
При кишечной лимфангиэктазии ворсины тонкой кишки нормальной высоты, но расширены вследствие отека; в строме видны расширенные лимфатические сосуды.
При амилоидозе обнаруживаются отложения амилоида по ходу мембран капилляров.
При лимфоме и болезни Крона выявляются специфические гистологические изменения в тонкой кишке, которые носят очаговый характер.
Для диагностики синдрома избыточного роста бактерий выполняются дыхательные тесты. Для проведения дыхательного водородного теста используются глюкоза, лактоза, лактулоза. Сахар метаболизируется бактериями тонкой кишки с образованием водорода, который затем всасывается в кишечнике. Поэтому после приема сахара он обнаруживается в выдыхаемом воздухе. Если у пациента имеется синдром избыточного бактериального роста, то при приеме любого сахара будет наблюдаться увеличение концентрации водорода в выдыхаемом воздухе.
Для диагностики лактазной недостаточности проводится проба с лактозой. Пациент должен принять внутрь 50 г лактозы, после чего определяется содержание глюкозы в крови. Отсутствие повышения содержания глюкозы в крови после нагрузки лактозой подтверждает диагноз лактазной недостаточности.
В крови пациентов с целиакией повышены титры антиглиадиновых антител; выявляются антитела к эндомиозину гладкомышечных клеток и тканевой трансглютаминазе. Обнаружение антиглиадиновых антител (IgG и IgA) и антител к тканевой трансглютаминазе свидетельствует о целиакии. Определение этих показателей производится иммуноферментным методом ЕLISA. Чувствительность теста — 100 %, специфичность — 95–97 %.
Специфичность метода выявления антител (IgA) к эндомиозину составляет 100 %. Однако важно помнить, что определение титров антител (IgA) к эндомиозину не проводится детям до 2 лет и может приводить к ложноположительным результатам в 2–3 % случаев у пациентов с селективным дефицитом IgA.
Лечение
Закономерности развития патологического процесса и основных патологических симптомокомплексов при различных видах СМА схожи, поэтому и тактика ведения больных с данной патологией мало зависит от этиологических факторов. Главные способы лечения больных с СМА — это диета и лечебное питание, основными принципами которых являются определение и элиминация продуктов, вызывающих СМА, с их адекватной заменой, а также индивидуальный подход к составлению элиминационного рациона.
Составление меню для детей с СМА требует от врача высокой квалификации и знаний в различных областях теоретической и практической медицины.
Необходимо учитывать:
— наследственные или приобретенные нарушения всасывания, требующие максимально быстрой коррекции;
— степень гипотрофии и обусловленное ею нарушение толерантности к пищевой нагрузке;
— состояние печени, поджелудочной железы и почек, лимитирующее количество белков и жиров в пище;
— высокую чувствительность кишечника больных детей к осмотической нагрузке;
— возраст ребенка;
— аппетит ребенка, его пищевые привычки и предпочтения.
Цели лечения:
— устранение симптомов мальабсорбции;
— нормализация массы тела;
— лечение основного заболевания, вызвавшего синдром мальабсорбции;
— профилактика и лечение осложнений синдрома мальабсорбции.
Основные принципы лечения больных с синдромом мальабсорбции:
— лечение основного заболевания — причины синдрома мальабсорбции;
— коррекция диеты больного с учетом этиологии и клинической картины;
— коррекция нарушений белкового обмена;
— коррекция витаминной недостаточности;
— коррекция электролитных нарушений;
— коррекция моторных нарушений пищеварительного тракта;
— лечение сопутствующего дисбактериоза;
— проведение регидратационной терапии.
Диетотерапия
Рациональное питание детей первого года жизни является одним из важнейших условий, обеспечивающих как их адекватный рост и развитие, так и устойчивость к действию инфекций и других неблагоприятных факторов внешней среды. Характер вскармливания на первом году жизни в значительной степени определяет состояние здоровья ребенка не только в раннем возрасте, но и в последующие периоды его жизни. Оптимальным видом питания для ребенка первого года жизни является материнское молоко. Его состав адекватен особенностям метаболизма малыша на ранних этапах его развития. При отсутствии возможностей грудного вскармливания должны использоваться адаптированные смеси. Основные принципы адаптации состава молочных смесей:
— увеличение количества бифидогенных и защитных факторов (введение лактулозы — пребиотика, благодаря которому микрофлора кишечника искусственно вскармливаемых детей приближается к микрофлоре младенцев, питающихся материнским молоком);
— уменьшение количества кальция, калия, натрия и обогащение комплексом витаминов, минеральных солей и микроэлементов;
— введение холина, карнитина, инозитола и других биологически активных соединений.
Так, например, детям с целиакией показано введение безглютеновых адаптированных смесей и продуктов питания [15, 19, 21]. К безглютеновым относят продукты, содержащие не более 200 мг глютена на килограмм сухого вещества. Безглютеновая диета предусматривает использование риса, гречихи, кукурузы, картофельной муки, сои, различных овощей (картофель, морковь, капуста, кабачок, тыква и др.), фруктов (яблоки, груши, бананы и др.), может включать фруктовые соки, различные сорта мяса и птицы, нежирные сорта рыбы, маргарин, растительные масла, мед, варенье, джемы, желатин. Разработаны специальные безглютеновые диеты, по своему составу являющиеся физиологическими, имеющие повышенное содержание белка и кальция.
У детей первого года жизни можно использовать безглютеновые каши, монокомпонентные консервы для детского питания и безлактозные смеси, а в тяжелых случаях — гидролизатные смеси, которые в значительной степени сокращают сроки парентерального питания, если в нем есть необходимость. Приведем несколько примеров таких продуктов.
Безглютеновые молочные каши:
— Винни (Колинска, Польша);
— Милупа (Milupa, Германия);
— Симилак (Abbott Laboratories, США);
— Хумана (Humana, Германия);
— Малышка (МакЛав, Лавр-К, Россия);
— Топ-Топ (Nutricia, Нидерланды);
— Туттели (Valio Tutteli, Финляндия);
— Хайнц (Heinz, Германия).
Безглютеновые безмолочные каши:
— Бич нат (Beech Nut Naturals, США);
— Винни;
— Гербер (Gerber, США);
— Нестле (Nestle, Швейцария);
— Симилак;
— Хайнц;
— Хумана;
— Топ-Топ.
Мясные монокомпонентные консервы:
— с говядиной: Пюре говядина (Тихорецкий МК, Россия), Гербер 71 (Gerber, США), Маклав Малыш (МакЛав, Лавр-К, Россия), Говядина (Тихорецкий МК, Россия);
— со свининой: Пюре ветчина (Тихорецкий МК, Россия), Гербер 71, Пюре из свинины, Пюре из свинины витаминизированное, Хрюша (МакЛав, Лавр-К, Россия);
— с индейкой, курицей, телятиной: Пюре индейка, Пюре телятина, Пюре цыпленок (Тихорецкий МК, Россия), Гербер 71;
— с мясом ягнят: Пюре ягнятина (МакЛав, Лавр-К, Россия), Гербер 71;
— с кониной: Конек-горбунок (МакЛав, Лавр-К, Россия).
Большое значение имеют смеси, обогащенные лизоцимом, цинком, секреторными иммуноглобулинами. Больным с нарушенной микрофлорой ЖКТ целесообразно пользоваться молочнокислыми препаратами, обогащенными биодобавками. Для детей старшего возраста в настоящее время выпускаются безглютеновые продукты, имитирующие хлеб, муку, полуфабрикаты для выпечки, крупы, печенье, макаронные изделия и др. Специальные безглютеновые продукты обычно имеют маркировку в виде перечеркнутого колоска и/или надписей Gluten-free или «Не содержит глютена». Основными производителями таких продуктов, представленных на российском рынке, являются компании Schar GmbH (Италия), Glutano (Pauli Bisquit GmbH, Германия), Finax AB и Semper (Швеция). В настоящее время появляются специализированные продукты для больных целиакией и отечественного производства, хотя их ассортимент пока остается скудным.
Больным с синдромом мальабсорбции назначается диета с высоким содержанием белка (до 130–150 г/сут). Содержание жира в пищевом рационе больных (особенно при наличии стеатореи) должно быть снижено примерно на 50 % по сравнению с рекомендуемым.
У больных с гипопротеинемией применяются смеси для энтерального питания, содержащие необходимые нутриенты, витамины и микроэлементы. Для более полного усвоения эти смеси вводятся в желудок через зонд. Рекомендуются специализированные продукты, которые представляют собой сбалансированные сочетания нутриентов, содержащие растворимые формы молочных белков, обезжиренное сухое молоко, сухой жировой компонент, легкоусвояемые углеводы, основные витамины, соли калия, натрия, магния, кальция; железо и фосфор.
В тяжелых случаях возможно проведение парентерального питания. Однако следует помнить, что длительное парентеральное питание часто приводит к развитию ряда осложнений и прогностически неблагоприятно для пациентов с синдромом мальабсорбции.
Медикаментозное лечение
СМА всегда сопровождается болевым синдромом, спастическими явлениями и гиперсекрецией. Патогенез нарушений двигательной функции ЖКТ при СМА проявляется в спастических сокращениях гладкой мускулатуры и атонии со стазом кишечного содержимого, повышении внутриполостного давления и растяжении стенки полостного органа. Моторика мышц регулируется периферическими и центральными механизмами. Через парасимпатический отдел вегетативной нервной системы непосредственно реализуется сокращение мышечного волокна. Блокада парасимпатических влияний дает возможность предупреждать мышечный спазм, гипермоторику кишечника, гиперсекрецию желудка и поджелудочной железы, что способствует исчезновению многих симптомов при заболеваниях ЖКТ, положительно влияет на течение болезни и ее прогноз [12]. Такими свойствами обладает препарат Риабал (прифиния бромид), который является селективным М-холиноблокатором.
Холиноблокаторы давно используются в различных областях медицины. В последнее время благодаря фармакологическим разработкам были усовершенствованы фармакодинамические и фармакокинетические характеристики препаратов этой группы. Сегодня важнейшим требованием, выдвигаемым к этим лекарственным средствам, является высокая селективность. Под селективностью холиноблокаторов подразумевают непосредственное и избирательное действие препарата на нервно-мышечный синапс или, при необходимости, на межнейронный синапс центральной нервной системы [2, 3, 9, 18]. Помимо этого, важным требованием, выдвигаемым к любым лекарственным препаратам, является минимизация побочных эффектов и противопоказаний к применению. В соответствии с этими требованиями разработаны и все более широко внедряются в современную клиническую практику селективные М-холиноблокаторы.
В настоящее время определено пять видов мускариновых рецепторов, концентрация которых в различных органах и системах существенно варьирует. В ЖКТ выявлены все пять видов М-холинорецепторов, в то время как в нервно-мышечных синапсах — преимущественно М3- и М4-холинорецепторы, которые тормозят передачу нервного импульса, инициирующего мышечное сокращение [11, 13].
Одним из современных и селективных в отношении гладкомышечных клеток ЖКТ М3-холиноблокаторов является препарат Риабал (прифиния бромид), применение которого может обеспечить купирование болевого абдоминального синдрома, а также положительно влиять на течение болезни, ее прогноз и качество жизни пациентов [1, 3, 4].
Учитывая механизм действия Риабала, его применяют у больных с СМА и болевым синдромом, спастическими явлениями и гиперсекрецией [5, 8, 12].
Благодаря высокой селективности побочные действия у Риабала значительно менее выражены, чем у неселективных нейротропных спазмолитиков. Побочные явления быстро исчезают после уменьшения дозы препарата или его отмены [16, 17].
Нейротропный селективный спазмолитик Риабал имеет ряд особенностей, которые выгодно отличают его от других препаратов этой группы. Риабал выборочно блокирует М-холинорецепторы органов брюшной полости и малого таза, корригирует моторику ЖКТ (способствует нормализации перистальтики и опорожнению желудка, снижает тонус гладкой мускулатуры) и практически не влияет на М-холинорецепторы других органов, умеренно угнетает секрецию соляной кислоты. Риабал имеет высокий профиль безопасности и может применяться у новорожденных и беременных.
Риабал выпускается в нескольких лекарственных формах — парентеральной (раствор для инъекций), таблетированной и в виде сиропа для детей раннего возраста [10].
Дозировка Риабала у детей от 3 до 6 месяцев — по 1–2 мл каждые 6–8 часов, от 6 до 12 месяцев — по 2 мл каждые 6–8 часов, от 1 года до 2 лет — по 5 мл каждые 6–8 часов, от 2 до 6 лет — 5–10 мл каждые 6–8 часов.
Учитывая отсутствие золотого стандарта для лечения боли при синдроме мальабсорбции, рекомендуется индивидуальный подход к каждому ребенку, учитывающий причину и клинические особенности СМА. При этом выбор препарата должен осуществляться на основе критериев высокого профиля безопасности и хорошей переносимости, с позиций чего применение Риабала является весьма актуальным.
Для коррекции поливитаминной недостаточности и дефицита минералов применяют витамин В12. Раствор цианокобаламина (В12) может вводиться парентерально. Детям 100 мкг/сут вводятся в/м или п/к в течение 10–15 дней, затем 60–100 мкг/мес.
Никотинамид или никотиновая кислота назначаются в/м: в начале лечения по 0,5 мл; затем доза увеличивается на 0,5 мл по следующей схеме: 2 мл — 2 дня, 3 мл — 3 дня и т.д. до 5 мл. После этого доза уменьшается.
Для коррекции анемии назначают препараты железа и фолиевой кислоты.
Фолиевая кислота назначается детям по 1 мг/сут (внутрь, в/м или п/к).
Антибактериальная терапия применяется для лечения детей с тропической спру, болезнями Гиршпрунга, Крона, Уиппла, синдромом избыточного бактериального роста.
Гормональная терапия применяется у пациентов с болезнями Крона, Уиппла, целиакией (при неэффективности аглютеновой диеты). С этой целью назначается преднизолон в возрастных дозах, в зависимости от степени тяжести.
Антисекреторные и противодиарейные препараты уменьшают кишечную секрецию и замедляют моторику тонкой кишки.
Применяется октреотид (сандостатин ) п/к: у детей препарат применяется в дозе 1–10 мкг/кг/сут в/в или п/к (не более 1500 мкг/сут).
Детям также назначается лоперамид (имодиум, лопедиум) в дозе 1 мг 2 р/сут; старше 5 лет — в дозе 2 мг 2 р/сут.
Препараты холеретического действия назначаются детям, у которых синдром мальабсорбции вызван хроническими заболеваниями печени (циррозом печени), а также больным с синдромом короткой кишки. Урсодеоксихолевая кислота (урсофальк) оказывает холеретический эффект. Применяется внутрь: у детей — 8– 10 мг/кг/сут 2 р/сут (не более 300 мг/сут). С этой же целью назначается фенобарбитал (люминал) внутрь: детям — в дозе 3–8 мг/кг 2–4 р/сут.
Ферментотерапия проводится при недостаточности поджелудочной железы у детей с синдромом мальабсорбции (например при хроническом панкреатите, болезни Уиппла, муковисцидозе).
Панкреатические ферментные препараты представляют собой микрогранулы или микротаблетки с различным содержанием панкреатических ферментов (липазы, амилазы и протеазы), покрытые рН-чувствительной оболочкой и помещенные в желатиновые капсулы. Оболочка растворяется только в щелочной среде двенадцатиперстной кишки, не разрушаясь в кислой среде желудка. В дозировке указывается активность препарата (в ЕД) по липазе.
Доза препаратов подбирается индивидуально (в зависимости от потребности в липазе), с учетом возраста и веса ребенка, а затем корригируется с учетом динамики клинической симптоматики на фоне лечения. В большинстве случаев достаточно 20 000–40 000 ЕД липазы на прием пищи. При тяжелом течении синдрома с выраженной стеатореей суточная доза препарата увеличивается до 50 000–60 000 ЕД на прием пищи.
Эффективность этой терапии оценивается по клиническим (нормализация частоты и характера стула) и лабораторным (исчезновение стеатореи и креатореи в копрограмме, нормализация концентрации триглицеридов в липидограмме кала) показателям.
Отсутствие клинического эффекта от заместительной терапии ферментами поджелудочной железы (дозы более 3000 ЕД/кг на прием пищи) может быть связано с повышенной кислотностью желудка или двенадцатиперстной кишки (оболочка микросфер или микротаблеток в кислой среде двенадцатиперстной кишки и тонкого кишечника не растворяется и фермент не действует). В таких случаях длительно применяются препараты, угнетающие секрецию соляной кислоты слизистой желудка (антагонисты Н2-рецепторов или ингибиторы протонной помпы).
Применяются креон 10 000 и креон 25 000, мезим форте 10 000, панцитрат 10 000 и панцитрат 25 000.
Профилактика синдрома мальабсорбции
Профилактика синдрома мальабсорбции сводится к профилактике того заболевания, которое привело к его развитию.
Прогноз при синдроме мальабсорбции
В некоторых случаях синдром мальабсорбции является транзиторным и купируется на фоне проведения диетотерапии. Так, атрофические изменения в слизистой оболочке тонкого кишечника, вызванные острыми энтеритами или неправильным питанием, приводят к повреждению примерно 80 % всасывающей поверхности. После устранения причинно-значимого фактора восстановление слизистой оболочки тонкого кишечника происходит в течение 4–6 дней. В некоторых случаях может понадобиться более длительный период времени — до 2 месяцев и более.
Если синдром мальабсорбции прогрессирует, то он может привести к осложнениям и сокращению продолжительности жизни пациента вследствие истощения. Например, пациенты с абеталипопротеинемией (врожденными нарушениями всасывания и транспорта жиров) погибают в молодом возрасте вследствие возникновения осложнений со стороны сердца.
Синдром избыточного бактериального роста может ингибировать адаптационные механизмы тонкой кишки и повышать риск возникновения нарушений со стороны печени.
Важная составляющая успешного выхаживания детей с СМА — правильный уход и профилактика вторичных инфекционных осложнений. Чтобы назначения врача соблюдались, к уходу и кормлению необходимо привлечь мать больного ребенка, так как именно от ее навыков и мотивированности зависит эффективность терапии, особенно в амбулаторных условиях.
1. Абаев Ю.К. Боли в животе у детей: Практическое руководство. — Ростов н/Д: Феникс, 2007. — 287 с.
2. Абдоминальная боль. Алгоритмы купирования (по материалам XIX Весенней сессии Национальной школы гастроэнтерологов, гепатологов «Билиопанкреатология — 2003», Москва) // Мистецтво лікування. — 2003. — № 2. — С. 45-47.
3. Артамонов Р.Г., Куйбышева Е.В., Бекташанц Е.Г. Боли в животе у детей // Мед. каф. — 2006. — № 3–4. — С. 19-31.
4. Лисенко Г.І., Хіміон Л.В., Ященко О.Б. та ін. Біль у животі (лекція) // Сімейна медицина. — 2007. — № 1. — С. 42-47.
5. Белоусов Ю.В., Шутова Е.В. Риабал в детской гастроэнтерологической практике // Современ. педиатрия. — 2008. — № 3. — С. 84-86.
6. Белоусов Ю.В., Белоусова О.Ю. Функциональные заболевания пищеварительной системы у детей. — Харьков: ИД «ИНЖЭК», 2005. — 256 с.
7. Третьякова О.С., Бекетова Г.В., Вовк С.С. и др. Гастроэнтерология детского и подросткового возраста: избр. вопр. / Под ред. С.С. Казак — К., 2006. — 260 с.
8. Денисова М.Ф., Донде С.М. Клиническая оценка применения препарата риабал у детей с заболеваниями органов пищеварения // Соврем. педиатрия. — 2006. — № 2. — С. 73-74.
9. Лысенко Г., Ткаченко В. Проблема боли в общеврачебной практике. Ч. 1 // Ліки України. — 2005. — № 3. — С. 5-10.
10. Машковский М.Д. Лекарственные средства: В 2 т. — Харьков: Форсинг, 1998. — Т. 1. — 592 с.
11. Минушкин О.Н. Абдоминальная боль. Спазмолитики: их выбор и продолжительность лечения // Врач. — 2007. — № 10. — С. 2-7.
12. Нагорная Н.В., Лимаренко М.П., Бордюгова Е.В. Рациональная фармакотерапия функциональных гастроинтестинальных расстройств у детей раннего возраста // Тези української наук.-практ. конф. «Проблемні питання діагностики та лікування дітей з соматичною патологією», 13–14 березня 2008 р., м. Харків. — С. 82-84.
13. Павлова С.И. Спазмолитические средства // Вестник семейной медицины. — 2008. — № 3. — С. 38-41.
14. Практическое руководство по детским болезням / Под ред. В.Ф. Коколиной, А.Г. Румянцева. — М.: Медпрактика, 2003. — Т. 2: Гастроэнтерология детского возраста / Бельмер С.В., Гасилина Т.В., Капранов Н.И. и др.; Под ред. С.В. Бельмера, А.И. Хавкина. — С. 151-161, 263.
15. Методическое письмо «Новые технологии питания детей, больных целиакией и лактазной недостаточностью». — М., 2005.
16. Скрыпник И.Н., Маслова А.С. Спазмолитическая терапия в клинике внутренних болезней: роль и место неселективных миогенных спазмолитиков // Укр. терапевт. журн. — 2008. — № 2. — С. 92-98.
17. Шульпекова Ю.О., Драпкина О.М., Ивашкин В.Т. Абдоминальный болевой синдром // Рос. журн. гастроэнтерол., гепатол. и колопроктол. — 2002. — Т. 12, № 4. — С. 8-15.
18. Эрдес С., Мухаметова Е. Абдоминальная боль у детей и пути ее терапии // Врач. — 2007. — № 5. — С. 27-31.
19. Руководство по лечебному питанию детей / Под ред. К.С. Ладодо. — М., 2000. — 384 с.
20. Чубарова А.И., Гераськина В.П., Кыштымов М.В. и др. Эффективность применения ферментотерапии и диетотерапии при лактазной недостаточности у новорожденных // Вопросы детской диетологии. — 2003. — Т. 1, № 4. — С. 21-24.
21. Рабочий протокол диагностики и лечения целиакии у детей // Детская гастроэнтерология. — 2005. — № 1. — С. 38-46.
22. Мухина Ю.Г., Шумилов П.В., Дубровская М.И., Чубарова А.И. Принципы диагностики и лечения синдрома мальабсорбции / ГОУ ВПО «Российский государственный медицинский университет» Федерального агентства по здравоохранению и социальному развитию, курс гастроэнтерологии и диетологии ФУВ, Москва.
23. Слободян Л.М. Синдром мальабсорбції, діагностика і реабілітація. — Тернопіль: Укрмедкнига, 2001. — 114 с.
24. Лукушкина Е.Ф., Лазарева Т.С. Диареи у детей. Клиника, диагностика, лечение. — Нижний Новгород: НГМА, 2002. — 51 с.
25. Сенаторова А.С. Дифференциальная диагностика синдрома мальабсорбции у детей // Сучасна педіатрія. Проблеми та перспективи. — 2007. — С. 21-24.
26. Белоусов Ю.В. Недостаточность органов пищеварения у детей: классификация, клиника, диагностика, принципы коррекции // Современная педиатрия. — 2005. — № 4 (9). — С. 88-90.