Журнал «Медицина неотложных состояний» 3(34) 2011
Вернуться к номеру
Механизм действия антикоагулянтов и перспективы клинического применения ривароксабана — первого эффективного ингибитора фактора Ха с возможностью энтерального введения (краткий литературный обзор)
Авторы: Никонов В.В., Курсов С.В. Харьковская медицинская академия последипломного образования Харьковский национальный медицинский университет
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Литературный обзор посвящен новым возможностям профилактики венозных тромбозов и тромбоэмболических осложнений в различных разделах клинической медицины при помощи появившегося на международном рынке фармпрепаратов и зарегистрированного в Украине первого действенного ингибитора десятого активированного фактора свертывания крови с возможностью энтерального применения препарата.
Свертывание крови, венозный тромбоз, фактор Ха, ривароксабан, ксарелто.
Острые венозные тромбозы — одна из сложных и чрезвычайно важных проблем ангиологии, и это обусловлено прежде всего тем, что они являются основным источником (свыше 90 %) тромбоэмболии ветвей легочной артерии, а потому тесно сопряжены с летальными исходами. Число случаев острых тромбозов глубоких вен оценивается на современном этапе как 56–160 на 100 000 населения в год [1–3]. Кроме того, в 80–95 % случаев после перенесенного тромбоза глубоких вен нижних конечностей в последующем развивается клиника посттромботической болезни [4–6]. Наиболее значительным фактором риска развития посттромбофлебитического синдрома является тромбоз глубоких проксимальных вен нижних конечностей. По отношению к общему числу больных с заболеваниями вен нижних конечностей больные острыми венозными тромбозами составляют 30 % обследованных, однако большое число тромбозов клинически не всегда представляется возможным выявить. Подозрение на наличие первичного тромботического очага или перенесенный тромбоз возникает лишь при развитии осложнений: тромбоэмболии легочной артерии или посттромботической болезни. Следовательно, реальный общий удельный вес венозных тромбозов в числе сосудистых заболеваний значительно выше, чем выявляется клинически. Число же тромбоэмболических осложнений оценивается в настоящее время как 71 на 100 000 населения в год. Тромбоэмболическим осложнениям в большей степени подвержены афроамериканцы и пациенты пожилого и старческого возраста [7–9]. В возрасте 20–40 лет наибольшая частота тромбоэмболических осложнений наблюдается у женщин в основном после родов, выкидышей и при применении противозачаточных средств. В возрасте 45–75 лет максимальная частота тромбоэмболии отмечена у мужчин, болеющих злокачественными новообразованиями [1, 3, 8].
Согласно классической концепции Рудольфа Вирхова, одного из пионеров исследования процессов внутрисосудистого свертывания крови, благодаря которому в физиологии появились такие термины, как «тромб», «эмболия», «фибриноген», причинами тромбообразования являются замедление кровотока, гиперкоагуляция и повреждения стенки сосуда [10, 11]. К развитию тромбообразования предрасполагают варикозное расширение вен [13–15], установка внутривенных катетеров (особенно в бедренную вену) [16–18], заболевания сердца (ишемическая болезнь сердца, пороки сердца) [19–21], нарушения сердечного ритма [22, 23], гипертоническая болезнь и симптоматические артериальные гипертонии [24, 25], атеросклероз [26, 27], злокачественные новообразования [28–30], острые и хронические инфекции [31], гиподинамия и вынужденная иммобилизация (хирургические операции, особенно в травматологии и ортопедии) [32, 33], нефротический синдром [34, 35], применение эстрогенов [36], неправильная терапия антагонистами витамина К [37], химиотерапия [38], назначение диуретиков [39], глюкокортикоидов [40], ганглиоблокаторов, эритропоэтина [41]. Таким образом, учитывая мировую тенденцию к постарению населения, широкое распространение атеросклероза, сахарного диабета и артериальной гипертонии, увеличение числа хирургических технологий, можно констатировать, что в современных клиниках имеется большое количество причин для наблюдения тромбообразования и тромбоэмболических осложнений. Данное обстоятельство диктует активное применение мероприятий, способствующих снижению тромбообразования как у стационарных, так и у амбулаторных больных.
Наиболее распространенными и эффективными методами профилактики и лечения венозных тромбозов являются: эластическая компрессия нижних конечностей (применение компрессионных чулок и гольфов), перемежающаяся пневматическая компрессия, терапия антикоагулянтами, инфузионная терапия с использованием синтетических коллоидных плазмозаменителей, хорошо удерживающихся в сосудистом русле (снижение вязкости крови), применение антиагрегантов, применение венотоников [42–44]. Все более широкое распространение получает установка cava-фильтров [45, 46].
Среди средств предотвращения и лечения венозных тромбозов, безусловно, лидирующее место занимают антикоагулянты. До недавнего времени (до широкого внедрения в клиническую практику нефракционированных гепаринов) длительная антикоагулянтная терапия осуществлялась за счет введения препаратов с непрямым действием с возможностью перорального приема — непрямых антикоагулянтов. Механизм действия этих препаратов обусловлен в основном угнетением пострибосомального синтеза прокоагулянтов группы протромбинового комплекса (факторов свертывания крови II, VII, IX, X), а также нарушением специфических превращений их главного предшественника — PIVKA (protein indused by vitamain K absence — протеин, индуцируемый отсутствием витамина К). Антивитамины К применяются в противотромботической терапии более 50 лет. За это время стали хорошо известны их отрицательные эффекты и слабые стороны [10, 47].
Серьезным недостатком действия непрямых антикоагулянтов является медленное наступление их эффекта. Максимальное гипокоагуляционное действие наступает через 4–5 суток после начала лечения. Попытки ускорить наступление желаемого эффекта, используя тактику применения в начале терапии ударных доз, зачастую приводят к развитию кровотечений. Частота наблюдений геморрагических осложнений при проведении терапии непрямыми антикоагулянтами может колебаться в пределах 12–20 %. Все объясняется отсутствием селективного действия препаратов. Как уже упоминалось, при применении антивитаминов К страдает активность сразу нескольких факторов свертывания крови, и это делает терапию трудноуправляемой. Различные препараты данной группы имеют различную скорость наступления действенного эффекта, его силу, а также различную кумуляцию. Восстановление процессов свертывания крови происходит быстрее при лечении препаратами с более коротким сроком действия, что грозит развитием рикошетных тромбозов. Помимо геморрагического синдрома препараты индуцируют повышение сосудистой проницаемости. Геморрагический синдром и кровоточивость связаны не только с изменением свертываемости крови, но и с повышением проницаемости капилляров и посткапиллярных венул (простациклинсинтезирующая активность). В среде практических врачей сложилось неправильное представление, что для контроля над терапией непрямыми антикоагулянтами необходимым и достаточным методом мониторинга является периодическое определение протромбинового времени. Между тем, геморрагии возникают и при нормальных показателях протромбинового времени, причина чего уже указана выше. Следовательно, контроль эффекта непрямых антикоагулянтов многоступенчатый и сложный [10, 47]. Антивитамины К могут оказывать общее токсическое действие. Главным отрицательным действием при этом является гепатотоксичность. Кроме того, имеются сложные взаимодействия между антивитаминами К и множеством других лекарственных средств, очень часто использующихся в клинической практике. И, наконец, следует отметить, что непрямые антикоагулянты эффективны главным образом при лечении венозных тромбозов и профилактике тромбоэмболий у больных с тромбозом глубоких вен голени, пороками митрального клапана и фибрилляцией предсердий. При лечении пациентов с протезированными клапанами сердца, шунтами, стентированием сосудов, синдромом диссеминированного внутрисосудистого свертывания крови, артериальной эмболией и инфарктом миокарда их эффективность значительно ниже [48–50]. Низкокачественная терапия непрямыми антикоагулянтами рассматривается как наиболее сильный фактор риска формирования посттромбофлебитического синдрома [51]. Перечисленные недостатки антивитаминов К уже давно заставляют ученых разрабатывать другие антикоагулянтные средства, пригодные для энтерального введения.
Ривароксабан (rivaroxaban) — новый антикоагулянтный препарат для перорального приема, разработанный и производящийся фирмой Bayer AG в кооперации с фирмой Johnson & Johnson Pharmaceutical Research & Development. В определенном количестве стран препарат зарегистрирован под названием хarelto. Это первый имеющийся в распоряжении действенный ингибитор коагуляционного фактора Ха (фактора Стьюарта — Прауэра), хорошо адсорбирующийся в кишечнике, а потому пригодный для энтерального введения. Фактор Ха является ключевым фактором процесса внутрисосудистого свертывания крови, поскольку катализирует превращение протромбина в тромбин. Угнетение ривароксабаном через нарушение работы фактора Ха указанного процесса приводит к уменьшению продукции тромбина и поэтому предотвращает образование фибрина. Фактор Х вырабатывается в печени в неактивном состоянии при участии витамина К и состоит из двух полипептидных цепей: тяжелой, содержащей активный центр, и легкой — с остатком карбоксиглутаминовой кислоты, необходимой для присоединения к фосфолипидам. Фактор Х трансформируется в активный фактор Ха. Последний является отличной мишенью для действия антикоагулянта, поскольку он инициирует коагуляционный каскад. При участии одной молекулы фактора Ха из протромбина синтезируется 1000 молекул тромбина. При ингибировании этого фактора блокируется и синтез тромбина [52, 53]. По сути дела, такой механизм действия совпадает с основным эффектом фракционированных гепаринов, действующих через активацию антитромбина III с предпочтительным ингибированием работы факторов Ха и IIa (протромбина) [52, 54, 55].
Преимущество данного эффекта очевидно вследствие того факта, что воздействие на свертывающую систему крови является прицельным и селективным, значительно отличаясь от работы в организме непрямых антикоагулянтов и гепарина. Гепарин влияет на процесс коагуляции в основном через связывание антитромбина III c образованием активного комплекса гепарин — антитромбин III. Этот комплекс инактивирует большое число коагуляционных энзимов, включая тромбин (IIa), факторы IXa, Xa, XIa (плазменный предшественник тромбопластина) и XIIa (фактор Хагемана). Из них тромбин и фактор Ха наиболее чувствительны к ингибированию, но человеческий тромбин в 10 раз более чувствителен к ингибированию комплексом гепарин — антитромбин III, чем фактор Ха. Для профилактики тромбообразования угнетение активности фактора Ха имеет, однако, большее значение, чем подавление последующих фаз коагуляции, связанных с эффектом тромбина [10, 56, 57]. Последние обстоятельства затрудняют «управление» терапией гепарином и повышают риск как геморрагических осложнений, так и рикошетных тромбозов, поскольку в организме только 1/3 гепарина связывается с антитромбином III, а 2/3 имеют минимальную противосвертывающую активность. Низкомолекулярные гепарины и ривароксабан, действуя избирательно на фактор Ха свертывания крови, обеспечивают противотромботический эффект при минимальном риске геморрагических осложнений. В частности, антикоагулянтное действие эноксапарина прямо коррелирует с угнетением активности фактора Х [56–58].
Ривароксабан (rivaroxaban, хarelto, BAY 59-7939) конкурентно ингибирует фактор Ха в концентрации 0,4 нмоль/л c 10 000-кратной селективностью по сравнению с другими сериновыми протеазами и также ингибирует протромбиназу. Ингибирование эндогенного фактора Ха более эффективно в плазме человека, чем в плазме животных. Ривароксабан демонстрирует антикоагулянтный эффект, удваивая протромбиновое время и активированное частичное тромбопластиновое время в концентрации 0,23–0,69 мкмоль/л. Invitro препарат разрушает венозные тромбы (фибриновые с малым числом тромбоцитов). Скорость действия дозозависима с эффективной дозой ED-50 (дозой, обеспечивающей наступление интересующего эффекта в 50 % наблюдений) 1 мг/кг. Ривароксабан, кроме того, проявляет способность разрушать артериальные тромбы (фибриновые с большим числом тромбоцитов) в артериовенозных шунтах у экспериментальных животных в дозе ED-50, составляющей 5 мг/кг. 32 % эффективной дозы обеспечивают слабое ингибирование фактора Ха, и этого достаточно для угнетения развития тромбоза в венах. Для редуцирования артериального тромбоза дозы должны обязательно составлять 74–92 % эффективной дозы ED-50 [59–61].
Ривароксабан не оказывает значительного влияния на функции протромбина и антитромбина III. Как уже упоминалось выше, пиковая концентрация препарата в плазме достигается в период от 2 до 4 часов после его приема внутрь. Биодоступность колеблется в пределах 60–80 %. Присутствие пищи увеличивает максимум концентрации в плазме, а также время до наступления максимума концентрации. Протромбиновое время увеличивается. Оно возрастает на 53 % после приема 10 мг препарата и на 83 % после приема 20 мг препарата в тех случаях, если больные принимают пищу, и увеличивается на 44 и 53 % соответственно, если пациенты находятся в состоянии голодания.
Таким образом, прием пищи увеличивает усвоение препарата. Стартовая активность фактора Ха после введения 5–80 мг ривароксабана уменьшается до 20–61 % своего исходного значения. Препарат действует в течение 8–12 часов, но активность фактора коагуляции Ха не возвращается к нормальной в течение 24 часов, что делает возможным принимать ривароксабан 1 раз в сутки. В отличие от варфарина и других непрямых антикоагулянтов процесс лечения ривароксабаном не требует рутинного исследования показателей коагулограммы [62–64].
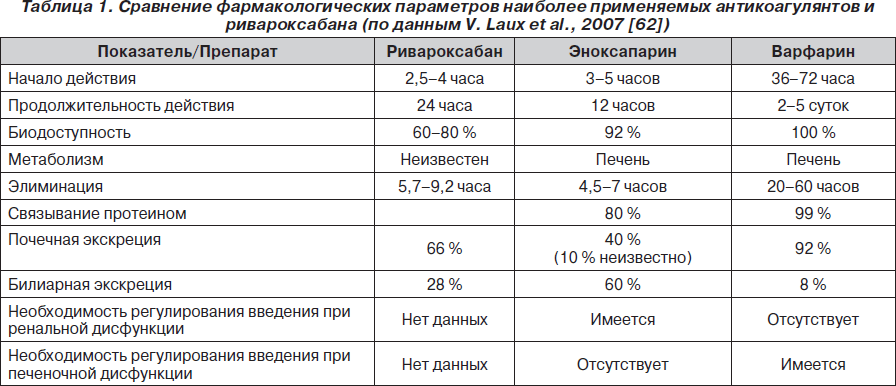
Метаболизм препарата до конца не изучен. Предполагается, что он может подвергаться превращению в печени и почках. В связи с тем, что другие известные ингибиторы фактора Ха метаболизируются в печени, имеется высокая вероятность превращений в этом органе ривароксабана. 66 % препарата и его метаболитов выводятся из организма через почки, причем около 36 % выводится в неизмененном виде. 28 % препарата и его метаболитов выводятся из организма через билиарный тракт. Не обнаружено различий в метаболизме препарата у мужчин и женщин. В табл. 1 указаны основные отличия фармакологических параметров наиболее часто применяющихся антикоагулянтов и ривароксабана [62, 65, 66].
Среди клинических исследований, посвященных изучению действия ривароксабана, следует выделить группу исследований RECORD (Regulation of Coagulation in Orthopaedic surgery to prevent Deep-vein thrombosis and pulmonary embolism — Регуляция коагуляции с целью предотвращения тромбоза глубоких вен и легочной эмболии при проведении ортопедических операций). Исследование RECORD 1 преследовало цель сравнительного изучения возможностей предотвращения глубоких венозных тромбозов с помощью ривароксабана и эноксапарина. Результаты проведенной работы показали, что эффект перорального приема 10 мг ривароксабана превосходил эффект подкожного применения эноксапарина в дозе 40 мг. Ривароксабан значительно лучше предотвращал как тромбообразование, так и смертельные исходы после тотального эндопротезирования тазобедренного сустава (ТЭТС) [61].
Результаты исследования RECORD 2 были опубликованы A.K. Kakkar et al. в журнале Lancet в июне 2008 года (epub ahead of print) и снова содержали результаты сравнительного изучения эффективности ривароксабана и эноксапарина в профилактике венозных тромбозов и тромбоэмболических осложнений после ТЭТС. Исследование проводилось в 123 центрах, расположенных на территории 21 страны. Обследовано и пролечено 2509 пациентов старше 18 лет. Ривароксабан назначался за 12 часов до операции, а затем через 6–8 часов после операции. Продолжительность лечения ривароксабаном составляла 31–39 суток. Эноксапарин назначался пациентам другой группы подкожно за 12 часов до операции и через 6–8 часов после операции. Срок лечения эноксапарином составил 10–14 суток. В результате анализа полученных данных снова выявлено преимущество перорального введения ривароксабана над подкожными инъекциями эноксапарина в дозе 40 мг. Частота осложнений при применении двух способов антикоагулянтной терапии, среди которых была отмечена только эпизодическая кровоточивость, была одинаковой [67].
Результаты исследования RECОRD 3 были опубликованы практически одновременно. Оно проводилось на базе 147 центров на территории 19 стран. В исследование включено 2556 пациентов, которым выполнялось тотальное эндопротезирование коленного сустава (ТЭКС). Ривароксабан назначался больным по схеме, аналогичной исследованию RECОRD 2, но средняя продолжительность лечения составила 11,9 суток. Средняя продолжительность терапии эноксапарином была 12,5 суток. В ходе исследования оказалось, что тромбоз глубоких вен, нефатальная тромбоэмболия ветвей легочной артерии и смерть от любой причины имели место у 79 из 824 пациентов (9,6 %) в группе, получавшей ривароксабан, и у 166 из 878 пациентов (18,9 %) в группе, получавшей инъекции эноксапарина. Тромбоэмболия крупных вен наблюдалась у 9 из 908 пациентов (1 %), принимавших ривароксабан, и у 24 из 925 пациентов (2,6 %), получавших эноксапарин. Частота симптоматической венозной тромбоэмболии была ниже в группе больных, принимавших ривароксабан. В данной группе не отмечено летальных исходов и случаев развития легочной эмболии. Во время лечения в группе больных, получавших эноксапарин, было отмечено 2 летальных исхода и 4 случая легочной эмболии. После окончания лечения в этой же группе отмечено 4 летальных исхода. Нефатальные массивные кровотечения имели место у 7 из 1220 пациентов (0,6 %), леченных ривароксабаном, и у 6 из 1239 больных (0,5 %), получавших инъекции эноксапарина. Профиль побочных эффектов у больных обеих групп при лечении ривароксабаном и эноксапарином был одинаковым. Больных чаще всего беспокоили тошнота, рвота и запоры. Частота всех побочных эффектов, связанных с приемом препаратов, была одинаковой в обеих группах. Увеличение активности аланиновой аминотрансферазы в 3 раза выше верхней границы нормы было отмечено у 20 из 1150 пациентов (1,7 %) в группе ривароксабана и у 20 из 1156 пациентов (1,7 %) в группе эноксапарина. При этом у 2 пациентов, получавших ривароксабан, наблюдалось увеличение уровня билирубина в плазме крови в 2 раза выше верхней границы нормы. В дальнейшем у всех этих больных показатели активности аланиновой аминотрансферазы и концентрации билирубина в плазме крови нормализовались без отмены назначенной терапии. Таким образом, было установлено, что пероральный прием ривароксабана более эффективно предотвращал венозный тромбоз по сравнению с подкожными инъекциями эноксапарина. Частота развития кровотечений при использовании обоих препаратов была одинаково низкой [68].
30 мая 2008 года были опубликованы результаты исследования RECORD 4. Данное исследование предусматривало сравнительное изучение эффективности пероральной терапии ривароксабаном в дозе 10 мг 1 раз в сутки и лечения эноксапарином путем его подкожного введения в дозе 30 мг 2 раза в сутки. Ривароксабан продемонстрировал 31% относительный риск редукции тромбоза, что еще раз показало его преимущество. Введение ривароксабана было более безопасным, учитывая частоту наблюдавшихся геморрагических осложнений. Других статистически значимых различий между больными двух групп не было обнаружено. Вероятность развития таких осложнений при лечении ривароксабаном в суточной дозе 10 мг полностью совпадает с той, которая имеет место при подкожном введении 30 мг эноксапарина 1 раз в сутки. Всего серия исследований RECORD включила около 12 500 пациентов [67].
Результаты приведенных исследований показали, что перед медиками многих специальностей открывается новая перспектива в профилактике тромбозов и тромбоэмболических осложнений у пациентов, имеющих высокую степень их риска. Эффективность и безопасность применения ривароксабана указывают на возможность в скором времени отказаться от терапии непрямыми антикоагулянтами, при которой наблюдается значительно большее количество разнообразных осложнений. Кроме того, исследования взаимодействия ривароксабана с другими часто применяющимися препаратами показали отсутствие серьезных отрицательных эффектов. Так, в частности, не установлено взаимодействия препарата с аспирином, другими нестероидными противовоспалительными средствами, антацидами, блокаторами гистаминовых Н2-рецепторов и дигоксином. 28 мая 2009 года ривароксабан был одобрен и рекомендован к применению Советом Комитета США по лекарственным препаратам и пищевым добавкам.
1. Кохан Е., Заварина И. Острые венозные тромбозы // http://www.medeffect.ru/phlebolog/angio-0077.shtml
2. Чернуха Л.М., Никульников П.И., Гуч А.А., Аттеменко М.О. Венозные тромбозы нижних конечностей: возможно ли решение проблемы сегодня? // Здоров’я України. — 2007. — № 18. — С. 5-7. // http://health-ua.com/articles/2060.html
3. Meissner M.H., Wakefield T.W., Ascher E. et al. Acute venous disease: venous thrombosis and venous trauma // Journal of Vascular Surgery. — 2007. — V. 46, Suppl. S. — 25S-53S.
4. Kahn S.R., Ginsberg J.S. Relationship between deep venous thrombosis and the postthrombotic syndrome // Archives of Internal Medicine. — 2004. — V. 164. — P. 17.
5. Porter J.M., Moneta G.L. Reporting standards in venous disease: an update. International Consensus Committee on Chronic Venous Disease // Journal of Vascular Surgery. — 1995. — V. 21, № 4. — Р. 635-645.
6. Johnson B.F., Manzo R.A., Bergelin R.O., Strandness D.E. Relationship between changes in the deep venous system and the development of the postthrombotic syndrome after an acute episode of lower limb deep vein thrombosis: A one-to-six year follow-up // Journal of Vascular Surgery. — 1995. — V. 21. — P. 307.
7. Wille-Jorgensen P., Jorgensen L.N., Crawford M. Asymptomatic postoperative deep vein thrombosis and the development of postthrombotic syndrome. A systematic review and meta-analysis // Thrombosis & Haemostasis. — 2005. — V. 93. — P. 236.
8. Snow V., Qaseem A., Barry P. et al. Management of venous thromboembolism: a clinical practice guideline from the American College of Physicians and the American Academy of Family Physicians // Annals of Internal Medicine. — 2007. — V. 146, № 3. — Р. 204-210.
9. Stain M., Schonauer V., Minar E. et al. The post-thrombotic syndrome: risk factors and impact on the course of thrombotic disease // Journal of Thrombosis and Haemostasis. — 2005. — V. 3. — P. 2671.
10. Бокарев И.Н., Щепотин Б.М., Ена Я.М. Внутрисосудистое свертывание крови. — Киев: Здоров’я, 1989. — 240 с.
11. Tan S.Y., Brown J. Rudolph Virchow (1821–1902): «pope of pathology» // Singapore Medical Journal. — 2006. — V. 47, № 7. — Р. 567-568 // http://www.sma.org.sg/smj/4707/4707ms1.pdf
12. Schreiber D. Deep Venous Thrombosis and Thrombophlebitis // E-Medicine from WebMD. Medcape’s Continually Updated Clinical Reference // http://emedicine.medscape.com/article/758140-overview
13. Косенков Н.А., Мизаушев Б.А., Царенко И.А. и др. Патогенез и диагностика хронической венозной недостаточности нижних конечностей с трофическими нарушениями // Хирургия. Журнал им. Н.И. Пирогова. — 2005. — № 5 // http://www.mediasphera.ru/journals/pirogov/detail/441/6624/
14. Guex J.J. Thrombotic complications of varicose veins: A literature review of the role of superficial venous thrombosis // Dermatologic surgery. — 1996. — V. 22. — № 4. — Р. 394-405.
15. Theodosis Ch., Feied C.F., Handler J.A. Thrombophlebitis, Septic // E-Medicine from WebMD. Medcape’s Continually Updated Clinical Reference // http://emedicine.medscape.com/article/786526-overview
16. Andes D.R., Urban A.W., Acher Ch.W., Maki D.G. Septic thrombosis of basilic, axillary, and subclavian veins caused by a peripherally inserted central venous catheter // American Journal of Medicine. — 1998. — V. 105. — P. 446-450.
17. Merrer J., De Jonghe B., Golliot F. et al. Complications of femoral and subclavian venous catheterization in critically ill patients: a randomized controlled trial // JAMA. — 2001. — V. 286. — P. 700-707.
18. Durbec O., Viviand X., Potie F., et al. Lower extremity deep vein thrombosis: a prospective, randomized, controlled trial in comatose or sedated patients undergoing femoral vein catheterization // Critical Care Medicine. — 1997. — V. 25. — P. 1982-1985.
19. Shively B.K. Deep venous thrombosis prophylaxis in patients with heart disease // Current Cardiology Reports. — 2001. — V. 3. — № 1. — P. 56-62.
20. Ridker P.M., Cushman M., Stampfer M.J. Inflammation, Aspirin, and the Risk of Cardiovascular Disease in Apparently Healthy Men // New England Journal of Medicine. — 1997. — V. 336, № 14. — P. 973-979.
21. Tasdemira K., Sarlib B., Kayab M.G., Gunebakmazb O. Mobile biatrial thrombus in a patient with mitral stenosis under heparin infusion // Interactive CardioVascular and Thoracic Surgery. — 2008. — V. 7. — P. 667-669.
22. Noel P., Gregoire F., Capon A., Lehert P. Atrial fibrillation as a risk factor for deep venous thrombosis and pulmonary emboli in stroke patients // Stroke. — 1991. — V. 22. — P. 760-762.
23. Singer D.E., Albers G.W., Dalen J.E. et al. Antithrombotic Therapy in Atrial Fibrillation // Chest. — 2008. — V. 133, suppl. 6. — 546S-592S.
24. Quist-Paulsen P., Nжss I.A., Cannegieter S.C. et al. // Arterial cardiovascular risk factors and venous thrombosis: results from a population-based, prospective study (the HUNT 2) // Haematologica. — 2009. — V. 95. — Issue 1. — P. 119-125.
25. Sшrensen H.T., Horvath-Puho E., Pedersen L. et al. Venous thromboembolism and subsequent hospitalisation due to acute arterial cardiovascular events: a 20-year cohort study // Lancet. — 2007. — V. 370, № 9601. — P. 1773-1779.
26. van der Hagen P.B., Folsom A.R., Jenny N.S. et al. Subclinical atherosclerosis and the risk of future venous thrombosis in the Cardiovascular Health Study // Journal of Thrombosis and Haemostasis. — 2006. — V. 4, № 9. — P. 1903-1908.
27. Reich L.M., Folsom A.R., Key N.S. et al. Prospective study of subclinical atherosclerosis as a risk factor for venous thromboembolism // Journal of Thrombosis and Haemostasis. — 2006. — V. 4, № 9. — P. 1909-1913.
28. Pritchard K.I., Paterson A.H., Paul N.A. et al. Increased thromboembolic complications with concurrent tamoxifen and chemotherapy in a randomized trial of adjuvant therapy for women with breast cancer: National Cancer Institute of Canada Clinical Trials Group Breast Cancer Site Group // Journal of Clinical Oncology. — 1996. — № 14. — P. 2731-2737.
29. Sorensen H.T., Mellemkjaer L., Steffensen F.H. et al. The risk of a diagnosis of cancer after primary deep venous thrombosis or pulmonary embolism // New England Journal of Medicine. — 1998. — V. 338, № 14. — P. 1169.
30. Nordstrom M., Lindblad B., Anderson H. et al. Deep venous thrombosis and occult malignancy: an epidemiological study // British Medical Journal. — 1994. — V. 308. — P. 891-894.
31. Emmerich J. Infection and venous thrombosis // Pathophysiology of Haemostasis & Thrombosis. — 2002. — V. 32, № 5–6. — P. 346-348.
32. Nesheiwat F., Sergi A.R. // Deep venous thrombosis and pulmonary embolism following cast immobilization of the lower extremity // Foot & Ancle Surgery. — 1996. — V. 35. — Issue 6. — P. 590-594.
33. Poelkens F., Thijssen D.H.J., Kersten B. et al. // Counteracting venous stasis during acute lower leg immobilization // Acta Physiologica. — 2005. — V. 186. — Issue 2. — P. 111-118.
34. De Swiet J., Wells A.L. Nephrotic Syndrome Associated with Renal Venous Thrombosis and Bronchial Carcinoma // British Medical Journal. — 1957. — V. 161(5031). — P. 1341-1343.
35. Mira Y. Sinus Venous Thrombosis Associated with a Nephrotic Syndrome in an Eight-Year-Old Child // Clinical and Applied Thrombosis/Hemostasis. — 1996. — V. 2, № 2. — P. 142-144.
36. Cushman M., Kuller L.H. // Estrogen Plus Progestin and Risk of Venous Thrombosis // JAMA. — 2004. — V. 292. — P. 1573-1580.
37. Ansell J., Hirsh J., Poller L. et al. The pharmacology and management of the vitamin K antagonists: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy // Chest. — 2004. — V. 126 (3 Suppl.). — 204S-233S.
38. Alberts S.R., Bretscher M., Wiltsie J.C. et al. // Thrombosis Related to the Use of L-Asparaginase in Adults with Acute Lymphoblastic Leukemia: a Need to Consider Coagulation Monitoring and Clotting Factor Replacement // Leukemia & Lymphoma. — 1999. — V. 32, № 5–6. — P. 489-496.
39. Sethna C.B. Renal Venous Thrombosis: Renal Venous Thrombosis — risk factors // http://www.wrongdiagnosis.com/d/deep_vein_thrombosis/book-diseases-20a.htm
40. Escher R. Extensive venous thrombosis following administration of high-dose glucocorticosteroids and tranexamic acid in relapsed Evans syndrome // Blood Coagulation & Fibrinolysis. — 2008. — Vol. 19. — Issue 7. — Р. 741-742.
41. Mahmut Tobu Omer Iqbal Daniel Fareed // Erythropoietin-Induced Thrombosis as a Result of Increased Inflammation and Thrombin Activatable Fibrinolytic Inhibitor // Clinical and Applied Thrombosis/Hemostasis. — 2004. — V. 10, № 3. — P. 225-232.
42. Alikhan R., Cohen A.T., Combe S. et al. Risk factors for venous thromboembolism in hospitalized patients with acute medical illness: analysis of the MEDENOX Study // Archives of Internal Medicine. — 2004. — V. 164, № 9. — P. 63-68.
43. Ramzi D.W., Leeper K.V. DVT and pulmonary embolism: Part I. Diagnosis // American Family Physician. — 2004. — V. 69, № 12. — P. 2829-2836.
44. Ramzi D.W., Leeper K.V. DVT and pulmonary embolism: Part II. Treatment and prevention // American Family Physician. — 2004. — V. 69, № 12. — P. 2841-2848.
45. Rectenwald J.E. Vena cava filters: uses and abuses // Seminars in Vascular Surgery. — 2005. — V. 18, № 3. — Р. 166-175.
46. Decousus H., Leizorovicz A., Parent F.et al. A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. Prйvention du Risque d’Embolie Pulmonaire par Interruption Cave Study Group // New England Journal of Medicine. — 1998. — V. 338, № 7. — Р. 409-415.
47. Машковский М.Д. Лекарственные средства. Издание XV. — Москва: Новая Волна, 2005. — С. 474-497.
48. Gallus A.S., Baker R.I., Beng H.C. et al. Consensus guidelines for warfarin therapy. Recommendations from the Australasian Society of Thrombosis and Haemostasis // Medical Journal of Australia. — 2000. — V. 172. — P. 600-605.
49. Palareti G., Leali N., Coccheri S. et al. Bleeding complications of oral anticoagulant therapy treatment: an inception cohort, prospective collaborative study (ISCOAT) // Lancet. — 1996. — V. 348. — P. 423-428.
50. May O., Garne E., Mickley H. // Complications of long-term treatment with vitamin K antagonists // Ugeskrift for Laeger. — 1990. — V. 152. — P. 17-20.
51. Van Dongen C.J., Prandoni P., Frulla M. et al. Relation between quality of anticoagulant treatment and the development of the postthrombotic syndrome // Journal of Thrombosis & Haemostfsis. — 2005. — V. 3. — P. 939.
52. Bayer’s Novel Anticoagulant Xarelto® now also Approved in the EU [press release]. Leverkusen, Germany, Bayer HealthCare AG; October 1, 2008; Available at http://www.press.bayer.com/baynews/baynews.nsf/id/4107FE412 DC2 C1A3C12574D5002C8130?Open&ccm=001
53. Turpie A.G. Oral, direct factor Xa inhibitors in development for the prevention and treatment of thromboembolic diseases // Arteriosclerosis, Thrombosis, and Vascular Biology. — 2007, 27. — № 6. — P. 1238-1247.
54. Bergqvist D. Venous thromboembolism: a review of risk and prevention in colorectal surgery patients // Diseases of the Colon & Rectum. — 2006. — V. 49, № 10. — P. 1620-1628.
55. Warwick D., Bannister G.C., Glew D. et al. Perioperative low-molecular-weight heparin. Is it effective and safe // Journal of Bone And Joint Surgery British. — 1995. — V. 77, № 5. — Р. 715-719.
56. Olson S.T., Bjцrk I. Mechanism of action of heparin and heparin-like antithrombotics // Perspectives in Drug Discovery and Design. — 1994. — V. 1, № 3. — P. 479-501.
57. Hirsh J., Warkentin T.E., Shaughnessy S.G. et al. // Heparin and Low-Molecular-Weight Heparin Mechanisms of Action, Pharmacokinetics, Dosing, Monitoring, Efficacy, and Safety // Chest. — 2001. — V. 119, № 1. — Suppl. — P. 64S-94S.
58. Hirsh J., Anand S.S., Halperin J.L., Fuster V. // Mechanism of Action and Pharmacology of Unfractionated Heparin // Arteriosclerosis, Thrombosis, and Vascular Biology. — 2001. — V. 21. — P. 1094-1096.
59. Perzborn E., Strassburger J. In vitro and in vivo studies of the novel antithrombotic agent BAY 59-7939 — An oral, direct Factor Xa inhibitor // Journal of Thrombosis and Haemostasis. — 2005. — V. 3, № 3. — P. 514-521.
60. Eriksson B.I., Borris L.C., Dahl O.E. et al. A Once-Daily, Oral, Direct Factor Xa Inhibitor, Rivaroxaban (BAY 59-7939), for Thromboprophylaxis After Total Hip Replacement // Circulation. — 2006. — V. 114. — P. 2374-2381.
61. Eriksson B.I., Borris L.C., Friedman R.J. et al. Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty // New England Journal of Medicine. — 2008. — V. 358. — P. 2765-2775.
62. Laux V., Perzborn E., Kubitza D., Misselwitz F. Preclinical and Clinical Characteristics of Rivaroxaban: A Novel, Oral, Direct Factor Xa Inhibitor // Seminars in Thrombosis and Hemostasis. — 2007. — V. 33. — P. 515-522.
63. Kubitza D., Becka M., Voith B. et al. Safety, pharmacodynamics, and pharmacokinetics of single doses of BAY-59-7939, an oral, direct factor Xa inhibitor // Clinical Pharmacology and Therapeutics. — 2005. — V. 78. — P. 412-421.
64. Graff J., Hentig N., Misselwitz F. et al. Effects of the Oral, Direct Factor Xa Inhibitor Rivaroxaban on Platelet-Induced Thrombin Generation and Prothrombinase Activity // Journal of Clinical Pharmacology. — 2007. — P. 1-9.
65. Hirsh J., O’Donnell M., Eikelboom J.W. Beyond Unfractionated Heparin and Warfarin: Current and Future Advances // Circulation. — 2007. — V. 216. — P. 552-560.
66. Kubitza D., Becka M., Zuehlsdorf M., Mueck W. Effects of food, an antacid, and the H2 antagonist ranitidine on the absorption of BAY 59-7939 (rivaroxaban), an oral, direct factor Xa inhibitor, in healthy subjects// Journal of Clinical Pharmacology. — 2006. — V. 46. — P. 549-558.
67. Kakkar A.K. Rivaroxaban (bay 59-7939), Xarelto a possible replacement for warfarin (coumadin, jantoven) // Warfarin Institute of America // http://www.warfarinfo.com/rivaroxaban.htm
68. Lassen M.R., Ageno W., Borris L.C. et al. Rivaroxaban versus Enoxaparin for Thromboprophylaxis after Total Knee Arthroplasty // New England Journal of Medicine. — 2008. — V. 358, № 26. — P. 2776-2786.