Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Взаємозв’язок між легеневою циркуляцією, споживанням кисню та оксидом азоту при септичних станах у дітей
Авторы: Корсунов В.А. Харкiвська медична академiя пiслядипломної освіти
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті обговорюється стан легеневої та системної гемодинаміки, транспорту та споживання кисню при сепсисі у дітей та їх взаємозв’язок із продукцією оксиду азоту, тяжкістю органних розладів та летальністю. Продемонстровано позитивний вплив оксиду азоту на стан легеневої циркуляції та споживання кисню і негативний вплив на систолічну функцію серця.
Сепсис, діти, оксид азоту.
Однією з актуальних проблем патогенезу септичних станів вважають розлади тканинної перфузії, адже вони є одним з важливих чинників формування синдрому поліорганної недостатності (СПОН) та несприятливих результатів при сепсисі [1]. Важливим компонентом органних розладів при септичних станах є синдром гострого ушкодження легенів [2]. Він нерідко супроводжується розладами легеневої гемодинаміки та перфузії, імовірним механізмом яких вважають вазоконстрикцію через дисбаланс між вазоконстрикторами (гіпоксія, ендотелін, лейкотрієни) та вазодилататорами (оксид азоту). Внаслідок цього відбувається збільшення індексу легеневого судинного опору (ІЛСО), що утруднює роботу правого шлуночка [2]. Згідно з результатами ряду досліджень у дорослих встановлено залежність між фракцією викиду (ФВ) правого шлуночка і ІЛСО та результатом при септичних станах [3, 4]. Також доведено, що існує кореляція між тяжкістю ураження легенів та розвитком легеневої гіпертензії (ЛГ) [4, 5]. За механізмом бівентрикулярної взаємодії ЛГ може впливати і на роботу лівого шлуночка, зменшувати його викид та через системні гемодинамічні розлади і циркуляторну гіпоксію утворювати порочне коло і збільшити ЛГ [2]. Таким чином, правошлуночкова недостатність внаслідок ЛГ та вторинне ушкодження циркуляції у великому колі кровообігу можуть безпосередньо впливати на пато- та танатогенез при септичних станах [2, 4].
Основним з важливих регуляторів судинного тонусу як у великому, так і у малому колах кровообігу вважається оксид азоту (NO). NO — сигнальна молекула із властивостями радикала. Час існування NO становить близько 6 с, після чого він перетворюється на нітрати (NO2–) та нітрити (NO3–). Утворення NO при сепсисі стимулюється ліпополісахаридом та прозапальними цитокінами. І навпаки, зменшення продукції NO відбувається під впливом протизапальних цитокінів та кортикостероїдів. NO утворюється з L-аргініну під впливом ізоформ ферменту NO-синтетази або завдяки відновленню нітратредуктазними системами з NO2– та NO3–. Ці механізми є взаємопов’язаними компонентами циклу NO: L-аргінін — NO — NO2–/NO3– — NO [6–8]. Вплив NO на макроорганізм реалізується через активацію розчинної гуанілатциклази в ендотелії. Отже, зростає синтез цГМФ, що викликає релаксацію гладком’язих клітин судин та, як наслідок, гіпотонію і збільшення капілярного витоку [6–8]. Таким чином, при сепсисі надлишок NO може зменшувати системний та легеневий судинний опір, що, у свою чергу, знижує системний і легеневий кров’яний тиск. Його надлишок також пов’язують з розвитком міокардіальної дисфункції і збільшенням споживання кисню [9–13].
Отже, при септичних станах NO може викликати як сприятливі (зниження легеневого судинного опору, збільшення споживання кисню), так і несприятливі (системна гіпотонія, капілярний виток) патофізіологічні зрушення. Саме тому останнім часом сепсис розглядається з позиції дефіциту NO та постає питання щодо можливості застосування прекурсорів NO (L-аргініну, нітрогліцерину) для лікування розладів мікроциркуляції та ЛГ при сепсисі [14, 15]. На жаль, у доступній нам літературі ми не знайшли відомостей щодо стану системи NO та її взаємозв’язку із споживанням кисню та легеневою гемодинамікою при сепсисі у дітей, що й стало предметом для дослідження.
Мета дослідження: дослідити продукцію NO при септичних станах у дітей; визначити взаємозв’язок між рівнем оксиду азоту сироватки та транспортом і споживанням кисню та легеневим кровообігом при септичних станах у дітей.
Матеріали та методи
Протягом 2006–2009 рр. було проведено дослідження, до якого увійшло 36 дітей, які перебували на лікуванні у відділенні інтенсивної терапії Обласної дитячої інфекційної клінічної лікарні м. Харкова з сепсисом, тяжким сепсисом та септичним шоком, діагноз яких встановлювався відповідно до критеріїв консенсусу SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference (2001). Вік пацієнтів становив від 1 міс. до 17 років, у середньому 41,3 ± 7,5 міс. Причиною розвитку критичного стану у 8 пацієнтів був менінгококовий сепсис, в 11 — інші нейроінфекції, у 9 — інфекції респіраторного тракту, у 3 — бактеріальні гастроентероколіти, інші причини — у 5 дітей. Групу контролю склали 9 дітей із відсутністю гострих або хронічних захворювань, які можуть впливати на стан гемодинаміки та легенів.
Проведене клінічне дослідження крові за загальноприйнятими методами (В.Е. Предтеченский, 1960). Тяжкість стану оцінювалась за шкалою PRISM. Моніторне спостереження за хворими включало визначення частоти серцевих скорочень (ЧСС), середнього артеріального тиску (САТ) осцилометрічним методом та центрального венозного тиску (ЦВТ), пульсоксиметрію (монітори UM-300). Всім хворим проводилась ехокардіоскопія у М-режимі за допомогою УЗ-сканера Ultima PA (Україна). Вимірювались кінцево-діастолічний (КДР) та кінцево-систолічний (КСР) розміри лівого шлуночка (ЛШ). На підставі отриманих даних за формулою L. Teichholz et al. (1976) проводився розрахунок кінцево-систолічного (КСО) та кінцево-діастолічного об’ємов (КДО) лівого шлуночка, ударного об’єму (УО), фракції викиду (ФВ). Хвилинний об’єм серця (ХОС) розраховувався за формулою ХОС = УО ґ ЧСС. Серцевий індекс (СІ) розраховувався за формулою СІ = ХОС/ППТ. Середній артеріальний тиск у легеневій артерії (САТ ЛА) вимірювався за А. Kitabatake et al. (1983). Індекс легеневого судинного опору визначався за формулою: ІЛСО = 80 ґ (САТ ЛА мм рт.ст. – ЦВТ мм рт.ст.)/СІ.
Показники кислотно-основного стану (КОС) і газів артеріальної та центральної венозної крові визначались за допомогою аналізаторів AVL-995 (Австрія) та Gastat-mini (Японія). Рівень гемоглобіну (Нb) визначався колориметричним методом. Розрахунок доставки кисню проводився за формулою DO2 = СІ ґ СaO2; споживання кисню — за формулою VO2 = СІ ґ (СaO2 – – СvO2); індексу тканинної екстракції кисню — за формулою ITО2 = DO2/VO2. Концентрацію С-реактивного протеїну визначали методом ІФА (ELISA-test, США). Вміст лактату крові визначався ензиматичним методом — «Ольвекс діагностікум» (Росія) на біохімічному аналізаторі Stat Fax 1904+ (США). Уміст оксиду азоту (NO) сироватки оцінювався за кінцевими метаболітами (нітрити/нітрати) колориметричним методом за допомогою реактиву Грейса в центральній науково-дослідній лабораторії Харківського національного медичного університету.
Зважаючи на те, що високе споживання кисню є кінцевою метою сучасних напрямків інтенсивної терапії сепсису в дітей, що здатно позитивно вплинути на тяжкість СПОН та зменшення летальності, ми розподілили хворих саме за цим показником [16]. Отже, усіх хворих було розподілено на дві групи: із споживанням кисню менше 120 мл/хв/м2 — група А (19 хворих) та із споживанням кисню понад 120 мл/хв/м2 — група В (17 хворих).
Для аналізу результатів створено базу даних у програмі Statistica 6. Вірогідність відмінностей між групами визначалась за допомогою критерію t Стьюдента. Наявність кореляційних зв’язків між досліджуваними показниками вивчалась за допомогою коефіцієнта рангової кореляції R (Спірмена).
Результати та їх обговорення
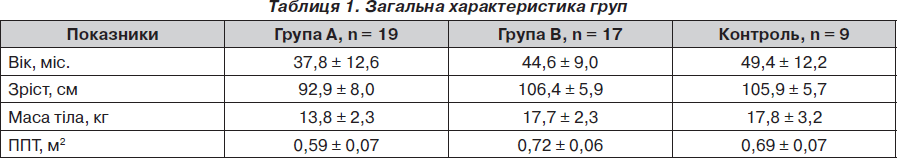
Хворі досліджуваних груп та групи контролю за віком та антропометричними показниками не мали вірогідних відмінностей (р > 0,05) (табл. 1).
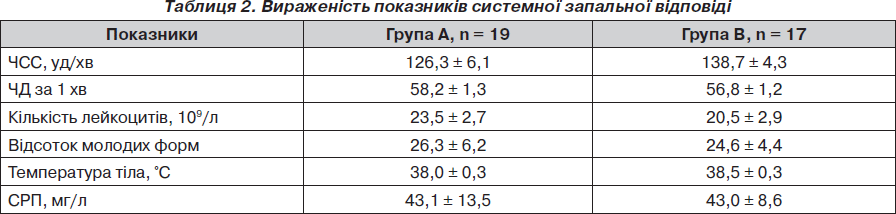
Досліджувані групи характеризувалися наявністю ознак системної запальної відповіді у вигляді гарячки, тахіпное, тахікардії, лейкоцитозу, збільшення кількості молодих форм нейтрофілів (паличкоядерні + юні + мієлоцити + метамієлоцити), підвищенням рівня СРП (у нормі становить менше 6 мг/л), за яким не мали вірогідних відмінностей (р > 0,05) (табл. 2).
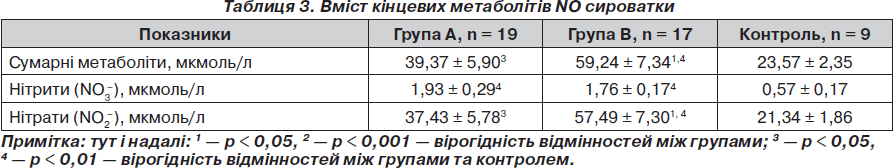
Рівень сумарних метаболітів, нітритів та нітратів у досліджуваних групах вірогідно перевищував норму (23,57 ± 2,35 мкмоль/л). Але рівні сумарних метаболітів NO та нітратів у групі А були вірогідно нижчими, ніж у групі В (р < 0,05) (табл. 3).
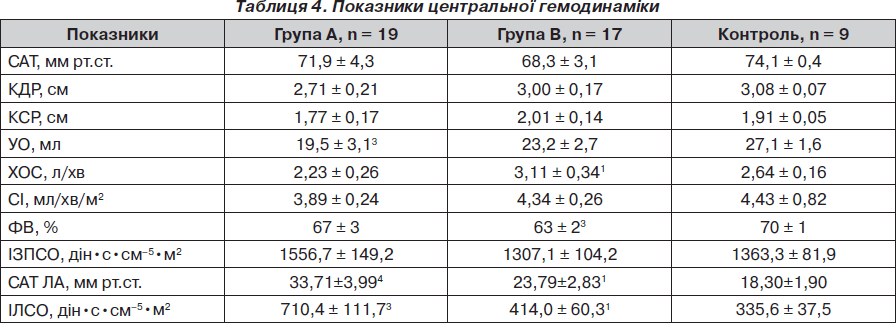
Також ми зіставили показники системної та легеневої гемодинаміки досліджуваних груп та групи контролю. З’ясувалось, що за показниками САТ, переднавантаження, УО, СІ та ІЗПСО між досліджуваними групами та між досліджуваними групами та групою контролю вірогідних відмінностей не спостерігалося (р > 0,05). Натомість ХОС був вірогідно вищим, а САТ ЛА та ІЛСО були вірогідно нижчими в групі В порівняно з групою А (р < 0,05). САТ ЛА та ІЛСО у групі А також були вірогідно вищими, ніж у групі контролю. Група В характеризувалася вірогідно нижчою порівняно з групою контролю ФВ лівого шлуночка (р < 0,05) (табл. 4). Також було встановлено, що рівень сумарних метаболітів мав позитивну кореляцію із ХОС — R = 0,24, p = 0,04 та негативну кореляцію з ІЛСО — R = 0,25, p = 0,04.
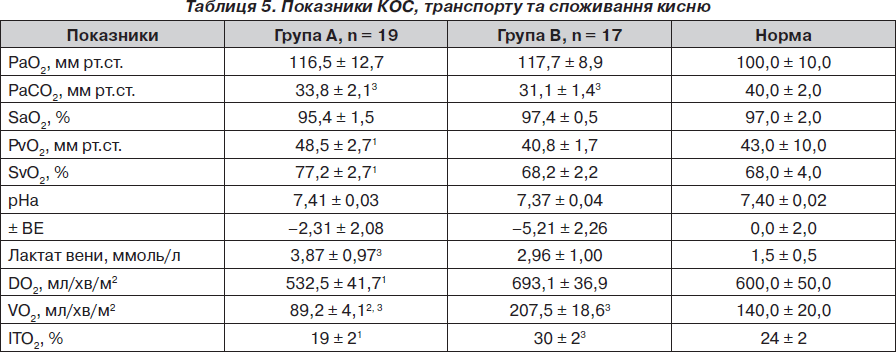
За парціальним тиском та сатурацією кисню у артеріальній крові у хворих у досліджуваних групах та між досліджуваними групами й нормальними показниками відмінностей не було (р > 0,05) (табл. 5). Парціальний тиск CO2 у досліджуваних групах не відрізнявся, але був вірогідно нижчим порівняно з нормою. Натомість PvO2, SvO2 у групі А були вірогідно нижчими, ніж у групі В. Зважаючи на те, що серцевий викид між групами вірогідно не відрізнявся, такі відмінності скоріше за все були обумовлені більшою тканинною екстракцією кисню у групі В. За показниками рН та ВЕ вірогідних відмінностей між групами А та В не спостерігалось, проте рівень лактату був вірогідно вищим за норму саме в групі А. Доставка кисню була вірогідно вищою у групі В, але вона не мала вірогідних відмінностей із нормою. Що стосується споживання кисню, то звичайно воно було вірогідно нижчим у групі А як порівняно із нормою, так і з групою В. Індекс тканинної екстракції також був вірогідно нижчим у групі А, у групі В він вірогідно перевищував норму (р < 0,05) (табл. 5).
Кореляційний аналіз продемонстрував наявність позитивних зв’язків між сумарними метаболітами та DO2 (R = 0,36, p = 0,002), нітратами та DO2 (R = 0,36, p = 0,002), сумарними метаболітами та VO2 (R = 0,39, p = 0,01), нітратами та VO2 (R = 0,41, p = 0,01) та відсутність вірогідних зв’язків між рівнем сумарних метаболітів і лактатом — R = 0,17, p = 0,22.
На завершення слід зазначити, що оцінка за шкалою PRISM у хворих групи А дорівнювала 14,7 ± 2,1 бала, а у групі В становила 8,7 ± 2,1 бала і вірогідно відрізнялась (р < 0,05), але летальність між групами вірогідно не відрізнялась, адже у групі А померли 4 (21,0 ± ± 0,46 %) хворі, а у групі В — 3 (17,6 ± 0,40 %) хворі (р > 0,05).
Висновки
1. У дітей із септичними станами спостерігається вірогідне збільшення продукції NO, що корелює з показниками серцевого викиду, легеневого кровообігу, доставки і споживання кисню.
2. Гіперпродукція NO має негативний вплив на систолічну функцію серця, проте не впливає негативно на інтегральні показники центральної та периферичної гемодинаміки.
3. Розвиток легеневої гіпертензії при сепсисі у дітей імовірно можна пов’язувати з відносно недостатньою продукцією NO, що також асоціюється із меншим серцевим викидом.
4. Збільшення продукції NO при сепсисі у дітей сприяє формуванню гіпердинамічного типу кровообігу із збільшенням доставки, споживання та екстракції кисню, отже може попереджати тканинну гіпоксію і органну дисфункцію.
5. Вплив гіперпродукції NO на летальність при сепсисі у дітей залишається нез’ясованим, що потребує подальших досліджень.
1. Bridges E., Dukes M.S. А сardiovascular аspects of septic shock // Critical Care Nurse. — 2005. — Vol. 25. — P. 14-40.
2. Киров М.Ю., Кузьков В.В., Недашковский Э.В. Острое повреждение легких при сепсисе: патогенез и интенсивная терапия. — Архангельск: Северный государственный медицинский университет, 2004. — 96 с.
3. Liu D., Du B., Long Y. et al. Right ventricular function of patients with septic shock: clinical significance // Zhonghua Wai Ke Za Zhi. — 2000. — № 7. — P. 488-492.
4. Vieillard-Baron A., Prin S., Chergui K. et al. Hemodynamic instability in sepsis. Bedside assessment by doppler echocardiography // Am. J. of Respiratory an Crit. Care Med. — 2003. — Vol. 168. — P. 1270-1276.
5. Moloney E.D., Evans T.W. Pathophysiology and pharmacological treatment of pulmonary respiratory distress syndrome // Eur. Respir. J. — 2003. — Vol. 21. — P. 720-727.
6. Черний В.И., Несторенко А.Н. Нарушения иммунитета при критических состояниях. Особенности диагностики // Лікарю-практику. — 2007. — № 3. — С. 1-20.
7. Сомова Л.М., Плехова Н.Г. Оксид азота как медиатор воспаления // Вестник ДВО РАН. — 2006. — № 2. — С. 77-80.
8. Дмитренко Н.П., Кишко Т.О., Шандречко С.Г. Аргинин: биологическое действие, влияние на синтез оксида азота // Український хіміотерапевтичний журнал. — 2008. — № 1–2. — С. 137-140.
9. Symeonides S., Balk R.A. Nitric oxide in the pathogenesis of sepsis // Infect. Dis. Clin. North. Am. — 1999. — № 13. — P. 449-460.
10. Landry D.W., Oliver J.A. The pathogenesis of vasodilatatory shock // The New Engl. J. Med. — 2001. — Vol. 354. — P. 588- 595.
11. Doughty L.A., Kaplan S., Carcillo J. Inflammatory cytokine and nitric oxide responses in pediatric sepsis and organ failure // Critical Care Medicine. — 1996. — № 7. — P. 1137-1143.
12. Carcillo J.A. Nitric oxide production in neonatal and paediatric sepsis. Editorials // Critical Care Medicine. — 1999 — № 6 — P. 1063-1065.
13. Figueras-Aloy J., Gуmez L., Rodrнguez-Miguйlez J.M. et al. Plasma nitrite/nitrate and endothelin-1 concentrations in neonatal sepsis // Acta Paediatrica. — 2007. — № 5. — Р. 582-587.
14. Yvette C. Luiking, Martijn Poeze, Cornelis H. Dejong et al. Sepsis: An arginin deficiency state? // Crit. Care Med. — 2004. — Vol. 166. — P. 98-104.
15. Stechmiller J.K. et al. Arginine immunonutrition in critically ill patients: a clinical dilemma // Am. J. of Crit. Care. — 2004. — Vol.13. — P. 17-23.
16. Khilnani P., Deopujari S., Carcillo J. Recent advances in sepsis and septic shock // Indian J. of Ped. — 2008. — № 8. — P. 821-830.