Международный неврологический журнал 3 (41) 2011
Вернуться к номеру
Особенности холинергической нейромедиации при ишемических инсультах в зависимости от их патогенетической гетерогенности
Авторы: Расулова Х.А., Ташкентская медицинская академия, кафедра нервных болезней, Узбекистан
Рубрики: Неврология
Версия для печати
В целях сравнительного изучения особенностей холинергической нейромедиации при атеротромботическом, лакунарном и кардиоэмболическом подтипах ишемического инсульта (острейший и острый период) в сыворотке крови больных исследовалось содержание ацетилхолинэстеразы. При этом учитывались как подтип, так и степень тяжести инсульта. Результаты исследования показали, что снижение уровня холинэстеразы в сыворотке крови было наиболее выражено при кардиоэмболическом и лакунарном подтипах ишемического инсульта, что может свидетельствовать о дефиците холинергической нейромедиации в исследованных периодах болезни, особенно на фоне артериальной гипертензии и сердечной патологии. Это следует учитывать при назначении холинергической нейропротективной терапии в комплексном лечении данного заболевания.
Ишемический инсульт, патогенетическая гетерогенность, холинергическая нейромедиация.
Введение
Инсульт остается важной медико-социальной проблемой не только ангионеврологии, но и всего общества. Не вызывает сомнения концепция гетерогенности инсультов, которая предполагает деление их на типы и подтипы, обозначает чрезвычайный полиморфизм структурных поражений головного мозга и его клинических проявлений. В структуре всех инсультов и нозологий в целом ишемический инсульт (ИИ) прочно удерживает лидирующую позицию, по причине смертности находится среди тройки лидеров после инфаркта миокарда, опередив опухоли, а по причине инвалидности остается на первом месте. Согласно современной концепции гетерогенности, различают следующие подтипы ИИ: атеротромботический (АТИ) (34–50 %), кардиоэмболический (КЭИ) (22–30 %), лакунарный (ЛИ) (20–25 %), гемодинамический (15–20 %), реологический (9–12 %) [9]. Не детализируя многообразие причин и факторов риска развития ИИ (атеротромбоз, кардиогенная эмболия, микроангиопатии при артериальной гипертонии, сахарном диабете, реологические, гемодинамические нарушения и др.), следует отметить, что вопросы распространенности патогенетических подтипов ИИ, их патофизиологических и нейрохимических особенностей, а также возможности дифференциальной диагностики и оптимальной терапевтической тактики остаются актуальной проблемой.
В последние десятилетия большое внимание ученых привлекает изучение различных нарушений центральных механизмов холинергической регуляции, которые лежат в основе патогенеза целого ряда заболеваний и патологических состояний. В центральной нервной системе (ЦНС) холинергические нейроны находятся в стриатуме, ядре Мейнерта, лимбической системе, коре больших полушарий. Холинергическая система играет определяющую роль в процессе внимания, памяти, обучения. Известно также, что холинергическая система тесно взаимодействует с дофамин-, глутамат- и ГАМКергическими медиаторными системами [1, 3].
Ацетилхолин (АХ) — четвертичное моноаммониевое соединение, относящееся к биогенным аминам. Действие АХ очень кратковременно (1–2 мс), часть его диффундирует из области концевой пластинки, а другая часть легко гидролизуется ферментом ацетилхолинэстеразой (АХЭ) на холин и уксусную кислоту. Эндогенный АХ играет важную роль в процессах жизнедеятельности: он принимает участие в передаче нервного возбуждения в ЦНС, вегетативных узлах, окончаниях парасимпатических и двигательных нервов. В малых дозах он является физиологическим передатчиком нервного возбуждения; окончания нервных волокон, для которых он служит медиатором, называются холинергическими, а рецепторы, взаимодействующие с ним, называют холинорецепторами. Он не оказывает строгого избирательного действия на разновидности холинорецепторов. В той или иной степени он действует на М- и Н-холинорецепторы и на подгруппы М-холинорецепторов. Периферическое мускариноподобное действие АХ проявляется в замедлении сердечных сокращений, расширении периферических кровеносных сосудов и понижении артериального давления, усилении перистальтики желудка и кишечника, сокращении мускулатуры бронхов, матки, желчного и мочевого пузыря, усилении секреции пищеварительных, бронхиальных, потовых и слезных желез, сужении зрачков (миоз). Периферическое никотиноподобное действие АХ связано с его участием в передаче нервных импульсов с преганглионарных волокон на постганглионарные в вегетативных узлах, а также с двигательных нервов на поперечнополосатую мускулатуру. В больших дозах АХ может вызвать стойкую деполяризацию в области синапсов и блокировать передачу возбуждения [1, 5, 6, 11, 13].
Изучая механизмы расширения кровеносных сосудов, R.W. Furchgott (1980) обнаружил, что АХ взаимодействует с рецепторами эндотелиальных клеток, что приводит к образованию малых молекул, мигрирующих в мышечный слой и вызывающих расслабление сосудов. Эти молекулы получили название «расслабляющий фактор эндотелия» (ЭФР). Было доказано, что ЭФР стимулирует образование циклического гуанозинмонофосфата (цГМФ), являющегося посредником нейромедиаторов и гормонов, обладающих вазодилататорным действием. Несмотря на доказательства того, что ЭФР и оксид азота (NO) являются идентичными, последующие исследования ставят эту идентификацию под сомнение [3, 12]. Исследованиями показано, что NO обладает эффектом реактиватора АХЭ, сущность которого состоит в дефосфорилировании ингибированной различными ядами АХЭ и восстановлении активности фермента. В основе этого эффекта лежит стимуляция растворимой гуанилатциклазы, которая активирует соответствующие протеинкиназы, и восстановление цГМФ. Так, нормализуется передача нервного импульса, нарушенная действием различных токсинов [3].
Дефицит АХ увеличивается с возрастом (до 75 %). У пожилых людей нарушается как пресинаптический, так и постсинаптический компоненты центральных холинергических синапсов, в частности расположенных в коре больших полушарий и гиппокампе. Установлена роль изменений пре- и постсинаптических мембран (возможно, за счет нарушений их липидного состава) с уменьшением высвобождения АХ и снижением чувствительности к медиатору в пожилом возрасте. При усугублении этих изменений при различных патологических состояниях происходит избыточное возбуждение длинных нейрональных цепей мозга (в основном передних отделов), которое вначале является компенсаторным для уменьшения дефицита холинергической трансмиссии, однако вскоре вызывает дегенеративные изменения. Ацетилхолинергическая недостаточность приводит к когнитивным нарушениям, лежит в основе «бродяжничества» и бесцельной двигательной активности, нарушений цикла «сон — бодрствование» (дневная сонливость и ночная спутанность — так называемый «синдром захода солнца»), зрительных галлюцинаций и др. Недостаток АХ в периферической нервной системе ведет к нарушению проведения импульса по периферическим нервам, блоку нервно-мышечной передачи [2, 10, 11, 14].
Влияние АХ на сосудистую стенку является одним из методов определения эндотелиальной дисфункции: введение АХ во время коронарографии для оценки реактивности коронарных артерий по количественному измерению диаметра сосуда и/или с помощью ультразвуковой допплерографии. Для этой цели используют постепенно увеличиваемые дозы АХ (до 30 мкг/мин) и нитроглицерин (300 мкг), что позволяет оценить эндотелийзависимую и эндотелийнезависимую дилатацию коронарных артерий [8].
Исходя из доказанного факта эндотелиальной дисфункции и когнитивных расстройств при сосудистых заболеваниях головного мозга, можно предполагать, что при острых цереброваскулярных инцидентах холинергическая нейромедиация подвергается значительным изменениям. Однако при инсультах исследования холинергической системы единичны, а сравнительная ее характеристика в зависимости от патогенетической гетерогенности практически отсутствует. Изучение дополнительных патогенетических механизмов ИИ в зависимости от их гетерогенности с оценкой холинергической нейромедиации позволит разработать новые подходы к патогенетическому лечению ИИ.
Целью данного исследования явилось изучение в сравнительном аспекте особенности холинергической нейромедиации при наиболее часто встречающихся патогенетических подтипах ишемического инсульта (атеротромботическом, лакунарном, кардиоэмболическом).
Материал и методы исследования
Было обследовано 120 больных, из них 100 больных ИИ (основная группа) — 57 мужчин и 43 женщины в возрасте от 25 до 92 лет (в среднем 62,63 ± 4,68 года). Контрольную группу составили 20 пациентов, проходивших лечение по поводу дисциркуляторной энцефалопатии (ДЭ) 1–2-й стадии, — 8 мужчин (40 %) и 12 женщин (60 %) в возрасте от 37 до 77 лет (средний возраст 59,75 ± 3,08 года). Основное количество больных ИИ поступило в 1-й день — 64, из них до 3 часов — 30, до 6 часов — 25, до 24 часов — 9, на 2-й день до 5-х суток поступили 26 и после 5-х суток — 10 больных. У 72 % больных ИИ развился в каротидном бассейне (КБ) (левом — 41 %, правом — 31 %), у 22 % — в вертебробазилярном бассейне (ВББ), у 6 % пациентов выявлены очаги в обоих бассейнах, в том числе подострые и «немые», которые подтверждались нейровизуализационными исследованиями (КТ/МРТ головного мозга). Выраженность неврологического дефицита и степень тяжести инсульта оценивались по шкалам инсульта: Скандинавской (Scandinavian Stroke Study Group, 1985), Оргогозо (J.M. Orgogozo, 1986) и Оригинальной (Е.И. Гусев, В.И. Скворцова, 1991). Для определения атеротромботического, лакунарного и кардиоэмболического подтипов ИИ использовался метод компьютерной программы для определения вероятностей подтипов ИИ, разработанный Национальным центром инсульта НИИ неврологии РАМН (2004) [7]. Изучение холинергической нейромедиации проводилось по содержанию в сыворотке крови больных фермента АХЭ в ЦНИЛ ТМА по методу В.С. Камышникова (2002) [4]. Результаты исследования подвергались статистической обработке в программной среде StatSoft, Inc. (2003) при проверке нормальности распределения Statistica (data analysis software system), version 6.
Результаты исследования и их обсуждение
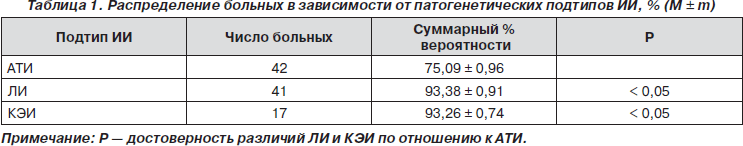
С помощью компьютерной программы для определения вероятностей подтипов ИИ больные были распределены на три группы: АТИ — 42 больных, ЛИ — 41 и КЭИ — 17 больных. Распределение пациентов по группам осуществлялось на основании наибольшего процента вероятности того или иного подтипа ИИ. Больные с вероятностью ниже 70 % исключались из исследования (табл. 1).
В зависимости от степени тяжести и выраженности неврологического дефицита в момент поступления больные ИИ были разделены на группы: с легким ИИ (n = 62), в которой суммарный клинический балл (СКБ) составил по Скандинавской шкале 45,17 ± 0,35, Оргогозо — 80,44 ± 0,36, Оригинальной — 39,29 ± 0,32 балла; со среднетяжелым ИИ (n = 24), СКБ которой составил 26,29 ± 0,98; 46,83 ± 0,74; 30,63 ± 0,61 балла соответственно; с тяжелым ИИ (n = 14) — 8,17 ± 0,97; 25,80 ± 0,81; 14,50 ± 0,76 балла соответственно.
Результаты сравнительного анализа тяжести ИИ в зависимости от его подтипов показали, что при АТИ СКБ при поступлении составил: по Скандинавской шкале — 36,89 ± 0,73; Оргогозо — 62,36 ± 0,77; Оригинальной — 34,38 ± 0,49 балла, что расценивалось в целом как состояние средней тяжести. СКБ больных ЛИ по шкалам составил: по Скандинавской — 40,01 ± 0,63; Оргогозо — 70,11 ± 0,78; Оригинальной — 37,15 ± 0,54 балла, что соответствовало легкому инсульту. Исходная степень тяжести КЭИ по шкалам инсульта составила: по Скандинавской — 31,78 ± 1,31; Оргогозо — 60,59 ± 1,86; Оригинальной — 33,70 ± 0,86 балла, что расценивалось в целом как состояние средней тяжести (нижняя граница), однако более тяжелое, чем при АТИ (р < 0,02).
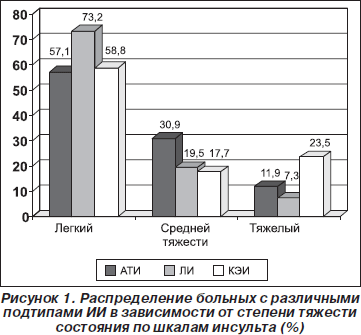
В зависимости от исходной степени тяжести состояния больных при каждом подтипе ИИ с легкой степенью тяжести поступили 24 больных АТИ (57,1 %), 30 пациентов с ЛИ (73,2 %) и 10 больных КЭИ (58,8 %), тогда как в среднетяжелом состоянии оказались 13 больных АТИ (30,9 %), 8 лиц с ЛИ (19,5 %) и 3 больных КЭИ (17,7 %). В тяжелом состоянии пребывали 5 пациентов с АТИ (11,9 %), 3 больных ЛИ (7,3 %) и 4 — КЭИ (23,5 %). Тяжесть ИИ зависела от длительности и тяжести фоновой и сопутствующей патологии, размера инфаркта и его локализации (ИИ тяжелее был при более крупных очагах в ВББ и его сочетании в КБ) (рис. 1).
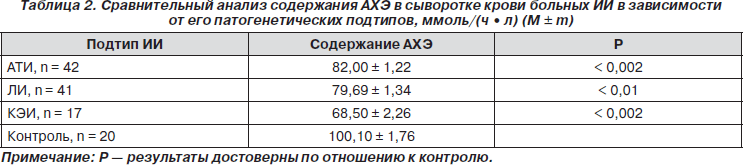
Результаты биохимических исследований показали, что в острейший и острый период ИИ отмечается снижение содержания АХЭ в крови на 24 % (76,73 ± 1,61 ммоль/(ч • л), p < 0,002) по сравнению с контролем (100,10 ± 1,76 ммоль/(ч • л). Этот факт может свидетельствовать о дефиците холинергической системы при ИИ. В зависимости от патогенетических подтипов ИИ было выявлено значительное снижение уровня АХЭ при КЭИ на 31,5 %, тогда как при ЛИ и АТИ отмечалось менее выраженное его снижение — на 20,3 и 18 % соответственно (табл. 2).
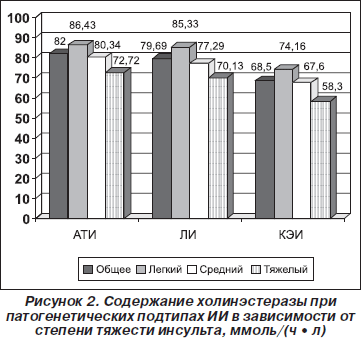
В ходе исследования степени тяжести каждого подтипа ИИ было выявлено, что уровень АХЭ зависел от степени тяжести ИИ: чем тяжелее было состояние больных в каждой группе, тем его уровень был ниже, особенно на фоне системного атеросклероза, артериальной гипертензии, сердечной патологии и сахарного диабета (рис. 2).
Указанные изменения содержания АХЭ, оценивающие состояние холинергической системы при ИИ в острейшем и остром периодах, позволяют предполагать, что при ИИ содержание АХ может увеличиваться и действовать в качестве возбуждающего нейромедиатора или изначально быть сниженным, что в конечном итоге приводит к низкому содержанию его метаболитов, в основном холина. Холин превращается в метаболически активную форму фосфорилхолин, способный проникать через гематоэнцефалический барьер и активировать биосинтез АХ в пресинаптических мембранах холинергических нейронов. Дефицит АХ, в свою очередь, обусловливает выраженный вазоспазм, парезы и параличи, а также изменение мышечного тонуса при ИИ [10, 11].
Выводы
1. Содержание АХЭ в крови больных с различными подтипами ИИ подвержено значительным изменениям и свидетельствует о дефиците холинергической нейромедиации в острейшем и остром периодах болезни, особенно на фоне артериальной гипертензии и сердечной патологии.
2. Разработка способов своевременной коррекции указанных изменений с включением новых холинергических препаратов (холина альфосцерат, цитиколин и др.) в комплексную терапию ИИ с учетом его подтипа и степени тяжести позволит снизить смертность и раннюю инвалидизацию пациентов, перенесших острую цереброваскулярную катастрофу.
1. Афанасьев В.В. Ноотропы в остром периоде черепно-мозговой травмы. Да или нет? (Взгляд с позиций клинич. фармаколога) // Мат-лы VII Всерос. съезда анестезиологов и реаниматологов. — СПб., 2000. — С. 15.
2. Балунов О.Н., Черненков В.П., Михайлов В.А. и др. Опыт клинического применения комбинации глиатилина и препаратов, улучшающих церебральную микроциркуляцию у больных с мультиинфарктными деменциями // Человек и лекарство: VIII Национальный конгресс. — М., 2000. — С. 55.
3. Ивашкин В.Т., Драпкина О.М. Оксид азота в регуляции функциональной активности физиологических систем // Рос. журн. гастроэнтерол., гепатол. и колопроктол. — 2000. — № 4. — С. 16-21.
4. Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике: В 2 т. — Мн.: Беларусь, 2002. — Т. I. – С. 466-476.
5. Одинак М.М., Вознюк И.А. Современные средства лечения ишемического инсульта // Терра Медика. — 1999. — № 2. — С. 50-51.
6. Одинак М.М., Вознюк И.А. Новое в терапии при острой и хронической патологии нервной системы: (нейрометаболическая терапия при патологии нервной системы). — СПб.: ВМедА, 2001. — 63 с.
7. Определение вероятностей подтипов ишемического инсульта / Под рук. Н.В. Верещагина, З.А. Суслиной. — 2004. // www.stroke-center.ru.
8. Саиджанов К.С., Саиджанова Д.Х. Методы исследования эндотелиальной дисфункции периферических артерий // Неврология. — 2007. — № 2. — С. 58-60.
9. Суслина З.А., Варакин Ю.А., Верещагин Н.В. Сосудистые заболевания головного мозга: Эпидемиология. Патогенетические механизмы. Профилактика — 2-е изд., доп. и перераб. — М.: Медпресс-информ, 2009. — 352 с.
10. Adibhatla R.J., Hatcher J.R., Dempsey R.J. Citicoline: neuroprotective mechanisms in cerebral ischemia // J. Neuroschem. — 2002. — Vol. 80. — P. 12-23.
11. Fibiger H.C. Cholinergic mechanisms in learning, memory and dementia: a review of recent evidence // Trends Neurosci. — 1991. — № 14. — P. 220-223.
12. Furchgott R.W., Zawadzki J.V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine // Nature. — 1980. — Vol. 288. P. 373-376.
13. Krasnoperova M.G., Simashkova N.V., Bashina V.M. Use of cholinomimetics in the treatment of endogenous autism in children // Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. — 2004. — Vol. 104, № 6. — P. 35-39.
14. Moreno M. Cognitive improvement in mild to moderate Alzheimer’s dementia after treatment with the acetylcholine precursor choline alfoscerate: a multicenter, double-blind, randomized, placebo-controlled trial // Clin. Ther. — 2003. — Vol. 25, № 1. — P. 178-193.