Международный неврологический журнал 4 (42) 2011
Вернуться к номеру
Ефективність противірусного лікування при герпесвірусній нейроінфекції зі скроневою епілепсією
Авторы: Мальцев Д.В., Казмірчук В.Є., Інститут імунології та алергології Національного медичного університету імені О.О. Богомольця, м. Київ
Рубрики: Неврология
Версия для печати
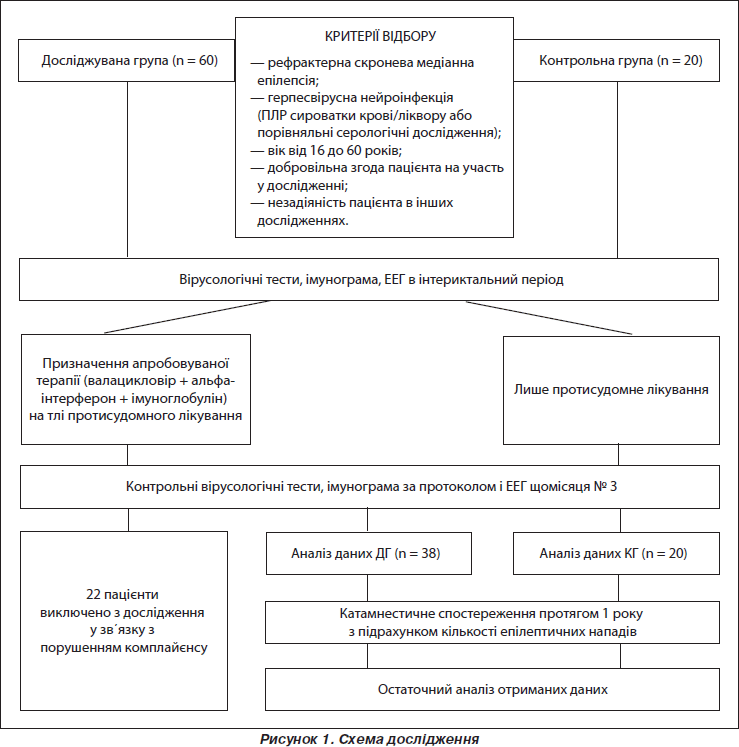
Досліджувана група складалася із 60 пацієнтів віком від 16 до 60 років, які страждали від верифікованої скроневої епілепсії, асоційованої з герпесвірусною нейроінфекцією, з ознаками рефрактерності до протисудомних ліків. Апробоване лікування забезпечує пригнічення або навіть усунення репродуктивної активності герпесвірусів у тканині ЦНС у 68 % випадків, причому терапія є ефективнішою у разі HSV-1-, EBV-, HHV-7-нейроінфекцій і демонструє дещо нижчу, однак достатню ефективність при HHV-6-нейроінфекції. В 76 % випадків досягається покращення показників імунорезистентності організму, зокрема низки індикаторів клітинної ланки природженого імунітету, а також кількості цитотоксичних Т-клітин у крові та сироваткової концентрації IgG. При цьому відзначається вірогідне зменшення тяжкості епілептичного синдрому у 71 %, а покращення ЕЕГ-картини — у 74 % випадків, що позитивно впливає на якість життя пацієнтів і діапазон їх соціальної адаптації.
Скронева епілепсія, герпесвіруси, противірусне лікування.
Вступ
Останнім часом у низці експериментальних і клінічних досліджень переконливо продемонстрована етіологічна роль вірусу герпесу 6-го типу (HHV-6) та деяких інших герпесвірусів у розвитку скроневої медіанної епілепсії в людей. Зокрема, серія робіт присвячена ідентифікації ДНК або антигенів HHV-6 у біоптатах головного мозку з ділянок епілептичних вогнищ, результати яких свідчать про тісну асоціацію між темпоральною епілепсією і хронічною HHV-6-нейроінфекцією. Про це йдеться в повідомленнях, виконаних групами дослідників під керівництвом V. Sanders (1997) [11], H. Uesugi (2000) [12], D. Donati (2003) [4], J. Fotheringham (2007) [5] і H. Karatas (2008) [6]. У подальшому з’явилися дослідження, присвячені вивченню механізмів розвитку скроневого епілептичного синдрому у разі персистенції HHV-6 в медіанних відділах темпоральних часток. Так, S. Meeuwsen зі співавт. [9] у дослідженнях на клітинних культурах уперше продемонстрували потенційний механізм епілептогенезу при HHV-6-нейроінфекції, що полягає в індукції посиленого синтезу гліальних прозапальних цитокінів з проконвульсивними ефектами і пов’язаній з цим патологічній зміні чутливості нейронів і астроцитів до активуючих і гальмівних стимулів [8, 9]. Ці дані узгоджуються з теорією зміненого мікрооточення, яка була запропонована раніше для пояснення феномену епілептогенезу. В подальшому J. Fotheringham зі співавт. [12] у дослідженнях за участю людей виявили опосередковане вірусом критичне зниження експресії астроцитарного глутаматного траспортеру EAAT2, що дозволило вважати механізм глутаматергічної ексайтотоксичності провідним у патогенезі скроневої медіанної епілепсії, пов’язаної з HHV-6 [11]. Нещодавно J.M. Li зі співавт. у клінічному дослідженні описали асоційовану з HHV-6 аномально підвищену експресію прозапального посередника нуклеарного фактора kВ у гліальних клітинах темпоральних часток головного мозку хворих зі скроневою медіанною епілепсією [7], що узгоджується з результатами експериментальних робіт щодо ролі запальної реакції в патогенезі хвороби [9].
Ці відкриття можна використати для обґрунтування ініціації спеціальних досліджень, присвячених вивченню ефективності противірусного лікування при тих формах темпоральної епілепсії, що асоційовані з герпесвірусною нейроінфекцією. Є підстави вважати, що за допомогою такої терапії можна досягнути поліпшення контролю за епілептичними припадками за рахунок пригнічення вірусної репродукції і зменшення пов’язаних з нею локальної запальної реакції та глутаматергічної ексайтотоксичності в медіанних відділах темпоральних часток головного мозку. Це допомогло б покращити якість життя хворих шляхом зниження тяжкості епілептичного синдрому, а також зменшити потребу у протисудомних медикаментах, а в низці випадків — відмовитися від нейрохірургічних втручань, які показані пацієнтам з рефрактерними формами хвороби. Справді, розробка альтернативних методів лікування особливо важлива для пацієнтів з рефрактерними епілепсіями, при яких рекомендовані антиконвульсанти не забезпечують належного профілактичного ефекту, через що у них зазвичай швидко розвиваються ознаки інвалідності.
У лікуванні гострих форм EBV-, HHV-6- та HHV-7-нейроінфекцій, що проявляються як енцефаліт, застосовують ациклічний аналог ганцикловір у дозі 5 мг/кг, який характеризується високою токсичністю та потребою у щоденних внутрішньовенних інфузіях [3]. Останні повідомлення щодо ефективності перорального препарату валацикловіру (валінового ефіру ацикловіру) у високій дозі (3 г/добу) відкривають шлях до покращення безпечності і комплайєнсу противірусної терапії [10]. Доцільність застосування препаратів імуноглобулінів та a-інтерферонів продемонстрована в низці невеликих досліджень. Однак досі не з’ясовано, наскільки ефективним виявиться противірусне лікування, розроблене для усунення гострої реактивованої інфекції, досягнення контролю за вірусом при хронічній нейроінфекції, коли відзначається тривала персистенція патогену в гліальних клітинах глибинних відділів скроневих часток. Також невідома ефективність подібного лікування щодо купірування асоційованого з герпесвірусною нейроінфекцією епілептичного синдрому, особливо у пацієнтів із тривалим анамнезом хвороби, у яких наявний феномен епілептизації мозку.
Мета дослідження: оцінити ефективність противірусного лікування за допомогою валацикловіру, препаратів специфічних імуноглобулінів та рекомбінантного альфа2-інтерферону при скроневій епілепсії, асоційованій з герпесвірусними інфекціями, викликаними вірусами герпесу 1, 4, 6, 7-го типів.
Матеріали і методи дослідження
Для досягнення поставленої мети нами у період з 2009 до 2011 року набрано досліджувану групу (ДГ), що складалася з 60 пацієнтів віком від 16 до 60 років, які страждали від верифікованої скроневої епілепсії з ознаками рефрактерності до протисудомних ліків. У середньому хворі змінили 4–5 різних антиконвульсантів протягом анамнезу хвороби без досягнення належного контролю за епілептичними пароксизмами. На момент включення до ДГ 11 (29 %) пацієнтів приймали вальпроати, по 9 (24 %) — карбамазепін і топірамат, 8 (21 %) — ламотриджин, 3 (8 %) — бензонал і 1 (3 %) — фенобарбітал. 8 (21 %) хворих були змушені вдаватися до комбінованої протисудомної терапії, що, однак, також не забезпечувала належного клінічного ефекту. 5 (13 %) хворих ДГ останнім часом зовсім не приймали протисудомних ліків, аргументуючи це відсутністю відчутної користі від їх застосування.
У всіх цих хворих за допомогою полімеразної ланцюгової реакції (ПЛР) сироватки крові або ліквору, а також на підставі даних порівняльних серологічних досліджень (аномальне співвідношення концентрацій сироваткових і лікворних антитіл) була виявлена герпесвірусна нейроінфекція (рис. 1).
Етіологічна діагностика проводилася на підставі результатів кількісної ПЛР із використанням видоспецифічних праймерів до НSV-1, CMV, EBV, HHV-6, HHV-7 (реактиви і обладнання фірми «ДНК-технологія», м. Москва, Росія) або за співвідношенням концентрацій специфічних IgG у сироватці крові і лікворі (реактиви «Вектор-Бест», м. Новосибірськ, Російська Федерація). Крім того, вивчали репродуктивну активність герпесвірусів у слинних залозах за рахунок кількісної ПЛР слини для оцінки стану вірусу у зоні первинного афекту.
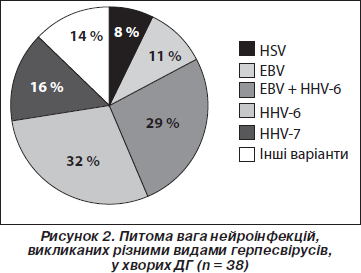
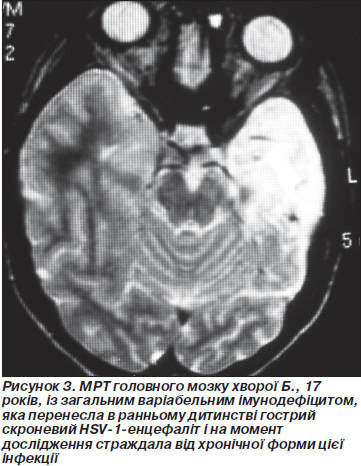
HHV-6-нейроінфекцію виявлено у 22 хворих ДГ (58 % випадків), причому у 12 (32 %) з цих пацієнтів відзначалася герпесвірусна мікст-інфекція, переважно HHV-6 + EBV (11 (29 %) хворих). EBV-нейроінфекцію верифіковано у 16 (42 %) пацієнтів ДГ, здебільшого у складі мікст-інфекцій з HHV-6. HHV-7-нейроінфекція була у 7 (18 %) хворих, переважно як моноінфекція (рис. 2). Лише у 3 (8 %) пацієнтів відзначалася НSV-1-нейроінфекція в моноформі. Це були хворі, які в гострому періоді перенесли скроневий частковий некротично-геморагічний енцефаліт (рис. 3).
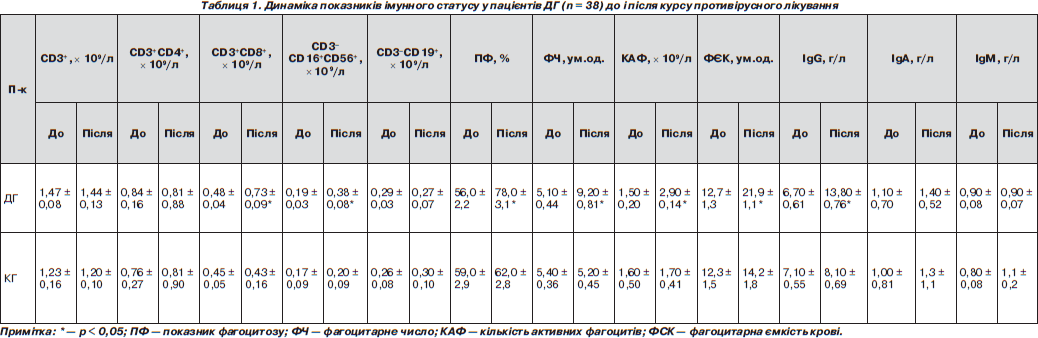
Імунологічне обстеження включало визначення показників загального аналізу крові з підрахунком лейкоцитарної формули; оцінку фагоцитарної активності нейтрофілів у латекс-тесті з визначенням величини показника фагоцитозу (N = 60–80 %), фагоцитарного числа (N = 5–10 ум.од.), кількості активних фагоцитів (N = = 1,6–5,0 ´ 109/л) і фагоцитарної ємності крові (N = 12,5–25,0 у.о.); вивчення кількісних показників субпопуляційного складу лімфоцитів крові — CD3+ (N = 0,95–2,10 ´ ´ 109/л), CD3+CD4+ (N = 0,58–1,34 ´ 109/л), CD3+CD8+ (N = 0,37–0,97 ´ 109/л), CD3–CD16+CD56+ (N = = 0,20–0,37 ´ 109/л), CD3–CD19+-клітин (N = 0,11–0,38 ´ ´ 109/л) — методом непрямої імунофлуоресценції за допомогою мічених моноклональних антитіл до CD-маркерів (реактиви фірми Beckman Coulter, CШA) та підрахунком результатів на проточному цитофлуориметрі Epics XL; вимірювання концентрації імуноглобулінів класів М (N = 0,8–1,6 г/л), G (N = 6,0–15,0 г/л), А (N = 1,25–2,50 г/л) методом простої радіальної імунодифузії за Манчіні та Е (N = 30–100 МО/мл) шляхом імуноферментного аналізу (фірма «Вектор-Бест», РФ) у сироватці крові (рис. 4). Всі ці дослідження виконувалися в лабораторії імунодіагностики Інституту імунології та алергології Національного медичного університету імені О.О. Богомольця МОЗ України.
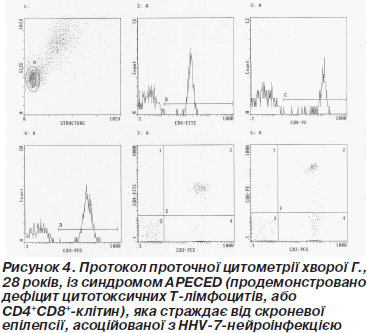
Усі пацієнти проходили чотири імунологічних обстеження з інтервалом принаймні в один місяць, тому остаточний висновок щодо імунного статусу досліджуваних пацієнтів здійснено на підставі аналізу серії імунологічних досліджень, виконаних у динаміці спостереження. Завдяки попередній оцінці імунного статусу встановлено, що у 16 хворих наявний первинний імунодефіцит (5 випадків загального варіабельного імунодефіциту, 2 — APECED, 2 — синдрому Джоба, 2 — сімейної доброякісної нейтропенії, 2 — селективного дефіциту IgM, 1 — синдрому Віскотта — Олдрича, 1 — дефіциту мієлопероксидази фагоцитів, 1 — синдром Швахмана). Інші 22 пацієнти страждали від вторинних імунодефіцитів, обумовлених спільною дією нейрогенних механізмів, антиконвульсантів і герпесвірусних агентів, як це продемонстровано в нашій попередній роботі [1], причому здебільшого відзначалася недостатність клітинної ланки природженого імунітету.
Критерії включення пацієнта у дослідження:
1) наявність скроневої медіанної епілепсії з ознаками рефрактерності до рекомендованих антиконвульсантів;
2) верифікована герпесвірусна нейроінфекція (дані ПЛР сироватки крові/ліквору або порівняльних серологічних досліджень);
3) вік від 16 до 60 років;
4) добровільна згода пацієнта на участь у дослідженні;
5) незадіяність пацієнта в інших дослідженнях.
Критерії виключення пацієнтів із дослідження:
1) відсутність верифікованої герпесвірусної нейроінфекції;
2) недотримання протоколу дослідження пацієнтом;
3) розвиток побічних реакцій на застосовувані медикаменти, що унеможливлюють подальшу участь пацієнта у дослідженні;
4) заява пацієнта про вихід із дослідження на будь-якому етапі.
Пацієнтам ДГ на тлі антиконвульсивної терапії, що була призначена раніше лікарями спеціалізованих закладів і не призводила до досягнення належного контролю за епілептичними припадками, призначено противірусне лікування за розробленою схемою:
— валацикловір per os у дозі 3 г/добу протягом перших 2 місяців, потім у дозі 1 г/добу ще протягом 2 міс.;
— препарат рекомбінантного людського альфа2-інтерферону в дозі 1 млн МО в/м 1 раз на 2 доби двома курсами по 15 ін’єкцій з інтервалом в 1 міс., зважаючи на дані щодо періодів індукованої рефрактерності до інтерферонів під час інтерферонотерапії;
— препарат специфічного імуноглобуліну до герпесвірусу з титром антитіл 1 : 2000 в дозі 15–24 мл на 1 міс. залежно від маси тіла № 4.
Вибір валацикловіру був обумовлений нещодавніми повідомленнями щодо ефективності високодозової терапії валіновим ефіром ацикловіру при лікуванні інфекцій, викликаних тими герпесвірусними агентами, тимідинкіназа яких не фосфорилює ацикловір [10]. Зважили також на можливість перорального прийому препарату, що покращує комплайєнс терапії. Препарати специфічних імуноглобулінів чинять вірус-нейтралізуючу, а препарати a-інтерферонів — віростатичну дію. Крім того, за допомогою комбінованої терапії «імуноглобулін + інтерферон» намагалися моделювати реакцію антитілозалежної клітинно-опосередкованої цитотоксичності, що відіграє важливу роль у противірусному імунітеті людини, зокрема в елімінації патогену in situ.
Термін лікування становив 4 міс., у подальшому проводилося катамнестичне спостереження протягом 1 року. Повний курс лікування пройшли лише 38 пацієнтів ДГ (14 чоловіків і 24 жінки), інші були виключені з дослідження через порушення комплайєнсу.
Для проведення порівняльного аналізу сформовано контрольну групу (КГ), яку становили 20 осіб подібного гендерного і вікового розподілу, які також хворіли на рефрактерну скроневу епілепсію і страждали від герпесвірусної нейроінфекції, однак отримували лише протисудомні ліки. У 12 (60 %) пацієнтів КГ відзначалася HHV-6-нейроінфекція, у 7 (35 %) — EBV, у 4 (20 %) — HHV-7. 7 (35 %) хворих КГ приймали вальпроати, 6 (30 %) — топірамат, по 5 (25 %) — карбамазепін і ламотриджин, 1 (5 %) — бензонал. Комбінована протисудомна терапія була призначена 4 (20 %) хворим КГ.
Кінцеві точки дослідження:
— активність герпесвірусної нейроінфекції (за кількістю копій ДНК у пробі за результатами ПЛР-досліджень або величиною індексу співвідношення сироваткових і лікворних антитіл у порівняльних серологічних дослідженнях);
— стан лабораторних показників імунного статусу;
— кількість зареєстрованих епілептичних припадків за звітний період;
— результати ЕЕГ в інтериктальний період.
Статиcтичний аналіз отриманої інформації проводився шляхом здійснення структурного та порівняльного аналізу з використанням комп’ютерної програми Microsoft Excel. Отримані дані оброблені із застосуванням методу варіаційної статистики за t-критерієм Стьюдента з розрахунком коефіцієнту довірчої ймовірності р (параметричний критерій) та числа знаків Z за Ю.В. Урбахом (непараметричний критерій). Вірогідною вважали різницю, коли p < 0,05 і Z < Z0,05.
Результати та їх обговорення
Дані ПЛР сироватки крові/ліквору та результати порівняльних серологічних досліджень свідчать, що активну HSV-1-нейроінфекцію було усунено у 3 пацієнтів (100 % випадків), EBV — у 15 (95 %), HHV-6 — в 11 (50 %), HHV-7 — у 5 (71 %). Отже, найкращі результати отримані у разі HSV-1 і EBV-нейроінфекції, а найгірші — при HHV-6-нейроінфекції, оскільки лише у половини пацієнтів досягнено припинення репродукції цього збудника в тканині ЦНС. Ще у 3 із 11 пацієнтів вдалося знизити вірусне навантаження, сформоване HHV-6, однак 8 хворих виявилися абсолютно резистентними до проведеного лікування. Ці відмінності в ефективності терапії можна пояснити як біологічними властивостями HHV-6, який має найнижчу чутливість до ациклічних аналогів гуанозину з-поміж інших герпесвірусів, так і особливостями біологічної програми патогену, який здебільшого перебуває в стані персистенції, хоча найбільш доступним для противірусного лікування є саме реактивований збудник.
Негативні результати ПЛР отримували вже після першого місяця лікування, однак індекси співвідношення нормалізувалися тільки через 2–4 місяці після початку терапії. Деяка інертність порівняльних серологічних тестів, що полягала в отриманні відстроченого негативного результату, пов’язана з тривалим періодом напіврозпаду молекул IgG, що становить у середньому 23 доби і може подовжуватися у деяких пацієнтів. У цілому негативні вірусологічні тести отримані у 26 пацієнтів ДГ (68 % випадків), що свідчить про достатньо високу ефективність апробованого противірусного лікування. Слід зазначити, що у пацієнтів, вірусна інфекція в яких була верифікована шляхом ПЛР, отримані кращі результати терапії, ніж у хворих, в яких діагноз нейроінфекції підтверджено на підставі аномального індексу співвідношення специфічних антитіл (Z < Z0,05). На нашу думку, це означає, що вірус у стані реактивації виявився чутливішим до апробованого лікування, ніж у стані персистенції. Однак на ефективність лікування могла впливати не лише поточна біологічна програма збудника, але і його видова належність. Оскільки шляхом порівняльних серологічних тестів здебільшого верифікували діагноз HHV-6-нейроінфекції, можна обґрунтовано вважати, що відмінності у результатах проведеної терапії пов’язані також із чутливістю цього патогену до ациклічного аналогу гуанозину, яка виявилася нижчою, ніж у інших досліджуваних представників родини Herpesviridae. Натомість за результатом ПЛР слини репродукція вірусів у слинних залозах припинена лише у 9 (24 %) пацієнтів, що свідчить про збереження вірусу в активному стані в місці вхідних воріт інфекції у більшості пацієнтів, які пройшли повний курс терапії за розробленою схемою. На нашу думку, це вказує на збереження ризику розвитку повторної герпесвірусної нейроінфекції в майбутньому.
Позитивна динаміка досліджуваних показників імунограми досягнена у 29 пацієнтів ДГ, що становило 76 % випадків (табл. 1). У той самий час у хворих КГ, які не приймали противірусного та імунотропного лікування, аналогічна динаміка зареєстрована лише у 3 (15 %) пацієнтів. Порівняльний аналіз отриманих даних свідчить про вірогідний вплив проведеного лікування на показники імунорезистентності організму (Z < Z0,05). Зокрема, відзначалася нормалізація порушених показників, що характеризують клітинну ланку природженого імунітету. Як показали результати наших попередніх досліджень, саме клітинна ланка природженого імунітету є найбільш уразливою у цієї категорії пацієнтів [1]. Зокрема, досягнута нормалізація кількості природних кілерів, великих гранулярних лімфоцитів, показників фагоцитозу — фагоцитарного числа, фагоцитарного показника, кількості активних фагоцитів, фагоцитарної ємності крові (p < 0,05 і Z < Z0,05). Паралельно відбулася нормалізація кількості цитотоксичних Т-лімфоцитів, що беруть участь у противірусному імунітеті як ефекторні клітини, безпосередньо знищуючи вірус-інфіковані клітини з використанням специфічного механізму розпізнавання мішеней. Ці ефекти можна пояснити як зниженням вірусного навантаження, тобто зменшенням проявів вірус-індукованої імуносупресії, так і відомими імунотропними ефектами препарату альфа-інтерферону. Вірогідна динаміка сироваткової концентрації IgG (p < 0,05 і Z < Z0,05) пояснюється застосуванням імуноглобулінотерапії у складі апробованого лікування, тобто введенням екзогенних молекул IgG, що входять до складу препаратів. Кількість нейтрофілів, лімфоцитів, Т-клітин, Т-хелперів і В-лімфоцитів у пацієнтів ДГ вірогідно не змінилася. Натомість, у пацієнтів КГ відзначалася лише вірогідна позитивна динаміка кількості великих гранулярних лімфоцитів у крові (p < 0,05).
Повної ремісії епілептичного синдрому протягом курсу лікування досягнуто у 16 пацієнтів ДГ, що становило 42 % випадків. Ремісія досягалася здебільшого, починаючи з другого або навіть третього місяця терапії. При цьому у 5 з цих пацієнтів на першому місяці лікування було короткочасне погіршання стану, пов’язане з незначним почастішанням припадків. Часткова ремісія, під якою розуміли зниження частоти припадків, принаймні, на третину, спостерігалася у 11 (29 %) хворих. Ще у 4 пацієнтів відзначалася позитивна динаміка частоти епілептичних пароксизмів, що, однак, не була вірогідною. Сім (18 %) пацієнтів ДГ виявилися рефрактерними до проведеного лікування, тобто у них зберігалася попередня частота припадків. У жодного пацієнта не відзначено негативного впливу апробованого лікування на частоту епілептичних пароксизмів після завершення курсу терапії. В цілому противірусне лікування виявилося ефективним у 71 % хворих ДГ. У той самий час часткова або повна ремісія судомного синдрому відзначалася лише у 3 (15 %) хворих КГ (Z < Z0,05).
Епілептичні припадки, тобто генералізовані тоніко-клонічні судомні припадки, виявилися чутливішими до лікування, ніж абсанси або парціальні пароксизми. Зокрема, позитивна динаміка частоти первинно або вторинно генералізованих тоніко-клонічних припадків досягнута у 21 із 31 пацієнтів ДГ (67 %), у яких відзначалися такі пароксизми. В той самий час зменшення частоти абсансів відзначено лише у 2 із 7 хворих (29 %) з цим типом генералізованих припадків, а зниження частоти парціальних пароксизмів — у 5 із 11 хворих ДГ (45 %) з переважно фокальним патерном припадків. У всіх 5 пацієнтів, у яких відзначалися серійні епілептичні припадки, останні були усунені повністю наприкінці курсу терапії.
Результати катамнестичного спостереження за хворими ДГ вказують на те, що досягнена повна ремісія епілептичного синдрому зберігалася протягом наступного року після завершення терапії у третини пацієнтів (6 хворих, 38 %), а в інших хворих (10 пацієнтів, 62 %) відзначалася поява судомних пароксизмів, щоправда зазвичай з меншою частотою, ніж та, що була раніше. Середня тривалість індукованої повної ремісії епілептичного синдрому серед тих пацієнтів, у яких відзначалося поновлення припадків, становила 4,5 ± 0,9 міс. (95% ДІ 2,6–9,4).
Серед тих пацієнтів, в яких була часткова ремісія, досягнена позитивна динаміка зберігалася у половини учасників (6 хворих, 54 %), а в інших (5 пацієнтів, 46 %) відзначалося збільшення частоти припадків, однак не завжди до вихідного рівня. У цих хворих середня тривалість індукованої часткової ремісії становила 5,4 ± 1,1 міс.
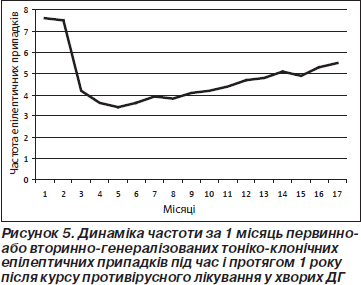
У цілому ефективність лікування була майже вдвічі вищою у пацієнтів із нетривалим анамнезом хвороби (перші 3 роки від дебюту епілепсії) у порівнянні з хворими, які страждали від епілептичного синдрому протягом тривалішого терміну, особливо з тими пацієнтами, анамнез хвороби яких перевищував 10 років, що можна пояснити феноменом епілептизації мозку (Z < Z0,05). Отримані дані свідчать про необхідність ранньої діагностики і своєчасного призначення адекватного лікування (рис. 5).
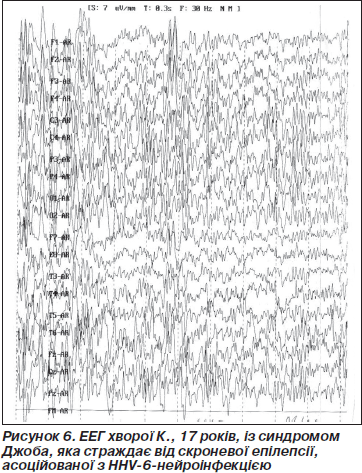
У 24 із 38 пацієнтів ДГ (63 %) до моменту участі у дослідженні була зареєстрована епілептиформна активність на ЕЕГ, виконаних в інтериктальний період. Відзначалися спайки, поліспайки, комплекси пік-хвиля (рис. 6). Після завершення апробованої терапії епілептиформна активність в інтериктальний період визначалася лише у 12 (32 %) пацієнтів (Z < Z0,05). Ще у 18 хворих були лише дифузна дезорганізація ритмів і переважання повільнохвильової біоелектричної активності, у 8 хворих досягнута майже повна нормалізація ЕЕГ-картини. В цілому позитивна динаміка даних ЕЕГ досягнута у 28 пацієнтів ДГ, що становило 74 % випадків. У КГ подібна позитивна динаміка зареєстрована лише у 4 (20 %) пацієнтів (Z < Z0,05).
У двох пацієнтів, які приймали противірусне лікування, відзначалися випадки шкірного свербежу, ще в одного було зафіксовано запаморочення, яке усунули шляхом зменшення дози валацикловіру вдвічі. Майже у третини пацієнтів відзначалася транзиторна гіпертермія на рівні субфебрилітету, що можна пояснити біологічними ефектами застосовуваного препарату альфа-інтерферону. Отже, переносимість терапії була цілком задовільною.
Це перше в світі контрольоване дослідження, в якому апробовано профілактичне противірусне лікування при скроневій медіанній епілепсії, асоційованій з герпесвірусною нейроінфекцією. Результати даного дослідження продемонстрували користь від застосування противірусних та імунотропних препаратів у цієї категорії пацієнтів, оскільки під впливом проведеної терапії досягнуто вірогідної позитивної динаміки за всіма кінцевими точками — активністю герпесвірусів, показниками імунного статусу, частотою епілептичних припадків і результатами ЕЕГ в інтериктальний період. Вдалося отримати докази, що під впливом апробованого лікування відбувається пригнічення репродуктивної активності вірусу в тканині ЦНС або навіть індукується перехід інфекції до латентного стану, і паралельно посилюється імунорезистентність організму, що передбачає покращання імунного нагляду за ендогенним патогеном, а також досягається зменшення частоти епілептичних пароксизмів, тобто поліпшення якості життя пацієнтів. Власне, результати даної роботи вказують на прямий зв’язок між пригніченням інтрацеребральної репродукції патогену і покращенням імунного статусу, з одного боку, і зменшенням тяжкості епілептичного синдрому — з іншого. Лише третина хворих виявилася рефрактерною до проведеного лікування. Можливо, видозміна схеми терапії допоможе досягти ефекту і у цієї категорії пацієнтів. Зокрема, замість валацикловіру таким хворим можна застосовувати ганцикловір, що має виразнішу противірусну активність у разі HHV-6-нейроінфекції. Використання ганцикловіру може знизити безпечність лікування, однак ця стратегія є виправданою у пацієнтів з тяжкою, так званою катастрофічною, епілепсією. Крім того, замість імуноглобулінів для в/м уведення можна використовувати аналогічні препарати для в/в терапії, які продемонстрували не тільки противірусну, але й пряму протиепілептичну активність при деяких формах епілепсій, зокрема — інфантильних спазмах у дітей, епілептичній афазії та синдромі Леннокса — Гасто [2]. Хоча застосування препаратів імуноглобулінів для в/в уведення пов’язано зі збільшенням фінансових витрат на лікування, а також з ускладненням самої процедури терапії, що обумовлено необхідністю госпіталізації пацієнтів до денного стаціонару для отримання інфузій, такий підхід може виявитися обґрунтованим для окремих хворих, що не відповідають на апробовану схему терапії. Без сумніву, подальші дослідження в окреслених напрямках можуть пролити світло на шляхи оптимізації противірусного лікування у пацієнтів зі скроневою медіанною епілепсією, асоційованою з герпесвірусною нейроінфекцією.
Висновки
1. У пацієнтів зі скроневою медіанною епілепсією, що асоційована з герпесвірусною нейроінфекцією, противірусне лікування із застосуванням валацикловіру, альфа-інтерферону та специфічних імуноглобулінів, забезпечує пригнічення або навіть усунення репродуктивної активності герпесвірусів у тканині ЦНС у 68 % випадків, причому терапія є ефективнішою у разі HSV-1-, EBV-, HHV-7-нейроінфекцій і демонструє дещо нижчу, однак достатньо високу ефективність при HHV-6-нейроінфекції.
2. Апробоване противірусне лікування в 76 % випадків призводить до покращення показників імунорезистентності організму, зокрема низки індикаторів клітинної ланки природженого імунітету, а також кількості цитотоксичних Т-клітин у крові та сироваткової концентрації IgG. Це дозволяє говорити про посилення імунного нагляду за ендогенною інфекцією, що особливо важливо при герпесвірусній патології, зважаючи на опортуністичні властивості збудника.
3. У пацієнтів зі скроневою медіанною епілепсією, що приймають лікування за розробленою схемою, відзначається вірогідне зменшення тяжкості епілептичного синдрому у 71 %, а покращення ЕЕГ-картини — у 74 % випадків, що позитивно впливає на якість життя пацієнтів і діапазон їх соціальної адаптації. При цьому лікування сильніше впливає на частоту первинно або вторинно генералізованих тоніко-клонічних епілептичних пароксизмів, ніж абсансів і парціальних припадків, особливо у пацієнтів з нетривалим анамнезом хвороби (протягом перших 3 років від дебюту епісиндрому).
4. Результати даного дослідження можуть стати підґрунтям для подальших науково-дослідних робіт у сфері скроневої медіанної епілепсії, а противірусне лікування за розробленою схемою рекомендується до впровадження в клінічну практику.
1. Мальцев Д.В. Діагностика вторинних імунодефіцитів у хворих на герпесвірусну нейроінфекцію, ускладнену епілептичним синдромом // Імунологія та алергологія. — 2010. — № 2. — С. 76-90.
2. Aarli J.A. Immunological aspects of epilepsy // Brain Dev. — 1993. — Vol. 15. — P. 41-50.
3. Birnbaum T., Padovan C.S., Sporer B., et al. Severe meningoencephalitis caused by herpesvirus 6 type B in an immunocompetent woman treated with ganciclovir // Clin. Infect. Dis. — 2005. — Vol. 40. — P. 887-889.
4. Donati D., Akhiani N., Fogdell-Hahn A., et al. Detection of human herpesvirus-6 in mesial temporal lobe epilepsy surgical resections // Neurology. — 2003. — Vol. 61(10). — P. 1405-1411.
5. Fotheringham J., Donati D., Akhyani N. et al. Association of human herpesvirus-6-B with mesial temporal lobe epilepsy // PLoS Med. — 2007. — Vol. 4(5). — P. e180.
6. Karatas H., Gurer G., Pinar A. et al. Investigation of HSV-1, HSV-2, CMV, HHV-6 and HHV-8 DNA by real-time PCR in surgical resection material of epilepsy patients with mesial temporal lobe sclerosis // J. Neurol. Sci. — 2008. — Vol. 264(1–2). — P. 151-156.
7. Li J.M., Lei D., Peng F. et al. Detection of human herpes virus 6B in patients with mesial temporal lobe epilepsy in West China and the possible association with elevated NF-κB expression // Epilepsy Res. — 2011. — Vol. 94(1–2). — P. 1-9.
8. Meeuwsen S., Bsibsi M., Persoon-Deen C., Ravid R., van Noort J.M. Cultured human adult microglia from different donors display stable cytokine, chemokine and growth factor gene profiles but respond differently to a pro-inflammatory stimulus // Neuroimmunomodulation. — 2005. — Vol. 12(4). — P. 235-245.
9. Meeuwsen S., Persoon-Deen C., Bsibsi M., Bajramovic J.J., Ravid R., De Bolle L., van Noort J.M. Modulation of the cytokine network in human adult astrocytes by human herpesvirus-6A // J. Neuroimmunol. — 2005. — Vol. 164(1–2). — P. 37-47.
10. Miller C.S., Avdiushko S.A., Kryscio R.J. et al. Effect of prophylactic valacyclovir on the presence of human herpesvirus DNA in saliva of healthy individuals after dental treatment // J. Clin. Microbiol. — 2005. — Vol. 43(5). — P. 2173-80.
11. Sanders V.J., Felisan S.L., Waddell A.E. et al. Presence of herpes simplex DNA in surgical tissue from human epileptic seizure foci detected by polymerase chain reaction: preliminary study // Arh. Neurol. — 1997. — Vol. 54(8). — P. 954-960.
12. Uesugi H., Shimizu H., Maehara T., Arai N., Nakayama H. Presence of human herpesvirus 6 and herpes simplex virus detected by polymerase chain reaction in surgical tissue from temporal lobe epileptic patients // Psychiatry Clin. Neurosci. — 2000. — Vol. 54(5). — P. 589-593.