Журнал «» 3(17) 2011
Вернуться к номеру
Эффект валсартана и атенолола на сексуальное поведение женщин с гипертензией в менопаузе
Авторы: Fogari R., Preti P., Zoppi A., Corradi L., Pasotti C., Rinaldi A., Mugellini A., Отдел интернальной медицины, Университет Павии, г. Павия, Италия
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Целью данного исследования было оценить эффект валсартана по сравнению с атенололом на сексуальное поведение женщин с гипертензией в постменопаузе. Методы. Были включены 120 женщин в постменопаузе в возрасте от 51 до 55 лет с гипертензией от легкой до средней степени тяжести (диастолическое артериальное давление (ДАД) ≥ 95 и ≤ 105 мм рт.ст.). После 4-недельного периода плацебо они были рандомизированы на терапию валсартаном по 80 мг (n = 60) или атенололом по 50 мг (n = 60) в соответствии с дизайном исследования с параллельными группами. После 4 нед. лечения пациентки, которые не отвечали на лечение (ДАД > 90 мм рт.ст.), получали двойную дозу каждого препарата. Контроль проводили в конце плацебо-фазы и далее каждые 4 нед. На каждом визите измеряли АД в положении сидя при помощи ртутного сфигмоманометра (Коротков I и V). В начале и через 16 нед. лечения пациентки заполняли опросник, который содержал 10 самооценочных вопросов, касающихся разных аспектов сексуального желания, оргастической функции и сексуальной активности. Вопросы были представлены в виде визуальной аналоговой шкалы. Результаты. Оба препарата значительно снижали АД без достоверной разницы между этими двумя режимами. У женщин, получавших валсартан, показатели шкалы по трем вопросам, касающимся либидо, достоверно улучшились: сексуальное желание (+38 %, р < 0,01), изменение поведения (+45 %, р < 0,001) и сексуальные фантазии (+51 %, р < 0,001). В отличие от этой группы показатели сексуального желания и сексуальных фантазий в группе атенолола достоверно ухудшились (–18 %, р < 0,01, и –23 %, р < 0,001, соответственно). Выводы. Эти результаты позволяют предположить, что у сексуально активных женщин с гипертензией в постменопаузе лечение валсартаном улучшало сексуальную функцию как минимум по нескольким параметрам, в то время как атенолол ухудшал ее. Это может быть существенным для качества жизни таких пациенток и влиять на комплайенс к антигипертензивной терапии.
Валсартан, атенолол, гипертензия, женская сексуальность.
Большинство исследований, касающихся влияния гипертензии и ее фармакотерапии на сексуальную функцию, проводили на мужчинах [1–3], хотя эта тема совершенно не изучена у женщин [4–6]. Это может быть частично связано со сложностью в определении и оценке объективных параметров сексуальной функции у женщин, но еще больше — с отсутствием специфических опросников, затрагивающих тему сексуальной жизни у участниц фармакотерапевтических исследований, редким вовлечением только женщин в исследование и относительно малым количеством женщин-исследователей в этих исследованиях [5–8]. Сексуальная дисфункция у женщин может проявляться в виде нарушения оргазма, снижения влагалищной любрикации, вагинизма, потери либидо или бесплодия [4]. Мало известно о частоте этих проблем среди женщин в общей популяции [9, 10] и еще меньше — у получающих или не получающих лечение женщин с гипертензией [4–6, 8, 11–14].
Известно, что препарат-индуцированная сексуальная дисфункция часто наблюдается на фоне антигипертензивной терапии у мужчин, кроме того, последняя усугубляет сексуальные проблемы, которые вызывает сама гипертензия [1–3, 15]. Однако существуют данные, что некоторые классы антигипертензивных препаратов, такие как диуретики, центральные a-агонисты и b-блокаторы, имеют большее влияние на мужскую сексуальную функцию, чем другие классы, такие как блокаторы кальциевых каналов и ингибиторы ангиотензин-превращающего фермента (АПФ) [2, 3, 8, 11, 15–17]. Современные знания об эффектах блокаторов рецепторов ангиотензина II (БРА) ограниченны, но некоторые данные свидетельствуют о том, что сексуальная функция у мужчин, получающих препараты этой группы, не только не ухудшается, но и улучшается [18–20]. Намного меньше данных существует относительно влияния антигипертензивных препаратов на женскую сексуальную функцию [4, 6, 11–14]. Современные данные свидетельствуют, что клонидин, метилдофа, гуанетидин и резерпин связаны с побочными эффектами на сексуальную функцию (потеря либидо, невозможность достигать оргазма). Сообщалось, что b-блокаторы снижают либидо, в то время как прием тиазидных диуретиков может быть связан с усугублением сексуальных проблем (уменьшение либидо и влагалищной любрикации), которые, однако, уменьшаются при снижении массы тела [11]. Современные данные по эффектам вазодилататоров ограниченны, но исследование TOMHS (Исследование по лечению гипертензии легкой степени) указывало на более частую встречаемость сниженной частоты сексуальной активности среди женщин, получающих амлодипин, по сравнению с таковой при приеме других препаратов (ацебутолол, эналаприл, хлорталидон и доксазозин) [14]. В недавно проведенном контролируемом исследовании, в котором изучали сексуальную функцию у женщин с гипертензией и нормальным давлением, а также влияние четырех классов препаратов (диуретики, b-блокаторы, блокаторы кальциевых каналов и ингибиторы АПФ), наблюдались снижение влагалищной любрикации, уменьшение частоты оргазма и учащение болевых ощущений во время коитуса у женщин с гипертензией. Между четырьмя группами лечения достоверной разницы в качестве сексуальной функции не установлено [6]. Насколько нам известно, на сегодняшний день пока нет данных по эффекту БРА на женскую сексуальную функцию.
На этом основании настоящее исследование направлено на сравнение влияния на сексуальное поведение терапии блокатором рецепторов ангиотензина II валсартаном и b1-селективным b-блокатором атенололом у сексуально активных женщин с гипертензией в постменопаузальный период, которые составляли гомогенную группу по возрасту, семейному положению и по использованию гормональной заместительной терапии (ГЗТ) (что позволило нам ограничить возможную дисперсию и вариабельность результатов из-за сниженных уровней женских половых гормонов).
Материалы и методы
В исследование включали 120 женщин в период постменопаузы в возрасте 51–55 лет, с вновь диагностированной, ранее нелеченной эссенциальной гипертензией легкой или средней степени тяжести (диастолическое артериальное давление (ДАД) > 90 и < 105 мм рт.ст., систолическое АД (САД) > 140 и < 180 мм рт.ст.). Менопаузальный статус определяли как прекращение месячных на протяжении как минимум 1 года, что подтверждалось плазменными уровнями фолликулостимулирующего гормона (ФСГ) > 20 МЕ/л, более высокими концентрациями ФСГ, чем лютеинизирующего гормона, и плазменными концентрациями 17b-эстрадиола (< 50 пкмоль/л). Все женщины принимали ГЗТ в течение как минимум 6 мес. и были все еще сексуально активными. Это определялось при помощи двух специфических вопросов, которые являлись частью сбора анамнеза: 1) есть ли у вас в настоящее время сексуальный партнер? 2) был ли у вас секс за последний месяц? Только те женщины, которые ответили «да» на оба вопроса, были включены в исследование. Пациентки с сахарным диабетом, ожирением (индекс массы тела (ИМТ) > 30), курящие, с раком грудной железы или тромбоэмболическими заболеваниями в анамнезе, серьезными сердечно-сосудистыми заболеваниями, а также в состоянии, которое требует применения сопутствующей терапии, исключались из исследования.
Протокол исследования был одобрен местным этическим комитетом, все пациентки давали свое информированное согласие перед включением в исследование. После 4-недельного вводного периода на плацебо пациентки были рандомизированы на прием валсартана по 80 мг один раз в день или атенолола по 50 мг один раз в день в соответствии с дизайном исследований с параллельными группами. Титрование дозы проводили после 4 нед. лечения: те, которые не отвечали на терапию (ДАД > 90 мм рт.ст.), получали двойную дозу каждого препарата. Пациенток обследовали на скрининговом визите (начальные показатели), в конце плацебо-фазы, а затем каждые 4 нед. На каждом визите измеряли частоту сердечных сокращений (ЧСС) и АД. АД каждой пациентке измеряли в положении сидя при помощи стандартного ртутного сфигмоманометра (Коротков I и V). В начале и через 16 нед. пациентки заполняли опросник, оценивающий уровень разных параметров сексуального желания [21], с инструкциями по его заполнению. Опросник, в котором показана эффективность в оценке сексуального желания после менопаузы [22], состоял из таких 10 вопросов:
1. Считаете ли Вы, что степень Вашей сексуальной привлекательности для партнера изменилась?
2. Изменилось ли Ваше сексуальное желание и интерес?
3. Изменилась ли частота случаев, когда Вы были инициатором сексуальных отношений?
4. Изменилась ли частота случаев, когда Ваш партнер был инициатором сексуальных отношений?
5. Изменилось ли Ваше поведение в ответ на предложение заняться сексом от Вашего партнера?
6. Изменились ли Ваши сексуальные фантазии и сны?
7. Изменилось ли Ваше сексуальное возбуждение?
8. Изменилась ли частота занятий сексом?
9. Изменилась ли частота и интенсивность Ваших оргастических ощущений?
10. Произошли ли какие-то изменения в отношении трудности или болевых ощущений во время коитуса?
Вопросы были представлены в виде визуальной аналоговой шкалы (ВАШ). Пациентки могли отвечать, выбирая из 7 вариантов, начиная со «значительно ухудшилось» до «значительно улучшилось». Для объективизации результатов каждому ответу присваивалось цифровое значение: соответственно отсутствие изменений определялось как 0, «значительное ухудшение» — как –3 и «значительное улучшение» — как +3. После подтверждения конфиденциальности опросники, кодированные при помощи идентификационных номеров, респондентки заполняли самостоятельно секретно, после чего возвращали в запечатанном конверте. Опросники, полученные на первом визите, сравнивали с сексуальным поведением пациенток до менопаузы, в то время как опросники, заполненные после 16 нед. антигипертензивной терапии, сравнивали с результатами, полученными на первом визите.
Статистический анализ
Данные подавались как среднее ± СО. Для лучшей сравниваемости данных ВАШ все они были переведены в положительные числа, где –3 соответствовало 0, а +3 переводилось в +6. Статистический анализ данных выполняли при помощи дисперсионного анализа и включали только тех пациенток, которые полностью закончили исследование и правильно заполнили опросник (104 пациентки). Гомогенность значений АД перед лечением оценивали при помощи c2-теста. Различия между двумя группами сравнивали при помощи t-критерия Стьюдента для количественных переменных и непараметрических тестов (знаково-ранговый тест и двухвыборочный тест Вилкоксона) для других переменных. Значимым считался показатель р < 0,05.
Результаты исследования и их обсуждение
Всего 120 женщин (средний возраст 53,4 года) были включены в исследование и 104 закончили его (50 в группе атенолола и 54 в группе валсартана). Пять пациенток не пришли на повторный визит. Четыре пациентки прекратили участие в исследовании из-за побочных эффектов: трое в группе атенолола (одна из-за гипотензии, одна из-за брадикардии и одна из-за чувства усталости и холода в конечностях); одна — в группе валсартана (из-за головной боли и головокружения). Девять пациенток не смогли заполнить опросники полностью и правильно.
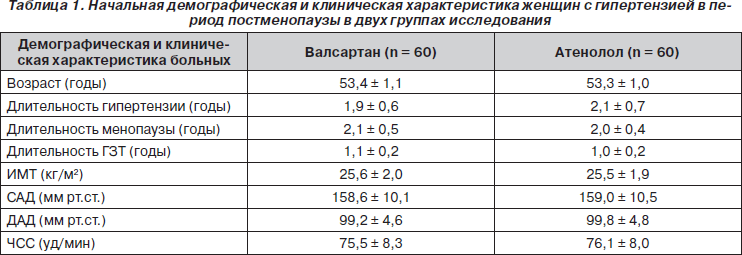
Данные табл. 1 показывают начальные клинические и демографические характеристики пациенток в двух группах исследования. Достоверной разницы между исследуемыми параметрами не установлено.
Валсартан и атенолол одинаково снижали уровни АД без достоверной разницы между режимами. Среднее снижение САД и ДАД было достоверным уже через 4 нед. лечения как валсартаном (–10,9/9,7 мм рт.ст., р < 0,01 по сравнению с начальным показателем), так и атенололом (–12/11,4 мм рт.ст., р < 0,01 по сравнению с начальным показателем), еще более выраженным — после титрования дозы (–18/15,2 мм рт.ст. на фоне валсартана, р < 0,001, и –19,5/15,7 мм рт.ст. на фоне атенолола, р < 0,001) и оставалось таким же после 16 нед. лечения (–19,6/15,7 мм рт.ст. и –19,1/15,3 мм рт.ст. соответственно). ЧСС значительно снижалась на фоне атенолола (с 76,2 ± 8,3 до 54,2 ± 2,8 уд/мин, р < 0,001 по сравнению с начальным показателем), но не менялась на фоне валсартана.
Удвоение дозы было необходимо у 31 из 54 пациенток, получающих лечение валсартаном, и у 25 из 50 пациенток на атенололе. Нормализация АД (ДАД < 90 мм рт.ст.) достигалась у 62 % пациенток, принимающих валсартан, и у 58 % принимающих атенолол.
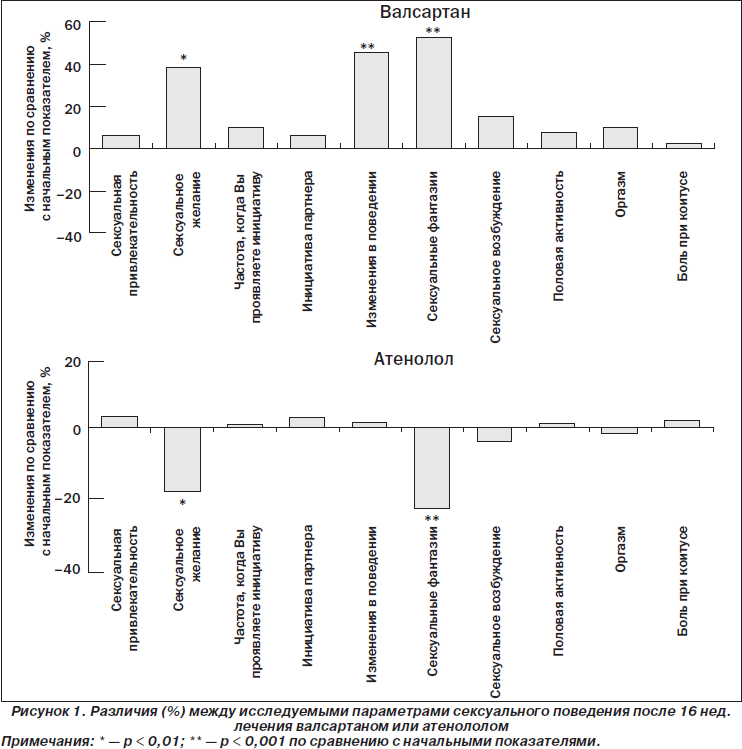
Различия в сексуальном поведении, наблюдаемые по ВАШ из опросников до и после 16 нед. терапии, в двух группах приведены на рис. 1.
Женщины, получающие валсартан, продемонстрировали значительное повышение показателя по вопросу 2 («Изменилось ли Ваше сексуальное желание и интерес?») — с 2,09 ± 0,68 до 2,89 ± 0,81 (+38 %, р < 0,01 по сравнению с начальным показателем); по вопросу 5 («Изменилось ли Ваше поведение в ответ на предложение заняться сексом от Вашего партнера?») — с 2,36 ± 0,86 до 3,42 ± 1,25 (+45 %, р < 0,001 по сравнению с начальным показателем) и по вопросу 6 («Изменились ли Ваши сексуальные фантазии и сны?») — с 2,23 ± 0,78 до 3,40 ± 1,26 (+51 %, р < 0,001 по сравнению с начальным показателем). Показатели других вопросов достоверно не изменились по сравнению с начальными.
В то же время на фоне атенолола сексуальная функция ухудшилась. Максимально снизились показатели вопроса 2 — с 2,17 ± 0,71 до 1,78 ± 0,89 (–18 %, р < 0,01 по сравнению с начальным показателем и р < 0,05 по сравнению с валсартаном), вопроса 6 — с 2,33 ± 0,65 до 1,79 ± 0,93 (–23 %, р < 0,001 по сравнению с начальным показателем и р < 0,001 по сравнению с валсартаном). Кроме того, показатель вопроса 5 был значительно ниже у женщин, получающих атенолол, чем у женщин, получающих валсартан (2,39 ± 0,90 по сравнению с 3,42 ± 1,25, р < 0,001). Показатели по остальным вопросам остаются почти неизменными по сравнению с начальными показателями.
Результаты данного исследования свидетельствуют, что, несмотря на одинаковую антигипертензивную активность, БРА валсартан и b-адреноблокатор атенолол оказывают неодинаковое влияние на сексуальное поведение женщин с гипертензией.
Во время лечения валсартаном женская сексуальная функция не только не ухудшалась, но даже улучшилась: субъективное восприятие пациентками изменения либидо, сексуального желания, сексуальных фантазий и поведения в ответ на предложение партнера заняться сексом достоверно улучшились после 16 нед. терапии. В отличие от этого лечение атенололом вызвало ухудшение сексуальной функции, значительно уменьшая показатели ответов на 2 вопроса, связанных с либидо (сексуальное желание и сексуальные фантазии), а также достоверно отличалось от лечения валсартаном по влиянию на поведение женщин в ответ на инициативу партнера.
Причины такого разного влияния этих двух препаратов на сексуальное поведение женщин неясны. Одним из возможных объяснений может быть разное влияние на плазменные уровни тестостерона. В отличие от валсартана, который, казалось бы, не влияет на уровни тестостерона [20], атенолол продемонстрировал уменьшение плазменных уровней тестостерона [20, 23, 24]. Имеется большое количество данных по влиянию тестостерона на повышение сексуального желания как у мужчин, так и у женщин [25]; у женщин в период менопаузы, получающих адекватную эстрогеновую ГЗТ, снижение сексуального желания и активности было связано с андрогенной недостаточностью [26, 27]. Поэтому возможно еще большее снижение уровней тестостерона, вызванное терапией атенололом, что может привести к снижению либидо в нашем исследовании.
В связи с тем что на женскую сексуальную функцию большое влияние оказывают также физическое и эмоциональное самочувствие [28], улучшение сексуального поведения, наблюдаемое на фоне валсартана, может быть хотя бы частично связано с общим улучшением качества жизни, которое отмечается на фоне приема БРА.
Так как никакой разницы в отношении эффекта на АД не наблюдалось, мы можем исключить возможность, что наблюдаемая разница во влиянии на сексуальное поведение была связана с разной степенью снижения АД на фоне приема валсартана и атенолола.
В заключение следует отметить, что результаты данного исследования, которые касаются достаточно гомогенной группы женщин с гипертензией в постменопаузе, свидетельствуют, что БРА валсартан и b-блокатор атенолол имеют разное влияние на женское сексуальное поведение и что, несмотря на одинаковую антигипертензивную эффективность, валсартан имеет определенные преимущества в отношении качества сексуальной жизни и комплайенса к антигипертензивной терапии.
Перевод М.Г. Романюк, ГУ «Институт урологии АМН Украины», г. Киев
Впервые опубликовано в журнале «Здоровье мужчины», № 4, 2010
1. Bansal S. Sexual dysfunction in hypertensive men. A critical review of the literature // Hypertension. — 1988. — 12. — 1-10.
2. Kochar M., Mazur L.I., Patel A. Sexual dysfunction. Uncovering a conne ction with hypertension and antihypertensive therapy // Postgrad. Med. — 1999. — 106. — 149-157.
3. Fogari R., Zoppi A. Effects of antihypertensive therapy on sexual activity in hypertensive men // Curr. Hypertens. Rep. — 2002. — 4. — 202-210.
4. Duncan L., Bateman D.N. Sexual function in women. Do antihypertensive drugs have an impact? // Drug Saf. — 1993. — 8. — 225-234.
5. Lewis C., Duncan L.E., Balance D.I., Pearson T.A. Is sexual dysfunction in hypertensive women uncommon or understudied? // Am. J. Hypertens. — 1998. — 11. — 733-735.
6. Duncan L.E., Lewis C., Jenkins P., Pearson T.A. Does hypertension and its pharmacotherapy affect the quality of sexual function in women? // Am. J. Hypertens. — 2000. — 13. — 640-647.
7. Anastos K., Charney P., Charon R.A., Cohen E., Jones C.Y., Marte C., Swiderski D.M., Wheat M.E., Williams S. Hypertension in women: what is really known? // Ann. Intern. Med. — 1991. — 115. — 287-293.
8. Prisant L.M., Carr A.A., Bottini P.B., Solursh D.S., Solursh L.P. Sexual dysfunction with antihypertensive drugs // Arch. Intern. Med. — 1994. — 154. — 730-736.
9. Osborne M., Hawton K., Gath D. Sexual dysfunction among middle aged women in the community // Br. Med. J. — 1988. — 296. — 959-962.
10. Laumann E.O., Gagnon J.H., Michael R.T., Michaels S. The Social Organization of Sexuality: Sexual Practices in the United States. — Chicago, University of Chicago Press, 1994.
11. Wassertheil-Smoller S., Blaufox M.D., Oberman A., Davis B.R., Swencionis C., Knerr M.O., Hawkins C.M., Langford H.G. Effect of antihypertensives on sexual function and quality of life: the TAIM Study // Ann. Intern. Med. — 1991. — 114. — 613-620.
12. Hodge R.H., Harward M.P., West M.S., Krongaard-DeMong L., Kowal-Neely M.B. Sexual function of women taking antihypertensive agents. A comparative study // J. Gen. Intern. Med. — 1991. — 6. — 290-294.
13. Rosen R.C., Taylor J.F., Leiblum S.R., Bauchman G.A. Prevalence of sexual dysfunction in women; results of a survey study of 329 women in an outpatient gynecological clinic // J. Sex Marital Ther. — 1993. — 19. — 171-188.
14. Grimm R.H. Jr, Grandits G.A., Prineas R.J., McDonald R.H., Lewis C.E., Flack J.M., Yunis C., Svendsen K., Liebson P.R., Elmer P.J. Long-term effects on sexual function of five antihypertensive drugs and nutritional hygienic treatment of hypertensive men and women: Treatment of Mild Hypertensive Study (TOMHS) // Hypertension. — 1997. — 27. — 8-14.
15. Rosen R.C. Sexual dysfunction as an obstacle to compliance with antihypertensive therapy // Blood Press. — 1997. — 6 (Suppl. 1). — 47-51.
16. Croog S.H., Levine S., Sudilovsky A., Baume R.M., Clive J. Sexual symptoms in hypertensive patients. A clinical trial of antihypertensive medications // Arch. Intern. Med. — 1988. — 148. — 788-794.
17. Chang S.W., Fine R., Siegel D., Chesney M., Black D., Hulley S.B. The impact of diuretic therapy on reported sexual function // Arch. Intern. Med. — 1991. — 151. — 2402-2408.
18. Fogari R., Zoppi A., Poletti L., Marasi G., Mugellini A., Corradi L. Sexual activity in hypertensive men treated with valsartan or carvedilol: a cross-over study // Am. J. Hypertens. — 2001. — 14. — 27-31.
19. Llisterri J.L., Lozano Vidal J.V., Aznar Vicente J., Argaya Roca M., Pol Bravo C., Sanchez Zamorano M.A., Ferrario C.M. Sexual dysfunction in hypertensive patients treated with losartan // Am. J. Med. Sci. — 2001. — 321. — 336-341.
20. Fogari R., Preti P., Derosa G., Marasi G., Zoppi A., Rinaldi A., Mugellini A. Effect of antihypertensive treatment with valsartan or atenolol on sexual activity and plasma testosterone in hypertensive men // Eur. J. Clin. Pharmacol. — 2002. — 58. — 177-180.
21. Palacios S., Menendez C., Jurado A.R., Castano R., Vargas J.C. Changes in sex behavior after menopause: effects of tibolone // Maturitas. — 1995. — 22. — 155-161.
22. Montgomery J.C., Studd J.W.W. Psychological and sexual aspects of the menopause // Br. J. Hosp. Med. — 1991. — 45. — 300-302.
23. Suzuki H., Tominaga T., Kumagai H., Saruta T. Effects of first-line antihypertensive agents on sexual function and sex hormones // J. Hypertens. — 1988. — 6 (Suppl. 4). — S649-S651.
24. Andersen P., Seljeflot I., Herzog A., Arnesen H., Hjerman I., Holme I. Effects of doxazosin and atenolol on atherothrombogenic risk profile in hypertensive middle-aged men // J. Cardiovasc. Pharmacol. — 1998. — 31. — 677-683.
25. Sherwin B.B. A comparative analysis of the role of androgens in human male and female sexual behavior: behavioral specificity, critical thresholds and sensitivity // Psychobiology. — 1988. — 16. — 416-425.
26. Davis S.R. Androgen replacement in women: a commentary // J. Clin. Endocrinol. Metab. — 1999. — 84. — 1886-1891.
27. Maartens L., Leusink G., Knottnerus J., Smeets C., Pop A. Climateric complaints in the community // Fam. Pract. — 2001. — 18. — 189-194.
28. Rosen R.C., Beck J.G. Patterns of Sexual Arousal. — Guildford Press, New York, 1988.