Журнал «Боль. Суставы. Позвоночник» 2 (02) 2011
Вернуться к номеру
Экспериментальные аспекты моделирования грыжи межпозвоночного диска
Авторы: Радченко В.А., Дедух Н.В., Бенгус Л.М., Шимон М.В., Государственное учреждение «Институт патологии позвоночника и суставов им. проф. М.И. Ситенко АМН Украины», г. Харьков
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
Введение
Среди населения земного шара, и особенно цивилизованных стран, наблюдается прогрессирование заболеваний позвоночника, при этом лидирующие позиции занимает остеохондроз и связанные с ним отдаленные последствия в виде грыж межпозвоночного диска. Несмотря на огромное количество публикаций этого направления, решение проблемы этиологии и патогенеза грыж межпозвоночного диска далеко от совершенства. В связи с этим внимание исследователей привлекает проблема экспериментального моделирования, позволяющего как раскрыть механизмы формирования грыж диска и болевого синдрома, так и разработать способы эффективного лечения и профилактики этой тяжелой патологии. С этой целью в качестве модельных объектов исследователи часто используют мелких животных: кроликов, крыс и мышей [1–6], реже — крупных животных, таких как собаки, овцы, свиньи, крупный рогатый скот [7–14]. Экспериментальное моделирование грыж межпозвоночного диска осуществляется с помощью механических методов, математического моделирования, а также различных способов повреждения структур диска или имплантации студенистого ядра в эпидуральное пространство.
Цель настоящего сообщения — на основе данных литературы обобщить результаты исследований относительно формирования и экспериментального моделирования грыж межпозвоночного диска у животных и раскрыть механизмы развития воспалительного процесса в этих условиях.
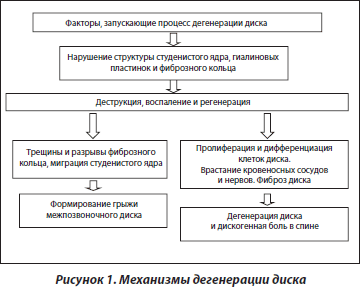
Механизмы дегенерации межпозвоночного диска
Межпозвоночный диск состоит из центрально расположенного студенистого ядра, окруженного фиброзным кольцом. Основные макромолекулярные компоненты, присутствующие в нормальном студенистом ядре, — это фибриллы коллагена II типа, имеющие нерегулярное расположение в богатом протеогликанами гидратированном матриксе (около 80 % воды от сухого веса). Коллаген II типа составляет около 80 % коллагеновых белков студенистого ядра, 15 % приходится на коллаген VI типа, 1–2 % — на коллаген IX типа, около 3 % — на коллаген XI типа и 1 % — на коллаген III типа [15]. Нотохордальные клетки студенистого ядра имеют длинные отростки, переплетающиеся между собой, формируя структуру, подобную синцитию.
Для фиброзного кольца характерны различия организации матрикса и клеток в наружных и внутренних отделах. Между пластинами из коллагеновых волокон в наружных отделах фиброзного кольца располагаются фибробластоподобные клетки, а в матриксе преобладает I тип коллагена. Во внутренних отделах фиброзного кольца располагаются хондроциты и, соответственно, преобладает II тип коллагена. Наряду с этим типом коллагена в небольшом количестве содержатся коллагены V (3 %), VI (10 %) и IX типа (1–2 %).
Дегенерация межпозвоночного диска может начинаться с различных отделов, в том числе со студенистого ядра, и ассоциируется с изменением его структуры и механических свойств. Одним из ранних нарушений в межпозвоночном диске является элиминация молекул аггрекана в студенистом ядре вследствие его дегидратации [16, 17]. Известно, что степень гидратации диска обусловливает величину внутридискового давления [18–21].
Процесс формирования грыжи межпозвоночного диска сопровождается разрывами фиброзного кольца и миграцией студенистого ядра в эти области. Небольшие по объему щели в фиброзном кольце не подлежат репарации и служат путем для проникновения жидкости из студенистого ядра, что обусловливает впоследствии развитие нарушений. Так как диск является аваскулярной структурой, его репаративный потенциал низкий.
На фоне прогрессирования дегенеративных изменений диска возникает дисбаланс процессов диффузии веществ, снижаются его амортизационные свойства, студенистое ядро уменьшается в размерах, при этом происходит соответствующее увеличение внутридискового давления, влияющее в первую очередь на внутренние отделы фиброзного кольца.
Известно, что фиброзное кольцо представлено волокнистым хрящом, который хорошо адаптирован к растяжению, но недостаточно адаптирован к вертикальным статическим нагрузкам. При снижении высоты диска основная биомеханическая нагрузка приходится не на студенистое ядро, которое утратило свои амортизационные свойства, а на биомеханически не соответствующую структуру фиброзного кольца. В результате возросшего внутреннего давления студенистое ядро проникает в образовавшиеся трещины и щели фиброзного кольца, что приводит к выпячиванию диска. Это выпячивание может быть одно- или двусторонним, вентральным, дорсальным, латеральным или комбинированным, в зависимости от локализации деструктивных изменений фиброзного кольца.
В литературе имеются экспериментальные работы, связанные с локальным точечным повреждением внутренних отделов фиброзного кольца [6] либо с его полнослойным разрезом [12]. Таким образом, авторы ставили своей целью воспроизведение последовательности событий, имеющих место в межпозвоночном диске на этапах формирования грыжи. В других работах авторы моделировали грыжу диска путем инъекции в него различных химических веществ, в частности физиологического раствора. K. Otani и соавт. (1997) выполняли операцию на позвоночном канале собак, включающую ламинэктомию нижней части дуги L6 и верхней части дуги L7 с левой стороны позвоночника. У животных было выполнено отведение в сторону нервного корешка L7, после чего производили прокалывание межпозвоночного диска L6–L7. Затем в него инъекционным путем вводили физиологический раствор (для создания избыточного давления и воспроизведения грыжи диска). С помощью локальной электростимуляции определяли скорость нервной проводимости корешка. Оказалось, что максимальное снижение нервной проводимости, вызванное повреждением нервных корешков, достигалось уже на 7-й день после операции и восстанавливалось до исходного уровня через 2 мес. В течение этих 7 дней после экспериментального моделирования грыжи прогрессировала дегенерация диска, что было доказано с помощью МРТ-исследований.
Важным аспектом в изучении факторов, приводящих к грыжеобразованию, является выяснение роли наследственности в этом процессе. Оказалось, что ускоренная дегенерация межпозвоночного диска может быть связана со структурными нарушениями коллагена I типа — основного компонента матрикса фиброзного кольца. Было установлено, что причиной дегенерации диска может также быть нарушение структуры коллагена IX типа. Методами генной инженерии была получена линия трансгенных мышей, несущих мутацию коллагена IX типа (альфа-1-коллагена) [1], приводящую к экспрессии у животных аномального коллагена. Рентгенологические и гистологические исследования показали, что дегенерация шейных и поясничных дисков быстрее происходила у трансгенных мышей, чем у контрольных однопометных животных. Изменения включали снижение объема или полное исчезновение студенистого ядра, формирование щелей в фиброзном кольце, приводящих к пролабированию диска. Как и у человека, у этой линии мышей зафиксировано формирование остеофитов.
Важным моментом реакции организма на грыжу диска является присутствие воспаления в компримированной области. Воспалительная реакция сопровождается аттракцией моноцитов и формированием макрофагов (рис. 1).
В литературе имеются данные гистологических исследований, согласно которым грыжи диска могут быть сформированы фрагментами студенистого ядра, фиброзного кольца и хрящевой ткани гиалиновой замыкательной пластинки. При этом в 89 % грыж присутствовало только студенистое ядро [22–24, 26, 27]. Знание тканевого состава грыжи является важным для прогнозирования воспалительного ответа организма [22, 24, 25, 27, 28]. Несмотря на то что межпозвоночный диск является аваскулярной структурой, в грыжах имеет место неоангиогенез. Согласно существующему мнению [9, 11, 14], дисфункция нервных корешков и боль в области седалищного нерва при грыже диска обусловлены механической компрессией и связаны с присутствием студенистого ядра в эпидуральном пространстве.
В условиях грыжеобразования нарушается метаболизм студенистого ядра и окружающих тканей. Имеет место экспрессия вазоактивных факторов, повышается проницаемость сосудов, выработка хемотакcических факторов, кумуляция в области дегенеративного студенистого ядра клеток воспаления [29–35]. Возможный механизм грыжеобразования, вызванный пролабированием студенистого ядра и биосинтезом провоспалительных факторов, схематически представлен на рис. 2.

На важную роль воспаления в процессе грыжеобразования указывают и другие авторы, которые с помощью иммуногистохимических методов изучали клетки воспаления в экспериментальных полнослойных дефектах фиброзного кольца свиней при воспроизведении полнослойного переднелатерального разреза фиброзного кольца дисков на уровне L3–L4 или L4–L5 [10]. Иммуногистохимическими методами были проанализированы образцы тканей (из области повреждения диска и смежных участков), взятые через 1, 2 и 3 мес. после операции. Выявлено, что в 58 % поврежденных дисков среди клеток воспаления преобладали макрофаги, а в 33 % — Т-лимфоциты. Макрофаги играют важную роль в процессах резорбции экструзионных тканей диска [36–39]. Эти данные согласуются с результатами анализа послеоперационного материала больных с грыжами диска, показавшими наличие в них клеток воспаления, преимущественно макрофагов.
На животных модельных объектах было получено подтверждение того, что макрофаги из области воспаления могут мигрировать в смежные неповрежденные участки диска. Однако авторами была использована экспериментальная модель переднелатеральной грыжи диска, что не полностью соответствует клиническим ситуациям, при которых большинство грыж диска являются заднелатеральными. Несмотря на это, полученные результаты подтверждают роль воспаления в процессе грыжеобразования.
Моделирование грыжи диска путем имплантации в эпидуральное пространство аутологичного студенистого ядра
В экспериментальных работах многие авторы изучали механизм развития грыж диска при имплантации студенистого ядра в эпидуральное пространство канала спинного мозга [8, 9, 14]. Для моделирования подобных нарушений авторы использовали аутологичное студенистое ядро, которое извлекали из хвостового отдела позвоночника животных с последующей его имплантацией в эпидуральное пространство спинномозгового канала поясничного отдела позвоночника. Таким образом, с одной стороны, достигалось моделирование экструзии диска, а с другой стороны — стеноза позвоночного канала.
Имеется ряд работ, рассматривающих влияние имплантированного аутологичного студенистого ядра на нервные корешки спинного мозга. Показано, что студенистое ядро, имплантированное в эпидуральное пространство (при моделировании экструзии диска), может индуцировать морфологические и функциональные изменения нервных корешков. В эксперименте на свиньях M. Cornefgord [41] изучал морфологические и функциональные изменения нервных структур, индуцированных студенистым ядром, механической компрессией корешков или их совместным воздействием. Применение одного лишь студенистого ядра или компрессии корешков вызывало снижение скорости нервной проводимости, аналогичный эффект наблюдали при их совместном воздействии. После имплантации студенистого ядра снижение скорости нервной проводимости было зафиксировано и в контралатеральном корешке.
В научной литературе также широко освещена роль студенистого ядра, имплантированного в эпидуральное пространство, в формировании боли в нижнем отделе спины и ишиалгии [14]. При этом, как и в случаях с экспериментальным рассечением диска [8], авторы отмечали снижение скорости нервной проводимости [9]. В эксперименте на крысах линии Вистар аутологичное студенистое ядро извлекали из межпозвоночного диска крестцово-копчикового отдела позвоночника и помещали на твердую мозговую оболочку спинного мозга, нервный корешок или дорсальные ганглии корешков L4, L5 или L6 [14]. Было показано, что студенистое ядро индуцирует гипералгезию в конечности крыс во всех перечисленных случаях, однако наиболее высокая степень гипералгезии имела место в случае контакта студенистого ядра с ганглием дорсального корешка L5.
В экспериментах на животных моделях было показано, что компрессия нервных корешков не является существенной причиной ишиалгии [42, 43]. Механическая компрессия здорового нервного корешка может вызывать дизестезию, парестезию, потерю двигательной функции, но не боль [13]. К. Olmarker [7] впервые представил доказательства того, что студенистое ядро может индуцировать повреждения нервных корешков при отсутствии механической компрессии. В эксперименте на 30 свиньях была произведена имплантация студенистого ядра и заднебрюшинного жира (контроль) в эпидуральное пространство без механической компрессии. Студенистое ядро индуцировало снижение скорости нервной проводимости в течение 1–7 дней по сравнению с контрольной группой. Снижение скорости нервной проводимости было значительным уже в 1-й день после операции и становилось еще более выраженным на 3-й и 7-й день. Гистологически было отмечено сходное количество лейкоцитов и макрофагов в эпидуральной ткани животных обеих групп. Выраженность эндоневральной гиперемии и дегенерации нервных волокон была больше в группе животных с имплантацией студенистого ядра. Для объяснения этих данных было выдвинуто две гипотезы: 1) высвобождение студенистым ядром веществ, имеющих непосредственное влияние на нервные волокна; 2) воспалительная или сосудистая реакция. Это исследование впервые продемонстрировало роль химических факторов, высвобождаемых студенистым ядром, в повреждении нервных корешков.
Согласно современным представлениям ишиалгия обусловлена не только механическим повреждением нервных корешков дегенеративным диском или грыжевым материалом, но и цитокинами, которые продуцируются клетками диска либо грыжи. Была разработана экспериментальная модель грыжи диска для изучения природы боли и изменения поведенческих реакций у животных. В эксперименте на 40 крысах (4 группы по 10 животных: контрольная группа; группа с рассечением диска; группа со смещением нервного корешка (смещение дорсального ганглия L4 и растягивание L4-корешка) и группа с комплексным воздействием) нарушения поведения были обнаружены только в группе с комплексным воздействием 2 факторов. Было сделано заключение о важной роли как химического, так и механического фактора [44]. В других экспериментальных работах на 18 собаках электрофизиологическими методами было исследовано изменение нервной проводимости, а гистологическими — интранейральный отек, отек шванновских клеток и повреждение нервных волокон у животных 4 групп: контрольной; групп с применением студенистого ядра без компрессии и хронической компрессии, а также группы с совместным воздействием 2 факторов (студенистое ядро и хроническая компрессия) [45]. Нарушения были более выражены у животных после совместного воздействия.
В экспериментах на крысах было установлено, что гипералгезия после имплантации студенистого ядра была более выраженной и продолжительной в том случае, когда нерв предварительно подвергали механической компрессии [46]. В исследованиях S.X. Hou было проведено изучение патогенеза дискогенного ишиаса [47]. Эксперимент был выполнен на 51 крысе и включал 6 серий: 1) компрессию нервных корешков межпозвоночным диском; 2) недискогенную компрессию; 3), 4), 5) имплантацию диска либо студенистого ядра или фиброзного кольца в эпидуральное пространство без компрессии; 6) контроль [47]. Во всех 5 опытных группах у животных имелась длительная гипералгезия. Эти результаты показали, что как механические, так и химические факторы способствуют патогенезу дискогенной боли и что при комплексном воздействии этих факторов они выступают как синергисты (усиливают действие друг друга), т.е. происходит не просто суммирование их эффекта. На ранней стадии патологического процесса могут преобладать химические факторы. Эти данные подтверждены в исследовании на модели крыс [48], когда более выраженный эффект был отмечен при сочетанном воздействии компрессии и имплантации студенистого ядра, а также была произведена оценка роли биосинтеза фактора роста нервов — потенциального источника гипералгезии и нейропатической боли.
Несмотря на все имеющиеся противоречия и сложности интерпретации проблемы ишиалгии, клинические и экспериментальные данные в настоящее время базируются на следующих заключениях: 1) вещества, продуцируемые студенистым ядром, могут индуцировать структурные и функциональные нарушения нервных корешков даже при отсутствии их механической компрессии; 2) боль, по-видимому, имеет место только тогда, когда присутствует предварительное или сопутствующее механическое повреждение.
Для выяснения механизма влияния студенистого ядра на нервные корешки в области грыжи диска представляют интерес исследования по установлению роли в этом процессе медиаторов воспаления [11, 13]. Было показано [11], что аутологичное студенистое ядро индуцирует эндоневральный отек и снижение скорости нервной проводимости в спинальных нервных корешках при экспериментально смоделированной грыже диска. В этот механизм, как полагают, вовлечены медиаторы воспаления. Оксид азота — это мощный медиатор воспаления, который участвует в процессах вазорегуляции, нейротрансмиссии и нейропатической боли. Синтез оксида азота может быть индуцирован различными цитокинами, такими как фактор некроза опухоли α, который играет важную патофизиологическую роль в процессе экспериментального грыжеобразования.
В исследовании, выполненном на свиньях, D. Mulleman [13] также отметил роль провоспалительных цитокинов, секретируемых аутологичным студенистым ядром, имплантированным в область нервных корешков конского хвоста. При этом фактор некроза опухоли альфа является основным кандидатом среди веществ, потенциально ответственных за болезненность нервных корешков. Эти данные позволяют внести ясность в тех ситуациях, когда имеют место неудовлетворительные результаты после выполненной хирургической декомпрессии корешков, когда влияние механического фактора устраняется, но остается влияние химических компонентов, продуцируемых грыжевым диском.
Подтверждение этих данных было получено при изучении влияния культивированных клеток студенистого ядра на изменение скорости нервной проводимости [49]. После 3 недель культивирования аутологичных клеток студенистого ядра и фибробластов 29 свиней животным в область конского хвоста инъекционным способом вводили культуральную среду (содержащую вещества, экспрессируемые этими клетками), погибшие/живые фибробласты или клетки студенистого ядра. На 7-й день эксперимента после трансплантации погибших или живых клеток студенистого ядра было отмечено снижение скорости нервной проводимости, в то время как использование мертвых или живых фибробластов не влияло на этот показатель [49]. Эти данные свидетельствуют в пользу активации провоспалительных цитокинов, которые экспрессируются клетками студенистого ядра в условиях трансплантации. Цитокины, экспрессированные в культуральную среду, по всей вероятности, инактивированы или содержатся в следовых количествах.
С учетом роли химических компонентов, продуцируемых студенистым ядром, в генезе ишиалгии становится понятным большое количество экспериментальных работ, направленных на локальное подавление воспалительного процесса в области грыжи диска при использовании медикаментозной терапии.
Следовательно, проведенный анализ данных литературы по проблеме формирования и моделирования грыж межпозвоночного диска у животных показал, что нарушение структурной организации и топографии студенистого ядра является одним из ключевых моментов в запуске каскада патологических событий, приводящих к дегенерации межпозвоночного диска и к грыжеобразованию. В патогенезе дискогенной боли и ишиалгии важная роль принадлежит секретируемым хондроцитами студенистого ядра грыжевого диска цитокинам — в первую очередь фактору некроза опухолей α. Обосновано значение в генезе гипералгезии синергизма механической компрессии корешков спинного мозга и химических компонентов грыжи. Представлены данные об участии клеток воспаления в процессе грыжеобразования. Дана характеристика спектра вазоактивных, хемотакcических факторов и провоспалительных цитокинов, вовлеченных в генез грыжи.
1. Progressive degeneration of articular cartilage and intervertebral discs. An experimental study in transgenic mice bearing a type IX collagen mutation / T. Kimura, K. Nakata, N. Tsumaki et al. // Int. Orthop. — 1996. — Vol. 20, № 3. — P. 177-181.
2. Experimental model of multidirectional disc hernia in rats / A. Latorre, J. Albareda, T. Castiella et al. // Int. Orthop. — 1998. — Vol. 22, № 1. — P. 44-48.
3. Monocyte chemoattractant protein-1 in the intervertebral disc. A histologic experimental model / T. Kikuchi, T. Nakamura, T. Ikeda et al. // Spine. — 1998. — Iss. 15. — Vol. 23, № 10. — P. 1091-1099.
4. Kuga N. Histology of intervertebral disc protrusion: an experimental study using an aged rat model / N. Kuga, M. Kawabuchi // Spine. — 2001. — Vol. 26, № 17. — P. 379-384.
5. A study of a rat lumbar disc herniation model and the mechanism spontaneous of resorption / J.T. Liu, H. Jiang, Y.J. Wang et al. // Zhongguo Gu Shang. — 2010. — Vol. 23, № 5. — P. 370-372.
6. Michalek A.J. Needle puncture injury of the rat intervertebral disc affects torsional and compressive biomechanics differently / A.J. Michalek, K.L. Funabashi, J.C. Iatridis // Eur. Spine J. — 2010. – Vol. 19. — № 12. — P. 2110-2116.
7. Olmarker K. Autologous nucleus pulposus induces neurophysiologic and histologic changes in porcine cauda equina nerve roots / K. Olmarker, B. Rydevik, C. Nordborg // Spine. — 1993. — Vol. 18. — P. 1425-1432.
8. Incision of the anulus fibrosus induces nerve root morphologic, vascular, and functional changes. An experimental study / S. Kayama, S. Konno, K. Olmarker et al. // Spine. — 1996. — Iss. 15. — Vol. 21, № 22. — P. 2539-2543.
9. Experimental disc herniation: evaluation of the natural course / K. Otani, I. Arai, G.P. Mao et al. // Spine. — 1997. — Vol. 22, № 24. — P. 2894-2899.
10. Inflammatory cells in full-thickness anulus injury in pigs. An experimental disc herniation animal model / A. Habtemariam, J. Virri, M. Gronblad et al. // Spine. — 1998. — Iss. 1. — Vol. 23, № 5. — P. 524-529.
11. Nitric oxide as a mediator of nucleus pulposus-induced effects on s pinal nerve roots / H. Brisby, G. Byrod, K. Olmarker et al. // J. Orthop. Res. — 2000. — Vol. 18, № 5. — P. 815-820.
12. Simunic D.I. Biomechanical factors influencing nuclear disruption of the intervertebral disc / D.I. Simunic, N.D. Broom, P.A. Robertson // Spine. — 2001. — Vol. 26, № 11. — P. 1223-1230.
13. Pathophysiology of disk-related sciatica I. Evidence supporting a chemical component. Review / D. Mulleman, S. Mammou, I. Griffoul et al. // Joint Bone Spine. — 2006. — Vol. 73. — P. 151-158.
14. Experimental model to study intervertebral disc herniation / A. de Souza, L. Fernando, C. Amilcar, L.A. Helton // Rev. Bras. Orthop. — 2008. — Vol. 43, № 4.
15. Buckwalter J.A. Aging and degeneration of the human intervertebral disc / J.A. Buckwalter // Spine (Phila Pa 1976). — 1995. — Vol. 20, № 11. — P. 1307-1314.
16. Olczyk K. Age-related changes in proteoglycans of human intervertebral discs / K. Olczyk // Zeitschrift fur rheumatologie. — 1994. — Vol. 53, № 1. — P. 19-25.
17. Height of lumbar discs measured from radiographs compared with degeneration and height classified from MR images / W. Frobin, P. Brinckmann, M. Kramer, E. Hartwig // European Radiology. — 2001. — Vol. 11, № 2. — P. 263-269.
18. The human lumbar endplate: evidence of changes in biosynthesis and denaturation of the extra-cellular matrix with growth, maturation, ageing, and degeneration / J. Antoniou, N.M. Goudsouzian, T.F. Heathfield et al. // Spine. — 1996. — Vol. 21. — P. 1153-1161.
19. Iencean S.M. Lumbar intervertebral disc herniation following experimental intradiscal pressure increase / S.M. Iencean // Acta. Neurochir. — 2000. — Vol. 142, № 6. — P. 669-676.
20. Wognum S. Influence of osmotic pressure changes on the opening of existing cracks in 2 intervertebral disc models / S. Wognum, J.M. Huyghe, F.P. Baaijens // Spine (Phila Pa 1976). — 2006 — Vol. 31, № 16. — P. 1783-1788.
21. Rajasekaran S. Assessment of status of end plate and diffusion in degenerative disc disease / S. Rajasekaran // Selected abstracts delivered at the 8th Annual АО Spine North America Fellows Forum. — 2010. — Vol. 1. — Iss. 2. — P. 47-55.
22. Brock M. The form and structure of the extruded disc / M. Brock, S. Patt, H.M. Mayer // Spine. — 1992. — Vol. 17. — P. 1457-1461.
23. Kokubun S. Cartilaginous endplate in cervical disc herniation / S. Kokubun, M. Sakurai, Y. Tanaka // Spine. — 1996. — Vol. 21. — P. 190-195.
24. Weidner N. Intervertebral disk material: criteria for determining probable prolapse / N. Weidner, D.T. Rice // Hum. Pathol. — 1988. — Vol. 19. — P. 406-410.
25. Histological changes in aging lumbar intervertebral discs / T. Yasuma, S. Koh, T. Okamura, Y. Yamauchi // J. Bone Joint. Surg. Am. — 1990. — Vol. 72. — P. 220-229.
26. Moore R.J. The vertebral endplate: disc degeneration, disc regeneration / R.J. Moore // Eur. Spine J. — 2006. — Vol. 15, Suppl. 3. — SS333-SS337.
27. Histological development of intervertebral disc herniation / T. Yasuma, E. Makino, S. Saito, M. Inui // J. Bone Joint Surg. Am. — 1986. — Vol. 68. — P. 1066-1072.
28. Histologic changes in the disc after cervical spine trauma: evidence of disc absorption / L.Y. Carreon, T. Ito, M. Yamada et al. // J. Spinal. Disord. — 1996. — Vol. 9. — P. 313-316.
29. Herniated lumbar intervertebral discs spontaneously produce matrix metalloproteinases, nitric oxide, interleukin-6, and prostaglandin E2 / J.D. Kang, H.I. Georgescu, L. McIntyre-Larkin et al. // Spine. — 1996. — Vol. 21. — P. 271-277.
30. High levels of inflammatory phospholipase A2 activity in lumbar disc herniations / J.S. Saal, R.C. Franson, R. Dobrow et al. // Spine. — 1990. — Vol. 15. — P. 674-678.
31. Inflammatory cytokines in the herniated disc of the lumbar spine / H. Takahashi, T. Suguro, Y. Okazima et al. // Spine. — 1996. — Vol. 21. — P. 218-224.
32. mRNA expression of cytokines and chemokines in herniated lumbar intervertebral discs / S.H. Ahn, Y.W. Cho, M.W. Ahn et al. // Spine. — 2002. — Vol. 27. — P. 911-917.
33. Spontaneous production of monocyte chemoattractant protein-1 and interleukin-8 by the human lumbar intervertebral disc / J.G. Burke, R.W. Watson, D. McCormack et al. // Spine (Phila Pa 1976). — 2002. — Vol. 27, № 13. — P. 1402-1407.
34. The role of inflammation in disk herniation-associated radiculopathy / P. Goupille, M.I. Jayson, J.P. Valat, A.J. Freemont // Semin. Arthritis Rheum. — 1998. — Vol. 28. — P. 60-71.
35. Matrix metalloproteinases: the clue to intervertebral disc degeneration? / P. Goupille, M.I. Jayson, J.P. Valat, A.J. Freemont // Spine. — 1998. — Vol. 23. — P. 1612-1626.
36. Influence of macrophage infiltration of herniated disc tissue on the production of matrix metalloproteinases leading to disc resorption / M. Doita, T. Kanatani, T. Ozaki et al. // Spine (Phila Pa 1976). — 2001. — Vol. 26, № 14. — P. 1522-1527.
37. Podichetty V.K. The aging spine: the role of inflammatory mediators in intervertebral disc degeneration / V.K. Podichetty // Cell Mol. Biol. (Noisy-le-grand). — 2007. — Vol. 53, № 5. — P. 4-18.
38. Vascular endothelial growth factor (VEGF)-induced angiogenesis in herniated disc resorption / Hirotaka Haro, Tsuyoshi Katob, Hiromichi Komorib, Motonobu Osadaa and Kenichi Shinomiya // Journal of Orthopaedic Research. — 2002. — Vol. 20, Iss. 3. — P. 409-415.
39. Chemokine profile of herniated intervertebral discs infiltrated with monocytes and macrophages / S. Kawaguchi, T. Yamashita, G. Katahira et al. // Spine (Phila Pa 1976). — 2002. — Vol. 27, № 14. — P. 1511-1516.
40. Autio R.A. MRI of herniated nucleus pulposus:correlation with clinical findings, determinants of spontaneous resorption and effects of antiinflammatory treatments on spontaneous resorption / R.A. Autio — OULUN YLIOPISTO: OULU, 2006. — Р. 75.
41. Mechanical and biochemical injury of spinal nerve roots: a morphological and neurophysiological study / M. Cornefjord, K. Olmarker, R. Rydevik, C. Nordborg // Eur. Spine J. — 1996. — Vol. 5. — P. 187-192.
42. Cavanaugh J.M. Neural mechanisms of lumbar pain / J.M. Cavanaugh // Spine. — 1995. — Vol. 16. — P. 1804-1809.
43. Kulisch S.D. The tissue origin of low-back pain and sciatica: a report of pain response to tissue stimulation during operations on the lumbar spine using local anesthesia / S.D. Kulisch, C.L. Ulstrom, C.J. Michael // Orthop. Clin. North. Am. — 1991. — Vol. 22. — P. 181-187.
44. Olmarker K. Pathogenesis of sciatic pain. A study of spontaneous behavior in rats exposed to experimental disc herniation / K. Olmarker, R. Storkson, O.G. Berge // Spine. — 2002. — Vol. 27. — P. 1312-1317.
45. Pathomechanisms of nerve root injury caused by disc herniation. An experimental study of mechanical compression and chemical irritation / N. Takahashi, S. Yabuki, Y. Aoki, S. Kikuchi // Spine. — 2003. — Vol. 28. — P. 435-441.
46. Comparison of neuropathic pain induced by the application of normal and mechanically compressed nucleus pulposus to lumbar nerve roots in the rat / M. Kawakami, H. Hashizume, H. Nishi et al. //J. Orthop. Res. — 2003. — Vol. 21. — P. 535-539.
47. Chronic inflammation and compression of the dorsal root contribute to sciatica induced by the intervertebral disc herniation in rats / S.X. Hou, J.G. Tang, H.S. Chen, J. Chen // Pain. — 2003. — 105. — 255-264.
48. Nerve growth factor involvement in pain behavior in a rat model of experimental disc herniation / A. Onda, Y. Murata, B. Rydevik et al. // Porto: 31st annual meeting of the International Society for the Study of the Lumbar Spine. — 2004.
49. Cultured, autologous nucleus pulposus cells induce functional changes in spinal nerve roots / S. Kayama, K. Olmarker, K. Larsson et al. // Spine. — 1998. — Vol. 23, № 21. — P. 55-58.

