Журнал «Травма» Том 9, №1, 2008
Вернуться к номеру
Динаміка клініко-рентгенологічних змін васкуляризованого малогомілкового трансплантату при заміщенні великих дефектів кісток кінцівок
Авторы: О.А. Бур’янов, І.М. Курінний, О.С. Страфун, Г.С. Силко - Інститут травматології та ортопедії АМН України, Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
У статті представлені результати обстеження 21 пацієнта, що перенесли операцію по пересадженню васкуляризованого малогомілкового трансплантата для заміщення великіх сегментарних дефектів кісток кінцівок. На рентгенограмах 15 хворих у динаміці оцінювалося зрощення трансплантата з реципієнтною кісткою, консолідація стресових переломів при їхній наявності, ступінь і тип гіпертрофії трансплантата. Зрощення трансплантата з кісткою-реципієнтом відбулося в строки від 2 до 12 місяців після операції (у середньому 5 місяців). Гіпертрофія васкуляризованого трансплантата досягала 118% і виникала при наявності підвищених осьових навантажень при заміщенні дефектів кісток нижніх кінцівок. Стресові переломи малогомілкового трансплантата були зафіксовані у 5 хворих (33%) винятково на нижніх кінцівках, гіпертрофічна кісткова мозоля, яка виникала на місці перелому, активізувала гіпертрофію всього трансплантата. Наші результати порівнянні з літературними даними. Ми вважаємо, що мікрохірургічне пересадження малогомілкової кістки є методом порятунку важко ушкоджених кінцівок.
В статье представлены результаты обследования 21 пациента, перенесших операцию по пересадке васкуляризированого малоберцового трансплантата для замещения больших сегментарных дефектов костей конечностей. На рентгенограммах 15 больных в динамике оценивалось сращение трансплантата с реципиентной костью, консолидация стрессовых переломов при их наличии, степень и тип гипертрофии трансплантата. Сращение трансплантата с костью-реципиентом наступало в сроки от 2 до 12 месяцев после операции (в среднем 5 месяцев). Гипертрофия васкуляризированого трансплантата достигала 118% и возникала при наличии повышенных осевых нагрузок при замещении дефектов костей нижних конечностей. Стрессовые переломы малоберцового трансплантата были зафиксированы у 5 больных (33%) исключительно на нижних конечностях, гипертрофическая костная мозоль, возникшая на месте перелома, активизировала гипертрофию всего трансплантата. Наши результаты сопоставимы с литературными данными. Мы считаем, что микрохирургическая пересадка малоберцовой кости является методом спасения тяжело поврежденных конечностей.
We report a retrospective review of 21 consecutive patients who underwent a vascularised fibular transfer to reconstruct a large skeletal defect. Bone union, stress fracture and percentage of graft hypertrophy were assessed radiographically. Hypertrophy was measured in 15 patients and ranged from 0 to 118%. That was fibula physiological respond to biomechanical loading in lower limb. Bony union was achieved in 2 to 12 months after surgery (median 5 months). Stress fractures were observed in 5 patients (33%) in lower limb only. We discover that stress fracture activates bone hypertrophy of all graft. Our results compare well with other series. We consider that the free fibula transplantation is an excellent method for salvage of limbs with large bony defects.
мікрохірургія, сегментарні дефекти кісток, васкуляризовані кісткові трансплантати, гіпертрофія трансплантата
микрохирургия, сегментарные дефекты костей, васкуляризированые костные трансплантаты, гипертрофия трансплантата
microsurgery, segmental bone defects, vascularized bone grafts, graft hypertrophy
Васкуляризований трансплантат малогомілкової кістки вже протягом більш ніж 30 років з успіхом застосовується для лікування значних сегментарних дефектів кісток кінцівок, пластики дефектів лицьового черепа, замикання міжхребцевих проміжків та фалопластики [5]. У порівнянні із стандартним неваскуляризованим трансплантатом малогомілкова кістка на судинній ніжці має значні переваги. Зокрема, це на порядок швидший процес зрощення трансплантата з реципієнтною кісткою, можливість пересадки кістки із шкірним клаптем значних розмірів, що отримує кровопостачання з басейну малогомілкової артерії, стійкість васкуляризованої кістки до інфекції, значно нижчий рівень утворення несправжніх суглобів та переломів трансплантата, гіпертрофія трансплантату з часом під впливом фізіологічних осьових навантажень [4].
Незважаючи на широке розповсюдження за кордоном методики лікування сегментарних дефектів кісток кінцівок шляхом пересадки малогомілкової кістки на судинній ніжці [3-9], у вітчизняній літературі зустрічаються лише поодинокі повідомлення про застосування даної мікрохірургічної операції [1,2]. Питання клініко-рентгенологічних змін трансплантованої малогомілкової кістки у вітчизняній та зарубіжній літературі висвітлені недостатньо, деякі дані та висновки видаються нам суперечливими, що і спонукало нас до власних досліджень.
Матеріал і методи
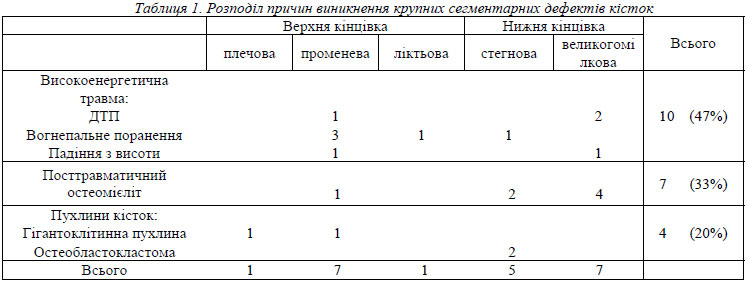
Представлені результати обстеження 21 хворого, що зазнали пересадки васкуляризованої малогомілкової кістки для заміщення значних сегментарних дефектів кісток кінцівок в клініці мікрохірургії та реконструктивної хірургії верхньої кінцівки в період з 1983 по 2005 рік. Серед прооперованих було 19 чоловіків та 2 жінки з середнім віком на момент оперативного втручання 30,5 років. Пацієнтам під час оперативного втручання замістили сегментарні дефекти кісток довгих кінцівок від 5 до 17 см, у середньому 11,2см. Мікрохірургічне заміщення дефектів довгих трубчастих кісток кінцівок виконували у хворих з наслідками високоенергетичних травм, а також після радикального лікування остеомієліту та пухлин кісток (табл. 1). Час післяопераційного спостереження хворих становив від 2 до 24 років, в середньому 11,2 років. Хворим виконували стандартизоване обстеження, що включало клінічне обстеження функції прооперованої кінцівки та рентгенографію ураженого сегменту в терміни 3-4, 6, 12 та 24 місяці після операції, а також в подальшому при повторному зверненні. На рентгенограмах, що виконувались в 2 стандартних проекціях, оцінювали наявність зрощення трансплантата з реципієнтною кісткою, ступінь та тип гіпертрофії трансплантата в порівнянні з вихідною товщиною.
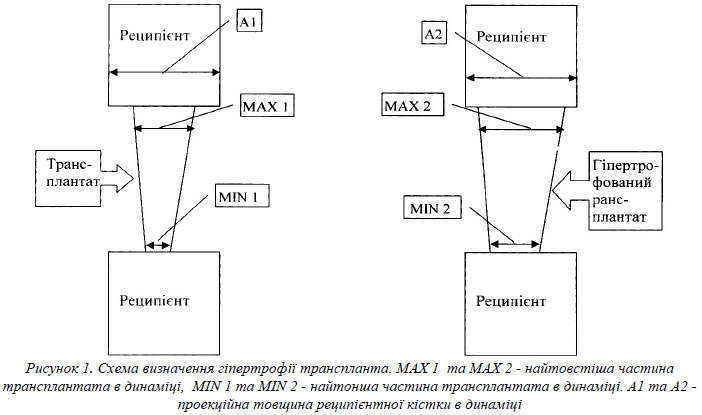
Для визначення гіпертрофії трансплантата ми застосовували інтегральну методику, що була розроблена нами на основі робіт S.Falder [6] та H.De Boer [3]. На рентгенограмах прооперованої кінцівки в динаміці ми вимірювали найтоншу (MIN) та найтовстішу (MAX) частини трансплантата [6] (рис. 1) з визначенням середньої товщини трансплантата (В). Для уникнення помилок при вимірюванні ступеня гіпертрофії пересадженої малогомілкової кістки через рентгенологічне збільшення об’єктів, що може виникнути при здійсненні знімків на рентгенівських апаратах з різною фокусною відстанню, застосовувався спеціальний індекс рентгенологічної гіпертрофії трансплантата (ІРГТ) [3]. Індекс визначався згідно формули: ІРГТ1=В1/А1, де А проекційна товщина реципієнтної кістки (рис. 1), а В - середнє значення товщини трансплантата, що визначали за формулою В = (MIN+MAX)/2. Гіпертрофія трансплантованої малогомілкової кістки у відсотках визначалась згідно наступної формули: Гіпертрофія = (ІРГТ2 - ІРГТ1)/ ІРГТ1 х100. Оскільки хворим завжди здійснювали рентгенографію у 2 проекціях, то після визначення гіпертрофії трансплантата в кожній проекції знаходили середню величину гіпертрофії за кожний період.
У пацієнтів, що зазнавали стресових переломів трансплантованої малогомілкової кістки, оцінювали рентгенологічну динаміку зрощення та перебудови перелому.
Проекційна товщина малогомілкової кістки на рентгенівській плівці може змінюватись залежно від кута, під яким здійснюється рентгенівський знімок. Це пов'язано з тим, що діафіз малогомілкової кістки на поперечному перерізі тригранний. В своїх анатомічних дослідженнях De Boer [3] виявив, що проекційна товщина малогомілкової кістки на рентгенівській плівці може змінюватись на 20% при різних кутах розвороту трансплантата. Тому достовірно встановленою вважалась гіпертрофія трансплантата, що перевищувала 20% від початкової товщини пересадженої малогомілкової кістки.
Тип гіпертрофії трансплантата визначали наступним чином: якщо трансплантат збільшувався за рахунок потовщення кортикального шару, без зміни товщини інтрамедулярного каналу, - це була періостальна гіпертрофія; за умови пропорційного збільшення порожнини інтрамедулярного каналу - гіпертрофія вважалась ендостальною [3].
Результати та обговорення
В 15 пацієнтів вдалось досягнути первинного зрощення трансплантата з реципієнтною кісткою на обох полюсах та гіпертрофії трансплантата (добрі результати), дослідження рентгенограм саме цих пацієнтів представлено в нашій роботі. Окрім того, один пацієнт після операції на повторні огляди не з’являвся, 1 пацієнт помер від серцево-судинної патології, у 2 хворих (незадовільні результати лікування) трансплантат був загублений (тромбоз судинних анастомозів з подальшою активацією остеомієліту), що надалі призвело до ампутації ураженої нижньої кінцівки (1 випадок) та видалення трансплантата з утворенням несправжнього суглоба-дефекту (1 випадок). В 2 пацієнтів не відбулось зрощення трансплантата на одному з полюсів (задовільний результат), проте від подальших оперативних втручань хворі відмовились.
Зрощення малогомілкового трансплантата з реципієнтною кісткою відбувалось в строки 2-12 місяців після операції (в середньому 5 місяців). Швидке зростання трансплантата з реципієнтною кісткою відмічалось при співпадінні діаметрів цих кісток, що спостерігалось при заміщенні дефектів кісток верхніх кінцівок. Чим більшою була невідповідність діаметрів кісток, тим повільніше наставала консолідація фрагментів.
Гіпертрофія трансплантатів малогомілкової кістки коливалась від 0 до 118%. Нами не було виявлено жодного випадку достовірної (більше 20%) гіпертрофії трансплантатів на верхній кінцівці (обстежено 5 пацієнтів, у яких заміщались дефекти кісток передпліччя). Варто зауважити, що в дослідженні відсутні хворі з заміщеними дефектами плечових кісток. Оскільки діаметр малогомілкової кістки відповідає діаметру кісток передпліччя, після консолідації фрагментів та початку розробки рухів гіпертрофії трансплантата не відбувається.
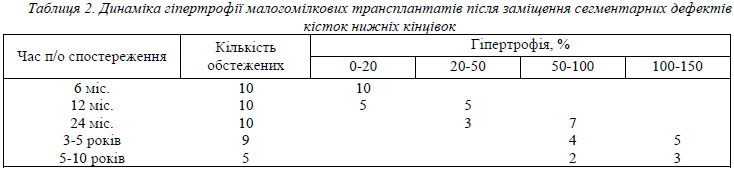
Зовсім інша картина спостерігається на нижніх кінцівках (табл. 2). Малогомілкова кістка в нормі несе від 10% до 16% навантаження на нижню кінцівку [7]. Тому після зрощення трансплантата та початку осьових навантажень на нижню кінцівку починається її гіпертрофія. Дані розрахунків гіпертрофії малогомілкового трансплантата наведені в табл. 2 та 3.
Значно посилює гіпертрофію трансплантата стресовий перелом малогомілкової кістки (табл. 3). Стресовий перелом трансплантата виник у 5 з 15 чоловік і виключно на нижніх кінцівках (33% від загальної кількості, 50% від пересаджених в дефекти кісток нижніх кінцівок трансплантатів). Таким хворим призначали гіпсову іммобілізацію травмованої кінцівки на 3 місяці. За цей час спостерігалось зрощення перелому з утворенням гіпертрофічної мозолі та спостерігалась активація гіпертрофії трансплантата по всій довжині.
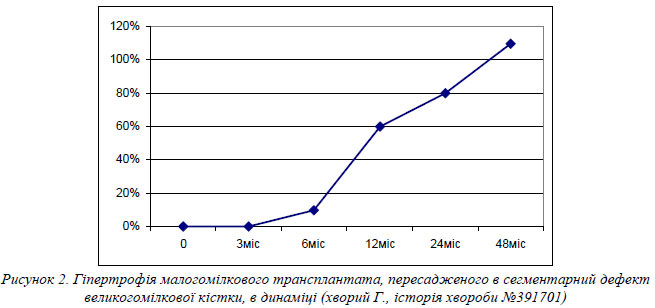
Етапність гіпертрофії малогомілкового трансплантата (рис. 2) представлена на прикладі хворого Г. (історія хвороби №391701). Протягом перших 4-5 місяців відбувається первинне зростання трансплантата з реципієнтною кісткою. Після зрощення трансплантата пацієнт розпочинає дозоване навантаження на прооперовану кінцівку, що призводить до достовірної гіпертрофії трансплантату. Саме на цьому етапі реабілітаційного лікування (6-12 місяців після операції) найчастіше виникають стресові переломи малогомілкової кістки. Через 2 роки після операції товщина гіпертрофованої малогомілкової кістки стає достатньою, щоб ходити без додаткової опори. В подальшому трансплантат продовжує повільно гіпертрофуватись, аж поки не досягне товщини реципієнтної кістки.
У проведеному дослідженні ми також намагались встановити, за рахунок чого відбувається гіпертрофія малогомілкового трансплантата. В усіх випадках було встановлено, що потовщення малогомілкової кістки здійснюється за рахунок окістя, а кістково-мозковий канал залишається інтактним і не розширюється слідом за перебудованою кісткою.
Клініко-експериментальним шляхом було встановлено, що механічна стимуляція або осьові навантаження на кістку - головний фактор в підтриманні нормального балансу між формуванням та резорбцією кісткової тканини [3]. Зростання механічних навантажень на довгі кістки призводить до певних адаптаційних змін, які проявляються стимуляцією формування кісткової тканини та пригніченням її резорбції. Але якщо повторні механічні навантаження перевищують міцність кістки, виникає її стресовий перелом. Здатність васкуляризованих та неваскуляризованих кісткових трансплантатів витримувати та пристосовуватись до повторних механічних навантажень залежить як від міцності, так і від життєздатності трансплантата [3].
В нашому дослідженні частота стресових переломів малогомілкового трансплантата становила 33%, всі переломи виникли в нижніх кінцівках переважно протягом 1-го року після оперативного втручання. Ці показники збігаються з дослідженнями інших авторів, у яких частота переломів коливалась від 15 до 40% [3,6,8]. Стресовий перелом недостатньо гіпертрофованої малогомілкової кістки пов’язаний з її механічною втомою, оскільки для досягнення адекватної гіпертрофії кісткового трансплантата потрібно як мінімум 2 роки [9].
Minami A. та співавтори [8] на основі аналізу результатів лікування 102 пацієнтів, яким здійснювали пересадку малогомілкової кістки на судинній ніжці, дійшли до висновку, що переломи трансплантата пов’язані з порушенням біомеханічної вісі кінцівки. За даними авторів, усі переломи виникли у пацієнтів, у яких кут між малогомілковим трансплантатом та віссю реципієнтної кінцівки перевищував 10º. Якщо під час пластики СДК вдавалось зафіксувати малогомілковий трансплантат з відхиленням від біомеханічної вісі кінцівки до 10º, то в післяопераційному періоді переломів трансплантата не спостерігалось.
Результати наших спостережень підтверджують ці дані. Після перелому трансплантати зростались з певним відхиленням від початкового положення, що покращувало кутові співвідношення між реципієнтною кісткою та трансплантатом. Варто зауважити, що навколо перелому формувалась гіпертрофічна кісткова мозоля, а гіпертрофія по всій довжині трансплантата прискорювалась.
У спостереженнях закордонних авторів гіпертрофія малогомілкового трансплантата виникала як на нижніх, так і на верхніх кінцівках і коливалась від 0 до 150% при застосуванні методу H.De Boer та від 0 до 300% при вимірі ступеня гіпертрофії за S. Falder. В нашому дослідженні ми спробували поєднати обидві методики і отримали гіпертрофію трансплантата в межах 0 - 118% в 66% хворих (10 з 15), причому ми спостерігали достовірну гіпертрофію трансплантата виключно на нижніх кінцівках, які зазнають постійних значних механічних навантажень.
Гіпертрофія трансплантата на 300% (тобто потовщення в 4 рази), на нашу думку, малоймовірна. Можливо, в даному випадку S. Falder здійснював вимірювання рівня гіпертрофії трансплантата в зоні епіметафіза довгих кісток нижніх кінцівок чи в зоні гіпертрофічної мозолі, що виникає в місці перелому трансплантата. Такий підхід до визначення гіпертрофії трансплантата не відображає середніх значень потовщення малогомілкової кістки, а лише фокусується на її найширших ділянках.
В літературі описано близько півдесятка способів оцінки гіпертрофії васкуляризованого трансплантата, які дають значні розбіжності в результатах [6]. Розроблена нами інтегральна методика оцінки рівня гіпертрофії трансплантата хоч і дає скромні у відсотковому еквіваленті результати, проте забезпечує визначення середньої величини гіпертрофії незалежно від особливостей анатомічного сегменту, способів укладки чи фокусної відстані рентгенівського апарату.
Висновки
- Гіпертрофія трансплантата розпочинається лише після його зрощення з реципієнтною кісткою на обох полюсах, за умови дозованих осьових навантажень на прооперовану кінцівку.
- Перелом трансплантата виникає в строки 6-12 місяців при кутових відхиленнях останнього від біомеханічної вісі кінцівки, більших за 10º, за умови перевантаження кінцівки. Внаслідок перелому виникає гіпертрофічна кісткова мозоля та активується гіпертрофія всього трансплантата.
- Гіпертрофія трансплантата здійснюється за рахунок потовщення окістя (періостальна гіпертрофія) без розширення кістково-мозкового каналу малогомілкової кістки.
- При наявності кісткового регенерату поруч з трансплантованою малогомілковою кісткою після початку дозованих осьових навантажень гіпертрофується як малогомілковий трансплантат, так і регенерат реципієнтної кістки.
- Гіпертрофія малогомілкового трансплантата припиняється після досягнення ним товщини реципієнтної кістки.
- Курінний І.М., Страфун О.С., Крижанівський А.В. Досвід застосування мікрохірургічного трансплантату малогомілкової кістки у реконструктивній хірургії сегментарних дефектів діафізів кісток кінцівок // Вісник ортопедії, травматології та протезування. - 2006. - №2 (49). - С.51-54.
- Радомский А.А. Особенности пересадки сдвоенной малоберцовой кости на микрососудистой ножке // Клінічна хірургія. - 1996. - №5. - С.19-21.
- De Boer H.H., Wood M.B. Bone changes in the vascularized fibular graft. // J. Bone Joint Surg. - Vol. 71-B. - 1989. - P. 374-378.
- DeCoster T. A., Gehlert R.J., Mikola E.A., Pirela-Cruz M.A. Management of Posttraumatic Segmental Bone Defects // J. Am. Acad. Orthop. Surg. - 2004. -Vol.12. - P.28-38.
- Erdmann D., Giessler G. A., Bergquist G. E. O., Bruno W., Young H., Heitmann C., Levin L. S. Freier fibulatransfer. Analyse einer serie von 76 konsekutiven mikrochirugischen operationen und literaturübersicht // Chirurg. - 2004. - Vol.75. - P.799–809.
- Falder S., Sinclair J.S., Rogers C.A., Townsend P.L.G. Long-term behaviour of the free vascularised fibula following reconstruction of large bony defects // Brit.J. Plast. Surg. - 2003. - Vol.56 - P.571–584.
- Lee E.H., Goh C.H. Helm R., Pho W.H. Donor site morbidity following resection of the fibula // J. Bone Joint Surg. - 1990. - Vol.72B. - P.129-31.
- Minami A., Kasashima T., Iwasaki N., Kato H., Kaneda K. Vascularised fibular grafts: An experience of 102 patients // J. Bone Joint Surg. - 2000. - Vol.82B. - P. 1022-1025.
- Minami A., Kimura T., Matsumoto O., Kutsumi K. Fracture through united vascularized bone grafts // J. Reconstr. Microsurg. - 1993. - Vol.9. - P.227-233.