Журнал «Травма» Том 9, №4, 2008
Вернуться к номеру
Влияние механизма травмы на состояние периостальных источников остеорепарации
Авторы: В.Г. Климовицкий, В.М. Оксимец, В.Ю. Черныш, А.Г. Попандопуло, А.В. Оберемко - Донецкий национальный медицинский университет им. М. Горького, Институт неотложной и восстановительной хирургии им. В.К. Гусака АМН Украины, Донецк, Украина
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
В статье на основании экспериментальных исследований in vitro и in vivo показано влияние механизма травмы на состояние периостальных клеточных источников остеорепарации. Установлено, что в результате прямого воздействия травмирующего агента происходит нарушение пролиферативных способностей клеток надкостницы, что ведет к замедлению и нарушению остеорепаративных процессов.
В статті на основі експериментальних досліджень in vitro та in vivo показано вплив механізму травми на стан періостальних клітинних джерел остеорепарації. Встановлено, що у результаті прямої дії травмуючого агенту порушується проліферативна здатність клітин накістя, що веде до сповільнення та порушення остеорепаративних процесів.
In the article on experimental research in vitro and in vivo show the influence of traumatic mechanism on the state of periostalic sources of osteoreparation. It’s stated that at result of the direct contact of traumatic object the dysfunction proliferation of cells of periostal, which leads retardation and dysfunction of osteoreparativ processes.
периостальные источники остеорепарации, пролиферация клеток, прямой и непрямой механизм травмы
періостальні джерела остеорепарації, проліферація клітин, прямий та непрямий механізм травми
periostalic sources of osteoreparation, proliferation of cells of periostal
Процессы восстановления поврежденных тканей можно рассматривать как сложнейшее проявление жизни в экстремальных условиях. Даже если ограничиться только изучением процессов восстановления целостности костной ткани, то и тогда репаративная регенерация вырисовывается как проблема, имеющая глобальное значение для ортопедии и травматологии [7]. Несмотря на то, что при репаративном остеогенезе имеются предпосылки к полному восстановлению утраченной костной ткани, количество осложнений, связанных с нарушением или замедлением заживления костной раны после травматического повреждения, остается достаточно высоким и, по данным различных авторов, колеблется от 2,5–18% [4,9,10] до 25% [1,2].
К нарушению заживления костной раны на той или иной стадии репарации может привести несоответствие активности и дисбаланс регуляторных факторов. Значительный интерес представляет работа коллектива авторов Харьковского института патологии позвоночника и суставов, в которой приводятся обобщенные данные анализа клинико-экспериментальных исследований нарушений сращения переломов [8]. Рассматривая репаративный остеогенез как многоуровневый и многофазный процесс клеточной реакции на повреждение, авторы отмечают, что большинство причин замедления или несращения переломов связано с ранней стадией регенерации, на которой возможен «биологический сбой» генетически заложенной программы восстановления ткани. В ряде работ отечественных авторов указывается, что на течение репаративного процесса значительное влияние оказывает вид травмирующего агента и характер повреждения костной ткани [4,6,8]. А.В. Калашниковым [5] было показано, что у 55% больных с нарушением репаративного остеогенеза травма была получена в результате воздействия высокоэнерге-тического травмирующего агента (ДТП и производственная травма, связанная с воздействием движущихся механизмов), у 24% – в результате среднеэнергетической травмы и у 21% – низкоэнергетической (падение на бок, неудачное разгибание конечности). Такого же мнения придер-живаются и Л.Д. Горидова и К.К. Романенко [4, 9]. По мнению В.Г. Гололобова с соавт. «современные травмы органов опорно-двигательного аппарата характеризуются большой тяжестью» [3]. В связи с этим в ряде случаев происходит значительное разрушение клеток камбия костной ткани, в результате чего клетки не могут реализовать свои гистобластические потенции, направленные на восстановление поврежденной костной ткани. Данное состояние авторы расценивают как «остеогенная недостаточность». Однако несмотря на то, что воздействие механической силы как этиологического фактора перелома, запускающего каскад патологических и адаптационных механизмов и занимающего одно из главенствующих мест в воздействии на репаративную регенерацию костной ткани, литературных источников, посвященных детальному изучению взаимосвязи механизма травмы с состоянием клеточных источников репарации после травмы, найти не удалось. В связи с этим нами были проведены исследования, целью которых было изучение состояния периостальных источников остеорепарации в зависимости от выраженности энергетического воздействия на костную ткань травмирующего агента.
Материал и методы
Мы провели экспериментальные исследования in vivo и in vitro. Исследования осуществлялись на 30 лабораторных животных. В качестве последних были взяты белые половозрелые крысы преимущественно самцы линии Вистар массой 150-200 гр. Животные были разделены на две группы по 15 животных в группе. У животных моделировали низкоэнергетические и высокоэнергетические переломы берцовой кости. У 15 животных (1 группа) перелом берцовой кости получали в результате ее пересечения при помощи маникюрных ножниц (модель непрямого, низкоэнергетического механизма травмы). У 15 (2 группа) – перелом берцовой кости был получен в результате механического воздействия, наносимого ударным устройством, позволяющим стандартизировать силу удара (модель прямого, высокоэнергетического механизма травмы). Через 1 час после нанесения травмы по 10 крыс из каждой группы выводились из эксперимента (1 подгруппа в каждой группе). У остальных животных (по 5 животных в каждой группе) фрагменты берцовой кости иммобилизировали. Эти животные выводились из эксперимента на 10 сутки после моделирования перелома (2 подгруппа в каждой группе).
У всех животных после выведения из эксперимента травмированный сегмент отчленялся. В 1 подгруппе фрагменты берцовой кости отделялись от мягких тканей, костномозговая полость отмывалась от содержимого при помощи инсулинового шприца и физиологического раствора. После этого костные фрагменты помещали в культуральную среду на коллагеновую подложку и культивировали в СО2-инкубаторе при одинаковых условиях (37° С и 5% СО2). На пятые сутки культивирования при помощи фазовоконтрастного микроскопа, осуществляли подсчет пролиферирующих клеток надкостницы. Клетки подсчитывали в одном поле зрения микроскопа при увеличении 100 на пяти уровнях от линии перелома.
Полученный цифровой материал выражали как среднее значение со стандартной ошибкой среднего и статистически анализировали. После подсчета количества клеток костные фрагменты аккуратно извлекались из среды и продолжали культивирование прикрепившихся к коллагеновой подложке клеток надкостницы до формирования монослоя.
При помощи фазовоконтрастной микроскопии оценивали морфологическое состояние пролиферирующих клеток.
Во 2-й подгруппе отчлененные сегменты освобождались от кожных покровов, фиксировались в 10% нейтральном формалине и окрашивались гематоксилином и эозином по общепринятой методике и изучались в световом микроскопе. Оценивали наличие или отсутствие остеорепаративных процессов в области перелома и состояние клеток костной ткани.
Результаты и обсуждение
При культивировании костных фрагментов берцовых костей количество пролиферирующих клеток надкостницы на одних и тех же уровнях у животных обеих групп было не одинаково (табл.).
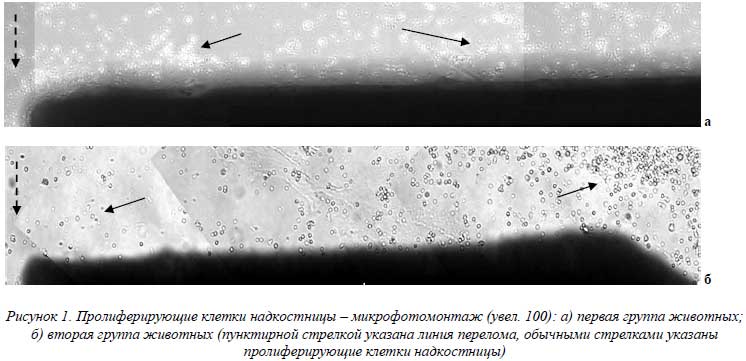
Из представленных в таблице данных видно, что в первой группе количество пролиферирующих клеток на всех пяти уровнях находилось в пределах 27-29 в поле зрения и достоверно не различались. Во второй группе количество клеток на двух первых уровнях не превышало 6 клеток в поле зрения, а на третьем, четвертом и пятом увеличивалось от 17 до 54 клеток соответственно. На этих уровнях от линии перелома различия в количестве пролиферирующих клеток имели достоверные различия (р < 0,001). При сопоставлении количества клеток на первом – пятом уровнях между группами отчетливо отмечается наличие достоверных различий. Так, у животных первой группы на первых трех уровнях количество пролиферирующих клеток значительно превосходит таковое у животных второй группы (р < 0,001). На четвертом уровне количество пролиферирующих клеток надкостницы в двух группах одинаково (р > 0,10). На пятом уровне от линии перелома отмечается обратная закономерность. Здесь количество пролиферирующих клеток во второй группе достоверно превосходит количество клеток в первой группе (р < 0,001). На рисунке 1 представлены микрофотографии пролиферирующих клеток надкостницы у животных двух групп.
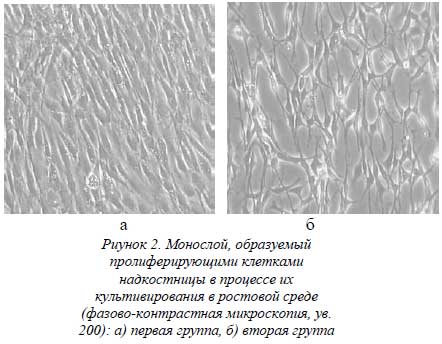
При дальнейшем культивировании клеток надкостницы (клетки всех уровней, прикрепившиеся к коллагеновому носителю) до образования клеточного монослоя были отмечены морфологические отличия между клетками надкостницы у крыс первой и второй групп. Во всех наблюдениях первой группы клетки надкостницы имели веретенообразную форму, плотно прилегали друг к другу и располагались параллельно (рис. 2 а). Во второй группе пролиферирующие клетки надкостницы имели звездчатую форму с явно выраженными выростами цитоплазмы. Образуемый этими клетками монослой имел сетчатую структуру (рис. 2 а).
При гистологических исследованиях области костной раны было отмечено, что репаративные процессы в области костной раны у животных второй подгруппы обеих групп (по 5 животных) протекают по-разному. У животных первой группы в костной ткани области повреждения отмечалось обилие остеоцитов и образование примитивных костных балок, характерных для процессов образования молодой костной ткани (рис. 3 а).

Во второй группе количество остеоцитов в костной ткани было во много раз меньше, чем в первой группе. Причем остеоциты наблюдались в участках кости, удаленных от линии перелома. В костной ткани, прилегающей непосредственно к перелому, встречались единичные клетки со слабо окрашенными ядрами. В месте повреждения отмечалось образование волокнистой ретикулярной соединительной ткани без признаков костеобразования, которая замещала костную рану (рис. 3 б).
Представленные выше данные свидетельствуют о том, что функциональное состояние периостальных клеточных остеорепаративных источников находится в зависимости от механизма травмы. При переломе, полученном в результате ударного воздействия (модель прямого механизма перелома), клетки периоста повреждаются на значительном расстоянии от линии перелома. Это обуславливает практически полное отсутствие пролиферативной активности клеток надкостницы в области перелома (см. рис. 1 б) и, как следствие, замедление или нарушение остеорепаративных процессов (см. рис. 3 б). При перекусывании берцовой кости (модель непрямого механизма травмы) повреждения периостальных клеточных источников практически не происходит. Последние сохраняют свою пролиферативную активность как в области перелома, так и на удалении от него (рис.1а), что позволяет клеткам активно участвовать в процессах заживления костной раны (рис.3б).
Наряду с тем, что в результате ударного воздействия на костную ткань в области перелома клетки надкостницы теряют свою пролиферативную возможность, клетки, находящиеся на удалении от линии перелома и способные к пролиферации, также подвергаются определенным изменениям. В отличие от клеток надкостницы животных первой группы, которые при культивировании формируют на подложке плотную монослойную структуру (см. рис. 2 а), клетки надкостницы животных второй группы теряют эту способность и образуют на подложке сетевидную, нехарактерную для нормальных клеток надкостницы, структуру (см. рис. 2 б). Почему происходят эти изменения в клетках надкостницы не известно. Вероятнее всего в результате тех или иных экстрацеллюлятных воздействий (контузионное воздействие, действие некротоксинов, нарушение микроциркуляции и др.) происходят какие-то нарушения как на клеточной мембране, так и внутри самой клетки, что в свою очередь приводит к изменению морфо-функционального состояния клеток надкостницы. Данное явление нами описано впервые и требует дальнейшего детального изучения.
Кроме того, что ударное воздействие приводит к изменениям со стороны периостальных источников остеорепарации, оно также оказывает влияние и на эндостальные источники. В результате удара в костной ткани происходит гибель клеток (рис.3б). При таком механизме травмы костная ткань в области перелома по своей структуре напоминает таковую в очагах асептического остеонекроза.
Выводы
Таким образом, данные наших исследований позволяют сделать заключение, что одной из предпосылок замедления или нарушения течения процессов остеорепарации при прямом механизме травмы заложена в самой травме. В результате прямого воздействия на костную ткань травмирующего агента клетки надкостницы претерпевают морфо-функциональные изменения, которые характеризуются потерей ими пролиферативных способностей или нарушением клеточной морфологии. Наряду с утратой клетками надкостницы способности к пролиферации в результате прямого механизма травмы происходит гибель значительного количества собственно костных клеток. Эти изменения, на наш взгляд, являются одной из ведущих причин замедления или нарушения заживления костной раны, возникшей в результате прямого механизма травмы.
- Афаунов А. И., Афаунов А. А. Внеочаговый остеосинтез анкерно-спицевым аппаратом при лечении несросшихся переломов и ложных суставов плечевой кости // Вестн, травматол. и ортопед. им. Н. Н. Пирогова. – 1999. – № 4. – С. 9-12.
- Гайдуков В. М. Ложные суставы. – СПб.: Наука, 1995. – 204 с.
- Гололобов В.Г., Дулаев А.К., Деев Р.В., Николаенко Н.С., Цупкина Н.В., Пинаев Г.Л. Оптимизация репаративного остеогенеза трансплантацией стромальных клеток костного мозга // Клеточная трансплантология. – 2004. – № 1. – С. 15-16.
- Горидова Л.Д., Романенко К.К. Несращения плечевой кости (факторы риска)//Ортопед., травматол. и протезирование. – 2000. – №3. – С. 72-76.
- Калашніков А В. Профілактика порушень репаративного остеогенезу// Вісник ортопедії, травматології та протезування. – 2002. – № 2. – С. 54-57.
- Калашніков А. В., Бруско А. Т. Діагностика та лікування розладів репаративного остеогенезу у хворих із переломами кісток // Вісник ортоп., травматол. та протезування. – 2002. - № 3. – С. 35-40.
- Корж А.А. Регенерация кости – актуальная для ортопедов и травматологов проблема. Вступительное слов // Ортопедия травматология и протезирование. – 2006. – № 1. – С. 76.
- Корж М.О., Горидова Л.Д., Романенко К.К., Дєдух Н.В. Чинники ризику, діагностика та лікування порушень репаративного остеогенезу при діафізарних переломах довгих кісток: Методичні рекомендації. – Київ, 2005. – 20 с.
- Романенко К.К. Несросшиеся диафизарные переломы длинных костей (факторы риска, диагностика, лечение)//Дис. ... канд. мед наук: 14.01.21 /ІПХС ім. проф. М.І Ситенка АМНУ. – Харків, 2002. – 226 с.
- Claes L., Willie B. The enhancement of bone regeneration by ultrasound // Prog. Biophys. Mol. Biol. – 2007. – Vol. 93, N 1-3. – P. 384-398.