Журнал «Медицина неотложных состояний» 5 (36) 2011
Вернуться к номеру
Нарушение микроциркуляции как причина полиорганной недостаточности у пострадавших с тяжелой черепно-мозговой травмой
Авторы: ТОКМАКОВА Т.О.1, КАМЕНЕВА Е.А.2, ГРИГОРЬЕВ Е.В.3 1ГОУВПО «Кемеровская государственная медицинская академия Росздрава» 2МУЗ «Городская клиническая больница № 3 им. М.А. Подгорбунского», г. Кемерово 3УРАМН НИИ комплексных проблем сердечно-сосудистых заболеваний СО РАМН, г. Кемерово
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
Цель исследования. Определение прогностической и диагностической значимости микроциркуляторных нарушений в развитии полиорганной недостаточности (ПОН) у пострадавших с тяжелой черепно-мозговой травмой (ЧМТ). Материалы и методы. Двадцать девять больных с изолированной тяжелой закрытой/открытой черепно-мозговой травмой (исходная оценка по шкале комы Глазго — 8 баллов) были включены в исследование. Больные были разделены на группы: с благоприятным исходом — 14 (48,28 %) человек и неблагоприятным исходом — 15 (51,72 %) человек. Проведена оценка тяжести состояния больных по шкале комы Глазго (Teasdale G.M., 1974) и APACHE II (Knaus W.A., 1985), тяжести повреждения головного мозга — по шкале Marshall (Marshall L.F., 1991), полиорганной недостаточности — по шкале SOFA (Vincent J.L., 1996). Микроциркуляция оценивалась методом лазерной допплеровской флоуметрии (ЛАКК-02, НПП «Лазма», г. Москва, Россия). Центральная гемодинамика исследовалась методом тетраполярной импедансной реовазографии («Диамант-М», НПО «Диамант», г. Санкт-Петербург, Россия). Расчет кислородного транспорта проводился по стандартным формулам (Marino P., 1998). Результаты исследования и обсуждение. У пациентов с благоприятным исходом показатель перфузии микроциркуляции (ПМ) увеличивался к 5-м суткам, достигая значения контрольной группы. В группе с летальным исходом интенсивность перфузии снижалась. Параллельное снижение миогенного тонуса и показателя шунтирования свидетельствует об увеличении кровотока через капиллярное русло, что наблюдается в группе с благоприятным исходом. Показатель доставки кислорода (DO2) снижался относительно нормальных значений в группе умерших. Определена сильная прямая корреляционная связь DO2 с показателем микроциркуляции (r = 0,6168; p < 0,05) и потребления кислорода (VO2) — с ПМ (r = 0,6484; p < 0,05) вне зависимости от исхода. Выявлена обратная корреляционная связь с показателем ПМ (r = –0,6255; p < 0,05 — для показателей шкалы Marshall; r = –0,6255; p < 0,05 — для показателя APACHE II в первые сутки; r = –0,5455; p < 0,05 — для показателя SOFA). Выводы. В первые сутки у всех больных с тяжелой ЧМТ вне зависимости от исхода отмечается снижение показателей тканевой перфузии. Неблагоприятный прогноз у исследуемых больных коррелировал со снижением показателя перфузионного коэффициента. Полученная корреляционная связь между показателями микроциркуляции и данными шкалы SOFA определяет прогностическую и диагностическую значимость исследованных нарушений в разви- тии ПОН.
Несмотря на прогресс, достигнутый в интенсивной терапии критических состояний, обусловленных тяжелыми травмами, летальность среди подобной категории пострадавших остается достаточно высокой [1]. Основной причиной летальных исходов является развитие полиорганной недостаточности (ПОН) вследствие нарушения тканевой перфузии и оксигенации [2]. Ведущим механизмом развития ПОН многие исследователи считают нарушения микроциркуляции [3, 4]. В литературных источниках сведения об исследовании микроциркуляции у критических больных единичные, что объясняется неясностью методических подходов к исследованию расстройств микроциркуляции [5]. Одной из методик, позволяющих оценить тканевую локальную перфузию и функциональное состояние регуляторных систем микроциркуляторного русла, является лазерная допплеровская флоуметрия (ЛДФ) [6, 7]. Методика основана на зондировании тканей лазерным излучением и выделении при обработке в отраженном сигнале (ЛДФ-сигнал) допплеровского сдвига частоты, что позволяет оценить общую перфузию, а также выделить различные компоненты регуляции тонуса микрососудов. Авторы отмечают возможность активного ведения больных с подобного вида мониторингом с использованием «рекрутмента» микроциркуляции как основы восстановления перфузии и предотвращения ПОН [8]. Анализ микроциркуляции у критических больных, возможность оценки взаимосвязи микроциркуляторных нарушений, транспорта кислорода в качестве факторов формирования ПОН у пострадавших с тяжелой черепно-мозговой травмой (ЧМТ) остается малоизученной проблемой, что в конечном итоге и послужило основой для проведения нашего исследования.
Цель исследования — определить прогностическую и диагностическую значимость микроциркуляторных нарушений в развитии полиорганной недостаточности у пострадавших с тяжелой ЧМТ.
Материалы и методы
Исследование одобрено этическими комитетами КемГМА и ГКБ № 3. Проспективно включены в исследование 29 больных с изолированной тяжелой закрытой/открытой (ушибы головного мозга + оболочечные гематомы) черепно-мозговой травмой (исходная оценка по шкале комы Глазго (ШКГ) — 8 баллов). Средний возраст больных составил 43,3 ± 2,9 года; мужчины — 24 (82,76 %), женщины — 5 (17,24 %). Больные были разделены на группы: с благоприятным исходом — 14 (48,28 %) человек и неблагоприятным исходом — 15 (51,72 %) человек.
Критерии включения: пострадавшие с изолированной тяжелой ЧМТ в возрасте от 18 до 60 лет; исходная оценка по ШКГ — 8 баллов; без сопутствующей соматической патологии, известной на момент исследования.
Критерии исключения: пострадавшие с изолированной тяжелой ЧМТ в возрасте менее 18 и более 60 лет; оценка по ШКГ — менее 8 баллов; пострадавшие с сочетанной ЧМТ.
Всем пострадавшим проводилась стандартная терапия (инфузионная терапия в процессе первичной стабилизации состояния больного, энтеральное питание стандартными сбалансированными изокалорическими смесями, искусственная вентиляция легких в режиме контроля давления). Всем пострадавшим проводилась декомпрессивная костнопластическая/резекционная (варианты) трепанация черепа, удаление гематом по нейрохирургическим показаниям. Исходно и в динамике после операции проводилась компьютерная томография.
Помимо общеклинических исследований (биохимический анализ крови, клинический анализ крови) проводилась объективная оценка тяжести состояния больных по ШКГ (Teasdale G.M., 1974), APACHE II (Knaus W.A., 1985). Тяжесть повреждения головного мозга оценивалась по шкале Marshall (Marshall L.F., 1991), полиорганная недостаточность оценивалась по шкале SOFA (Vincent J.L., 1996). Микроциркуляция и центральная гемодинамика, кислородный статус оценивались спустя сутки с момента поступления пострадавших в стационар, далее ежесуточно в течение семи дней. Контрольная группа (для показателей микроциркуляции) представлена 22 здоровыми добровольцами (средний возраст — 23,14 ± 1,50 года).
Микроциркуляция оценивалась методом лазерной допплеровской флоуметрии с использованием флоуметра ЛАКК-02 (НПП «Лазма», г. Москва, Россия). Микроциркуляция оценивалась на коже тыльной поверхности предплечья на 4 см выше шиловидного отростка лучевой и локтевой костей. С помощью лазерного излучения зондировали ткани в ближней инфракрасной области спектра (длина волны 830 нм) в объеме 1 мм3 [13]. ЛДФ позволяет неинвазивно измерять величину перфузии ткани кровью, то есть определять величину потока эритроцитов в зондируемом лазерном излучением объеме ткани. Запись сигнала проводилась в течение 3 минут, три измерения с вычислением средних величин. При анализе микроциркуляторного кровотока оценивали средние значения изменения перфузии: показатель микроциркуляции (ПМ), среднеквадратическое отклонение (СКО), коэффициент вариации (Кв) ЛДФ-сигнала. Амплитудно-частотный анализ использовали для оценки вклада пассивных компонентов в регуляцию тканевого кровотока. Использовали вейвлет-анализ, позволяющий выделять различные компоненты регуляции тонуса микрососудов. Центральная гемодинамика исследовалась методом тетраполярной импедансной реовазографии аппаратом «Диамант-М» (НПО «Диамант», г. Санкт-Петербург, Россия). Расчет кислородного транспорта проводился по стандартным формулам с расчетом показателей доставки кислорода (DO2), потребления кислорода (VO2), экстракции кислорода (ErО2) (Marino P., 1998). Данные представлены в виде средней арифметической (M) ± ошибка средней (m). Использовали точный критерий Фишера для оценки достоверности различий. Для определения вида распределения переменных применяли критерий Колмогорова — Смирнова. Оценка связи проводилась с использованием корреляционного анализа с расчетом коэффициента корреляции Спирмена.
Результаты исследования и обсуждение
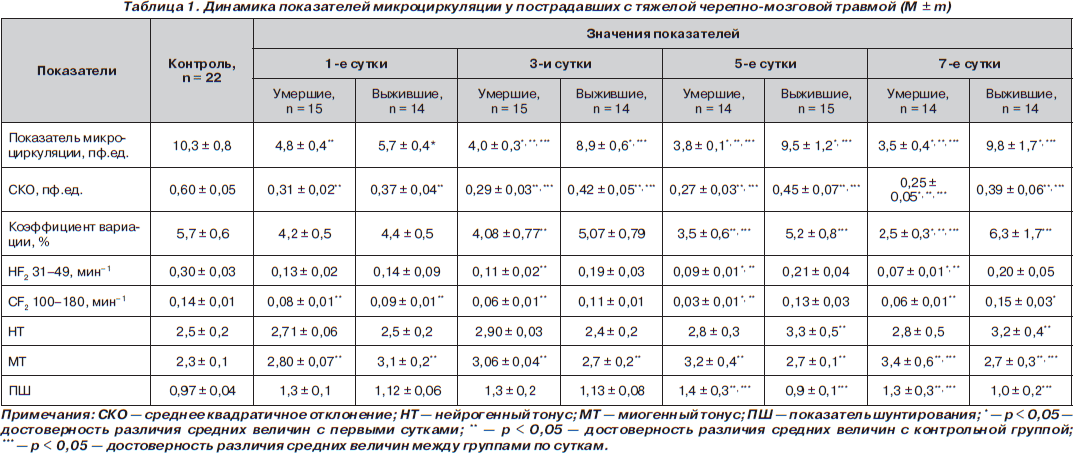
Анализ полученных результатов показал, что у всех больных вне зависимости от прогнозируемого исхода, по данным ЛДФ, в конце первых суток отмечается снижение показателей тканевой перфузии ниже контрольных значений. У пациентов с благоприятным исходом показатель перфузии микроциркуляции увеличивался к 5-м суткам, достигая значения контрольной группы. В группе с летальным исходом интенсивность перфузии снижалась, несмотря на проводимую интенсивную терапию. Снижение среднеквадратичного отклонения в группе с неблагоприятным исходом указывало на ухудшение миогенной, нейрогенной и дыхательной модуляций тканевого кровотока, ряд авторов связывают данный процесс с центральной дисрегуляцией вследствие тяжелого повреждения головного мозга. Уменьшение коэффициента вариации свидетельствует о снижении вазомоторного компонента в регуляции тканевого кровотока. У всех пациентов в первые сутки регистрировались более низкие (р < 0,05) амплитуды колебаний во всех частотных спектрах по сравнению с контрольной группой. Снижение в дальнейшем амплитуд колебаний в группе с летальным исходом свидетельствует о снижении пассивной регуляции тканевого кровотока. Увеличение коэффициента вариации связано с ростом нейрогенного компонента сосудистого тонуса. Параллельное снижение миогенного тонуса (МТ) и показателя шунтирования (ПШ) свидетельствует об увеличении кровотока через капиллярное русло, что наблюдается в группе с благоприятным исходом (табл. 1).
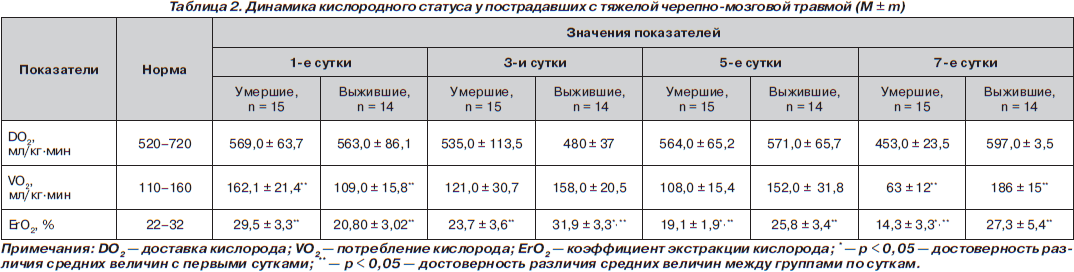
Уровень доставки кислорода в обеих группах достоверно не отличался при межгрупповом сравнении (табл. 2).
Наблюдалось снижение показателя DO2 от нормальных значений в группе умерших, тогда как в группе с благоприятным исходом показатели транспорта кислорода сохранялись на уровне, сравнимом с нормальным. Аналогичная динамика снижения потребления кислорода наблюдалась в группе больных с неблагоприятным исходом, начиная с пятых суток.
Для оценки взаимосвязи между показателями микроциркуляторного анализа, транспорта кислорода и тяжестью полиорганной недостаточности проведен корреляционный анализ. Определена сильная прямая корреляционная связь DO2 с показателем микроциркуляции (r = 0,6168; p < 0,05) и VO2 — с ПМ (r = 0,6484; p < 0,05) вне зависимости от исхода. При оценке пострадавших по шкалам Marshall, APACHE II, SOFA выявлена обратная корреляционная связь с показателем перфузии микроциркуляции (r = –0,6255; p < 0,05 — для показателей шкалы Marshall; r = –0,6255; p < 0,05 — для показателя APACHE II в первые сутки; r = –0,5455; p < 0,05 — для показателя SOFA). Аналогичные коэффициенты корреляции получены по всем суткам наблюдения при анализе микроциркуляции и показателей шкалы SOFA.
Согласно данным Shoemacker et al., снижение показателей доставки, потребления и экстракции кислорода ниже критических значений нормальных показателей ассоциируется с неблагоприятным исходом. Однако четких объяснений связи между снижением экстракции кислорода и неблагоприятным исходом авторы не дают. Логичным является объяснить данную взаимосвязь развитием гипоперфузионной полиорганной недостаточности, однако уровень доставки кислорода сохраняется нормальным (и даже в ряде ситуаций переходит в режим гипердинамии), снижаясь только на поздних стадиях после травмы. De Backer объясняет данный феномен не столько развитием гипоперфузионной ПОН, сколько вероятным повреждением микроциркуляции вследствие влияния свободных радикалов, эндотелиального повреждения вследствие ишемии/реперфузии, мобилизации полиморфноядерных нейтрофилов с развитием периваскулярного отека и синдрома повышенной капиллярной проницаемости с тканевой дизоксией [9–12].
Выводы
1. В первые сутки у всех больных с тяжелой ЧМТ вне зависимости от исхода отмечается снижение показателей тканевой перфузии. Неблагоприятный прогноз у исследуемых больных коррелировал со снижением показателя перфузионного коэффициента. Снижение амплитуд колебаний микроциркуляторного кровотока во всех частотных спектрах отмечается в группе с неблагоприятным исходом, что является свидетельством дисрегуляции микроциркуляции.
2. Полученная корреляционная связь между показателями микроциркуляции ПШ и данными шкалы SOFA определяет прогностическую и диагностическую значимость исследованных нарушений в развитии ПОН.
1. Мороз В.В., Чурляев Ю.А. Вторичные повреждения головного мозга при тяжелой черепно-мозговой травме. — М., 2006. — С. 403.
2. Inсе С. The microcirculation is the motor of sepsis // Critical Care. — 2005. — 9 (S4). — 19.
3. Vinсеnt J.-L. Microvascular dysfunction as а cause of organ dysfunction in severe sepsis // Critical Care. — 2005. — 9(4). — 6-12.
4. Landsverk S., Kvandal P., Kjelstrup T. et al. Human skin microcirculation after brachial plexus block evaluated by Wavelet transform of the laser Doppler flowmetry signal // Anesthesiology. — 2006. — 105. — 478-484.
5. De Backer D., Creteur J., Preiser J.C., Dubois M.J., Vincent J.L. Microvascular blood flow is altered in patients with sepsis // Am. J. Respir. Crit. Care Med. — 2002. — 166. — 98-104.
6. Чурляев Ю.А., Вереин М.Ю., Данцигер Д.Г., Кан С.Л., Мартыненков В.Я., Григорьев Е.В. Нарушения микроциркуляции, внутричерепного давления и церебрального перфузионного давления при тяжелой черепно-мозговой травме // Общая реаниматология. — 2008. — 5. — 5-9.
7. Лазерная допплеровская флоуметрия микроциркуляции крови: Руководство для врачей / Под ред. А.И. Крупаткина, В.В. Сидорова. — М., 2005.
8. Sakr Y., Dubois M.J., De Backer D., Creteur J., Vincent J.L. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock // Crit. Care Med. — 2004. — 32. — 1825-1831.
9. Wolin M.S. Reactive oxygen species and the control of vascular function // Am. J. Physiol. Heart Circ. Physiol. — 2009. — 296. — 539-549.
10. Levraut J., Iwase H., Shao Z.H., Vanden Hoek T.L., Schumacker P.T. Cell death during ischemia: relationship to mitochondrial depolarization and ROS generation // Am. J. Physiol. Heart Circ. Physiol. — 2003. — 284. — 549-558.
11. Klijn E., Den Uil C.A., Bakker J., Ince C. The heterogeneity of the microcirculation in critical illness // Clin. Chest Med. — 2008. — 29. — 643-654
12. Bateman R.M., Walley K.R. Microvascular resuscitation as a therapeutic goal in severe sepsis // Crit. Care. — 2005. — 9 (Suppl 4). — S27-S32.