Журнал «Травма» Том 12, №2, 2011
Вернуться к номеру
Оценка обезболивающей активности декскетопрофена трометамола и его способности снижать потребность в морфине по сравнению с кетопрофеном и плацебо
Авторы: Hanna M.H.1, Elliott K.M.1, Stuart-Taylor M.E.2, Roberts D.R.3, Buggy D.4, Arthurs G.J.5, 1King’s College Hospital, Pain Research Unit, London, 2Southampton General Hospital, Anaesthetic Department, Southampton, 3Freeman Hospital, Anaesthetic Department, Newcastle, 4Leicester General Hospital, Anaesthetic Department, Leicester, 5Wrexham Malor Hospital, Anaesthetic Department, Wrexham, UK
Рубрики: Травматология и ортопедия
Версия для печати
Цель. Считается, что применение мультимодальной анальгезии позволяет добиться сбалансированного и эффективного контроля над послеоперационной болью. Назначение комбинированной терапии нестероидными противовоспалительными средствами (НПВС) и опиатами приводит к активации разных по своей сути механизмов, что потенциально может проявиться развитием синергистической анальгезии. В настоящее время доступно очень малое количество парентерально вводимых НПВС, пригодных к назначению в раннем послеоперационном периоде. Учитывая это, цель настоящего исследования сводилась к тому, чтобы оценить обезболивающую эффективность, относительную силу и безопасность парентерально вводимого декскетопрофена трометамола после крупных ортопедических операций.
Методы. В рамках настоящего двойного слепого исследования 172 пациента, отобранных для ортопедической операции (замена тазобедренного или коленного сустава), были рандомизированы к получению двух внутримышечных инъекций (с интервалом 12 ч) декскетопрофена 50 мг, кетопрофена 100 мг или плацебо. В послеоперационном периоде, как только боль была купирована, пациентов подключали к системе РСА (система обезболивания, управляемая пациентами), обеспечивавшей поступление морфина в течение 24 ч (однократная доза 1 мг; время между последовательными введениями составляло не менее 5 мин).
Результаты. Среднее кумулятивное количество морфина, введенное пациентам в течение всего времени исследования, составило 39 мг в группе с декскетопрофеном, 45 мг в группе с кетопрофеном и 64 мг в плацебо-группе. Снижение потребления морфина в группах с активной терапией составило примерно 1/3 по сравнению с плацебо-группой (скорректированная разница средних между группой с декскетопрофеном и плацебо-группой составила –25 мг, между группой с кетопрофеном и плацебо-группой –23 мг (эти различия были статистически достоверными: p ≤ 0,0003; 95% доверительный интервал от –35 до –14). Интенсивность боли была ниже в обеих группах с активной терапией по сравнению с плацебо-группой, причем наиболее низкой она была в группе с декскетопрофеном. В отношении седации статистически достоверные различия между группами с активной терапией и плацебо-группой наблюдались только на 2-м и 13-м часу исследования. В ходе исследования была также оценена выраженность кровотечения из раневого дренажа: статистически достоверных различий между всеми группами обнаружено не было.
Выводы. Внутримышечное введение декскетопрофена трометамола в дозе 50 мг приводило к развитию хорошего обезболивающего эффекта и снижению потребности в опиоидах после крупных ортопедических операций.
Анальгезия; декскетопрофен; морфин; нестероидные противовоспалительные средства; обезболивание, управляемое пациентом; послеоперационная боль.
Введение
В настоящее время боль рассматривают как результат сложного взаимодействия между возбудительными и ингибиторными системами на разных уровнях центральной нервной системы (ЦНС), которые конвергируют в спинном мозге [1]. Понимание этого привело к представлению о том, что при фармакологическом воздействии вместо одной на несколько точек приложения можно добиться усиления анальгезии, уменьшения побочных эффектов (ПЭ) и улучшения наблюдаемых исходов. В настоящее время общепризнано, что при большинстве хирургических операций наиболее адекватное обезболивание достигается с помощью мультимодальной, или комбинированной, анальгезии [2].
Опиоиды рассматривают в качестве основных средств для лечения умеренной и тяжелой послеоперационной боли [3]. Их использование вместе с нестероидными противовоспалительными средствами (НПВС) приводит к активации разных по своей сути механизмов, что проявляется развитием аддитивной или синергистической анальгезии [4]. В ряде клинических исследований с крупными оперативными вмешательствами было показано, что подобный эффект может способствовать уменьшению дозы вводимого опиоида и улучшению качества послеоперационной анальгезии [5, 6]. Кроме того, отмечается более быстрое восстановление двигательной активности пациентов и более ранняя выписка их из стационара [6]. Декскетопрофена трометамол является новым НПВС, которое принадлежит к производным арилпропионовой кислоты. Он представляет собой водорастворимую соль S(+)-энантиомера рацемического соединения кетопрофен [7]. В доклинических исследованиях было четко показано, что противовоспалительные и обезболивающие свойства кетопрофена связаны исключительно с его S(+)-энантиомером (декскетопрофен), в то время как R(–)-энантиомер лишен подобной активности [7]. При моделировании воспаления и анальгезии у животных было показано, что декскетопрофен не менее чем в 2 раза эффективнее по сравнению с его родительским соединением кетопрофеном [8]. У людей обезболивающая эффективность пероральной формы декскетопрофена трометамола была продемонстрирована для таких болевых состояний, как зубная боль и дисменорея [9, 10]. В настоящее время на фармацевтическом рынке доступно мало НПВС для парентерального введения, хотя именно в этой форме они более предпочтительны для назначения в раннем послеоперационном периоде [11].
Цель настоящего исследования сводилась к тому, чтобы сравнить обезболивающую эффективность и безопасность декскетопрофена трометамола для внутримышечного введения в дозе 50 мг с кетопрофеном для внутримышечного введения в дозе 100 мг и плацебо при их применении после крупных ортопедических операций (замена тазобедренного/коленного сустава).
Методы
Дизайн исследования и лекарственные средства
Настоящее исследование было выполнено как многоцентровое двойное слепое рандомизированное с тремя параллельными группами. Пациенты были случайным образом распределены для получения двух внутримышечных инъекций декскетопрофена трометамола в дозе 50 мг, кетопрофена в дозе 100 мг или плацебо. Первая инъекция вводилась в конце операции (время наложения первого закрывающего шва), вторая — через 12 ч. Все тестируемые препараты вводились в виде растворов объемом 2 мл. В качестве активного препарата сравнения служил кетопрофен (коммерческое название: оруваил®; производитель: Rhone-Poulenc Rorer, Великобритания). Для того чтобы дизайн исследования был двойным слепым, тестируемые препараты готовились и вводились лицами, не принимавшими участия в оценке пациентов.
Оперативное вмешательство выполняли в условиях стандартизированной общей анестезии. Общие анестетики и другие лекарственные вещества, используемые во время операции, должны были быть короткодействующими и, по возможности, ограничены одним или несколькими из следующих средств: пропофол, фентанил, альфентанил, атракурий, векуроний, рокуроний, кислород (33–35 %) с закисью азота, изофлюран. Местная анестезия не выполнялась.
После выхода из наркоза в случае необходимости пациентам вводили титровочные дозы морфина (в/в 2–5 мг) до ослабления боли и одновременно подключали пациентов к системе РСА (система обезболивания, управляемая пациентом), позволяющей вводить морфин в/в.
При необходимости разрешалось вводить противорвотные средства. По-возможности они должны были быть ограничены циклизином, ондансетроном и дроперидолом.
Вследствие возможного влияния на терапевтическую эффективность тестируемых препаратов во время исследования было запрещено применение следующих лекарственных средств (т.е. применение или необходимость в любом из следующих лекарственных средств автоматически приводили к исключению пациента из исследования):
— других анальгетиков или противовоспалительных средств, за исключением морфина, вводимого в виде нагрузочной дозы или с помощью РСА;
— анестетиков, за исключением тех, которые применялись для премедикации или самой анестезии;
— более чем 300 мг кислоты ацетилсалициловой в течение 24 ч;
— солей лития;
— системных глюкокортикоидов;
— метотрексата;
— ингибиторов моноаминоксидазы (МАО);
— седативных средств, за исключением короткодействующих;
— противоэпилептических средств;
— циклоспорина.
Общее количество крови в раневом дренаже измерялось в установленные точки времени. Доза морфина, вводимая за один раз с помощью РСА, составляла 1 мг, причем следующее введение морфина могло быть выполнено не ранее чем через 5 мин. В ходе исследования разрешалось использовать сопутствующие препараты, используемые в рутинной клинической практике (например, антибиотики).
Оценка эффективности
Первичной конечной точкой исследования служило общее кумулятивное количество морфина (ККМ), введенного в виде нагрузочной дозы и с помощью РСА в течение всего времени исследования (т.е. в течение 24 ч после получения первой дозы тестируемого препарата). Количество морфина, введенного с помощью РСА, регистрировалось автоматически.
Вторичными конечными точками исследования были: количество морфина, введенного в виде нагрузочной дозы (ККМ 1) и с помощью РСА в течение двух 12-ч интервалов: с t = 1 ч по t = 12 ч (ККМ 2) и с t = 12 ч по t = 24 ч (ККМ 3); время, прошедшее с момента получения первой дозы тестируемого препарата до нагрузочной (титровочной) дозы; время, прошедшее до первого применения РСА. Кроме того, в качестве вторичных конечных точек оценивали интенсивность боли и качество сна.
Интенсивность боли измеряли с помощью 10-см визуальной аналоговой шкалы (ВАШ), на левом конце которой было отмечено «полное отсутствие боли», на правом — «непереносимая боль», а также с помощью вербальной шкалы со значениями от 0 до 3 (0 = нет боли, 1 = легкая боль, 2 = умеренная боль, 3 = тяжелая боль). Измерения выполняли в различные точки времени: непосредственно перед введением нагрузочной дозы морфина, непосредственно перед введением второй дозы тестируемого препарата и спустя заранее предопределенные интервалы времени (2, 4, 6 и 9 ч после получения первой дозы тестируемого препарата, а также 1, 9 и 12 ч после получения второй дозы).
Качество сна оценивали с помощью 5-пунктовой порядковой шкалы («великолепный», «хороший», «минимальный дискомфорт», «значительный дискомфорт» и «спалось совсем плохо») спустя 12 ч после получения второй дозы тестируемого препарата, т.е. после ночного отдыха, следующего за днем операции.
Оценка безопасности и переносимости
Безопасность и переносимость оценивали с помощью следующих показателей: 1) сообщения о развитии побочных эффектов (регистрируемые врачом или спонтанно сообщаемые пациентами), 2) значение по шкале седации (0 = абсолютное бодрствование, 1 = легкая седация, 2 = тяжелая седация, 3 = сон), измеренное в те же самые точки времени, что и значение по ВАШ, 3) боль и/или дискомфорт в месте инъекции, 4) величина потери крови из раневого дренажа и 5) лабораторные показатели (стандартные гематологические и биохимические показатели в исходных условиях и после проведения терапии).
Статистическая обработка
Исходя из результатов предыдущих исследований [12–14] было сделано предположение, что средний расход морфина в группах с активной терапией составит 40 мг, а в плацебо-группе 60 мг (станд. откл. ± 30 мг). Было рассчитано, что для выявления клинически значимого 30% различия в расходе морфина между группами с активной терапией и плацебо-группой при уровне значимости 5 % и мощности 80 % в каждую группу должно было быть включено по 45 пациентов.
Оценку безопасности проводили у всех рандомизированных пациентов, которые получили по крайней мере одну дозу тестируемого препарата.
Оценку эффективности выполняли у всех пациентов, которые получили по крайней мере одну дозу тестируемого препарата и у которых имелись валидные данные о расходе морфина по крайней мере спустя 1 ч после операции.
Различия между группами по первичной конечной точке исследования оценивали с помощью дисперсионного анализа (ANOVA). Различия по вторичным конечным точкам, в зависимости от ситуации, оценивали с помощью дисперсионного анализа (ANOVA или его непараметрический вариант — критерий Краскела — Уоллиса), критерия хи-квадрат или критерия Мак-Немара.
Поскольку в ходе нашего исследования сравнивались несколько возможных видов лечения, глобальный уровень значимости должен был быть ограничен 5 % путем применения адекватного подхода к множественным сравнениям. Учитывая это, на первом шаге группы с активной терапией сравнивали с плацебо-группой. Полученные р-значения корректировали с помощью поправки Бонферрони — Хохберга. Только в том случае, если на этом этапе обнаруживались достоверные различия, выполняли второй шаг — группы с активной терапией сравнивали с помощью раздельных t-критериев Стьюдента, а полученные р-значения снова корректировали с помощью поправки Бонферрони — Хохберга. Такой пошаговый подход с внесением поправок уменьшал вероятность ложного отклонения хотя бы одной гипотезы до 5 %.
При тестировании статистических гипотез ошибка первого рода (a) была установлена на уровне 0,05; рассчитывались 95% доверительные интервалы.
Пациенты
В настоящее исследование, охватившее 15 клинических центров Великобритании, было включено 172 пациента (мужчины и женщины) в возрасте 18–75 лет с I и II классом физического статуса по классификации Американского общества анестезиологов (ASA). Всем пациентам выполняли плановую операцию по замене тазобедренного или коленного сустава в условиях общей анестезии.
Критерии включения и исключения
Критерии включения:
1. Пациенты мужского и женского пола в возрасте 18–75 лет.
2. Выполнение операции по замене тазобедренного или коленного сустава в условиях общей анестезии.
3. Наличие I и II класса физического статуса по классификации Американского общества анестезиологов (ASA) [24].
4. Наличие письменного информированного согласия пациентов на участие в исследовании.
Критерии исключения:
1. Невозможность пребывания в больнице в течение всего времени исследования.
2. Случаи, когда морфин не был препаратом выбора при проведении РСА (обезболивание, управляемое пациентом).
3. Наличие противопоказаний к назначению кетопрофена или других нестероидных противовоспалительных средств.
4. Письменное информированное согласие пациентов на получение стероидных противовоспалительных средств.
5. Возникновение системной инфекции или инфекции в месте операции до того, как она была выполнена.
6. Возникновение осложнений во время или после операций.
7. Если пациенты во время исследования получали плановую сопутствующую терапию какими-либо из следующих препаратов: солями лития, кислотой ацетилсалициловой в дозе более 300 мг/день, другими нестероидными противовоспалительными средствами, системными глюкокортикоидами, метотрексатом, циклоспорином, седативными средствами (за исключением короткодействующих средств для премедикации), ингибиторами моноаминоксидазы, противоэпилептическими средствами.
8. Аллергия на кетопрофен или другие нестероидные противовоспалительные средства.
9. Наличие в анамнезе язвенной болезни, желудочно-кишечного кровотечения или тяжелой гастропатии.
10. Наличие умеренных или тяжелых почечных, печеночных или респираторных нарушений (по мнению врача).
11. Наличие в ближайшем анамнезе астмы, бронхоспазма, ангиоэдемы или нарушений свертывания крови.
12. Наличие неконтролируемых сахарного диабета, сердечной недостаточности или артериальной гипертензии.
13. Случаи злоупотребления препаратами или алкоголизм.
14. Наличие эпилепсии, психоза или других психических расстройств.
15. Участие в настоящее время или в течение предыдущих 3 месяцев в других клинических исследованиях нелицензированных препаратов.
16. Беременность, включая эктопическую, и период лактации.
17. Неадекватная контрацепция у женщин.
Пациентам была предоставлена письменная и устная информация о сути проводимого исследования. Все пациенты до включения в исследование дали информированное согласие на участие в нем. Исследование было одобрено комиссиями по биоэтике в каждом из участвующих центров и было выполнено в соответствии с правилами Надлежащей клинической практики (CPMP/ICH/135/95) [15].
Результаты
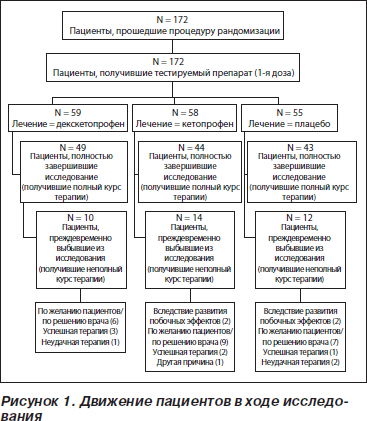
В общей сложности 172 пациента прошло процедуру рандомизации и получило первую дозу тестируемых препаратов. В анализ эффективности было включено 168 пациентов (58 в группе с декскетопрофеном, 56 в группе с кетопрофеном и 54 в плацебо-группе). Четыре пациента не были включены в анализ, поскольку у них не был получен требуемый минимум валидных данных о расходе морфина.
У 36 пациентов было отмечено нарушение комплайенса к лечению, и они выбыли из исследования до его завершения. Среди причин были: собственное желание пациентов или решение врача о тяжелом состоянии пациентов (n = 22), побочные эффекты (n = 4), неудачная терапия (n = 3), успешная терапия (n = 6) или другая причина (n = 1). Лечение расценивали как «успешная терапия» в том случае, если пациент отказывался принимать вторую дозу тестируемого препарата вследствие отсутствия боли к 12-му часу после операции. (Было неэтично выполнять вторую инъекцию пациентам, у которых к 12-му часу после операции боль отсутствовала.)
Для целей статистического анализа кумулятивную дозу морфина, зарегистрированную на момент выбывания пациентов из исследования, переносили вперед, чтобы восполнить отсутствие кумулятивного количества морфина, израсходованного к t = 24 ч.
Движение пациентов в ходе исследования представлено на рис. 1. Демографическая характеристика пациентов представлена в табл. 1. По этим показателям достоверные различия между тремя выделенными группами отсутствовали. Также не было обнаружено достоверных различий по препаратам, использованным для премедикации или в качестве сопутствующей терапии в ходе исследования, включая антикоагулянты.
Эффективность
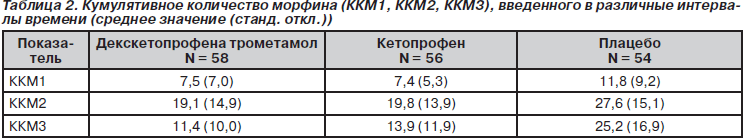
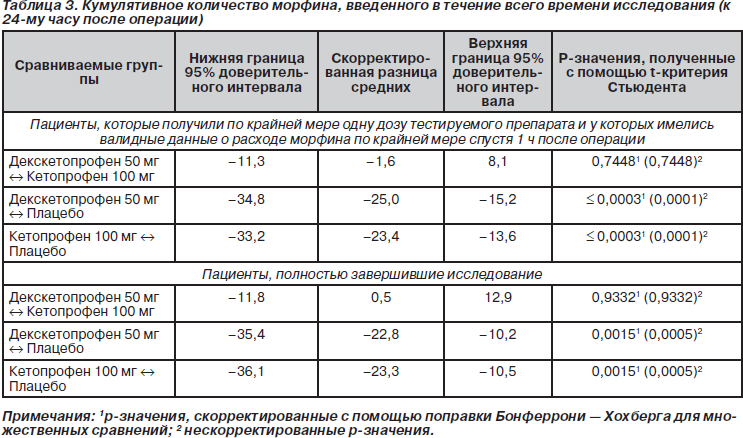
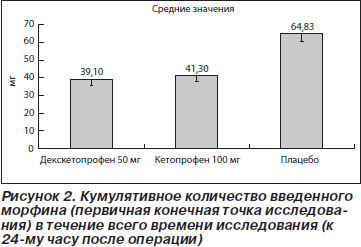
Результаты, полученные для первичной конечной точки исследования, представлены на рис. 2. Среднее ККМ, введенное в течение всего периода исследования, составило 39,1 мг в группе с декскетопрофеном, 41,3 мг в группе с кетопрофеном и 64,8 мг в плацебо-группе. Полученные данные свидетельствуют о том, что потребность в морфине была снижена примерно на 1/3 в группах с декскетопрофеном и кетопрофеном по сравнению с плацебо-группой. Причем различия были достоверны в обоих случаях. Кроме того, из данных табл. 2 и 3 следует, что снижение потребления морфина приблизительно на 1/3 в обеих группах с активной терапией по сравнению с плацебо-группой наблюдалось во все изученные интервалы времени.
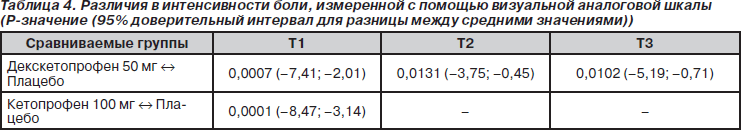
Среднее время до введения нагрузочной дозы морфина после первого введения тестируемого препарата составило 36 и 38 мин в группах с декскетопрофеном и кетопрофеном соответственно по сравнению с 29 мин в плацебо-группе. Различия были статистически достоверны только между группой с кетопрофеном и плацебо-группой (p < 0,05; 95% ДИ 4,40–15,25). Среднее время между введением нагрузочной дозы и первым применением РСА составило 44 мин в плацебо-группе по сравнению с 78 мин в группе с декскетопрофеном и 96 мин в группе с кетопрофеном; статистически достоверные различия между группами отсутствовали. Динамика интенсивности боли после выхода из наркоза, измеренная с помощью ВАШ и вербальной шкалы, представлена на рис. 3 (ВАШ) и рис. 4 (вербальная шкала). Три кривых изменения средней интенсивности боли с течением времени имели практически параллельный вид. При этом во все оцениваемые точки времени средняя интенсивность боли в плацебо-группе была больше, чем в двух группах с активной терапией. До введения нагрузочной дозы морфина среднее значение ВАШ в группах с активной терапией составляло примерно 6 см. К отметке времени t = 4 ч оно снижалось приблизительно до 3 см и оставалось на этом уровне или было ниже в течение всего времени исследования. В плацебо-группе средняя интенсивность боли была в основном выше по сравнению с двумя группами активной терапии в течение всего времени исследования (24 ч). Для целей статистического анализа были подсчитаны суммарные значения интенсивности боли для трех интервалов времени: T1 (t = 1 ч — t = 6 ч), T2 (t = 9 ч — t = 12 ч), T3 (t = 13 ч — t = 24 ч),
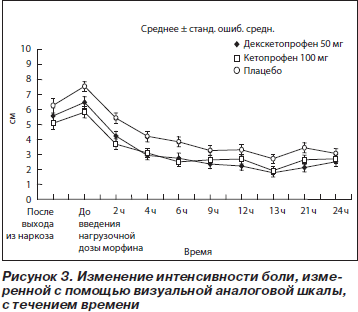
Статистически достоверные различия между группой с декскетопрофеном и плацебо-группой были обнаружены во всех трех выделенных интервалах времени, в то время как между группой с кетопрофеном и плацебо — только для первого интервала (табл. 4).
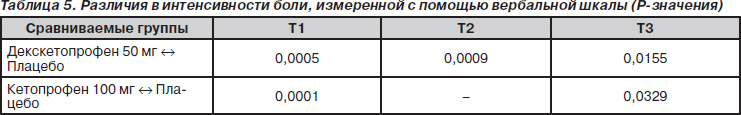
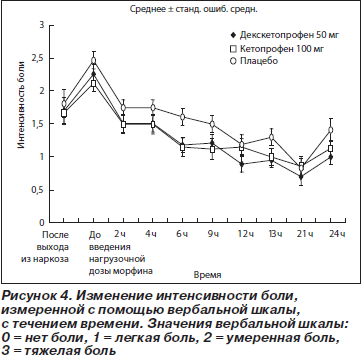
Изменение средней интенсивности боли, оцененной с помощью вербальной шкалы (рис. 4 и табл. 5), было аналогичным тому, которое наблюдалось при оценке с помощью ВАШ.
Среди 147 пациентов, у которых оценивали качество сна, совсем плохой сон наблюдался у 21 из 47 (44,7 %) пациентов в плацебо-группе по сравнению с 9 из 51 (17,8 %) пациента в группе с декскетопрофеном и 8 из 49 пациентов (16,3 %) в группе с кетопрофеном. Сравнительный анализ показал, что качество сна было достоверно лучше в обеих группах с активной терапией по сравнению с плацебо-группой (р = 0,0001 и р = 0,0002 соответственно).
Безопасность и переносимость
В общей сложности было зарегистрировано 338 побочных эффектов у 139 (81 %) из 172 пациентов, получавших лечение. Приблизительно 1/3 ПЭ расценили как связанные с проводимым лечением; при этом никаких различий не было обнаружено между тестируемыми препаратами и морфином при оценке достоверности причинно-следственных связей. Между группами не было обнаружено достоверных различий по общей частоте ПЭ и частоте ПЭ, связанных с проводимым лечением. Наиболее часто наблюдались нарушения со стороны желудочно-кишечного тракта, что проявлялось послеоперационной тошнотой и рвотой (ПОТР). Это проявление было наиболее частым побочным эффектом и встречалось в 48 (32 %) случаях ПЭ, связанных с проводимым лечением. Частота ПОТР в обеих группах с активной терапией была ниже, чем в плацебо-группе, косвенно отражая опиоидсберегающий эффект комбинированной анальгезии (частота ПОТР: 21 % в группе с декскетопрофеном, 34 % в группе с кетопрофеном и 47 % в плацебо-группе).
В ходе исследования была отмечена очень низкая частота желудочно-кишечных кровотечений (n = 3; два пациента в группе с декскетопрофеном, один пациент в группе с кетопрофеном). Не были отмечены случаи нарушения функции почек или острой почечной недостаточности. Реакции в месте инъекции (боль в покое или при движениях, эритема и отек) наблюдались относительно часто (до 16 %), однако достоверные различия между группами отсутствовали. В общей сложности было зарегистрировано четыре серьезных ПЭ, один в группе с кетопрофеном и три в плацебо-группе. Единственный серьезный ПЭ, отмеченный в группе с кетопрофеном (послеоперационное кровотечение), был расценен как вероятно связанный с приемом тестируемого препарата.
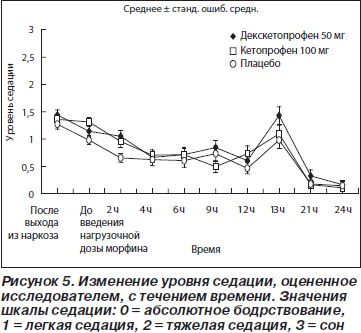
Среднее значение по шкале седации (максимальное значение: 3 = сон) находилось в пределах 0–1,5 балла во все точки времени в ходе исследования. По этому показателю были обнаружены достоверные различия между обеими группами с активной терапией и плацебо-группой на 2-й и 13-й час исследования: декскетопрофен и кетопрофен приводили к более выраженной седации по сравнению с плацебо в эти две точки времени (рис. 5). Между группами не было обнаружено достоверных различий по частоте реакций в месте инъекции (боль в покое или при движении, эритема или отек), когда данный параметр был введен в виде специфической и независимой переменной.
Средняя величина кровотечения из раневого дренажа в выделенных нами группах варьировала от 388 до 523 мл после приема первой дозы тестируемых препаратов и от 535 до 586 мл после приема второй дозы. Достоверных различий между группами по этому показателю получено не было.
Обсуждение
Было показано, что НПВС обеспечивают эффективную анальгезию в послеоперационном периоде после ортопедических вмешательств [13, 16]. Механизм действия объясняют угнетением синтеза простагландинов [17]. В ряде новых исследований было предложено связать раннюю обезболивающую активность с центральным механизмом действия этих средств [18–20]. Цель настоящего исследования сводилась к тому, чтобы оценить обезболивающую активность, влияние на расход морфина и безопасность декскетопрофена трометамола 50 мг, вводимого в виде двух внутримышечных инъекций с интервалом 12 ч после ортопедических операций, по сравнению со стандартным парентеральным НПВС кетопрофеном и плацебо. Основным показателем, отражающим эффективность терапии, служило кумулятивное количество морфина, введенного пациентам в ходе исследования. Данный показатель очень хорошо отражает выраженность боли в исследованиях подобного типа.
В результате было обнаружено статистически достоверное снижение кумулятивного количества введенного морфина в обеих группах с активной терапией — примерно на 1/3 по сравнению с плацебо. В работах, опубликованных ранее, эта величина снижения потребности в морфине рассматривается в качестве клинически значимой [12–14]. Кроме того, в ходе исследования было показано, что в обеих группах с активной терапией по сравнению с плацебо-группой наблюдался более длительный интервал времени до введения нагрузочной дозы морфина и подключения к системе РСА, более низкая интенсивность боли и значительное улучшение качества сна. В целом эти данные указывают на улучшение общего качества анальгезии без увеличения частоты побочных эффектов в обеих группах с активной терапией по сравнению с плацебо. В рамках настоящего исследования группы пациентов были однородны по их исходным характеристикам. Средний возраст всех пациентов, включенных в исследование, составил около 60 лет, как и ожидалось исходя из интересующей нас патологии.
Необходимо отметить, что частота ПОТР в обеих группах с активной терапией была ниже, чем в плацебо-группе, что косвенно отражает способность комбинированной анальгезии уменьшать потребность во введении морфина.
Декскетопрофен является S(+)-энантиомером рацемического соединения кетопрофен. В доклинических исследованиях было показано, что декскетопрофен обладает более выраженными обезболивающими свойствами, нежели родительское соединение; эти данные были подтверждены в модели острой боли у мужчин. Было показано, что активность декскетопрофена очень высокая в центральной нервной системе: по-видимому, на уровне спинного мозга он влияет на ноцицепцию и подавляет феномен «взвинчивания» [21], что делает этот препарат особенно эффективным в данной модели.
Относительно седации (четко установленный побочный эффект при использовании опиоидов) необходимо отметить, что в ходе исследования были обнаружены достоверные различия между обеими группами с активной терапией и плацебо ко 2-му и 13-му часу после операции. Это можно объяснить или улучшением качества анальгезии в обеих группах с активной терапией, которое приводило к релаксации и засыпанию пациентов, что затрудняло оценку седации (центральный эффект), или возможным наличием фармакокинетического взаимодействия [22, 23].
Потенциальный риск развития кровотечений при использовании НПВС во время периоперационного периода не может быть исключен, поскольку они ингибируют агрегацию тромбоцитов и, следовательно, увеличивают время кровотечения за счет торможения синтеза простагландинов. Однако результаты исследований клинической значимости влияния НПВС на развитие кровотечений не являются окончательными [4]. В нашем исследовании мы оценили величину потери крови путем регистрации выраженности кровотечения из раневого дренажа. Общее количество потерянной крови оказалось сравнимым между всеми выделенными группами. Эти данные свидетельствуют об отсутствии увеличения риска развития кровотечений при совместном введении антиагрегантов и декскетопрофена трометамола по сравнению с аналогичной комбинацией для кетопрофена или плацебо.
Таким образом, в ходе настоящего исследования было показано, что внутримышечное введение декскетопрофена трометамола в дозе 50 мг приводило к развитию хорошего обезболивающего эффекта и снижению потребности в опиоидах после крупных ортопедических операций.
Авторы благодарны Laboratorios Menarini S.A. за финансовую поддержку настоящего исследования. Кроме того, мы благодарим всех исследователей, которые приняли участие в настоящем исследовании и помогали нам собрать необходимые данные. Мы также выражаем свою признательность Harrison Clinical Research Ltd., особенно Sara Carter за ее помощь и поддержку в течение всего периода исследования, и доктору Isabel Paredes из Laboratorios Menarini S.A. за ее ценную помощь при подготовке рукописи.
Dickenson A.H. Physiological basis of analgesic drug combination // Dolor. — 2000. — 15 (Suppl. 1). — 7.
Kehlet H., Rung G.W., Callesen T. Postoperative opioid analgesia: time for reconsideration? // J. Clin. Anaesth. — 1996. — 8. — 441-445.
Europain. European Minimum Standards for the Management of Postoperative Pain. Goring-on-Thames: Pegasus Healthcare International Ltd, 1998.
Dahl J.B., Kehtlet H. Non-steroidal anti-inflammatory drugs: Rationale for use in severe postoperative pain // Br. J. Anaesth. — 1991. — 66. — 703-712.
Murphy D.F. NSAIDs and postoperative pain. Sooner is better than later // Br. Med. J. — 1993. — 306. — 1493-1494.
Dahl V., Raeder J.C. Non-opioid postoperative analgesia // Acta Anaesthesiol. Scand. — 2000. — 44. — 1191-1203.
Mauleуn D., Artigas R., Garcнa M.L., Carganico G. Preclinical and clinical development of dexketoprofen // Drugs. — 1996. — 52. — 24-46.
Cabrй F., Fernбndez M.F., Calvo L., Ferrer X., Garcнa M.L., Mauleуn D. Analgesic, anti-inflammatory and antipyretic effects of S(+)-ketoprofen in vivo // J. Clin. Pharmacol. — 1998. — 38. — 3S-10S.
Gay C., Planas E., Donado M. et al. Analgesic effect of low doses of dexketoprofen in the dental pain model: a randomised, double-blind, placebo-controlled study // Clin. Drug Invest. — 1996. — 11. — 320-330.
Ezcurdia M., Cartejoso F.J., Lanzуn R. et al. Comparison of the efficacy and tolerability of dexketoprofen and ketoprofen in the treatment of primary dysmenorrheal // J. Clin. Pharmacol. — 1998. — 38 (Suppl. 12). — 55S-64S.
Carr D.B., Goudas L.C. Acute pain // Lancet. — 1999. — 353. — 2051-2058.
Burns J.W., Aitken H.A., Bullingham R.E., McArdie C.S., Kenny G.N. Double blind comparison of the morphine sparing effect of continuous and intermittent i.m. administration of ketorolac // Br. J. Anaesth. — 1991. — 67. — 325-328.
Sevarino F.B., Sinatra R.S., Paige D., Silverman D.G. Intravenous ketorolac as an adjunct to patient-controlled analgesia for management of post-gynaecological pain // J. Clin. Anaesth. — 1994. — 6. — 23-27.
Laitinen J., Nuutinen L., Kiiskila E.L. et al. Comparison of intravenous diclofenac, indomethacin and oxycodone as postoperative analgesics in patients undergoing knee surgery // Eur. J. Anaesthesiol. — 1992. — 9. — 29-34.
CPMP/ICH/363/96. Note for Guidance on Statistical Principles for Clinical Trials. (CPMP Adopted March 1998) 1996.
Anderson S.K., Al-Shaikh B.A. Diclofenac in combination with opiate infusion after joint replacement surgery // Anaesthesia Intensive Care. — 1991. — 19. — 535-538.
Vane J. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin like drugs // Nature. — 1971. — 231. — 232-235.
Urquart E. Central analgesic activity of non-steroidal anti-inflammatory drugs in animal and human models // Semin. Arthritis Rheum. — 1993. — 23. — 198-205.
Malmberg A.B., Yaksh T.L. Spinal actions on non-steroidal anti-inflammatory drugs: evidence for central role of protanoid in nociceptive processing // Prog. Pharmacol. Clin. Pharmacol. — 1993. — 10. — 91-110.
Kaufman W.E., Anderson K.L., Isalson P.C., Worley P.F. Cyclooxygenases and the central nervous system // Prostaglandins. — 1997. — 54. — 601-624.
Mazario J., Rozaw C., Herrero J.F. NSAID dexketoprofen trometamol is as potent as μ-opioids in the depression of wind-up and spinal cord nociceptive reflexes in normal rats // Brain Res. — 1999. — 816. — 512-517.
Hobbs G.J. Ketorolac alters the kinetics of morphine metabolites // Br. J. Anaesth. — 1997. — 78. — 87-95.
Tighe K.E., Webb A.M., Hobbs G.I. Persistently high plasma morphine-6-glucuronide levels despite decreased hourly PCA morphine use after single dose diclofenac: potential for opioid related toxicity // Anaesth. Analg. — 1999. — 88. — 1137-1142.