Журнал «» 5(19) 2011
Вернуться к номеру
Механизмы формирования нарушений липидного спектра крови у подростков с артериальной гипертензией
Авторы: Коренев Н.М., Богмат Л.Ф., Носова Е.М., Сулима Т.Н., Яковлева И.М., ГУ «Институт охраны здоровья детей и подростков НАМН Украины», г. Харьков
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Цель исследования — определение особенностей липидного спектра крови, систем нейрогуморальной регуляции и их взаимовлияния у подростков с артериальной гипертензией в зависимости от наличия избыточной массы тела и ожирения. У 149 юношей 13–18 лет оценивали уровни в крови общего холестерина, триглицеридов, холестерина липопротеидов высокой, низкой и очень низкой плотности, коэффициент атерогенности, определяли состояние симпатоадреналовой системы по уровню экскреции в моче катехоламинов, изучали экскрецию мелатонина; состояние ренин-ангиотензин-альдостероновой системы. Анализ ассоциации показателей проведен методом множественного регрессионного анализа. Установлено наличие более глубоких нарушений циркадных ритмов мелатонина и катехоламинов у подростков с избыточной массой тела (низкий уровень мелатонина и относительно высокие показатели катехоламинов в ночное время существенно влияют на процессы энергетического дисбаланса). Независимо от массы тела, все показатели липидного спектра крови связаны с ангиотензином II. У лиц с избыточной массой тела, в отличие от подростков с первичной артериальной гипертензией, активность ренина плазмы не является детерминантом липидного спектра крови, а статистически значимое влияние оказывает звено ангиотензин II — альдостерон. Результаты исследования подтверждают имеющиеся сведения о возможной общности и синергизме прогипертензивных и проатерогенных механизмов при раннем развитии сердечно-сосудистых нарушений, в том числе и у подростков.
Подростки, артериальная гипертензия, липидный спектр крови, избыточная масса тела.
Введение
В последние десятилетия большое внимание исследователей сосредоточено на определении взаимоотношений и взаимовлияний таких факторов неблагоприятного течения сердечно-сосудистых заболеваний (ССЗ), как артериальная гипертензия (АГ), дислипопротеидемии (ДЛП), инсулинорезистентность (ИР) и системное воспаление [1–4].
Ранее было установлено, что у подростков под влиянием нейрогуморальных изменений пубертатного периода и неблагоприятных экзогенных и эндогенных факторов возникают транзиторные подъемы артериального давления (АД), нарушения в липидном спектре крови и в углеводном обмене, которые могут трансформироваться в хронические стабильные формы АГ и нарушения метаболизма углеводов и липидов [5–8].
Анализ динамики изменений показателей липидного спектра крови у лиц, у которых АГ дебютировала в подростковом возрасте, свидетельствует о постепенном формировании атерогенных нарушений в липидном спектре крови с повышением уровней общего холестерина (ОХС), триглицеридов (ТГ) и снижением показателей холестерина липопротеидов высокой плотности (ХС ЛПВП). При этом нарушения в липидном спектре крови формируются в двух направлениях: у одних, как правило, происходит преимущественное повышение ОХС со снижением показателей ХС ЛПВП, у других отмечается отчетливое повышение уровня ТГ с параллельным снижением ХС ЛПВП [9, 10].
Как известно, комплекс взаимозависимых и взаимопотенцирующих нарушений АД, углеводного и липидного обмена, дисфункция нейроэндокринных систем и эндотелия, которые формируются на фоне сниженной чувствительности тканей к инсулину — ИР и ожирения, объединены в так называемый метаболический синдром (МС) [11, 12].
Изначально МС, включающий в себя абдоминальное ожирение, ДЛП, нарушение толерантности к глюкозе и АГ, описывался как исключительно «взрослый» феномен. Однако сегодня проявления МС широко распространены в детской и подростковой популяции и имеют отчетливую тенденцию к увеличению [13–15].
Важную роль в формировании ДЛП и ИР играют абдоминальное ожирение и сопутствующие ему сдвиги в нейрогормональной регуляции. Висцеральный жир имеет ряд патофизиологических особенностей, в частности высокую чувствительность к липолитическому воздействию катехоламинов и низкую — к антилиполитическому действию инсулина, что стимулирует липолиз. В результате свободные жирные кислоты тормозят действие инсулина, еще более усугубляя ИР и гипергликемию. Помимо этого, висцеральный жир также является и эндокринным органом, синтезирующим множество биологически активных веществ (лептин, адипонектин, провоспалительные цитокины и др.), действие которых в рамках МС также приводит как к ИР, так и к другим метаболическим нарушениям [16–19].
Доказано, что формирование и прогрессирование самой АГ обусловлено сложным взаимодействием нейрогуморальных, гемодинамических, метаболических, генетических и внешнесредовых факторов [20–23]. Эти вопросы являются в настоящее время предметом глубокого изучения, но среди детей и подростков подобные исследования единичны, результаты их неоднозначны.
В связи с этим представлялось важным определить особенности липидного спектра крови, систем нейрогуморальной регуляции и их взаимовлияние у подростков с первичной (эссенциальной) артериальной гипертензией (ПАГ) и АГ, сопровождающейся избыточной массой тела (ИМТ) и ожирением.
Материалы и методы
Под наблюдением находились 93 юноши с ПАГ в возрасте 13–18 лет и 56 их сверстников с АГ, которая сопровождалась ИМТ (индекс массы тела превышал 85 ‰ процентильного распределения). Контрольную группу составили 19 практически здоровых подростков с нормальными росто-весовыми показателями и АД.
Показатели индекса массы тела между 85 и 95 ‰ расценивались как ИМТ, а выше 95 ‰ — как ожирение. Критерием абдоминального ожирения считали объем талии (ОТ), равный и более 94 см для юношей старше 16 лет и выше 90 ‰ процентильного распределения для детей до 15 лет (IDF 2007). Для выявления абдоминального типа ожирения у подростков старше 16 лет используется, так же как и у взрослых, индекс отношения ОТ к объему бедер (ОБ)).
Липидный спектр крови изучался на основании определения уровня ОХС, ТГ, ХС ЛПВП фотометрическим методом на фотометре общего назначения CORMAY MULTI (Польша). Показатели холестерина липопротеидов очень низкой плотности (ХС ЛПОНП) и холестерина липопротеидов низкой плотности (ХС ЛПНП), а также коэффициент атерогенности (КА) определяли расчетным способом по формулам:
ХС ЛПОНП = ТГ : 5;
ХС ЛПНП = ОХС – (ХС ЛПОНП + ХС ЛПВП);
КА = (ОХC – ХC ЛПВП) / ХC ЛПВП.
Оценку состояния симпато-адреналовой системы (САС) проводили на основании определения содержания в суточной моче свободных катехоламинов — норадреналина (НА) и адреналина (А), а также отдельно дневной фракции (НАд, Ад) и ночной фракции (НАн, Ан) флюорометрическим методом по Е.Ш. Матлиной и соавт. (1976). Уровень экскреции мелатонина (Ме) в суточной моче с учетом дневной (Мед) и ночной (Мен) фракции определяли по методу Друэкса в модификации Г.В. Зубкова (1974).
Ренин-ангиотензин-альдостероновую систему (РААС) оценивали по уровню активности ренина плазмы (АРП), содержанию ангиотензина II (А II) и альдостерона (Альд.) в периферической венозной крови с помощью радиоиммунологического анализа на гамма-счетчике «Наркотест». Использовали наборы «Ангиотензин 1-ренин», «Ангиотензин-II» и «Альдостерон» фирмы IMMUNOTECH (Чехия).
Все исследования проводились через 2–3 дня после поступления пациента в стационар, в условиях свободного режима, до назначения лечения.
Статистический анализ проводился с помощью пакета прикладных программ Statgraphics Plus for Windows 3.0 (Manugistic Inc., USA). Анализ ассоциации отдельных показателей липидного обмена с набором гормонов САС, РААС и мелатонином проводился методом множественного регрессионного анализа. Результаты приведены в виде таблиц набора зависимых (Yі) и независимых (Хі) переменных (детерминант), а также коэффициента детерминации (R2).
Результаты и их обсуждение
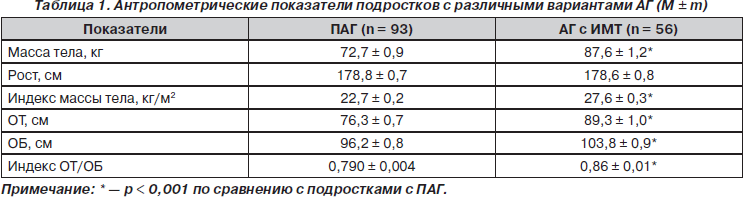
Средние значения антропометрических показателей исследуемых подростков свидетельствует о достоверном превышении массы тела, индекса массы тела, ОТ, ОБ, а также индекса ОТ/ОБ у пациентов с АГ и ИМТ по сравнению с подростками с ПАГ (табл. 1).
Следует отметить, что индекс массы тела у 15 % юношей с ПАГ находился также в пределах от 24,8 до 28,1 кг/м2 (между 85 и 95 ‰), но был обусловлен хорошо развитой скелетной мускулатурой. Ожирение 1-й степени (индекс массы тела превышал 95 ‰ и находился в пределах от 30,0 до 33,3 кг/м2) регистрировалось лишь у юношей второй группы и составило 17,9 %.
Установлены также достоверные различия средних показателей индекса ОТ/ОБ у подростков исследуемых групп (0,79 ± 0,004 с ПАГ против 0,86 ± 0,01 у подростков с АГ и ИМТ; р < 0,001) (табл. 1). Повышение массы тела с распределением жира по висцеральному типу не было выявлено ни у одного подростка с ПАГ, в то время как среди юношей второй группы этот тип ожирения выявлен у 19 (33,9 %), а показатель ОТ у них колебался от 92 до 105 см.
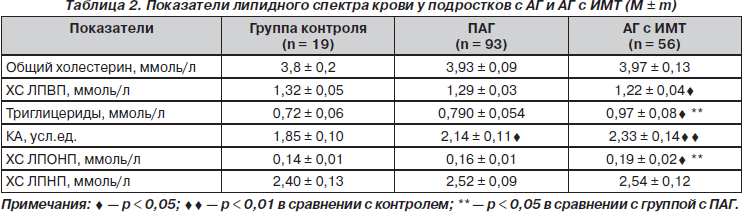
Анализ средних показателей липидного спектра крови у подростков с АГ по сравнению с их здоровыми сверстниками свидетельствует о том, что уровни ОХС и ХС ЛПНП не имели существенных различий, но при этом отмечено достоверное повышение у них уровня ТГ и ХС ЛПОНП, а также снижение показателей ХС ЛПВП, что влекло за собой достоверное снижение КА (табл. 2).
Как известно, большое значение в формировании атерогенного потенциала крови, прежде всего генетически детерминированного его компонента, придается белковой составляющей липопротеидов, а именно аполипопротеидам. Выделяют апо-a, апо-b и апо-преb липопротеиды. Белок апо-a, связываясь с большим количеством фосфолипидов и незначительным — ОХС и ТГ, образует липопротеиды высокой плотности (ЛПВП), основной функцией которых является выведение холестерина из тканей. Белок апо-b связывает большое количество холестерина и незначительное — фосфолипидов и ТГ, образуя липопротеидные комплексы низкой плотности (ЛПНП), которые являются основными транспортными формами переноса холестерина в ткани. Белок апо-преb, связывая большое количество ТГ, меньшее — холестерина и фосфолипидов, является белковой составляющей липопротеидов очень низкой плотности (ЛПОНП). Эти липопротеиды во многом потенцируют действие ЛПНП и способствуют перегрузке тканей холестерином. В связи с этим основным показателем, определяющим наследственную предрасположенность к атеросклерозу подростков с АГ, является соотношение между суммой апо-b и апо-преb и апо-a-липопротеидами [24–26].
При изучении содержания основных классов липопротеидов сыворотки крови у подростков с АГ было установлено преобладание их нарушений в группе с ИМТ (табл. 3).
Важно также было определить соотношение суммарного содержания проатерогенных липопротеидов (ЛПНП + ЛПОНП) и содержания антиатерогенных ЛПВП, что является отражением соотношения апо-b + апо-преb/апо-a. При этом установлено, что показатель среднего значения этого соотношения у подростков с АГ и ИМТ был достоверно выше, чем у юношей с ПАГ (соответственно 3,03 ± 0,51 против 2,23 ± 0,28; р < 0,05). У этих же подростков достоверно чаще регистрировалось повышение уровня ЛПНП (у 19,05 против 2,63 %; р < 0,02), а также снижение уровня ЛПВП (у 42,86 против 13,16 %; р < 0,01), но частота повышения уровня преb-липопротеидов в исследуемых группах была одинакова (80,1 и 84,2 %; р > 0,05).
Известно, что мощным фактором, который способствует формированию изменений системы кровообращения, центрального и периферического ее звеньев, а также региональных отделов (церебрального, почечного, коронарного), является активация нейрогуморальных систем. К ним относят прежде всего САС и РААС.
При изучении экскреции катехоламинов и мелатонина с мочой у подростков исследуемых групп было установлено, что наиболее значимые различия имелись лишь в отношении уровня экскреции Ме (табл. 4). Так, у подростков с АГ и ИМТ достоверно выше были показатели экскреции Ме, особенно дневной его фракции, по сравнению с подростками с ПАГ, но при этом у подростков с ПАГ наблюдалось существенное выравнивание циркадного ритма Ме, что подтверждается средним значением индекса отношения ночного уровня экскреции Мен к дневному Мед, который составил 0,96 ± 0,06. У подростков с АГ и ИМТ отмечено более выраженное снижение, по сравнению с дневной, ночной фракции Ме (0,69 ± 0,03), а также минимальное снижение ночной фракции НА (табл. 4).
Доказано, что НА и А являются гормонами, одновременно вовлеченными в регуляцию метаболических и соматических функций организма, а Ме осуществляет координацию циркадной активности многих гормонов, в том числе и РААС.
В связи с этим представляло интерес изучить их влияние на показатели липидного спектра крови, но при множественном корреляционном анализе использовались значения этих гормонов с учетом времени суток (табл. 5).
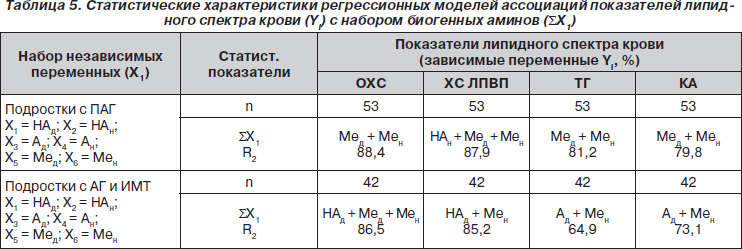
Как следует из табл. 5, у подростков с ПАГ большинство показателей липидного спектра крови испытывает доминирующее влияние Ме с учетом его циркадного ритма, за исключением ХС ЛПВП, на показатели которого помимо Ме существенно влияет и уровень НА в ночное время (R2 = 87,9 %).
Так как у подростков с ПАГ наблюдается выравнивание циркадного ритма экскреции Ме (индекс отношения уровня Мен/Мед равен 0,96 ± 0,06), не исключено, что пониженный уровень его экскреции ночью существенно влияет на метаболизм липидов и может быть причиной повышения атерогенных фракций липидного спектра крови. Высокая активность САС у подростков данной группы проявляется также взаимосвязью антиатерогенных фракций ХС ЛПВП с уровнем ночной экскреции НА (табл. 5).
У юношей с АГ и ИМТ наблюдается более дифференцированное влияние биогенных аминов на показатели липидного спектра крови. Так, ОХС имел высокий уровень взаимосвязи (R2 = 86,5 %) с показателями Мед и Мен, а также НАд, уровень ХС ЛПВП — с показателями НАд и Мен (R2 = 85,2 %), а уровень ТГ — с показателями Ад и Мен (R2 = 64,9 %).
Если учесть наличие более глубоких нарушений циркадных ритмов Ме и катехоламинов у подростков данной группы, можно предположить, что именно низкий уровень Ме и относительно высокие показатели катехоламинов в ночное время могут существенно влиять на процессы энергетического дисбаланса у лиц с АГ и ИМТ.
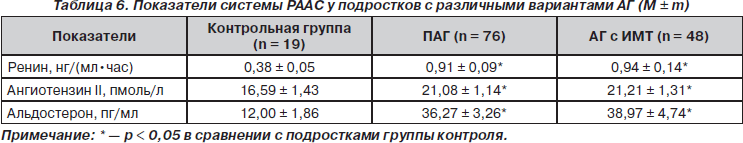
При изучении показателей РААС у подростков с АГ было установлено достоверное повышение всех ее составляющих по сравнению с контрольной группой, но отсутствие различий в зависимости показателей ИМТ (табл. 6).
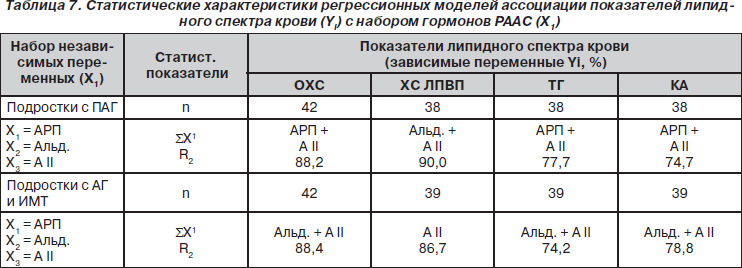
По результатам множественного регрессионного анализа выявлены особенности взаимодействия гормонов РААС с отдельными показателями липидного спектра крови у подростков с АГ исследуемых групп (табл. 7).
В рамках вариабельности показателей липидного спектра крови, а также РААС у подростков с ПАГ была выявлена статистически значимая (р < 0,001) положительная ассоциация ОХС (R2 = 88,2 %), ТГ (R2 = 77,7 %) и КА (R2 = 77,6 %) с уровнем АРП и А II, которая отличалась высокой степенью детерминации зависимых переменных (табл. 7).
У подростков с АГ и ИМТ наблюдался иной характер ассоциации гормонов РААС с показателями липидного спектра крови (табл. 7). Так, показатели ОХС (R2 = 88,4 %), ТГ (R2 = 74,2 %) и КА (R2 = 81,2 %) статистически значимо (р < 0,001) ассоциированы с уровнем Альд. и А II, тогда как показатели ХС ЛПВП — только с уровнем А II (R2 = 86,8 %).
Несмотря на отсутствие различий показателей РААС у подростков с АГ исследуемых групп, набор детерминант, предопределяющих уровень показателей липидного спектра крови, отличался (табл. 7). Обращает на себя внимание, что независимо от массы тела все показатели липидного спектра крови в той или иной мере связаны с А II — конечным гормональным субстратом превращений в системе РААС, который ответственен за развитие синдрома АГ.
У подростков с ПАГ АРП вместе с А II детерминирует уровень ОХС, ТГ и КА, в то время как ХС ЛПВП ассоциирован с А II и Альд. Это может быть свидетельством влияния различных звеньев РААС на атерогенные и антиатерогенные фракции липидного спектра крови у подростков с АГ и нормальной массой тела.
У лиц с АГ и ИМТ АРП не является детерминантом липидного спектра крови, а статистически значимое влияние оказывает звено ангиотензин II — альдостерон, что может указывать на доминирование альтернативного (лейкотриенового), не опосредованного ренином, пути синтеза А II у лиц с избыточной массой тела, т.е. с повышенным содержанием жировой ткани в организме.
Результаты данного исследования подтверждают имеющиеся немногочисленные сведения о возможной общности и синергизме прогипертензивных и проатерогенных механизмов при раннем развитии сердечно-сосудистых нарушений, в том числе и у подростков.
<p>1. Березин А.Е. Элевация концентрации триглицеридов в плазме крови и кардиоваскулярный риск [Текст] / А.Е. Березин // Укр. мед. часоп. — 2009. — № 3. — С. 70-76. </p>
<p>2.<strong> </strong>Амбросова Т.Н. Роль нарушений углеводного обмена и активности провоспалительных цитокинов в развитии артериальной гипертензии, ассоциированной с ожирением [Текст] / Т.Н. Ковалева, О.Н. Ковалева, Т.В. Ащеулова // Укр. кардиол. журнал. — 2009. — № 3. — С. 34-38.<strong> </strong></p>
<p>3. Плотникова И.В. Маркеры метаболического синдрома у подростков с артериальной гипертензией [Текст] / И.В. Плотникова, Т.Е. Суслова, Н.М. Желтоногова // Педиатрия. — 2007. — Т. 86, № 3. — С. 39-43.</p>
<p>4. Rahmouni K. Obesity-associated hypertension [Text] / Rahmouni K. et al. // Hypertension. — 2005. — Vol. 45. — P. 9-17.</p>
<p>5. Sing B.M., Mehta J.L. Interactions between the rennin-angiotensin system and dyslipidemia: relevance in the therapy of hypertension and coronary heart disease // Arch. Intern. Med. — 2003. — Vol. 163. — P. 1296-1304.</p>
<p>6. Chen J., Li D., Schaefer R., Mehta J.L. Cross-talk between dyslipidemia and rennin-angiotensin system and the role of LOX-1 and MARK in atherogenesis studies with the combined use of rosuvastatin and condesartan // Atherosclerosis. — 2006. — Vol. 184. — P. 295-301.</p>
<p>7.Gaudio G., Guasti L., Schizzarotto A., Simoni C. et al. Changes in plasma lipids during rennin-angiotensin system blockade combination therapy (enalapril plus valsartan) in patients with diabetes and hypertension // J. Cardiovasc. Pharmacol. — 2005. — Vol. 45, № 4. — P. 362-366.</p>
<p>8. Xilin Yang, Hailu Zhao, Yi Sui, Ronald C.W. Ma et al. / Additive interaction between the rennin-angiotensin system and lipid metabolism for cancer in type 2 diabetes // Diabetes. — 2009. — Vol. 58. — P. 1518-1525.</p>
<p>9. Коренев Н.М. Артериальная гипертензия подросткового возраста: распространенность, механизмы формирования, подходы к лечению [Текст] / Н.М. Коренев, Л.Ф. Богмат // Таврический медико-биологический вестник. — 2007. — № 2. — С. 83-86. </p>
<p>10. Особливості ліпідного та ліпопротеїдного спектрів крові у підлітків із різними формами артеріальної гіпертензії [Текст] / М.М. Коренєв, О.М. Носова, Л.Ф. Богмат, І.М. Яковлева, В.В.Ніконова // Современная педиатрия. — 2010. — № 6 (34). — С. 50-53.</p>
<p>11. Волкова Н.И. Артериальная гипертензия и метаболические нарушения [Текст] / Н.И. Волкова, И.С. Джериева // Клиническая медицина. — 2010. — № 2. — С. 4-8. </p>
<p>12. Lipid screening and cardiovascular health in childhood [Text] / S.R. Daniel, F.R. Greer // Pediatrics. — 2008. — № 122 (1). — Р. 198-208.</p>
<p>13. Метаболический синдром у детей и подростков. Консенсус Международной диабетической федерации [Текст] // Междунар. эндокрин. журн. — 2008. — № 2 (14). — С. 100-103.</p>
<p>14. Структура факторов риска поражения органов-мишеней и метаболических изменений у больных артериальной гипертензией в различных возрастных группах [Текст] / С.А. Бойцов и др. // Кардиология. — 2009. — № 4. — С. 19-24.</p>
<p>15. Нефедова Ж.В. Метаболические и нейрофизиологические аспекты артериальной гипертензии у детей и подростков [Текст]: Автореф. дис… д-ра мед. наук: 14.00.09 «Педиатрия» / Ж.В. Нефедова; Новосибирский государственный медицинский университет Росздрава. — Новосибирск, 2007. — 35 с.</p>
<p>16. Громнацкий Н.И. Липидный спектр крови у детей и подростков с артериальной гипертонией [Текст] / Н.И. Громнацкий, Н.Н. Громнацкая // Росс. кардиол. журн. — 2006. — № 4. — С. 24-26.</p>
<p>17. К проблеме патогенеза метаболического синдрома. Жировая ткань и маркеры острой фазы воспаления [Текст] / И.К. Кондаков и др. // Артериальная гипертензия. — 2009. — № 3 (5). — С. 39-43.</p>
<p>18. Rahmouni K. Obesity-associated hypertension [Text] / Rahmouni K. et al. // Hypertension. — 2005. — Vol. 45. — P. 9-17.</p>
<p>19. Rutter M.K., Meigs J.B., Sullivan L.M., D’Agostino R.B. Sr., Wilson P.W.F. C-reactive protein, the metabolic syndrome, and prediction of cardiovascular events in the Framingham Offspring Study // Circulation. — 2004. — 110. — 380-385.</p>
<p>20. Горбась І.М. Епідеміологічні аспекти поширеності артеріальної гіпертензії та дисліпідемії серед населення України [Текст ] / І.М. Горбась // Здоров’я України. — 2008. — № 6. — С. 30-31.</p>
<p>21. Дисліпідемії: Діагностика, профілактика та лікування [Текст]: Метод. рек. / Робоча група з проблем атеросклерозу та хронічних форм ІХС та Робоча група з проблем метаболічного синдрому, цукрового діабету, предіабету та серцево-судинних захворювань Українського наукового товариства кардіологів. — К., 2007. — 55 с.</p>
<p>22. Dzau V.J., Gibbons G.H. Endothelium and growth factors in vascular remodelling of hypertension // Hypertension. — 1991. — 18 (suppl. III). — III-115-III-121.</p>
<p>23. Vogel R.A. Coronary risk factors, endothelial function, and atherosclerosis: a review // Clin. Cardiol. — 1997. — 20 (5). — 426-432.</p>
<p>24. Hubert H.B. Obesity as an independent risk factor for cardiovascular disease: a 26 year follow up of participants of the Framingham Heart Study [Text] / H.B. Hubert, M. Feinleib, Mc. Namara // Circulation. — 1983. — № 67. — Р. 968-977.</p>
<p>25. Талаєва Т.В. Сучасні уявлення про системний характер порушень обміну ліпопротеїдів крові як основи патогенезу атеросклерозу [Текст] / Т.В. Талаєва, В.В. Братусь // Матеріали IX Національного конгресу кардіологів України. — К., 2009. — С. 29-39.</p>
<p>26. Non-high-density lipoprotein cholesterol level as a predictor of cardiovascular disease mortality [Text] / Cui Y. et al. // Arch. Intern. Med. — 2001. — Vol. 161 — Р. 1413-1419.