Журнал «Медицина неотложных состояний» 6 (37) 2011
Вернуться к номеру
Три кити інфузійної терапії: що? коли? скільки? (Сучасні відповіді на давні запитання)
Авторы: Галушко О.А. Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний
Версия для печати
У статті проаналізовано сучасні принципи раціональної інфузійної терапії, які дають відповідь на головні питання, що виникають при проведенні внутрішньовенних інфузій (що, коли й скільки?). Описано основні синдроми, при яких показане застосування інфузійних засобів, охарактеризовано сучасні групи розчинів для внутрішньовенної терапії, дані рекомендації з вибору об’ємів внутрішньовенних вливань. При обговоренні можливих компонентів інфузії акцентована увага як на позитивних ефектах, так і на можливості виникнення побічних реакцій та ускладнень при введенні різних груп інфузійних засобів.
Iнфузійна терапія, кристалоїди, колоїди, декстрани, гідроксіетильовані крохмалі, ускладнення.
Сьогодні раціональна інфузійна терапія — це один із наріжних каменів успішного лікування більшості внутрішніх захворювань. Роль інфузійної терапії в лікуванні хворого, її об’єми та склад залежать від певного кола обставин: загального вихідного стану пацієнта, глибини й поширення уражень органів, специфіки захворювання та його ускладнень.
Призначаючи інфузію, лікар прагне коригувати порушення, що були викликані самою хворобою та її ускладненнями: водно-електролітні розлади, анемію, інтоксикацію, порушення реології тощо. При цьому стандарти лікування в різних клініках можуть суттєво різнитися. Часом інфузійна терапія має досить формальний характер, що свідомо або підсвідомо відбувається через недооцінку її ролі в лікуванні хворого, недостатню орієнтованість лікаря в основних патофізіологічних механізмах наявних у хворого розладів. Проблема поглиблюється ще й через те, що за останні 20 років в Україні не було видано жодного підручника з питань інфузійної терапії, у той час як за цей же період з’явилася ціла низка нових інфузійних препаратів. І, звичайно, практичному лікарю важко розібратися в цьому різноманітті лікарських засобів.
На сьогодні основними питаннями, над якими точиться жвава дискусія, залишаються так звані головні три кити інфузійної терапії:
— Що (які препарати чи групи препаратів показані хворому)?
— Коли (при яких патологічних станах доцільно проводити інфузійну терапію)?
— Скільки (який оптимальний об’єм інфузій потрібно провести конкретному пацієнту)?
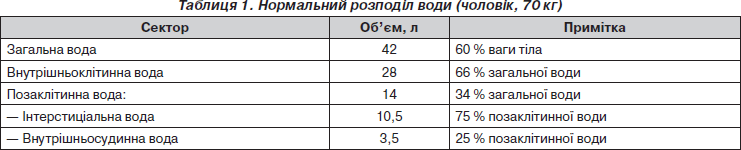
Приступаючи до обговорення поданих проблем інфузійної терапії, слід згадати декілька сторінок патофізіології. У нормі загальна вода в організмі становить до 60 % маси тіла в чоловіків та до 50 % — у жінок. У свою чергу, загальна вода розподіляється по внутрішньоклітинному та позаклітинному секторах (табл. 1).
Позаклітинна рідина поділяється на інтерстиціальну та внутрішньосудинну. Інтерстиціальна рідина омиває клітини ззовні та знаходиться поза судинним руслом. Вона виконує роль об’ємного буфера: при крововтраті рідина з інтерстицію мобілізується в судинне русло, при передозуванні інфузій рідина в інтерстиціальному просторі депонується.
При надлишку рідини в прикапілярному інтерстиції вона потрапляє в рихлу з’єднувальну тканину, перестає виконувати роль рідини та «втрачається» для організму як функціональне середовище («втрата в третій простір»). Це призводить до розвитку у хворих набрякового синдрому. Якщо і «третій простір» виснажується, вода може накопичуватись у порожнинах тіла, що за певних обставин може призводити до появи у хворих плевриту, асциту, альвеолярного набряку легень.
Вміст води в організмі визначається рівновагою між її надходженням та виділенням. Об’єм водних секторів та вміст у них електролітів залежать від надходження рідини (з питтям, їжею тощо) та втрат (з сечею, потом, при диханні тощо).
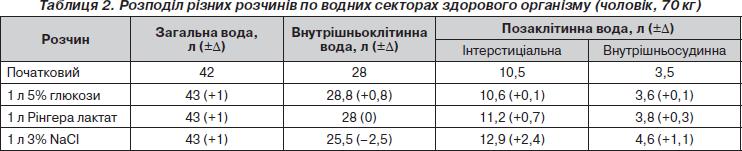
Проводячи інфузійну терапію, необхідно чітко уявляти, як той чи інший розчин розподіляється по водних секторах організму (табл. 2). Наприклад, якщо вводиться вода без електролітів (5% розчин глюкози), то вона поступає переважно у внутрішньоклітинний сектор і невеликі кількості її розподіляються між внутрішньосудинним та інтерстиціальним просторами. Тож при введенні великих об’ємів 5% розчину глюкози можлива клітинна гіпергідратація з загрозою загибелі клітини. Інший приклад: якщо ми введемо хворому 1 л розчину Рінгера, то в судинному руслі залишиться вже 300 мл, ще 700 мл перейде в інтерстицій, а об’єм внутрішньоклітинної води не зміниться. І нарешті, коли ми проводимо інфузію гіпертонічного розчину NaCl, відбувається значний перерозподіл рідини між водними секторами. Зокрема, розвивається дегідратація клітин, а забрана у клітин вода надходить в інтерстицій та судинне русло, сприяючи ліквідації гіповолемії або крововтрати.
Скільки рідини потрібно хворому?
Для обчислення об’ємів інфузійної терапії корисно спочатку розрахувати добову потребу хворого у рідині. Це дасть лікарю можливість відповісти на одне з головних питань: скільки (який об’єм інфузій потрібно провести хворому)? Для визначення цього показника існують декілька формул, однією з яких (і найпопулярнішою) є формула «4–2–1». Згідно з цією формулою, потреби хворого в рідині залежать від ваги та розраховуються таким чином (G.R. Park, P.G. Roe, 2005):
— перші 10 кг ваги — по 4 мл/кг/год;
— з 11 до 20 кг ваги — по 2 мл/кг/год;
— з 21 кг — по 1 мл/кг/год.
Таким чином, для пацієнта вагою 70 кг на перші 10 кг маси тіла (МТ) щогодинна потреба у воді становить 4 мл/кг (тобто 40 мл), з 11 до 20 кг ваги — по 2 мл/кг (тобто 20 мл) і для маси тіла, що залишилась (тобто з 21 кг), — 1 мл/кг. Таким чином, для пацієнта з МТ 70 кг щогодинна потреба у воді буде становити: 40 мл + + 20 мл + (1 мл х 50 кг) = 110 мл/год. А добова потреба: 110 мл/год х 24 год = 2640 мл [9]. Якщо пацієнт не може пити, а встановлення назогастрального зонду не показане, то фізіологічні потреби в рідині слід відновлювати переливанням інфузійних розчинів. Адекватний об’єм рідини для більшості дорослих пацієнтів дорівнює близько 3 л на добу і являє собою суму об’ємів: інфузія + ліки + їжа.
Слід пам’ятати, що сучасна інфузійна терапія є потужним та ефективним методом лікування, який при неправильному застосуванні здатен принести більше шкоди, ніж користі. Тому багато уваги приділяють питанням, з якою метою призначена інфузія чи трансфузія та які завдання лікар може вирішити при призначенні цього методу лікування.
Завдання інфузійно-трансфузійної терапії:
— Відновлення об’єму циркулюючої крові.
— Ліквідація порушень обміну речовин.
— Відновлення екстра- та інтрацелюлярного об’єму при дегідратації, яку викликає втрата рідини при різних патологічних процесах (порушення функції травного тракту, декомпенсація цукрового діабету, тяжкі форми інфекційних захворювань).
— Поліпшення реологічних властивостей крові.
— Покращення мікроциркуляції та перфузії тканин.
— Корегування гемостатичного потенціалу крові.
— Відновлення електролітного, осмотичного та кислотно-лужного балансу.
— Компонент дезінтоксикаційної терапії.
— Покращення доставки ліків до патологічного вогнища.
Перераховані завдання допомагають знайти відповідь на друге запитання: коли? Тобто з’ясувати, при яких патологічних станах і синдромах лікар має призначити внутрішньовенні вливання.
Гостра крововтрата. Наявність гострої масивної крововтрати є абсолютним показанням для енергійної інфузійної терапії. На переносимість крововтрати пацієнтом впливає багато факторів. Крім обсягу крововтрати, це і швидкість витікання крові; проведені паралельно лікувальні заходи, що компенсують втрату крові; загальний стан, вік, стать хворого тощо. Гостра масивна крововтрата складається з трьох головних патофізіологічних компонентів: гострої гіповолемії, порушень в системі гемостазу й втрати носія кисню (еритроцитів).
Гіповолемія. Зниження об’єму циркулюючої крові (ОЦК) — незмінний супутник гострих захворювань. Найбільш тяжка гіповолемія супроводжує масивну крововтрату, кишкову непрохідність, деструктивний панкреатит, декомпенсацію обміну речовин (кетонемічна та гіперосмолярна коми) [8]. Значна гіповолемія характерна для захворювань і станів, що супроводжуються постійною блювотою, дисфагією, системним запаленням і інтоксикацією.
Достатній ОЦК є необхідним для підтримки нормального кровообігу. При зниженні ОЦК відбувається так звана централізація кровообігу: для підтримки серцевого викиду, достатнього для функціонування головного мозку, серця й легень, за рахунок збільшення периферичного опору судин відбувається переміщення патологічно зниженого ОЦК до магістральних судин і серця. В інших органах і тканинах організму розвивається гіпоперфузія, наслідки якої коливаються від неприємних до необоротних.
Порушення водно-електролітного балансу. Гіповолемія формує умови для розвитку порушень водно-електролітного балансу — важливої ланки патогенезу серцевої та ниркової недостатності, цирозу печінки, асциту та багатьох інших захворювань. При порушенні обміну електролітів підвищується ризик виникнення аритмій, порушень нервово-м’язової провідності, ускладнюється регуляція обміну біологічних рідин. Зрозуміло, що хворий не може самостійно ліквідувати тяжкі розлади водно-електролітного обміну. І тут величезного значення набуває адекватна, раціонально побудована інфузійна терапія із застосуванням багатокомпонентних поліелектролітних сумішей (розчин Рінгера лактат, реосорбілакт та інші).
Порушення мікроциркуляції. Гіповолемія та порушення водно-електролітного балансу, до яких приєднуються зміни функції ендотелію судин, ведуть до розладів мікроциркуляції. Цей стан, у свою чергу, є незалежним предиктором розвитку ряду захворювань. Зокрема, у 7 незалежних дослідженнях, що охопили більше 1000 чоловік, було встановлено, що при гематокриті понад 50 % ризик розвитку захворювань серцево-судинної системи збільшується у 3 рази, а смертність від цих захворювань — у 6 разів [10]. Крім того, розлади мікроциркуляції є частою причиною неефективності інтенсивної терапії через порушення доставки лікарського препарату у вогнище патологічного процесу. Оптимальним методом лікування цих станів є застосування комплексної інфузійної терапії, направленої на різні ланки патогенезу порушень мікроциркуляції. Такий підхід має включати: вплив на внутрішньосудинні механізми (латрен), нормалізацію функції ендотелію (препарат L-аргініну — тивортин) та багатокомпонентний вплив на основні механізми, у тому числі на поповнення ОЦК та гемодилюцію (реосорбілакт).
Інтоксикація. Практикуючі лікарі щодня стикаються з проявами ендотоксикозу при лікуванні хронічної серцевої недостатності, цукрового діабету, печінкової та ниркової недостатності, дисбактеріозу, хронічного обструктивного бронхіту, системних захворювань, запальних та алергічних реакцій тощо. Екзогенна інтоксикація пов’язана з потраплянням токсинів ззовні, наприклад при отруєннях медичними препаратами, органічними та неорганічними сполуками тощо. У всіх подібних випадках один із головних шляхів природної детоксикації — виведення токсинів через нирки, із сечею.
Обов’язковим заходом у лікуванні екзо- та ендотоксикозів є гемодилюція, що передбачає парентеральне водне навантаження кристалоїдами (фізіологічний розчин, розчин Рінгера, розчин Рінгера лактатний і ін.), колоїдами (розчини гідроксіетильованих крохмалів) та багатокомпонентними препаратами (реосорбілакт, ксилат). Проводять також наводнення перорально або через зонд. Це призводить до зменшення концентрації токсичної речовини в крові й прискорює її виведення з сечею. Швидкість виведення більшості токсинів збільшується в лужному середовищі. З метою олужнення плазми хворим внутрішньовенно вводять розчини, що містять гідрокарбонат натрію (4 % розчин сода-буфер). Інфузійна програма визначається індивідуально з урахуванням рівня гематокриту, стану хворого, виду патології.
Специфічну детоксикуючу ефективність препаратів на основі полівінілпіролідонів (неогемодезу та ін.) у наш час багато фахівців беруть під сумнів [3]. Використання для зв’язування токсинів розчинів людського альбуміну вкрай дороге, пов’язане з чималим ризиком побічних реакцій, а показання далеко не завжди очевидні. Велику допомогу у виконанні програми детоксикації може надати застосування методу малооб’ємної інфузійної терапії, принципи якої будуть висвітлені нижче.
Порушення кислотно-лужної рівноваги (КЛР). Рівень рН залежить від стану буферних систем організму (бікарбонатної, фосфатної, білкової та гемоглобінової) та фізіологічних механізмів підтримання КЛР. Якщо врахувати, що в організмі утворюється в 20 разів більше кислих продуктів, ніж лужних, порушення фізіологічних механізмів компенсації при патології призводить у першу чергу до розвитку ацидозу. При цьому респіраторний ацидоз зумовлений переважно дихальною недостатністю різного генезу, у той час як метаболічний ацидоз супроводжує серцеву, дихальну, ниркову та печінкову недостатність [5]. В умовах ацидозу знижується активність лікарських препаратів, аритмії на фоні ацидозу зазвичай резистентні до лікування протиаритмічними препаратами. Таким чином, порушення КЛР значно погіршує перебіг різних патологічних процесів та ускладнює їх лікування.
Компоненти інфузії
Ну і, нарешті, третє з головних питань інфузійної терапії — що (який засіб слід обрати для проведення інфузійної терапії)?
Доцільно згадати, що ще в 1861 році дослідження шотландського вченого Томаса Грехема (T. Grahеm) з дифузії наштовхнули його на ідею поділити всі речовини, що вводяться внутрішньовенно, за здатністю проникати через ендотеліальну мембрану на розчини колоїдів та кристалоїдів. Кристалоїди вільно проникають через мембрану, тоді як колоїди в нормі не здатні проникати через ендотелій. Запропонований Т. Грехемом поділ речовин, що вводяться внутрішньовенно, на кристалоїди та колоїди зберігає актуальність і дотепер [2].
Колоїди чи кристалоїди?
Після створення синтетичних колоїдних плазмозамінників з’ясувалося, що застосування цих розчинів дозволяє значно швидше та стійкіше відновлювати дефіцит ОЦК і серцевий викид, ніж при застосуванні кристалоїдів. Натомість кристалоїди є значно дешевшими й не викликають анафілактоїдних реакцій, що становлять певну небезпеку при переливанні як синтетичних колоїдних розчинів, так і природних колоїдів (альбуміну). Згодом дискусія про перевагу колоїдної або кристалоїдної терапії поширилася від проблем лікування масивної крововтрати на побудову інфузійної терапії взагалі. Ця суперечка часом набуває таких форм, що P. Marino навіть назвав її колоїдно-кристалоїдною війною [6]. При цьому нерідко стали забувати, що основні дані про порівнянність результатів колоїдної та чисто кристалоїдної інфузії були отримані в експериментах на тваринах та переважно на молодих і здорових людях. Навряд чи ці результати можна коректно використовувати при лікуванні людей похилого віку, зі зниженими функціональними резервами, насамперед серцево-судинної системи й легень.
Які кристалоїди?
Основу кристалоїдної інфузії становлять розчини, що містять натрій. Найпростіший з них — 0,9% розчин хлориду натрію. Він є практично ізотонічним стосовно плазми крові, бо містить еквівалентну останній кількість катіонів та аніонів (по 154 мекв/л). Звідси пішла й назва препарату — «ізотонічний розчин». Друга назва цього розчину — «фізіологічний» — є не зовсім правильною, тому що в ньому наявні лише іони натрію та хлору, в той час як в плазмі є калій, кальцій, магній та інші мікроелементи. Першим удосконаленням ізотонічного розчину став розчин Рінгера, що був запропонований в 1882 році. Це був (і залишається) збалансований розчин, що містить хлориди натрію, калію й кальцію. Розчин повільно завойовував авторитет і з часом набув широкого визнання, але суттєвою вадою цього препарату був великий уміст іонів хлору. Тож, при введенні великих об’ємів розчину Рінгера у багатьох хворих виникав гіперхлоремічний ацидоз. Щоб подолати цей недолік, у 1930 році американський педіатр Алексис Хартман (А. Hartman) запропонував до розчину Рінгера додавати лактат. З тих часів розчин Рінгера лактат відомий як розчин Хартмана. Порівняно з 0,9% розчином NaCl та розчином Рінгера цей препарат містить меншу кількість іонів натрію та хлору, а наявність лактату передбачає збільшення буферних властивостей крові.
Велике значення для практичної медицини має також інший сольовий розчин — хлорид калію. Якщо головним позаклітинним катіоном є натрій, то основним внутрішньоклітинним катіоном — калій. Дуже багато запальних захворювань і критичних станів супроводжуються втратою калію та внутрішньоклітинною гіпокалігістією. Особливо важливою є корекція гіпокаліємії для профілактики й лікування порушень серцевого ритму. Сьогодні вважається, що найкращий спосіб доставити іон калію в клітину — перелити хворому так звану поляризуючу суміш, тобто суміш хлориду калію, глюкози й інсуліну (розчин ГіК).
Які колоїди?
У практичній діяльності сьогодні застосовують наступні колоїдні інфузійні середовища:
— синтетичні препарати: похідні гідроксіетильованого крохмалю, декстрану або желатини;
— розчини альбуміну;
— свіжозаморожену плазму (СЗП).
Першими синтетичними колоїдами (синтезовані у 1940 році) були препарати, створені на основі полівінілпіролідону (ПВП), серед яких у СРСР використовувався препарат під назвою гемодез. Тривалий час останній вважався незамінною складовою частиною інфузійної терапії (особливо при лікуванні інтоксикаційного синдрому).
З часом стало відомо, що при повторних введеннях гемодез гальмує функцію ретикулоендотеліальної системи, що призводить до тяжких уражень імунної системи. Особливо інтенсивно це явище виражене в новонароджених та дітей раннього віку [3]. Пізніше виявилися й інші недоліки похідних ПВП: бластогенна здатність, схильність до накопичення молекул ПВП за межами судинного русла. Внаслідок цього утворюється своєрідне депо токсинів, пов’язаних із молекулами колоїду в печінці, селезінці, нирках, легенях та кістковому мозку пацієнта, та посилюється інтерстиціальний набряк. Тому не дивно, що в 1958 році застосування похідних ПВП було заборонено в США, а з другої половини 1970-х років повідомлення про застосування цих препаратів зникли зі сторінок зарубіжної медичної літератури. В Україні наказ МОЗ про заборону використання гемодезу в клінічній практиці вийшов лише в 1998 році (у Росії — ще пізніше, у 2005 році).
У 1944 році у клінічну практику були введені кровозамінники на основі декстрану [4]. Декстрани є розчинами полімерів глюкози, вони синтезуються з сахарози бактеріями Leuconostoc mesenteroides. У 1954 році в СРСР був розроблений широко відомий препарат поліглюкін, у 1967 році — реополіглюкін. Таким чином, застосування декстранів має багату історію. Але за період інтенсивного клінічного використання цих препаратів накопичувалась і негативна інформація. Зокрема, до недоліків декстранів варто віднести загрозу підвищеної кровоточивості за рахунок дезагрегації тромбоцитів (більшою мірою належить до реополіглюкіну), здатність накопичуватися у тканинах і блокувати гломерулярну фільтрацію (так звана декстранова нирка). На жаль, усе частіше доводиться стикатися також з анафілактоїдними реакціями на декстрани, часом досить тяжкими.
Серед препаратів синтетичних колоїдів, що залишилися на ринку, завдяки біологічній інертності, тривалій циркуляції в судинному руслі й надзвичайно низькій алергогенності на перше місце в останні роки цілком обґрунтовано стали претендувати препарати гідроксіетильованих крохмалів. Від інших штучних плазмозамінників їх вигідно відрізняє значно менший вплив на агрегаційні властивості тромбоцитів, що дозволяє переливати значні дози (до 2 л і навіть більше) препаратів цієї групи без високого ризику викликати дезагрегаційну коагулопатію [7, 9].
Похідні желатини є ізотонічними, ізоонкотичними (4–8 %) розчинами желатину та низькомолекулярними (20 000–40 000 Да) плазмозамінниками. Через низьку молекулярну масу тривалість їх циркуляції в судинному руслі невелика і становить близько 2 годин. Желатин викликає збільшення викиду інтерлейкіну 1b, що стимулює запальні зміни ендотелію. В умовах загальної запальної реакції та генералізованого пошкодження ендотелію ця небезпека різко зростає. Інфузія цих препаратів знижує концентрацію фібронектину, що може додатково збільшувати проникність ендотелію. Введення цих препаратів викликає збільшення викиду гістаміну. Слід зазначити, що препарати желатини в США вважаються настільки небезпечними, що не дозволені до застосування.
Нарешті, ще одне важливе питання: чи можна розглядати свіжозаморожену плазму як альтернативний засіб колоїдної інфузійної терапії? Сьогодні ми можемо дати негативну відповідь. Призначення СЗП для відновлення ОЦК або корекції гіпопротеїнемії вважається нераціональним і небезпечним методом. Ризик переносу інфекцій, подібних ВІЛ, гепатиту В та С, при використанні СЗП великий і становить 1 : 100 [6]. Частота анафілактоїдних і пірогенних реакцій при переливанні СЗП також досить висока. Тому сьогодні єдиним показанням до застосування СЗП фахівці визнають профілактику й лікування коагулопатичних кровотеч [1, 5, 6].
Малооб’ємна інфузійна терапія
Останніми роками значної популярності набув метод малооб’ємної інфузійної терапії (Small volume resuscitation — SVR). Суть його полягає в тому, що в судинне русло вводяться препарати, які мають гіперосмолярні властивості. Завдяки цьому відбувається перерозподіл ендогенної рідини без введення значних об’ємів екзогенного розчинника. Завдяки цьому відбувається перехід рідини з міжклітинного простору в судинне русло, що сприяє посиленню мікроциркуляції та перфузії тканин і «вимиванню» з них метаболітів і токсинів. Часто для малооб’ємної терапії використовують препарати багатоатомних спиртів — реосорбілакт і ксилат. Крім зазначених ефектів, ці препарати сприяють корекції метаболічного ацидозу (тому що містять органічні аніони — відповідно натрію лактат та натрію ацетат — препарати із облуговуючим ефектом повільної дії), усуненню водно-електролітних розладів (містять збалансований набір мікроелементів), мають діуретичний та детоксикуючий ефекти.
Висновки
Інфузійна терапія є одним з основних методів лікування, що постійно розвивається і вдосконалюється. Приводами для призначення внутрішньовенної інфузії, як правило, служать:
— гіповолемія (в тому числі гостра крововтрата);
— набряк та інфільтрація тканин;
— інтоксикація;
— порушення згортання крові та розлади мікроциркуляції;
— розлади водно-електролітного гомеостазу;
— введення лікарських препаратів та поживних речовин.
Головними складовими частинами інфузії є кристалоїди (сольові розчини та глюкоза), синтетичні колоїди та компоненти крові (СЗП).
Серед синтетичних колоїдів найбільш перспективними сьогодні вважаються препарати групи гідроксіетильованих крохмалів.
Недоцільно призначати свіжозаморожену плазму як засобів для відновлення колоїдно-онкотичного тиску крові та корекції гіпоальбумінемії. Єдине показання до її переливання — масивна крововтрата, профілактика та лікування коагулопатичних кровотеч.
Використання препаратів малооб’ємної терапії дозволяє усунути водно-електролітні порушення без введення значних доз препаратів і тривалої інфузії, що має важливе значення при веденні пацієнтів із хронічним захворюваннями серцево-судинної, сечовивідної систем і шлунково-кишкового тракту.
1. Владыка А.С., Суслов В.В., Тарабрин О.А. Инфузионная терапия при критических состояниях. — К.: Логос, 2010. — 274 с.
2. Галушко О.А. Історія інфузійної терапії: від Вільяма Гарвея до наших днів // Внутрішня медицина. — 2011. — № 2. — С. 56-60.
3. Георгиянц М.А., Корсунов В.А. Интоксикационные синдромы в медицине критических состояний и возможности их инфузионной коррекции. Мифы и реальность // Мистецтво лікування. — 2007. — 4(40). — С. 74-77.
4. Гуменюк Н.И., Киркилевский С.И. Инфузионная терапия. — К.: Книга плюс, 2004. — 208 с.
5. Лишневская В.Ю. Посиндромная инфузионная терапия в практике врача-терапевта // Укр. хіміотерапевтичний журнал. — 2010. — 1–2.
6. Марино П. Интенсивная терапия: Пер. с англ. — М.: ГЭОТАР-Медиа, 2010. — 768 с.
7. Морган Дж.Э., Михаил М.С. Клиническая анестезиология: Пер. с англ. — М.: Бином, 2000. — Т. 2. — 366 с.
8. Шлапак І.П., Галушко О.А. Цукровий діабет: погляд з позиції лікаря-анестезіолога: Навчальний посібник. — К.: Книга-плюс, 2010. — 160 с.
9. Park G.R., Roe P.G. Инфузионная терапия: Пер. с англ. — М.: БИНОМ-Пресс, 2005. — 136 с.
10. Simone Y. Relation of blood viscosity to demographic and physiology variabies and cardiovascular risr factors in apparentie normal adults // Circulation. — 1990. — № 1, Vol. 81. — 107-117.