Международный неврологический журнал 6 (44) 2011
Вернуться к номеру
Когнитивные нарушения после общей анестезии при экстракардиальных вмешательствах и эффект раннего введения Тиоцетама в послеоперационном периоде
Авторы: Усенко Л.В., Полинчук И.С. Днепропетровская государственная медицинская академия
Рубрики: Неврология
Версия для печати
Общая анестезия может быть причиной возникновения в послеоперационном периоде повреждений ЦНС, среди которых особое место занимает послеоперационная когнитивная дисфункция. В статье приведены данные исследования эффективности отечественного комбинированного ноотропа Тиоцетама. Показано, что Тиоцетам способен не только предотвратить нарушения когнитивных функций, возникающие вследствие перенесенного оперативного вмешательства в условиях общей анестезии, но и существенно их улучшить.
Когнитивные функции, анестезия, послеоперационный период, ноотропы, Тиоцетам.
Нашей задачей в лечении болезни или дисфункций в человеческом организме должно быть сохранение личностных качеств и интеллекта больного.
В. Зельман, 2009
Самое страшное для общества — утрата памяти, когда человек становится беспомощным и бездеятельным. С каждым годом это вызывает все большую тревогу и у общества, и у врачей. Проблема сохранения и восстановления высших психических функций становится одной из глобальных в современной медицине, и в анестезиологии в частности, ввиду увеличения числа больных с различными когнитивными расстройствами.
Общая анестезия может быть причиной возникновения в послеоперационном периоде повреждений центральной нервной системы (ЦНС), среди которых особое место занимает послеоперационная когнитивная дисфункция (ПОКД), которая может развиться у больных различных возрастных групп и в случаях с неотягощенным психоневрологическим анамнезом.
В последнем обзоре литературы [1], охватившем 80 самостоятельных исследований, приведена частота ПОКД по данным разных авторов, которая составляет:
— в среднем — 36,8 % [2];
— после кардиохирургических операций — от 3 до 47 %, при этом у 42 % даже спустя 3–5 лет после операции;
— после некардиохирургических операций — от 7 % до 26 %, при этом у 9,9 % через 3 месяца и более, у 1 % больных — свыше 2 лет [3–4].
Важно отметить, что нарушения когнитивных функций после общехирургических вмешательств, выполненных в условиях общей анестезии, наблюдались во всех возрастных группах больных (табл. 1).
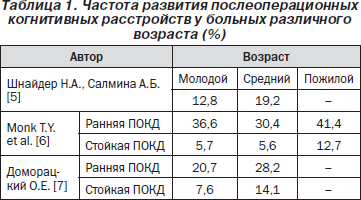
Как видно, когнитивные расстройства являются далеко не редким и безобидным осложнением.
Доказано, что ранняя ПОКД является главным предиктором стойкой ПОКД у лиц пожилого возраста. Последняя ухудшает качество жизни больных, затрудняя выполнение ими своих профессиональных и социальных функций на дооперационном уровне [2, 3, 18].
Кроме того, отмечается все возрастающий интерес к потенциальным отношениям между действием отдельных общих анестетиков и началом развития болезни Альцгеймера [8]. Изучение на молекулярном, клеточном и структурном уровнях in vitro с помощью ядерной магнитно-резонансной спектроскопии показало несколько механизмов влияния анестетиков на олигомеризацию и осаждение амилоидного бета-пептида. Бесконтрольная продукция, олигомеризация и депонирование амилоидного бета-пептида с последующим образованием амилоидных бляшек является фундаментальной основой в развитии болезни Альцгеймера. Амилоидный бета-пептид присутствует в ЦНС и находится в более высоких концентрациях в тканях у пожилых людей. Применение определенных общих анестетиков у пожилых людей может ухудшать олигомеризацию и депонирование амилоидного бета-протеина и таким образом вызывать долгосрочные когнитивные эффекты [9].
Нельзя не отметить и тот факт, что в последние годы именно ПОКД является основной причиной судебных исков в США к анестезиологам. Как сообщают P.S. Myles et al. (1999), проведенное исследование-опрос широкого круга респондентов в отношении самых важных показателей в оценке качества анестезии продемонстрировано, что больные и их родственники наиболее значимыми для себя считают сохранение в послеоперационном периоде персонального комфорта, способности к полноценному общению, возможности переписки и чтения, прежней трудоспособности.
Хотя одной из главных причин нарушения когнитивных функций после операции считают нейротоксическое действие общих анестетиков, в этиологии ПОКД выделяют 3 группы факторов:
— остаточное действие компонентов общей анестезии и продуктов их деградации, активных в отношении ЦНС, действие пролонгированных седативных средств, неадекватная послеоперационная аналгезия;
— уровень достигаемой во время операции антиноцицептивной защиты мозговых структур, несостоятельность которой приводит к перевозбуждению и истощению энергетического баланса нейронов коры больших полушарий и подкорковых образований, обеспечивающих достаточный уровень сознания;
— повреждающее действие гипоксии, как общей (гипоксемия, острая анемия, гипоциркуляция), так и локальной (изменение перфузии мозга, ВЧД) [10–13].
Наиболее уязвимыми к действию общих анестетиков являются функция внимания, краткосрочная память, скорость психомоторных и когнитивных реакций.
Вместе с тем в литературе лишь немногие работы посвящены применению нейропротективных препаратов для профилактики и лечения нейрокогнитивных расстройств в послеоперационном периоде [14–17].
Упреждающая нейропротективная терапия, наряду с выбором адекватного варианта анестезии, своевременной коррекцией нарушений гемодинамики, газообмена и гомео- стаза, приобретает важнейшее значение для предотвращения повреждений нейронов или устранения уже возникшей когнитивной дисфункции в раннем послеоперационном периоде, когда эти изменения еще потенциально обратимы [18].
Влияя на течение церебрального метаболизма, она предупреждает или прерывает патологические каскады, вызывающие дисфункцию или гибель нейронов.
Особое место в нейропротекции занимают препараты нейрометаболического действия — ноотропы [19].
Согласно определению ВОЗ, ноотропы — это фармакологические средства, оказывающие прямое активирующее влияние на обучение, улучшающие память и умственную деятельность, а также повышающие устойчивость мозга к агрессивным воздействиям гипоксии, травмам, интоксикации.
В основе действия ноотропов на ЦНС лежит два важнейших эффекта — влияние на интеллектуально-мнестические функции и церебропротекторный эффект. Препараты этой группы улучшают функции памяти, восприятия, мышления, ориентации, повседневную активность — именно те функции, которые в наибольшей степени подвержены возрастным нарушениям, стрессорным и травматическим воздействиям. В отличие от психостимуляторов мобилизирующего типа они не вызывают психомоторного возбуждения, истощения функциональных возможностей организма, привыкания и фармакологической зависимости.
Наиболее распространенным и изученным среди них является пирацетам — циклическое производное гамма-аминомасляной кислоты, являющейся центральным тормозным нейромедиатором [20].
Пирацетам обладает многогранным действием. Его быстрый метаболический эффект обусловлен активацией энергетического метаболизма и окислительно-восстановительных процессов, а пролонгированный — увеличением пластичности мозговой ткани за счет повышения чувствительности рецепторов к нейротрансмиттерам.
В последнее время прослеживается тенденция к созданию ноотропов не только на основе оригинальной химической субстанции, но и в комбинации с препаратами, усиливающими его позитивные свойства.
Наше внимание привлек отечественный комбинированный ноотропный препарат Тиоцетам (производство АО «Галичфарм» корпорации «Артериум»), содержащий в своем составе базовый рацетам — пирацетам и тиотриазолин, обладающий антиоксидантным, мембраностабилизирующим и противоишемическим эффектами. За счет тиотриазолина Тиоцетам приобрел более широкий спектр ноотропного действия, чем у пирацетама, действующего только на начальных этапах формирования памяти. Тиоцетам же положительно влияет на процессы первичной обработки информации, ее фиксацию и консолидацию, значительно активирует пролиферацию клеток глии и их функцию, что является ведущим фактором обеспечения жизнедеятельности нейронов [20–22].
Многофакторное влияние Тиоцетама послужило основанием для использования его в наших исследованиях.
Под нашим наблюдением находилось 172 больных, из которых 88 составили основные группы и 84 — контрольные. Больные были оперированы в условиях общей анестезии на основе пропофола, тиопентала натрия, кетамина, атаралгезии. Для фармакологической нейропротекции использовался комбинированный ноотропный препарат Тиоцетам по разработанным нами технологиям.
Состояние когнитивных функций мы оценивали у больных двух возрастных групп — среднего и пожилого возраста на основании комплекса психофизиологических методик, включающих прогрессивные матрицы Равена и качественный анализ ошибок при выполнении тестовых заданий, тестов Бурдона, Лурье, теста исключения лишнего в раннем (до 7 суток) и отдаленном (14, 30, 90-е сутки) послеоперационном периоде.
Также регистрировали показатели гемодинамики, газообмена, красной крови, глюкозы, лактата сыворотки крови для исключения их влияния на состояние психофизиологических функций.
По сравнению с исходным уровнем на этапах оперативного вмешательства и анестезии, в раннем послеоперационном периоде во всех группах наблюдения не отмечалось значимых различий исследуемых показателей (р > 0,05), что позволило нам отнести изменения когнитивных функций на счет влияния препаратов для общей анестезии и проведения нейропротективной терапии.
Больные среднего возраста (136 человек) были оперированы под общей анестезией с применением пропофола, тиопентала натрия, кетамина.
Каждая из этих групп была разделена на две подгруппы, одна из которых была контрольной (без введения Тиоцетама), другая — основной (с введением Тиоцетама). По демографическим (средний возраст больных от 45,7 ± 2,0 года до 46,9 ± 2,1 года) показателям, объему, характеру, длительности оперативного вмешательства и анестезии (64,3 ± 3,47 мин — 66,4 ± 4,2 мин), степени операционного риска (II по АSА ) подгруппы были однородными (р > 0,4).
Разработанная нами технология применения Тиоцетама, защищенная декларационным патентом Украины (№ 41023/2009), состояла в назначении насыщающей дозы препарата — 20 мл (тиотриазолин 500 мг + пирацетам 2000 мг) в 100 мл 0,9% раствора хлорида натрия внутривенно капельно сразу после окончания операции и поддерживающей — по 2 табл. 3 раза в день (тиотриазолин 300 мг + пирацетам 1000 мг) с первого послеоперационного дня в течение 7 дней.
Результаты исследований когнитивных функций у больных всех подгрупп в предоперационном периоде не выявили достоверных отличий (в среднем от 60,39 ± 1,35 % до 61,31 ± 1,06 %) и были отнесены согласно критериальным оценкам к среднему интеллектуальному уровню.
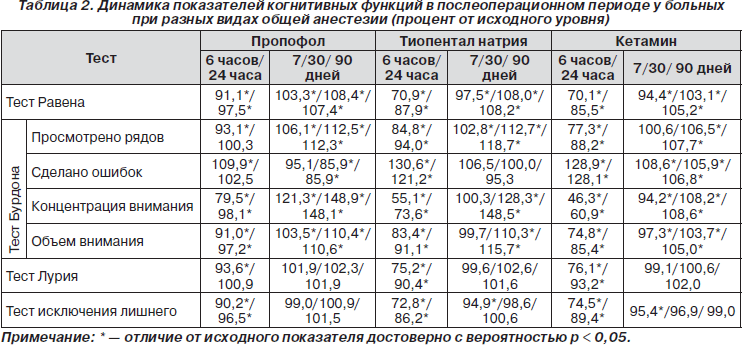
Характер и глубина изменений психофизиологических функций в раннем и отдаленном послеоперационном периодах представлены в табл. 2.
Как видно, у больных всех обследованных подгрупп в раннем послеоперационном периоде наблюдалось снижение когнитивных функций, которое было наименее выраженным при сбалансированной внутривенной анестезии на основе пропофола. К концу 1-х суток после операции у этих больных изучаемые показатели практически достигали исходного уровня с полным восстановлением их к 7-м суткам. В отдаленном послеоперационном периоде ухудшения изучаемых показателей не наблюдалось.
При использовании тиопентала натрия и кетамина к 7-му послеоперационному дню восстанавливались только простые когнитивные функции: краткосрочная память (тест Лурия), показатели уровня умственной работоспособности, объем внимания (тест Бурдона).
Более сложные высшие психофизиологические функции, такие как логичность мышления, концентрация внимания, способность к обобщению и абстрагированию, умение выделять существенные признаки, характеризующие способность к аналитико-синтетической мыслительной деятельности, достигли исходного уровня при использовании тиопентала натрия к 30-му дню, а при применении кетамина отдельные из них оставались ниже дооперационного уровня даже через 90 суток и более после операции.
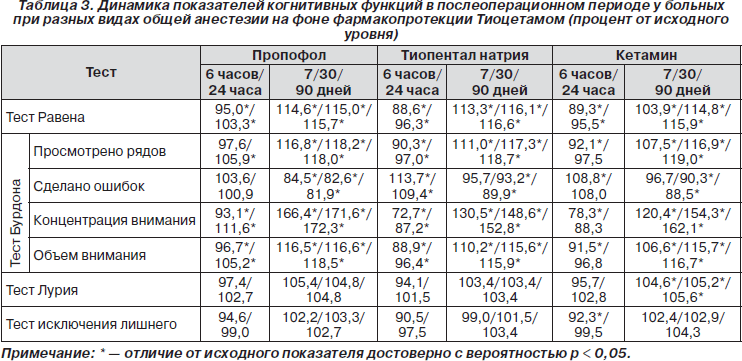
Фармакологическая нейропротекция с применением Тиоцетама оказывала достоверное положительное влияние на состояние когнитивных функций в раннем послеоперационном периоде, предупреждая развитие стойких когнитивных расстройств в отдаленном послеоперационном периоде (табл. 3).
Под влиянием курсового приема Тиоцетама в послеоперационном периоде не только достигался исходный уровень изучаемых показателей психофизиологических функций, но и статистически достоверно за счет его когнитиввосстанавливающего эффекта повышались умственная работоспособность, степень концентрации и стойкости внимания, восприятие и память, что свидетельствовало об улучшении психоэмоциональных и мнестических функций.
Также нами были исследованы группы больных пожилого возраста (старше 60 лет) с повышенным риском развития ПОКД. 36 больных, подвергшихся абдоминальным вмешательствам в условиях атаралгезии, были разделены на две подгруппы: контрольную (без введения Тиоцетама) — 16 больных и основную (с введением Тиоцетама) — 20 больных.
По демографическим показателям, основному и сопутствующим заболеваниям, степени операционного риска, длительности оперативного вмешательства и анестезии подгруппы больных были сопоставимы.
Разработанная нами технология применения Тиоцетама у этой категории больных, защищенная декларационным патентом Украины (№ 23959/2004), состояла в назначении месячного курса приема препарата в ступенчатом режиме; насыщающая доза — 25 мл (тиотриазолин 625 мг + пирацетам 2500 мг) внутривенно, начиная с первых минут после окончания операции, в течение 7 дней, и поддерживающая доза — по 2 табл. 3 раза в день в течение 21 дня (тиотриазолин 300 мг + пирацетам 1000 мг в сутки).
Исходный уровень высших психических функций у больных соответствовал среднему уровню (51,03 ± 6,33 %).
В раннем послеоперационном периоде (5-й день) установлено снижение когнитивных функций до уровня дисфункции (на 28,1 % от исходного) с неустойчивым их улучшением к 14-м суткам (рис. 1).

Качественный анализ отдельных видов допущенных ошибок при выполнении тестовых заданий больными показал, что основным видом нарушений когнитивных функций в послеоперационном периоде у больных пожилого возраста является снижение внимания и восприятия, что служит основной причиной увеличения количества ошибок, связанных со сложным восприятием и построением абстрактных умозаключений (рис. 2).
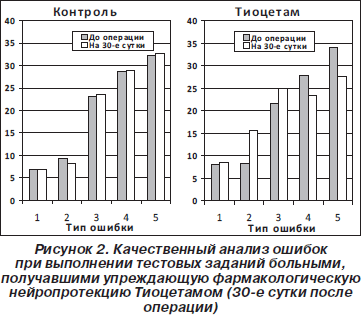
В то же время назначение Тиоцетама по предложенной нами схеме позволило не только сохранить, но и статистически достоверно улучшить состояние психофизиологических функций как в раннем, так и в отдаленном послеоперационном периоде (рис. 1). При этом к 30-му дню после операции количество ошибок, характеризующих сложные психофизиологические функции, достоверно уменьшалось (рис. 2).
Таким образом, полученные нами данные показывают высокую эффективность Тиоцетама, способного не только предотвратить нарушения когнитивных функций, возникающих вследствие перенесенного оперативного вмешательства в условиях общей анестезии, но и существенно их улучшить.
Выводы
1. При всех видах исследованных нами неингаляционных анестетиков в послеоперационном периоде развивается снижение уровня высших психофизиологических функций у больных среднего, в большей мере пожилого возраста, и тем в большей степени, чем сложнее когнитивная функция.
2. Наименее выраженные нарушения когнитивных функций в послеоперационном периоде развиваются при сбалансированной анестезии на основе пропофола.
3. Включение в комплекс интенсивной терапии Тиоцетама позволяет не только сохранить, но и достоверно повысить уровень когнитивных способностей, особенно более сложных, связанных с аналитико-синтетической мыслительной деятельностью, за счет его когнитиввосстанавливающего эффекта.
1. Большедворов Р.В., Кичин В.В., Федоров С.А., Лихванцев В.В. Эпидемиология послеоперационных когнитивных расстройств // Анестезия и реанимация. — 2009. — № 3. — С. 20-23.
2. Canet J., Raeder J., Rasmussen L.S. et al. Cognitive dysfunction after minor surgery in the elderly // Acta Anesth. Scand. — 2003. — Vol. 47,№ 10. — P.1204-1210.
3. Neuman S., Stygall J., Hurani C. et al. Postoperative cognitive dysfunction after noncardiac surgery: a systematic review // Anesthesiology. — 2007. — Vol. 106, № 3. — P.572-590.
4. Rasmussen L.S., Jonson T., Knipers H.M. et al. Does anesthesia cause postoperative cognitive dysfunction? A randomized study of regional versus general anesthesia in 438 elderly patients // Acta Anesth. Scand. — 2003. — Vol.47,№ 9. — P.1188-1194.
5. Шнайдер Н.А., Салмина А.Б. Когнитивные нарушения у пациентов молодого возраста после операций в условиях общей анестезии // Междунар. неврол. журнал. — 2006. — № 2(6).
6. Monk T. Older surgical patients at greater risk for developing cognitive problems // HealthNewsDigest.com, 2008.
7. ДоморацькийО.Е. Станкогнітивнихфункційвперіоперативномуперіодіпризагальнохірургічнихвтручаннях, виконанихвумовахтотальноїінтравенозноїанестезії:Авторефератдис...канд.мед. наук. — К., 2011. — 16 с.
8. Bittner E.A., Yue Y., Xie F. Brief review: anesthesia neuroto-xicity in the elderly, cognitive dysfunction and Alzheimer’s disease // Can. J. Anaesth. — Vol.50,№ 2. — P.216-223.
9. Fodale V., Santaria L.B., Schifilliti D., Mandel P.K. Anestetics and postoperative cognitive dysfunction: a pathological mechanism mimicking Alzheimer’s disease // Anesthesia. — 2010. — Vol.65,№ 4. — P.388-395.
10. Исаев С.В., Лихванцев В.В., Кичин В.В. Влияние периоперационных факторов и выбора метода анестезии на частоту когнитивных расстройств в послеоперационном периоде // Тpуды IX Съезда Федерации анестезиологов и реаниматологов. — Иркутск. — 2004. — С. 113-114.
11. Ибрагимов Н.Ю., Лебединский К.М., Микиртумов Б.Е. и др. Факторы риска нарушения когнитивных функций в послеоперационном периоде у пожилых пациентов // Общая реаним. — 2008. — Т. IV, № 4. — С. 21-25.
12. Соловьева Л.А. Послеоперационные нарушения сознания у гериатрических больных // Анестез. и реаним. — 2008. — № 3. — С. 71-74.
13. Loepke A.K., Soriano S.G. An assessment of the effects of general anesthetics on developing brain structure and neurocognitive function // Anesth. Analg. — 2008. — Vol. 106, № 6. — P. 1681-1707.
14. Шнайдер Н. Роль и место фармакологической церебропротекции в профилактике и коррекции когнитивной недостаточности: гипотезы и доказательства // Здоров’я України. — 2007. — № 3(160). — С. 29-30.
15. Усенко Л.В., Полинчук И.С., Болтянский С.В. Когнитивсберегающие технологии в анестезиологии // Біль, знебол. і інтенсивна терапія. — 2011. — № 2(д). — С. 192-193.
16. Никонов В.В., Савицкая И.Б., Нудьга А.Н. и др. Постгипоксическая энцефалопатия: возможности коррекции // Мед. неотл. состояний. — 2008. — № 4(17). — С. 65-71.
17. Клигуненко Е.Н., Дзяк Л.А., Площенко Ю.А. и др. Нейропротекция в анестезиологии и интенсивной терапии // Міжнар. невр. журн. — 2008. — № 2. — С. 41-50.
18. Шнайдер Н.А. Новый взгляд на проблему послеоперационной когнитивной дисфункции // Острые и неотложные состояния в практике врача. — 2008. — № 5-6. — С. 64-68.
19. Косарев В.В., Бабанов С.А. Клиническая фармакология ноотропов // Медицина неотложных состояний. — 2011. — № 5(36). — С. 64-68.
20. Бурчинский С.Г. Ноотропы как фармакологические средства: новые стратегии, новые возможности // Журнал практического врача. — 2003. — № 1. — С. 63-68.
21. Беленичев И.Ф., Сидорова И.В. Тиоцетам — новый церебропротекторный и ноотропный препарат // Новости медицины и фармации. — 2004. — № 13. — С. 3-4.
22. Беленичев И.Ф., Черний В.И., Колесник Ю.М. и др. Рациональная нейропротекция. — Донецк, 2009. — 261 с.
23. Дзяк Л.А., Сирко А.Г., Дозозависимая эффективность тиоцетама в лечении дисциркуляторной энцефалопатии II стадии на фоне атеросклероза сосудов головного мозга // Новости медицины и фармации. — 2006. — № 1–3. — С. 13-14.