Журнал «Травма» Том 12, №3, 2011
Вернуться к номеру
Возможности лечения хронических ишемических ран с обнажением костей стопы
Авторы: Миминошвили О.И., Штутин А.А., Самойленко Д.Г., Донецкий национальный медицинский университет им. М. Горького
Рубрики: Травматология и ортопедия
Версия для печати
Авторами представлен опыт применения раневого покрытия «Промогран» для ингибирования кислых протеиназ, модифицированного культуральной средой 119 для активации факторов роста при лечении гнойно-некротических поражений стопы вследствие хронической артериальной ишемии у 30 больных. Методика позволяет расширить показания к малым ампутациям при ишемических дефектах нижних конечностей с поражением костей и уменьшить количество высоких ампутаций.
Ишемические раны, раневые покрытия.
Среди больных с гнойно-некротическими поражениями стопы на фоне артериальной недостаточности частота остеомиелита костей стопы составляет 41,4 % [1]. Тактика хирурга в отношении костных поражений при артериальной ишемии, особенно при сопутствующем сахарном диабете, однозначно подразумевает остеонекрэктомию или мини-ампутацию, а у многих хирургов подобный диагноз, например, в отношении пяточной кости или костей предплюсны является показанием к ампутации, как минимум, голени [2, 3].
Арсенал средств, применяемых для местного лечения ран в условиях артериальной ишемии конечностей, достаточно широк, и выбор их зависит от фазы раневого процесса [4]. Так, в I фазе (фаза воспаления) используют: протеолитические ферменты, сорбенты, мази на водорастворимой основе, а также целый ряд многокомпонентных раневых покрытий. Это позволяет добиться скорейшего расплавления некротизированных тканей, очищения от них раневого дефекта и перехода раневого процесса во II фазу (фаза регенерации), которая характеризуется развитием грануляционной ткани, постепенно выполняющей раневой дефект. В фазе регенерации главную роль начинают играть эндотелий капилляров и фибробласты. Для III фазы раневого процесса (фаза реорганизации рубца и эпителизации) характерны возникновение волокнистой основы рубца, контракция краев раны и окончательная эпителизация раны. Однако при дефектах кожного покрова ишемического генеза в условиях их длительного существования самостоятельное заживление раны, особенно с обнажением костных структур, может затянуться на долгие месяцы и нередко вообще невозможно.
В таких случаях работа хирургов направлена на скорейшую подготовку раны к пластическому закрытию. В последние годы все сильнее проявляется интерес к применению биосинтезированных материалов (коллаген) и полученных методом биотехнологии ауто- и аллогенных культур клеток кожи (фибробластов и кератиноцитов). Это связано с развитием биотехнологии, возможностью быстро нарабатывать достаточное количество клеток in vitro [6].
В последнее время результаты большого количества работ подтверждают роль факторов роста (регуляторных пептидов — тканевых гормонов) в эпителизации ран [7]. Многие факторы роста продуцируются фибробластами и стимулируют как пролиферацию, так и миграцию кератиноцитов, кроме того, они могут ускорять восстановление пораженной дермы. В ряде случаев факторы роста действуют не прямо на эпидермис, а на клетки дермы, стимулируя продуцирование ими других факторов роста и компонентов межклеточного матрикса. Пролиферация клеток усиливается при совместном действии разных факторов роста и особенно в условиях ингибирования кислых протеиназ, активация которых сопровождает длительное существование ишемических ран [8].
Таким образом, возможность применения раневых покрытий на основе использования активации факторов роста патогенетически оправданна.
Целью работы было обоснование применения щадящей остеонекрэктомии и микроампутаций при одновременном использовании комплексных раневых покрытий при длительно незаживающих ранах с обнажением костей стопы на фоне хронической ишемии нижних конечностей в условиях ограничения возможности выполнения реконструктивных сосудистых операций.
Материал и методы
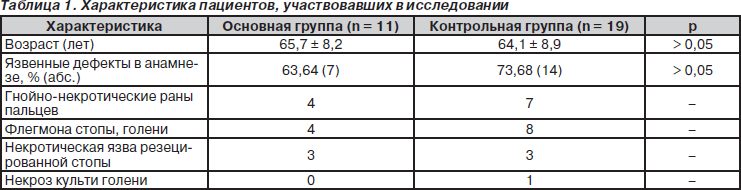
В условиях хирургической клиники им. В.М. Богославского ИНВХ им. В.К. Гусака НАМН Украины проанализирован опыт лечения 30 больных с ранами при субкомпенсированной и критической ишемии нижних конечностей с применением предложенного способа модификации в культивационной среде 119 покрытия «Промогран». В исследование включены 11 пациентов (основная группа) и 19 (контрольная группа) пациентов, лечившихся в клинике с использованием традиционного лечения ран, в том числе и для подготовки к пластическому закрытию (табл. 1). Двадцать три (76,67 %) пациента — люди в возрасте от 55 до 74 лет, у 13 (43,33 %) отмечалась артериальная гипертензия, у 22 (73,33 %) — облитерирующий атеросклероз сосудов нижних конечностей, у 8 (26,67 %) — диабетическая стопа.
Визуализация артерий нижних конечностей при дуплексном сканировании выявила, что в большинстве наблюдений магистральный тип кровотока был сохранен на бедре, в бедренно-подколенном сегменте — 23 (76,67 %) пациента, однако наблюдалось снижение его скоростных характеристик (магистрально-измененный кровоток). На уровне подколенно-тибиального сегмента магистральный и магистрально-измененный кровоток был сохранен у 17 больных (56,67 %). Кровоток по передней и задней большеберцовым артериям определялся у 10 (33,33 %) и не определялся у 20 (66,67 %) пациентов. На тыльной артерии стопы кровоток определялся у 13 человек (43,33 %), у остальных 17 больных (56,67 %) он отсутствовал. Состояние ран оценивали визуально при перевязках, проводили планиметрию ран, цитологическое исследование, бактериологическое исследование — посевы раневого отделяемого для определения микрофлоры и ее чувствительности к антибиотикам, определение количества микробных тел в 1 г ткани раны. Для контроля динамики состояния выполняли общеклинические и биохимические анализы крови. У пациентов контрольной группы местное лечение ран проводили по общепринятым методикам, в зависимости от стадии раневого процесса. По показаниям выполнялись операции, направленные на санацию гнойного очага. Проводили перевязки с ферментными препаратами, мазями на водорастворимой основе, сорбентами. Из физических методов санации использовали ультразвуковую кавитацию. В общем лечении — антибактериальная терапия, реологическая терапия, симптоматическое лечение.
В ранах присутствовала смешанная аэробно-анаэробная флора в 83,33 % случаев, аэробная — в 16,67 %. Ассоциации микроорганизмов в гнойном очаге носили поливалентный характер. Критерием готовности раны к применению пластического закрытия ран являлся переход во II фазу раневого процесса: очищение от некротических тканей, отсутствие патогенной микрофлоры в раневом отделяемом (менее 105 в 1 г ткани). Изучалась коллагенолитическая активность в сыворотке крови и клеточном гомогенате.
Результаты и их обсуждение
Все этапы хирургического лечения включали в себя элементы, обеспечивающие возможность выполнения восстановительных операций. Направление разрезов планировали с учетом сложной анатомической структуры стопы: кровоснабжения тканей, локализации и распространенности гнойно-некротического очага, перспектив возможного формирования различных лоскутов для закрытия образующихся раневых дефектов. Хирургическая подготовка раны на стопе к пластическому закрытию ввиду формирования обширных раневых дефектов требовала учета возможности ее афункциональности, риска реинфицирования.
В результате хирургического лечения, заключавшегося в санации гнойных очагов (экзартикуляция пальцев, некрэктомия, вскрытие и дренирование), удалось достигнуть уменьшения микробной контаминации, однако, учитывая невозможность первично-радикального пособия, в ранах сохранялась достаточно высокая степень обсемененности, что требовало продолжения антибактериальной терапии и интенсификации местного лечения. Применение метода УЗ-кавитации приводило к более быстрому переходу воспалительной фазы раневого процесса в репаративную за счет вымывания фибрина, некротически измененных тканей и экссудата из труднодоступных участков раны с минимальной травматизацией здоровых тканей. Такая динамика раневого процесса объясняется еще и тем, что при кавитации происходит улучшение регионарной микрогемодинамики.
На сегодняшний день механизм действия аллогенных клеток до конца не изучен, но их успешное использование при лечении трофических язв вследствие артериальной недостаточности нижних конечностей позволяет предположить, что аллогенные фибробласты могут продуцировать коллагены 1-го и 3-го типов и компоненты внеклеточного матрикса: ламинин, нидоген, тенасцин, хондроитин-4-сульфат протеогликан, фибронектин; некоторые факторы роста, факторы, стимулирующие адгезию к коллагену и миграцию кератиноцитов.
Покрытие «Промогран» вызывает необратимую инактивацию избыточного количества протеаз и в то же время оказывает защитное действие в отношении эндогенных факторов роста. Подготовленный в культуральной среде 119 «Промогран» накладывали как покрытие после проведения некрэктомии и остеонекрэктомии. При нахождении «Промограна» в ране протеазы остаются инактивированными, а тканевые факторы роста вместе с факторами роста фибробластов, содержащимися в культуральной среде, выделяются обратно в рану в активном состоянии. Таким образом, «Промогран» создает благоприятную среду для подготовки хронических ишемических ран и приживления аутодермотрансплантатов.
Вторичной повязкой служило покрытие «Адаптик» и стерильная марлевая салфетка с 1% раствором бетадина. Смену повязки проводили 1 раз в 1–2 дня. Для разгрузки пораженной зоны у пациентов как основной, так и контрольной группы использовалась иммобилизация или разгрузочная повязка (Total Contact Cast).
Основным параметром оценки эффективности избрана скорость очистки раны от некроза в 1 см2 за сутки наблюдения. Скорость очищения ран от некрозов в основной группе по сравнению с группой контроля была достоверно выше и составила –0,14 ± 0,02 см2/сут и –0,07 ± 0,03 см2/сут соответственно при p < 0,05. Срок подготовки к аутодермотрансплантации в основной группе составил 3–7 суток, в то время как в контрольной группе начало пластического закрытия дефекта отодвигалось в среднем до 8–13 суток.
У пациентов обеих групп до начала лечения отмечен высокий уровень коллагеназной активности как в клеточном гомогенате (в 1-й группе 48,5 ± 17,3 нг/мг, во 2-й группе — 50,1 ± 12,5 нг/мг), так и в сыворотке крови (в 1-й группе 272,1 ± 12,3 нг/мг, 288,5 ± 19,5 нг/мг — во 2-й группе). Через 3 недели лечения обследование показало достоверное снижение коллагенолитической активности в сыворотке крови больных основной группы: 172,1 ± ± 12,3 нг/мг против 291,5 ± 17,5 нг/мг (р < 0,05).
Удалось сохранить нижнюю конечность за счет выполнения усечений на уровне стопы 23 больным (76,67 %): все больные 1-й группы и 12 больных (63,16 %) 2-й группы, причем только у 7 (23,33 %) пациентов послеоперационные раны после малых ампутаций зажили первичным натяжением. У остальных после вскрытия затеков и дистальных ампутаций на уровне стопы образовались незаживающие дефекты тканей с обнажением глубоких субфасциальных структур, потребовавших аутодермотрансплантации. Хорошее приживление более 80 % аутотрансплантатов кожи было у всех, кроме одного пациента в основной группе, а в группе контроля у 8 (42,11 %) потребовались дополнительные оперативные вмешательства по очищению и закрытию ран. Во 2-й группе высокие ампутации в течение года наблюдения выполнены на уровне голени у 2 (10,53 %), на уровне бедра — у 5 (26,32 %). С критической ишемией высокие ампутации произведены у 6 пациентов (31,57 %), а среди больных без критической ишемии — в одном наблюдении (5,26 %).
Таким образом, использование современных биотехнологий модификации и активных раневых покрытий позволяет расширить показания к малым ампутациям при ишемических дефектах нижних конечностей с поражением костей и уменьшить количество высоких ампутаций.
Грекова Н.М. Хирургия диабетической стопы / Н.М. Грекова, В.Н. Бордуновский. — М.: Медпрактика, 2009. — 187 с.
Земляной А.Б., Жуков А.О., Оруджева С.А. Комплексное хирургическое лечение гнойно-некротических форм синдрома диабетической стопы / А.Б. Земляной, А.О. Жуков, С.А. Оруджева // Инфекции в хирургии. — 2008. — Т. 6, № 4. — С. 5-13.
Сергеев С.В. Ампутации по вторичным показаниям / С.В. Сергеев // Вестник гильдии протезистов-ортопе- дов. — 2002. — № 1. — С. 19-22.
Михальский В.В. Результаты комплексной терапии у больных с облитерирующими заболеваниями периферических артерий в стадии критической ишемии / В.В. Михальский, С.В. Горюнов, А.И. Ульянина // РМЖ. — 2008. — Т. 16, № 29(339). — С. 2019-2021.
Бігуняк В.В. Технологізація терапії ранового процесу: перспективи розвитку / В.В. Бігуняк, В.В. Дем’яненко, К.С. Волков // Клінічна хірургія. — 2009. — № 11–12. — С. 11-12.
Константинов Б.А. Генно-инженерные технологии в лечении хронической ишемии нижних конечностей / Б.А. Константинов, Н.П. Бочков, А.В. Гавриленко и др. // Вестн. РАМН. — 2006. — Т. 9, № 10. — С. 6-11.
Воронов Д.А. Использование генных индукторов неоангиогенеза в комплексном лечении пациентов с хронической ишемией нижних конечностей: фундаментальные аспекты и клинические результаты / Д.А. Воронов // Кардиология и сердечно-сосудистая хирургия. — 2009. — № 5. — С. 44-48.
Collinson D. Therapeutic angiogenesis in peripheral arterial disease: can biotechnology produce an effective collateral circulation? / D. Collinson, R. Donnelly // Eur. J. Vasc. Endovasc. Surg. — 2004. — Vol. 28. — P. 9-23.