Журнал «Болезни и антибиотики» 2 (05) 2011
Вернуться к номеру
Лечение внебольничных пневмоний у детей старше 3 месяцев. Рекомендации Общества педиатрических инфекций и Общества инфекционистов Америки
Рекомендации по ведению детей с внебольничными пневмониями (ВП) подготовлены Американскими Обществами педиатрических инфекций и инфекционистов. Главной целью создания этого документа было снижение заболеваемости и смертности у данного контингента пациентов. За рамками рекомендаций осталось ведение детей в возрасте до 3 месяцев, а также детей, находящихся на искусственной вентиляции в домашних условиях, лиц с иммунодефицитами, либо сопутствующими хроническими заболеваниями легких (такими как муковисцидоз и др.).
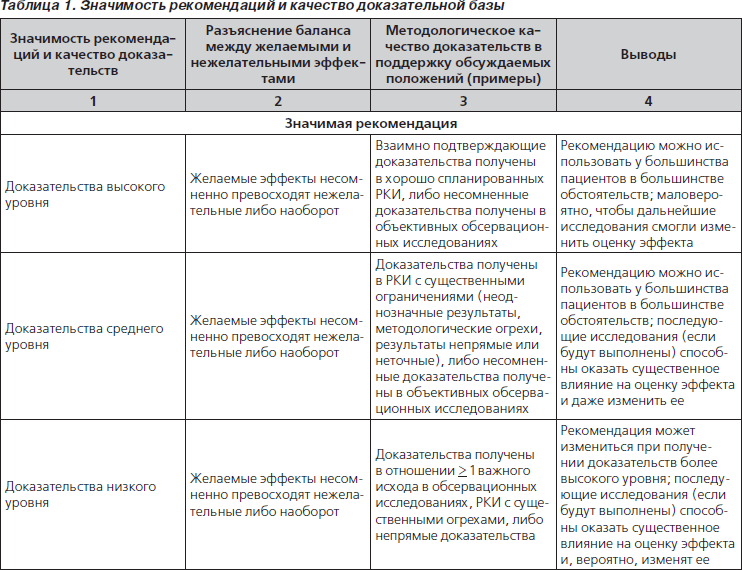
Значимость и обоснованность рекомендаций оценивались в соответствии с критериями, принятыми Обществом инфекционистов Америки (табл. 1). В данной публикации изложены основные положения документа.
Принятие решения о месте лечения пациента
I. Когда следует госпитализировать ребенка с ВП?
Рекомендации
1. Детей со среднетяжелой и тяжелой ВП, подтвержденной рядом факторов, включая респираторный дистресс и гипоксемию (насыщение крови кислородом (SpO2) стабильно < 90 % на уровне моря — см. Критерии респираторного дистресса), следует госпитализировать (значимая рекомендация; доказательства высокого уровня).
2. Детей в возрасте до 3–6 месяцев с подозрением на бактериальную пневмонию, по-видимому, лучше госпитализировать (значимая рекомендация; доказательства низкого уровня).
3. Детей с предполагаемой или документированной ВП, вызванной возбудителями с повышенной вирулентностью, такими как внебольничные метициллинорезистентные Staphylococcus aureus (MRSA), следует госпитализировать (значимая рекомендация; доказательства низкого уровня).
4. Следует госпитализировать детей, если имеются сомнения в возможности тщательного наблюдения за ними на дому, в соблюдении ими предписанного режима терапии, либо при невозможности последующего наблюдения (значимая рекомендация; доказательства низкого уровня).
Критерии респираторного дистресса у детей с пневмонией
1. Тахипноэ, частота дыхательных движений в минуту:
— возраст 0–2 мес.: > 60;
— возраст 2–12 мес.: > 50;
— возраст 1–5 лет: > 40;
— возраст > 5 лет: > 20.
2. Диспноэ.
3. Западения (надгрудинные, межреберные или подреберные).
4. Стоны.
5. Раздувание ноздрей.
6. Апноэ.
7. Нарушение психического состояния.
8. Показатели пульсоксиметрии < 90 % при дыхании комнатным воздухом (адаптировано согласно критериям Всемирной организации здравоохранения).
II. Когда ребенка с ВП следует госпитализировать в отделение реанимации и интенсивной терапии (ОРИТ) либо в отделение непрерывного кардиореспираторного мониторирования?
Рекомендации
5. Ребенка следует госпитализировать в ОРИТ, если он нуждается в инвазивной вентиляции через непостоянные искусственные воздушные пути (например, эндотрахеальную трубку) (значимая рекомендация; доказательства высокого уровня).
6. Ребенка следует госпитализировать в ОРИТ либо в отделение непрерывного кардиореспираторного мониторирования, если он срочно нуждается в неинвазивной вентиляции с положительным давлением (значимая рекомендация; доказательства очень низкого уровня).
7. Ребенка следует госпитализировать в ОРИТ либо в отделение непрерывного кардиореспираторного мониторирования, если ему угрожает развитие дыхательной недостаточности (значимая рекомендация; доказательства среднего уровня).
8. Ребенка следует госпитализировать в ОРИТ либо в отделение непрерывного кардиореспираторного мониторирования при наличии у него стойкой тахикардии, неадекватного артериального давления, либо если он нуждается в фармакологической коррекции артериального давления или перфузии (значимая рекомендация; доказательства среднего уровня).
9. Ребенка следует госпитализировать в ОРИТ, если показатели пульсоксиметрии Ј 92 % при фракции кислорода во вдыхаемом воздухе і 0,50 (значимая рекомендация; доказательства низкого уровня).
10. Ребенка следует госпитализировать в ОРИТ либо в отделение непрерывного кардиореспираторного мониторирования при нарушениях психического состояния, обусловленных гиперкапнией или гипоксемией вследствие пневмонии (значимая рекомендация; доказательства низкого уровня).
11. Подсчет индексов тяжести не следует использовать в качестве единственного критерия для госпитализации в ОРИТ, но их следует использовать вместе с другими клиническими, лабораторными и рентгенологическими данными (значимая рекомендация; доказательства низкого уровня).
Диагностические исследования у детей с ВП
III. Какие диагностические лабораторные и визуализирующие исследования следует использовать у детей при подозрении на ВП в амбулаторных условиях и в стационаре?
Рекомендации
Микробиологические исследования
Культуральное исследование крови у амбулаторных больных
12. Посев крови не следует рутинно производить у полностью привитых детей с ВП, у которых нет явлений интоксикации и которые лечатся амбулаторно (значимая рекомендация; доказательства среднего уровня).
13. Культуральное исследование крови следует произвести у детей, у которых после начала антибиотикотерапии не наступило клиническое улучшение, либо симптоматика прогрессирует, а клиническое состояние ухудшается (значимая рекомендация; доказательства среднего уровня).
Культуральное исследование крови у госпитализированных больных
14. Культуральное исследование крови следует произвести у детей, госпитализированных в связи с подозрением на среднетяжелую или тяжелую бактериальную ВП, в особенности при наличии осложнений (значимая рекомендация; доказательства низкого уровня).
15. Если у больного наступило улучшение и он удовлетворяет другим критериям для выписки, позитивная гемокультура в ожидании результатов идентификации возбудителя или его чувствительности к антибиотикам, как правило, не должна препятствовать выписке ребенка, получающего адекватную антимикробную терапию внутрь или парентерально. Больного можно выписать, если гарантировано последующее наблюдение за ним (малозначимая рекомендация; доказательства низкого уровня).
Последующие посевы крови
16. У детей с отчетливым клиническим улучшением нет необходимости проводить повторные посевы крови для подтверждения устранения пневмококковой бактериемии (малозначимая рекомендация; доказательства низкого уровня).
17. Повторные культуральные исследования крови для доказательства устранения бактериемии следует производить у детей с бактериемией, вызванной S.aureus, независимо от клинического состояния (значимая рекомендация; доказательства низкого уровня).
Окраска по Граму и культуральное исследование мокроты
18. У госпитализированных детей, отхаркивающих мокроту, следует взять образцы мокроты для окраски по Граму и культурального исследования (малозначимая рекомендация; доказательства низкого уровня).
Определение антигенов в моче
19. Для постановки диагноза пневмококковой пневмонии определение антигенов в моче не рекомендуется; ложноположительные результаты встречаются нередко (значимая рекомендация; доказательства высокого уровня).
Определение вирусов
20. При обследовании детей с ВП следует использовать чувствительные и специфичные тесты для быстрого выявления вируса гриппа и других респираторных вирусов. Обнаружение вируса гриппа может сократить потребность как в дополнительных диагностических исследованиях, так и в использовании антибиотиков и, с другой стороны, способствовать разумному использованию противовирусных препаратов в амбулаторных условиях и у госпитализированных больных (значимая рекомендация; доказательства высокого уровня).
21. Детям (и в амбулаторных условиях, и в стационаре) с положительными результатами теста на определение вируса гриппа не следует назначать антибиотики в отсутствие клинических, лабораторных и рентгенологических признаков бактериальной коинфекции (значимая рекомендация; доказательства высокого уровня).
22. Обнаружение респираторных вирусов, отличных от вируса гриппа, способно изменить лечение детей с предполагаемой пневмонией, поскольку таким больным в отсутствие клинических, лабораторных и рентгенологических признаков бактериальной коинфекции антибактериальные препараты обычно не нужны (малозначимая рекомендация; доказательства низкого уровня).
Определение атипичных бактерий
23. Детей с признаками возможной микоплазменной инфекции следует протестировать на предмет обнаружения Mycoplasma pneumoniae, что поможет при выборе антибиотиков (малозначимая рекомендация; доказательства среднего уровня).
24. Не рекомендуются диагностические исследования для выявления Chlamydophila pneumoniae — ввиду отсутствия в настоящее время достоверных и легкодоступных тестов (значимая рекомендация; доказательства высокого уровня).
Вспомогательные диагностические исследования
Клинический анализ крови
25. Нет необходимости в рутинном выполнении клинического анализа крови у всех детей с предполагаемой ВП, которые лечатся в амбулаторных условиях. Однако у детей с более тяжелым заболеванием этот анализ может оказаться полезным для оптимизации лечения (малозначимая рекомендация; доказательства низкого уровня).
26. У больных с тяжелой пневмонией следует провести развернутый клинический анализ крови и интерпретировать его в контексте результатов клинического исследования и других лабораторных и визуализирующих исследований (малозначимая рекомендация; доказательства низкого уровня).
Острофазовые реагенты
27. Острофазовые реагенты, такие как скорость оседания эритроцитов (СОЭ), С-реактивный белок (СРБ) либо концентрация прокальцитонина в плазме крови, не могут использоваться в качестве единственных параметров, позволяющих дифференцировать вирусные и бактериальные ВП (значимая рекомендация; доказательства высокого уровня).
28. Острофазовые реагенты не следует рутинно определять у полностью привитых детей с ВП, которые лечатся в амбулаторных условиях, хотя при более тяжелых заболеваниях их определение может оказаться полезным (значимая рекомендация; доказательства низкого уровня).
29. При среднетяжелых и тяжелых заболеваниях, как, например, у больных, нуждающихся в госпитализации, или при возникновении осложнений, связанных с пневмонией, острофазовые реагенты можно использовать в совокупности с клиническими данными для оценки ответа на лечение (малозначимая рекомендация; доказательства низкого уровня).
Пульсоксиметрия
30. Пульсоксиметрию следует проводить у всех детей с пневмонией и предполагаемой гипоксемией. Выявление гипоксемии будет определяющим для решения о месте лечения пациента и последующих диагностических исследованиях (значимая рекомендация; доказательства среднего уровня).
Рентгенография органов грудной клетки
Начальная рентгенография органов грудной клетки: амбулаторные условия
31. Рутинная рентгенография органов грудной клетки не является необходимой для подтверждения предполагаемой нетяжелой ВП у детей, которые могут лечиться в амбулаторных условиях (после осмотра в кабинете врача, поликлинике или в приемном покое стационара) (значимая рекомендация; доказательства высокого уровня).
32. Рентгенографию органов грудной клетки в переднезадней и боковой проекциях следует провести у больных с предполагаемой или документированной гипоксемией либо тяжелым респираторным дистрессом (см. Критерии респираторного дистресса), а также у детей, у которых стартовая антибактериальная терапия оказалась неэффективной — для верификации наличия или отсутствия осложнений пневмонии, в том числе парапневмонических выпотов, некротизирующей пневмонии и пневмоторакса (значимая рекомендация; доказательства среднего уровня).
Начальная рентгенография органов грудной клетки: стационар
33. Рентгенографию органов грудной клетки (в переднезадней и боковой проекциях) следует провести у всех госпитализированных детей с ВП для подтверждения наличия, характера и размеров паренхиматозных инфильтратов и идентификации осложнений пневмонии, которые могут привести к вмешательствам, выходящим за рамки антимикробной и поддерживающей медикаментозной терапии (значимая рекомендация; доказательства среднего уровня).
Повторная рентгенография органов грудной клетки
34. Повторные рентгенографические исследования органов грудной клетки обычно излишни у детей, выздоровевших без осложнений после эпизода ВП (значимая рекомендация; доказательства среднего уровня).
35. Повторные рентгенографические исследования органов грудной клетки следует проводить у детей, у которых отсутствует клиническое улучшение, у больных с прогрессирующими симптомами или клиническим ухудшением в течение 48–72 ч после начала антибактериальной терапии (значимая рекомендация; доказательства среднего уровня).
36. Детям с пневмонией, осложненной парапневмоническим выпотом, не рекомендуется рутинная ежедневная рентгенография органов грудной клетки после установки дренажа или торакоскопического хирургического вмешательства под визуальным контролем (ТХВВК) — если они остаются клинически стабильными (значимая рекомендация; доказательства низкого уровня).
37. Повторные рентгенографические исследования органов грудной клетки следует проводить у детей с осложненной пневмонией, клинически нестабильных или с усугубляющимся респираторным дистрессом, либо с персистирующей лихорадкой, не поддающейся лечению свыше 48–72 ч (значимая рекомендация; доказательства низкого уровня).
38. Повторные рентгенографические исследования органов грудной клетки спустя 4–6 нед. после постановки диагноза ВП следует проводить у детей с рецидивирующей пневмонией, захватывающей ту же самую долю легкого, а также у детей со спадением (коллапсом) доли легкого при первичном рентгенографическом исследовании органов грудной клетки — для исключения анатомической аномалии, новообразований в грудной клетке и аспирации инородного тела (значимая рекомендация; доказательства среднего уровня).
IV. Какие дополнительные диагностические исследования следует использовать у детей с тяжелой или жизнеугрожающей ВП?
Рекомендации
39. У детей, нуждающихся в механической вентиляции легких, во время установки эндотрахеальной трубки врачу следует взять аспират трахеи для окраски по Граму и культурального исследования, а также, при наличии клинических и эпидемиологических показаний, для вирусологического исследования, включая вирус гриппа (значимая рекомендация; доказательства низкого уровня).
40. Получение образцов дли микробиологических исследований при бронхоскопии с помощью защищенных щеток, при бронхоальвеолярном лаваже, с помощью чрескожной аспирации легких или биопсии открытого легкого следует оставить в резерве для детей с обычным уровнем иммунитета с тяжелой ВП, если предпринятые ранее диагностические тесты не дали результата (малозначимая рекомендация; доказательства низкого уровня).
Противоинфекционная терапия
V. Какую противоинфекционную терапию следует проводить ребенку с предполагаемой ВП как в амбулаторных условиях, так и в стационарах?
Рекомендации
Амбулаторные больные
41. Детям дошкольного возраста с ВП антимикробная терапия обычно не требуется, поскольку огромное большинство заболеваний вызывается вирусами (значимая рекомендация; доказательства высокого уровня).
42. Амоксициллин следует использовать в качестве препарата первой линии у ранее здоровых и должным образом вакцинированных детей раннего и дошкольного возраста с нетяжелой ВП предположительно бактериальной этиологии. Амоксициллин проявляет высокую активность в отношение Streptococcus pneumoniae, наиболее значимого инвазивного бактериального возбудителя. В табл. 2 перечислены предпочтительные антибиотики и альтернативные средства для детей с аллергией на амоксициллин (значимая рекомендация; доказательства среднего уровня).
43. Амоксициллин следует использовать в качестве препарата первой линии у ранее здоровых и должным образом вакцинированных школьников и подростков с нетяжелой ВП для воздействия на S.pneumoniae, наиболее значимого инвазивного бактериального возбудителя. При выборе лечения следует также учитывать атипичные бактериальные патогены (например M.pneumoniae) и более редких возбудителей инфекций нижних дыхательных путей, которые упоминаются в разделе обсуждения доказательств (значимая рекомендация; доказательства среднего уровня).
44. Макролидные антибиотики следует назначать для лечения детей (прежде всего школьников и подростков) в амбулаторных условиях при выявлении признаков, совместимых с ВП, вызванной атипичными патогенами. Следует предпринять лабораторные исследования на предмет обнаружения M.pneumoniae, если они доступны в клинически оправданные временные рамки. В табл. 2 перечислены предпочтительные и альтернативные антибиотики для лечения заболеваний, вызванных атипичными возбудителями (малозначимая рекомендация; доказательства среднего уровня).
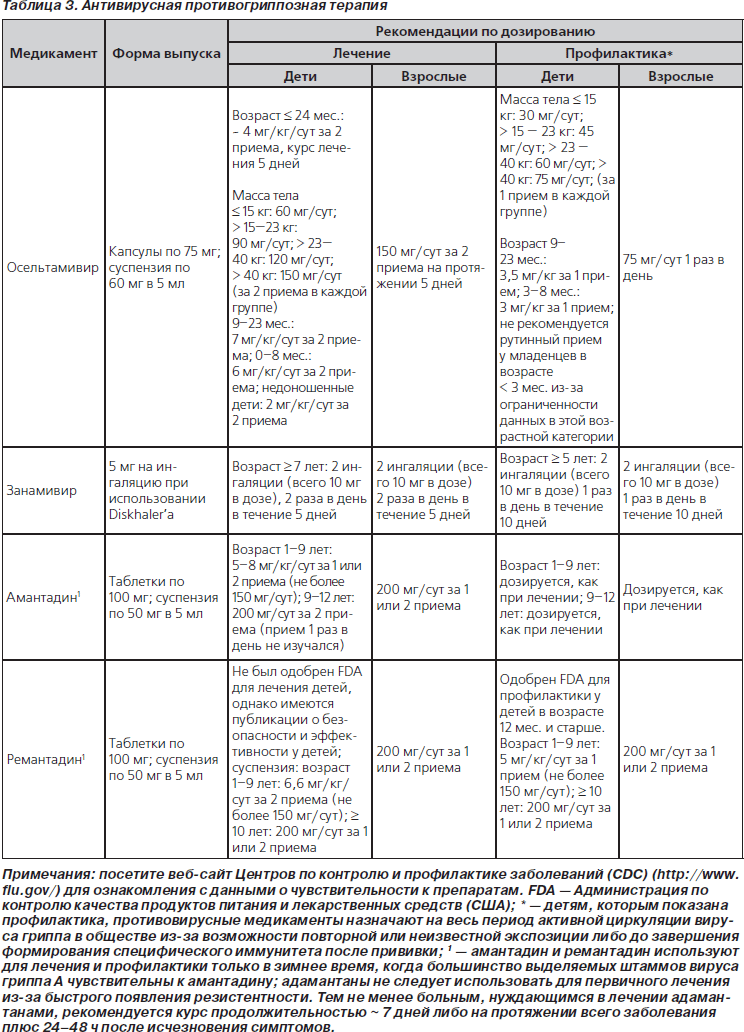
45. Противовирусную терапию в отношении вируса гриппа (табл. 3) следует назначить как можно быстрее детям со среднетяжелой и тяжелой ВП, клинически совместимой с гриппозной инфекцией, во время обширной локальной циркуляции вирусов гриппа, в особенности пациентам с клиническим ухудшением течения заболевания, документированным во время амбулаторного посещения. Поскольку максимальный эффект оказывает ранняя противовирусная терапия, лечение не следует откладывать до подтверждения диагноза с помощью соответствующих тестов. Отрицательные результаты диагностических исследований на выявление вируса гриппа, в особенности тестов на быстрое выявление антигенов, не позволяют окончательно исключить диагноз гриппа. Лечение, начатое спустя 48 ч после появления симптомов инфекции, все еще может принести клиническую пользу больным с более тяжелым течением заболевания (значимая рекомендация; доказательства среднего уровня).
Госпитализированные больные
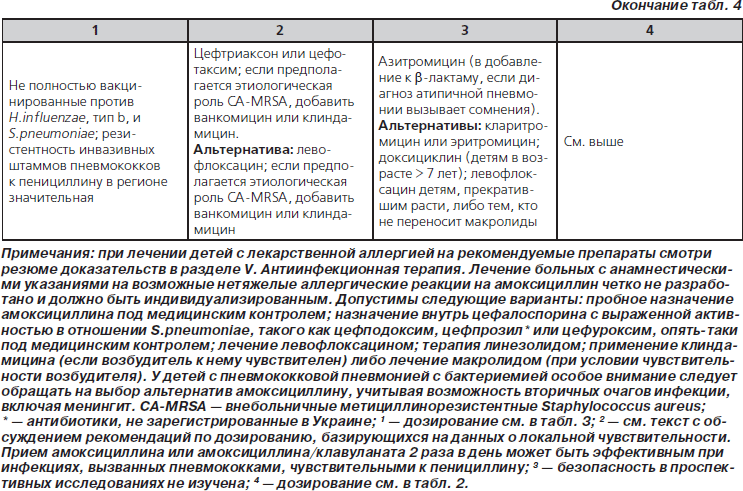
46. У полностью привитых детей дошкольного и школьного возраста, госпитализированных по поводу ВП, следует применять ампициллин или бензилпенициллин, если локальные эпидемиологические данные свидетельствуют о незначительном распространении высокой резистентности к пенициллину среди инвазивных S.pneumoniae. Другие антимикробные средства для эмпирической терапии перечислены в табл. 4 (значимая рекомендация; доказательства среднего уровня).
47. Эмпирическую терапию парентеральными цефалоспоринами III поколения (цефтриаксон или цефотаксим) следует назначить госпитализированным детям, не полностью привитым, проживающим в регионах со значительной распространенностью высокой резистентности к пенициллину среди инвазивных штаммов пневмококков, либо детям с жизнеугрожающими инфекциями, включая больных с эмпиемой (табл. 4). Не-b-лактамные антибиотики, такие как ванкомицин, не превосходят по эффективности цефалоспорины III поколения при лечении пневмококковых пневмоний при распространении резистентности, сопоставимой в настоящее время с таковой в Северной Америке (малозначимая рекомендация; доказательства среднего уровня).
48. Эмпирическую комбинированную терапию b-лактамным антибиотиком и макролидом (внутрь или парентерально) следует назначить госпитализированному ребенку при подозрении на этиологическую значимость M.pneumoniae и C.pneumoniae; следует предпринять диагностические исследования, если они доступны в клинически оправданные временные рамки (табл. 4) (малозначимая рекомендация; доказательства среднего уровня).
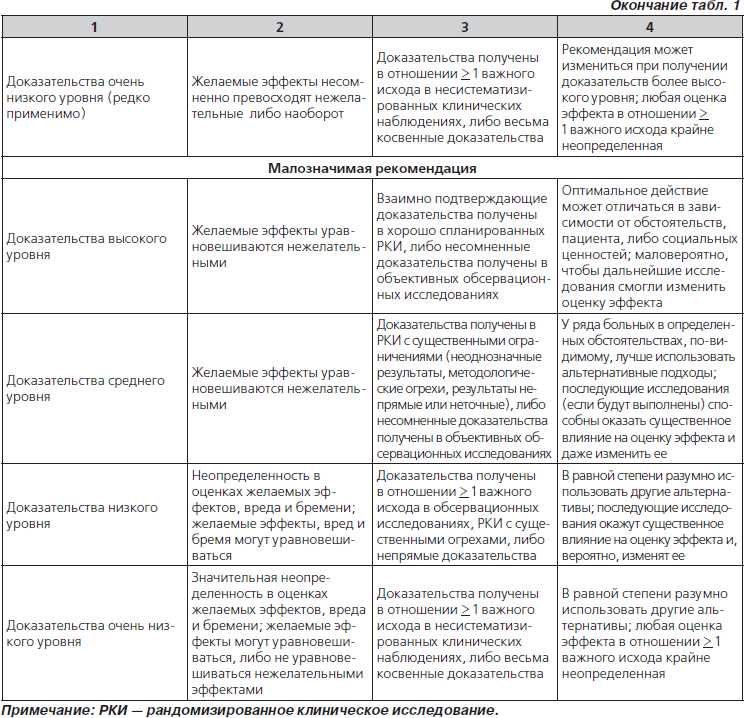
49. К терапии b-лактамом следует добавить ванкомицин или клиндамицин (в соответствии с данными о локальной чувствительности), если клинические, лабораторные или визуализирующие признаки заболевания сопоставимы с инфекцией, вызванной S.aureus (табл. 4) (значимая рекомендация; доказательства низкого уровня).
VI. Как можно минимизировать резистентность к антибиотикам?
Рекомендации
50. Прием антибиотиков способствует появлению резистентности к ним, следовательно, нужно стремиться к ограничению использования любого антибиотика, если это возможно (значимая рекомендация; доказательства среднего уровня).
51. Предпочтительно ограничивать спектр активности антибиотика тем, что необходимо для лечения выделенного возбудителя (значимая рекомендация; доказательства низкого уровня).
52. Важным для снижения развития резистентности является использование адекватных доз антибиотиков для достижения минимальной эффективной концентрации в очаге инфекции (значимая рекомендация; доказательства низкого уровня).
53. Минимальная эффективная длительность лечения будет минимизировать экспозицию и возбудителей, и нормальной микробиоты к антимикробным средствам и минимизировать селекцию резистентности (значимая рекомендация; доказательства низкого уровня).
VII. Какова адекватная длительность антимикробной терапии ВП?
Рекомендации
54. Лучше всего изучены курсы антимикробной терапии длительностью 10 дней, хотя более краткие курсы могут быть столь же эффективными, особенно при заболеваниях легкой степени тяжести, которые лечатся в амбулаторных условиях (значимая рекомендация; доказательства среднего уровня).
55. Инфекции, вызванные некоторыми возбудителями, а именно внебольничными метициллинорезистентными Staphylococcus aureus (CA-MRSA), могут потребовать более длительного лечения по сравнению с пневмококковыми инфекциями (значимая рекомендация; доказательства среднего уровня).
VIII. Как следует оценивать ответ ребенка с ВП на лечение?
Рекомендации
56. У детей, которым назначена адекватная терапия, клинические и лабораторные признаки улучшения наступают в течение 48–72 ч. Детям, чье состояние после госпитализации и начала антимикробной терапии ухудшается, либо у которых не наступает улучшение в течение 48–72 ч, следует провести дополнительное обследование (значимая рекомендация; доказательства среднего уровня).
Дополнительная хирургическая помощь и непротивоинфекционная терапия при педиатрических ВП
IX. Как идентифицируется парапневмонический выпот?
Рекомендации
57. Анамнез и физикальное исследование могут указывать на парапневмонический выпот у больного с предполагаемой ВП, однако для подтверждения наличия жидкости в плевральной полости следует провести рентгенологическое исследование. Если после рентгенологического исследования органов грудной клетки не представляется возможным сделать окончательное заключение, рекомендуется использование других визуализирующих методик — ультразвукового исследования грудной клетки или компьютерной томографии (КТ) (значимая рекомендация; доказательства высокого уровня).
X. Какие факторы имеют значение для определения потребности в дренировании парапневмонического выпота?
Рекомендации
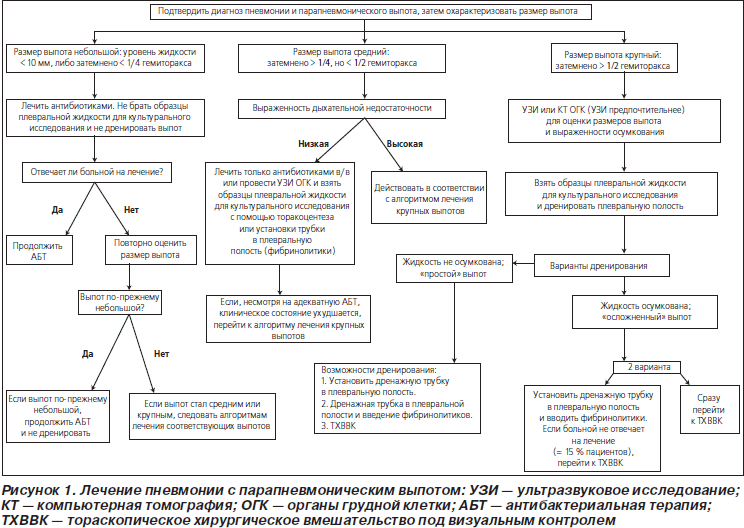
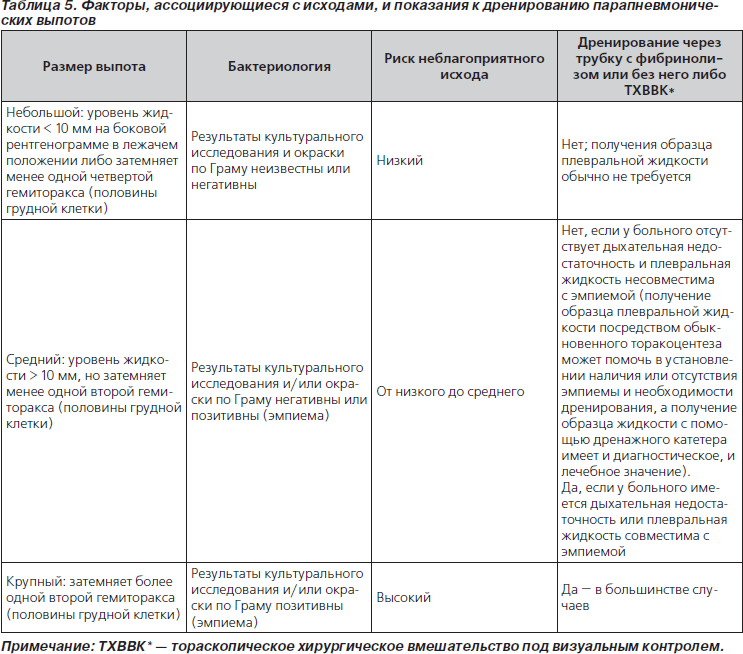
58. Размеры выпота являются важным фактором, определяющим лечение (табл. 5, рис. 1) (значимая рекомендация; доказательства среднего уровня).
59. Выраженность дыхательной недостаточности у ребенка является важным фактором, определяющим лечение парапневмонического выпота (табл. 5, рис. 1) (значимая рекомендация; доказательства среднего уровня).
XI. Какие лабораторные исследования следует выполнить при наличии выпота в плевральной полости?
Рекомендации
60. Всякий раз при получении образца жидкости из плевры следует окрасить его по Граму и провести культуральное исследование плевральной жидкости (значимая рекомендация; доказательства высокого уровня).
61. Определение антигенов или амплификация нуклеиновых кислот посредством полимеразной цепной реакции (ПЦР) увеличивают частоту обнаружения патогенов в плевральной жидкости и могут быть полезными для лечения (значимая рекомендация; доказательства среднего уровня).
62. Анализ ряда параметров плевральной жидкости, таких как pH, концентрация глюкозы, белка, лактатдегидрогеназы, редко влияет на лечение больного и поэтому не рекомендуется (малозначимая рекомендация; доказательства очень низкого уровня).
63. Определение в плевральной жидкости числа лейкоцитов и лейкоцитарной формулы рекомендуется прежде всего для облегчения дифференциальной диагностики между бактериальной и микобактериальной этиологией выпота, а также его опухолевой природой (малозначимая рекомендация; доказательства среднего уровня).
XII. Каким образом можно дренировать парапневмонические выпоты?
Рекомендации
См. табл. 5 и рис. 1.
64. Небольшие неосложненные парапневмонические выпоты не следует рутинно дренировать; их можно лечить с помощью одних только антибиотиков (значимая рекомендация; доказательства среднего уровня).
65. Парапневмонические выпоты средних размеров, ассоциирующиеся с респираторным дистрессом, крупные парапневмонические выпоты либо документированные гнойные выпоты следует дренировать (значимая рекомендация; доказательства среднего уровня).
66. И дренирование плевральной полости через торакостомическую трубку с добавлением фибринолитических средств, и ТХВВК являются эффективными методами лечения. Выбор способа дренирования зависит от квалификации персонала данного лечебного учреждения. Оба перечисленных способа ассоциируются со снижением заболеваемости по сравнению с одним только дренированием плевральной полости через трубку. Однако у больных с выпотами средних размеров и более со свободно смещаемой границей (отсутствие осумкования) установка дренажной трубки в плевральную полость без введения фибринолитиков является разумным первоначальным выбором (значимая рекомендация; доказательства высокого уровня).
XIII. Когда следует рассматривать возможность ТХВВК или открытой декортикации у больных с установленной в плевральной полости дренажной трубкой, получавших или не получавших фибринолитическую терапию?
Рекомендации
67. ТХВВК следует провести при персистировании выпотов средних размеров и более и сохраняющейся дыхательной недостаточности, несмотря на ~ 2–3 дня лечения с установленной в плевральной полости дренажной трубкой и завершенной фибринолитической терапией. Другой возможностью ведения таких детей является открытое удаление некротизированных тканей с декортикацией, однако оно ассоциируется с большей заболеваемостью (значимая рекомендация; доказательства низкого уровня).
XIV. Когда следует удалять дренажную трубку: после первичного дренирования или ТХВВК?
Рекомендации
68. Дренажную трубку можно удалять при отсутствии пневмоторакса и в случае дренирования плевральной жидкости < 1 мл/кг/24 ч, объем которой обычно рассчитывается за последние 12 ч (значимая рекомендация; доказательства очень низкого уровня).
XV. Какая антибактериальная терапия и какой продолжительности показана для лечения парапневмонического выпота/эмпиемы?
Рекомендации
69. Если при культуральном исследовании крови или плевральной жидкости выделен патогенный изолят, для определения антибактериального режима следует использовать результаты определения чувствительности к антибиотикам (значимая рекомендация; доказательства высокого уровня).
70. При культурально-негативных парапневмонических выпотах выбор антибиотиков должен базироваться на рекомендациях по лечению больных, госпитализированных по поводу ВП (см. резюме доказательств к рекомендациям 46–49) (значимая рекомендация; доказательства среднего уровня).
71. Длительность антибактериальной терапии зависит от адекватности дренирования и от клинического ответа на лечение, который индивидуален для каждого больного. У большинства детей адекватная продолжительность антибактериальной терапии 2 — 4 нед. (значимая рекомендация; доказательства низкого уровня).
Ведение ребенка, не отвечающего на терапию
XVI. Каково адекватное ведение ребенка, не отвечающего на терапию ВП?
Рекомендации
72. Детей, не ответивших в течение 48–72 ч на стартовую терапию, следует лечить одним или несколькими нижеследующими способами:
а) провести клиническую и лабораторную оценку тяжести заболевания, чтобы оценить потребность в оказании медицинской помощи более высокого уровня (значимая рекомендация; доказательства низкого уровня).
б) выполнить визуализирующие исследования для оценки выраженности и прогрессирования пневмонического или парапневмонического процесса (малозначимая рекомендация; доказательства низкого уровня).
в) произвести дополнительные исследования для выяснения, продолжает ли персистировать исходный возбудитель, развилась ли у него резистентность к используемому антибиотику, или же появился новый вторичный инфекционный агент (малозначимая рекомендация; доказательства низкого уровня).
73. У ребенка, находящегося на искусственной вентиляции легких, с помощью бронхоальвеолярного лаважа (БАЛ) следует получить образцы для окраски по Граму и культурального исследования (значимая рекомендация; доказательства среднего уровня).
74. У длительно и тяжело больного ребенка, у которого прежние исследования не позволили поставить микробиологический диагноз, с помощью чрескожной аспирации легких следует получить образцы для окраски по Граму и культурального исследования (малозначимая рекомендация; доказательства низкого уровня).
75. У длительно болеющего ребенка, находящегося в критическом состоянии на искусственной вентиляции легких, у которого прежние исследования не позволили поставить микробиологический диагноз, следует получить образцы для окраски по Граму и культурального исследования с помощью биопсии открытого легкого (малозначимая рекомендация; доказательства низкого уровня).
XVII. Как следует лечить ребенка с абсцессом легкого или некротизирующей пневмонией, если он не отвечает на терапию?
Рекомендации
76. Абсцесс легкого или некротизирующая пневмония, установленные у больного, не отвечающего на терапию, сначала можно лечить с помощью внутривенного введения антибиотиков. Полностью сформировавшиеся периферические абсцессы, не связанные с бронхиальным деревом, можно дренировать под контролем визуализирующей техники, либо путем аспирации, либо посредством установки дренажной трубки в нужное место. Тем не менее большинство абсцессов дренируются через бронхиальное дерево и излечиваются без хирургического или интервенционного вмешательства (малозначимая рекомендация; доказательства очень низкого уровня).
Критерии выписки
XVIII. Когда можно без риска выписывать госпитализированного ребенка с ВП?
Рекомендации
77. Больные являются кандидатами на выписку, если у них документировано всестороннее клиническое улучшение, включая уровень активности, аппетит и снижение лихорадки в течение не менее 12–24 ч (значимая рекомендация; доказательства очень низкого уровня).
78. Больные являются кандидатами на выписку, если у них при дыхании комнатным воздухом показатели пульсоксиметрии стабильно > 90 % в течение не менее 12–24 ч (значимая рекомендация; доказательства среднего уровня).
79. Больные являются кандидатами на выписку, если только у них стабильное и/или исходное психическое состояние (значимая рекомендация; доказательства очень низкого уровня).
80. Больные не являются кандидатами на выписку, если у них существенно повышена работа дыхания или имеется стойкая одышка или тахикардия (значимая рекомендация; доказательства высокого уровня).
81. Перед выпиской из стационара следует удостовериться, что больные способны переносить антиинфекционную терапию в домашних условиях, будь она пероральной или внутривенной, и дышать кислородом в домашних условиях, если это необходимо (значимая рекомендация; доказательства низкого уровня).
82. В случаях с детьми раннего возраста, нуждающихся в пероральной антибактериальной терапии в амбулаторных условиях, врачам до выписки следует убедиться, что родители способны применять антибиотики, а дети — адекватно их принимать (малозначимая рекомендация; доказательства очень низкого уровня).
83. Больных с дренажной трубкой в плевральной полости, соответствующих вышеперечисленным критериям, можно выписывать спустя 12–24 ч после удаления дренажной трубки, если отсутствуют признаки клинического ухудшения после удаления трубки либо при рентгенологическом исследовании органов грудной клетки, предпринятом по клиническим показаниям, не выявлено значительного повторного скопления парапневмонического выпота или пневмоторакса (значимая рекомендация; доказательства очень низкого уровня).
84. У детей с ограничениями для оказания медицинской помощи, включая сомнения в возможности тщательного наблюдения на дому, неспособность соблюдения предписанного режима терапии, трудности в контроле за отдаленными результатами, эти проблемы следует выяснить и разрешить до выписки (значимая рекомендация; доказательства очень низкого уровня).
XIX. Когда в амбулаторных условиях в отличие от ступенчатой терапии показана парентеральная терапия?
Рекомендации
85. Амбулаторную парентеральную антибактериальную терапию следует предлагать семьям детей, которые более не нуждаются в квалифицированной медсестринской помощи в отделениях скорой и неотложной медицинской помощи, но у которых очевидна необходимость в продолжении парентеральной терапии (малозначимая рекомендация; доказательства среднего уровня).
86. Амбулаторную парентеральную антибактериальную терапию следует проводить при наличии квалифицированных педиатрических медсестер, выполняющих манипуляции на дому, либо посредством ежедневных внутримышечных инъекций в оборудованном педиатрическом амбулаторном учреждении (малозначимая рекомендация; доказательства очень низкого уровня).
87. Проведение, когда возможно, ступенчатой терапии с переводом больного на прием медикаментов внутрь предпочтительнее амбулаторной парентеральной терапии (значимая рекомендация; доказательства низкого уровня).
Профилактика
XX. Можно ли предупредить педиатрическую ВП?
Рекомендации
88. Для предупреждения ВП детям следует сделать прививки против бактериальных патогенов, включая S.pneumoniae, Haemophilus influenzae типа b и коклюш (значимая рекомендация; доказательства высокого уровня).
89. Всех детей в возрасте і 6 мес., включая подростков, для предупреждения ВП следует ежегодно прививать противогриппозной вакциной (значимая рекомендация; доказательства высокого уровня).
90. Родителей и лиц, ухаживающих за детьми в возрасте < 6 мес., беременных подростков следует привить противогриппозной и противококлюшной вакцинами, чтобы не допустить экспозиции детей к этим инфекциям (значимая рекомендация; доказательства низкого уровня).
91. Заболеваемость пневмококковыми постгриппозными ВП снижается после вакцинации против гриппа (значимая рекомендация; доказательства низкого уровня).
92. Детям группы высокого риска следует проводить иммунопрофилактику против респираторного синцитиального вируса (РСВ) специфическими моноклональными антителами — для снижения риска тяжелой пневмонии и госпитализации, вызванной РСВ (значимая рекомендация; доказательства высокого уровня).
Введение
Эпидемиология
Согласно некоторым оценкам, во всем мире ежегодно насчитывается до 155 млн случаев пневмонии у детей. В развитых странах заболеваемость пневмониями детей в возрасте до 5 лет составляет ~ 3–4 случая на 100 человек в год. В США частота госпитализации детей по поводу внебольничной пневмонии (ВП) наибольшая в возрастной группе < 1 года (912,9 на 100 000 чел.), наименьшая — среди детей 13–18 лет (62,8 на 100 000 чел.).
Ежегодно более 2 млн детей в возрасте до 5 лет умирают от пневмонии, что составляет ~ 20 % всех смертей у детей данной возрастной группы.
Для ВП, которая находится в фокусе представленных рекомендаций, было использовано довольно простое определение: наличие у ранее здорового ребенка признаков и симптомов пневмонии, вызванных инфекцией, приобретенной за пределами больницы.
Этиология
Заболевание вызывают многие инфекционные агенты, главным образом вирусы и бактерии. Для выяснения микробной этиологии ВП использовались различные лабораторные тесты. Например, диагноз пневмококковой ВП базировался на выделении культуры пневмококков из крови, обнаружении пневмококковых антигенов, антител и нуклеиновых кислот. Каждый из методов исследования обладает разной чувствительностью, специфичностью, позитивной и негативной предсказательной значимостью, которые зависят от распространенности возбудителя во время проведения исследования. Поэтому сравнение данных об этиологии пневмонии в опубликованных работах представляет известные трудности.
В более поздних, особенно вирусологических, исследованиях использовались различные чувствительные молекулярные методики, включая определение нуклеиновых кислот. У многих детей с инфекциями нижних отделов дыхательных путей выделяют 2–3 возбудителя, включая сочетания вирусов и бактерий, что затрудняет определение значимости каждого из возбудителей по отдельности. Особенности созревания иммунной системы у детей и связанная с возрастом экспозиция к разным инфекционным агентам диктуют необходимость раздельной для каждой возрастной группы регистрации заболеваемости ВП и возможных возбудителей.
С появлением полисахаридно-белковых конъюгированных вакцин против H.influenzae типа b и 7 серотипов S.pneumoniae (7-валентная пневмококковая конъюгированная вакцина (PCV7)) распространенность инфекций, вызванных этими бактериями, включая ВП, значительно снизилась. В эпидемиологических исследованиях этиологии ВП, проведенных до широкого внедрения этих вакцин, среди бактериальных возбудителей чаще всего обнаруживали S.pneumoniae, на долю которого приходилось 4–44 % всех случаев заболевания.
В некоторых исследованиях у детей в возрасте до 2 лет вирусную этиологию ВП устанавливали почти в 80 % случаев. Напротив, у детей 10–16 лет с пневмонией, подтвержденной клинически и рентгенологически, доля вирусов в этиологии заболевания значительно ниже. Среди вирусов чаще других обнаруживают РСВ (до 40 % всех выявленных возбудителей у детей младше 2 лет, хотя у детей старших возрастных групп он регистрируется редко). Реже выявляются аденовирусы, бокавирусы, метапневмовирусы человека, вирусы гриппа А и B, парагриппа, корона- и риновирусы, причем 2–33 % больных инфицируются одновременно двумя и более вирусами.
В эпидемиологических исследованиях, в которых изучали и вирусных, и бактериальных возбудителей, последние обнаруживались у 2–50 % детей с ВП; в исследованиях у госпитализированных больных, в которые включали обычно более тяжелых пациентов, доля бактериальных возбудителей зачастую выше, чем в исследованиях среди амбулаторных больных.
Возбудители атипичных пневмоний обнаруживаются у 3–23 % детей, причем M.pneumoniae чаще всего выявляют у детей старших возрастных групп, в то время как C.pneumoniae — у детей раннего возраста. Микоплазменная пневмония характеризуется медленным прогрессированием с недомоганием, болями в горле, невысокой лихорадкой и кашлем, возникающим спустя 3–5 дней. В отличие от взрослых больных с пневмониями у детей Legionella spp. обнаруживается крайне редко.
Несмотря на документированные описания ВП, вызванных Mycobacterium tuberculosis и нетуберкулезными микобактериями, распространенность этих тяжелых инфекций в развитых странах мира во много раз ниже, чем вирусных и бактериальных ВП, причем заболевают обычно пациенты из групп высокого риска. Столь же редко у детей с обычным уровнем иммунитета встречаются пневмонии, вызванные грибами родов Histoplasma, Coccidioides, Blastomyces и Cryptococcus, которые не были выявлены в большинстве эпидемиологических исследований у детей. Обсуждение вопросов, связанных с пневмониями микобактериальной и грибковой этиологии, выходит за рамки представленных рекомендаций.
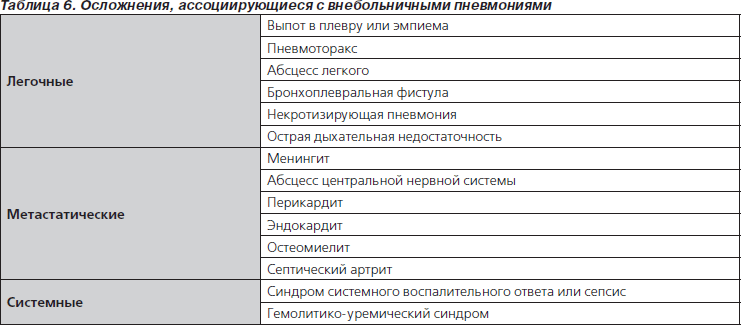
Существует множество аспектов лечения ВП и ее осложнений (табл. 6). Правила ежедневного лечения госпитализированных детей с ВП, включая внутривенное введение жидкостей, кислородотерапию, удаление выделений из респираторного тракта, а также важные экономические и социальные вопросы в данной первой версии рекомендаций по лечению детей с ВП не рассматривались.
Рекомендации по лечению ВП у детей
Принятие решения о месте лечения пациента
I. Когда следует госпитализировать ребенка с ВП?
Рекомендации
1. Детей со среднетяжелой и тяжелой ВП, подтвержденной рядом факторов, включая респираторный дистресс и гипоксемию (насыщение крови кислородом (SpO2) стабильно < 90 % на уровне моря — см. Критерии респираторного дистресса), следует госпитализировать (значимая рекомендация; доказательства высокого уровня).
2. Детей в возрасте до 3–6 месяцев с подозрением на бактериальную пневмонию, по-видимому, лучше госпитализировать (значимая рекомендация; доказательства низкого уровня).
3. Детей с предполагаемой или документированной ВП, вызванной возбудителями с повышенной вирулентностью, такими как внебольничные метициллинорезистентные Staphylococcus aureus (MRSA), следует госпитализировать (значимая рекомендация; доказательства низкого уровня).
4. Следует госпитализировать детей, если имеются сомнения в возможности тщательного наблюдения за ними на дому, в соблюдении ими предписанного режима терапии, либо при невозможности последующего наблюдения (значимая рекомендация; доказательства низкого уровня).
Резюме рекомендаций
Место лечения ребенка определяется врачом на основании результатов осмотра больного и ожидаемого течения заболевания. В то же время данные рентгенологического исследования органов грудной клетки (ОГК), пульсоксиметрии, лабораторных исследований при принятии решения о лечении детей используются врачами по-разному.
В представленных рекомендациях под «простой» пневмонией понимают либо бронхопневмонию (первичное вовлечение дыхательных путей и окружающего интерстиция), либо долевую пневмонию, захватывающую одну долю легкого. «Осложненная» пневмония определяется как инфекция паренхимы легкого, осложненная парапневмоническими выпотами, поражением нескольких долей легкого, абсцессами или полостями, некротизирующей пневмонией, эмпиемой, пневмотораксом или бронхоплевральной фистулой, либо как пневмония, осложняющая заболевание, протекающее с бактериемией и включающее другие очаги инфекции.
Для регионов мира с ограниченными ресурсами Всемирная организация здравоохранения (ВОЗ) определяет пневмонию прежде всего как кашель или затруднение дыхания и скорректированную по возрасту одышку (возраст 2–11 мес.: і 50/мин; 1–5 лет: і 40/мин; і 5 лет: > 20 дыхательных движений в 1 мин). Более того, тяжелая пневмония определяется как кашель или затруднение дыхания плюс один симптом из нижеследующих: втяжение межреберных промежутков в нижней половине грудной клетки, раздувание ноздрей или стонущее дыхание. Очень тяжелая пневмония определяется как кашель или затруднение дыхания плюс один симптом из нижеследующих: цианоз, тяжелый респираторный дистресс, неспособность пить или рвота всем, что поступает в желудок, либо заторможенность/бессознательное состояние/судороги. Такие определения различных степеней тяжести и исследования, призванные оценить эффективность вмешательств при заболеваниях разной степени тяжести, не вполне пригодны для детей, живущих в странах с высоким уровнем доходов.
Если клинические проявления свидетельствуют о тяжелом течении заболевания, большинство экспертов и профессиональных сообществ рекомендуют госпитализировать детей с респираторным дистрессом (см. Критерии респираторного дистресса). Однако до сих пор не были опубликованы сравнительные исследования, выполненные в развитых странах мира, где бы сравнивались исходы заболевания, протекающего с респираторным дистрессом разной степени выраженности, а больные лечились бы амбулаторно или в стационаре. «Токсический внешний вид» — понятие, которое не имеет четкого определения, но включает в себя компоненты, представленные в Критериях респираторного дистресса, и является общепринятым показанием к госпитализации.
В последние десятилетия было опубликовано несколько шкал для решения вопроса о месте лечения взрослого больного с ВП. К сожалению, пригодность этих шкал для использования в педиатрической практике не тестировалась; кроме того, в них не учитываются коморбидные состояния в педиатрии, стадия развития ребенка и психосоциальные факторы, значимые для клинициста при принятии решения о месте лечения ребенка с ВП.
Не существует ни одной валидной шкалы для оценки потребности в госпитализации детей с ВП. Доступные шкалы для оценки риска смерти у детей, госпитализированных в отделения реанимации и интенсивной терапии (ОРИТ), непригодны для детей с менее тяжелыми заболеваниями.
Для оценки тяжести ВП у детей более пригодно простое измерение оксигенации крови с помощью пульсоксиметрии. Гипоксемия — установленный фактор риска неблагоприятного исхода у детей с заболеваниями любого типа, в особенности респираторными болезнями. Поэтому использование пульсоксиметрии для выявления гипоксемии рекомендуется всем больным с пневмониями. У детей с нетяжелой пневмонией (согласно определению ВОЗ), проживающих в развивающихся странах, насыщение крови кислородом (SpO2) < 90 % во время первого визита к врачу позволяет предсказать неэффективность амбулаторного лечения амоксициллином для приема внутрь. У взрослых гипоксемия является индикатором дыхательной недостаточности и указывает на необходимость госпитализации больных с пневмониями в ОРИТ. Кроме того, гипоксемия является независимым фактором, ассоциирующимся с краткосрочной смертностью.
Общепринято мнение о необходимости госпитализации ранее здоровых детей с ВП и насыщением крови кислородом при дыхании комнатным воздухом (на уровне моря) < 90 %, хотя некоторые авторы рекомендуют госпитализировать детей при SpO2 < 93 %. В условиях высокогорья для определения дыхательной недостаточности могут использоваться меньшие величины насыщения кислородом, что было продемонстрировано в Боливии.
Для адекватного определения оксигенации или, напротив, гипоксемии и тяжелой пневмонии существуют также клинические суррогаты. Нормальную оксигенацию обычно характеризуют на основании общей оценки состояния ребенка и его способности успокаиваться. Умеренное или тяжелое нарушение общего состояния является независимым фактором риска смерти у детей, госпитализированных в развивающихся странах по поводу острой инфекции нижних дыхательных путей. Наличие цианоза, который не всегда легко выявить, означает, что у больного тяжелая пневмония. В систематическом обзоре исследований, выполненных преимущественно в развивающихся странах, было установлено, что наибольшей специфичностью среди всех симптомов, позволяющих предсказать гипоксемию у детей, обладает центральный цианоз.
Одышка не является специфическим клиническим симптомом, но может быть маркером респираторного дистресса и/или гипоксемии. Учащенное, по мнению матери, дыхание ребенка, по данным исследования у детей с пневмониями, статистически значимо ассоциируется с гипоксемией. В развивающихся странах установлена связь между увеличением скорректированной по возрасту частоты дыхательных движений или одышкой с клиническими неудачами при лечении детей с тяжелой пневмонией. Хотя у детей раннего возраста с пневмонией одышка может коррелировать с наличием гипоксемии, причинами одышки могут быть лихорадка, обезвоживание, сопутствующий метаболический ацидоз. В исследовании, выполненном в педиатрическом приемном отделении в г. Бостоне (США) среди детей в возрасте < 5 лет, которым производили рентгенологическое исследование ОГК в связи с подозрением на пневмонию, различия в частоте дыхательных движений у больных с документированной пневмонией и детей без пневмонии отсутствовали. Однако у детей с одышкой (в соответствии с определением ВОЗ) пневмония была подтверждена в 20 % случаев, в то время как у детей без одышки — в 12 % случаев.
Значимость втяжений и стонущего дыхания как индикаторов тяжести инфекций нижних дыхательных путей была подтверждена в аргентинском исследовании среди госпитализированных детей. Наличие втяжений — межреберных, надгрудинных или подреберных — указывает на большую тяжесть пневмонии. Установлена статистически значимая связь между раздуванием ноздрей, «качанием головой» и гипоксемией.
Дополнительными аргументами в пользу госпитализации являются обезвоживание, рвота либо невозможность перорального приема медикаментов. Чаще всего нуждаются в госпитализации дети в случае неудачи амбулаторного лечения пероральными антибиотиками, а также при появлении или прогрессировании респираторного дистресса (см. Критерии респираторного дистресса). Более того, может потребоваться госпитализация детей с проблемами психосоциального толка, если имеются сомнения в соблюдении ими предписанного режима терапии, либо при невозможности последующего наблюдения — вне зависимости от причины. Согласно исследованиям, выполненным в США и Канаде, чаще госпитализируются дети с пневмонией, если они имеют низкий социально-экономический статус. Отчасти это может объясняться немедицинскими обстоятельствами, включая недоступность адекватной поликлинической помощи.
Согласно опубликованным сериям наблюдений за детьми с пневмонией, вызванной внебольничными MRSA, у таких пациентов отмечается высокая заболеваемость некротизирующей пневмонией и они чаще нуждаются в госпитализации в ОРИТ. В ретроспективном исследовании у взрослых и детей с ВП, вызванной S.aureus, продуцирующими лейкоцидин Пантона — Валентина, 78 % пациентов нуждались в искусственной вентиляции легких. Если обоснованно предполагается или документирована этиологическая роль внебольничных MRSA, врачу следует госпитализировать ребенка для лечения парентеральными антибиотиками и тщательного наблюдения за больным, даже если респираторные симптомы во время первичного осмотра не расцениваются как тяжелые.
Наличие тяжелых сопутствующих заболеваний также является фактором риска развития пневмонии; в свою очередь, возникновение пневмонии нередко приводит к усугублению сопутствующих заболеваний. По данным исследования в г. Далласе (штат Техас), у 20 % детей, госпитализированных по поводу ВП, имели место сопутствующие заболевания, включая реактивное заболевание дыхательных путей, генетические синдромы и нейрокогнитивные нарушения. В другом исследовании было установлено наличие сопутствующих заболеваний у 36 % детей, госпитализированных с пневмококковыми пневмониями, в том числе иммунологических расстройств, гематологических, кардиальных и хронических легочных заболеваний. Потребность в госпитализации у детей с коморбидным состоянием, больных гриппом, выше, чем у детей без таких сопутствующих заболеваний. Хотя риск пневмонии у детей, страдающих сопутствующими заболеваниями, может быть повышен, эти заболевания чрезвычайно разнообразны, поэтому вопросы специфического лечения сопутствующих болезней не рассматриваются в данных рекомендациях.
Юный возраст является дополнительным фактором риска тяжелого течения пневмонии и потребности в госпитализации. Заболеваемость пневмонией и риск ее тяжелого течения повышен у детей раннего и дошкольного возраста. Так, заболеваемость пневмониями составляет ~ 35–40 на 1000 детей в возрасте < 12 мес., 30–35 на 1000 детей дошкольного возраста (2–5 лет), 15 на 1000 детей школьного возраста (5–9 лет) и 6–12 на 1000 детей старше 9 лет. Более того, у детей раннего и дошкольного возраста пневмония протекает тяжелее, а потребность в госпитализации и риск возникновения дыхательной недостаточности — выше. Одним из независимых факторов риска смерти у детей, госпитализированных в Центрально-Африканской Республике по поводу острых инфекций дыхательных путей, был возраст от 2 до 11 мес. С другой стороны, плохое питание также может вносить свой вклад в тяжесть течения заболевания в развивающихся странах, смягчая выводы о смертности в данной возрастной группе исключительно от заболевания дыхательных путей.
В исследованиях, проведенных в развивающихся странах, установлено, что возраст ребенка является одним из наиболее значимых предикторов неэффективности пероральной антимикробной терапии у детей с тяжелой пневмонией (в особенности у детей < 6 мес.). В развитых странах отсутствуют четкие данные о возрастном пороге, ниже которого для улучшения исходов необходима госпитализация. В США дети с ВП в возрасте до 3 мес. обычно госпитализируются для начала терапии. С учетом повышенного риска заболеваемости при подозрении на бактериальную ВП разумно госпитализировать детей в возрасте до 6 мес.
II. Когда ребенка с ВП следует госпитализировать в отделение реанимации и интенсивной терапии (ОРИТ) либо в отделение непрерывного кардиореспираторного мониторирования?
Рекомендации
5. Ребенка следует госпитализировать в ОРИТ, если он нуждается в инвазивной вентиляции через непостоянные искусственные воздушные пути (например, эндотрахеальную трубку) (значимая рекомендация; доказательства высокого уровня).
6. Ребенка следует госпитализировать в ОРИТ либо в отделение непрерывного кардиореспираторного мониторирования, если он срочно нуждается в неинвазивной вентиляции с положительным давлением (значимая рекомендация; доказательства очень низкого уровня).
7. Ребенка следует госпитализировать в ОРИТ либо в отделение непрерывного кардиореспираторного мониторирования, если ему угрожает развитие дыхательной недостаточности (значимая рекомендация; доказательства среднего уровня).
8. Ребенка следует госпитализировать в ОРИТ либо в отделение непрерывного кардиореспираторного мониторирования при наличии у него стойкой тахикардии, неадекватного артериального давления либо если он нуждается в фармакологической коррекции артериального давления или перфузии (значимая рекомендация; доказательства среднего уровня).
9. Ребенка следует госпитализировать в ОРИТ, если показатели пульсоксиметрии Ј 92 % при фракции кислорода во вдыхаемом воздухе і 0,50 (значимая рекомендация; доказательства низкого уровня).
10. Ребенка следует госпитализировать в ОРИТ либо в отделение непрерывного кардиореспираторного мониторирования при нарушениях психического состояния, обусловленных гиперкапнией или гипоксемией вследствие пневмонии (значимая рекомендация; доказательства низкого уровня).
11. Подсчет индексов тяжести не следует использовать в качестве единственного критерия для госпитализации в ОРИТ, но их следует использовать вместе с другими клиническими, лабораторными и рентгенологическими данными (значимая рекомендация; доказательства низкого уровня).
Резюме рекомендаций
Если ребенок нуждается в госпитализации по поводу ВП, врачу предстоит решить, в какое именно отделение его направить. На решение будут оказывать влияние возможности мониторирования и квалификация медицинского персонала (врачей и медицинских сестер). Адекватный выбор места лечения больного ребенка с одышкой или гипоксемией позволяет оптимизировать ресурсы как ОРИТ, так и общемедицинских палат. При наличии сомнений относительно оптимального места лечения больного, продиктованных тяжестью заболевания (табл. 7), рекомендуется проконсультировать ребенка у педиатра, специализирующегося в области оказания неотложной помощи. Обычно нет необходимости в госпитализации детей с ВП в ОРИТ. Тем не менее в исследовании в г. Далласе (штат Техас) 6,5 % детей, госпитализированных по поводу ВП, нуждались в искусственной вентиляции легких, а 1,3 % детей с ВП умерли, при том что коморбидные состояния были зарегистрированы почти у одной трети больных. Среди детей, у которых ВП была вызвана смешанной бактериальной и вирусной флорой, доля нуждающихся в искусственной вентиляции легких была выше (8,3 %); смертность в этой подгруппе госпитализированных детей составила 5,6 %.
У многих детей с ВП отмечается гипоксемия. Зачастую подача кислорода через носовую канюлю или с помощью лицевой маски позволяет восстановить насыщение крови кислородом в обычной госпитальной палате. Детей, нуждающихся во фракции кислорода во вдыхаемом воздухе (FiO2) і 0,50 для поддержания сатурации > 92 %, следует лечить в отделении непрерывного кардиореспираторного мониторирования. Другие признаки респираторного дистресса и возможной дыхательной недостаточности включают в себя повышенную работу аппарата дыхания (на что указывают втяжения (надгрудинные, подреберные или межреберные), раздувание ноздрей и использование вспомогательных мышц), рецидивирующее апноэ или стонущее дыхание. Наличие стонущего дыхания является признаком тяжелого заболевания и угрожающей дыхательной недостаточности. У детей с повышенной работой аппарата дыхания или выраженным дистрессом, в особенности если ребенок малоподвижен или возбужден, постоянно мониторируют насыщение крови кислородом с помощью пульсоксиметрии.
Клиническое состояние ребенка и его поведение говорят о тяжести заболевания не меньше, чем любой из известных индексов. Использование при поступлении пациента в стационар одних только индексов тяжести заболевания не обеспечивает клиницистов достаточными данными для определения потребности в госпитализации в ОРИТ.
Величина показателя PaO2/FiO2 указывает на выраженность дыхательной недостаточности и нарушения диффузии кислорода и вместе с клиническим осмотром позволяет уточнить тяжесть заболевания. Показатель PaO2/FiO2 следует использовать только при тяжелых ВП, а его интерпретацию предоставить врачу с опытом лечения детей с дыхательной недостаточностью.
Тяжесть заболевания и потребность в госпитализации в ОРИТ отчасти обусловлены этиологией заболевания. В ретроспективном исследовании среди детей, госпитализированных с инвазивной пневмококковой инфекцией, установлено, что если у них одновременно обнаруживали вирусы (грипп, риновирус, аденовирус, респираторный синцитиальный вирус (РСВ)), то такие дети чаще поступали и дольше находились в педиатрических ОРИТ. В двух ретроспективных сериях наблюдений за детьми с ВП, вызванной внебольничными MRSA, зарегистрирована повышенная заболеваемость некротизирующей пневмонией, потребность в госпитализации в ОРИТ и высокая ассоциированная смертность.
Диагностические исследования у детей с ВП
III. Какие диагностические лабораторные и визуализирующие исследования следует использовать у детей при подозрении на ВП в амбулаторных условиях и в стационаре?
Рекомендации
Микробиологические исследования
Культуральное исследование крови у амбулаторных больных
12. Посев крови не следует рутинно производить у полностью привитых детей с ВП, у которых нет явлений интоксикации и которые лечатся амбулаторно (значимая рекомендация; доказательства среднего уровня).
13. Культуральное исследование крови следует произвести у детей, у которых после начала антибиотикотерапии не наступило клиническое улучшение либо симптоматика прогрессирует, а клиническое состояние ухудшается (значимая рекомендация; доказательства среднего уровня).
Культуральное исследование крови у госпитализированных больных
14. Культуральное исследование крови следует произвести у детей, госпитализированных в связи с подозрением на среднетяжелую или тяжелую бактериальную ВП, в особенности при наличии осложнений (значимая рекомендация; доказательства низкого уровня).
15. Если у больного наступило улучшение и он удовлетворяет другим критериям для выписки, позитивная гемокультура в ожидании результатов идентификации возбудителя или его чувствительности к антибиотикам, как правило, не должна препятствовать выписке ребенка, получающего адекватную антимикробную терапию внутрь или парентерально. Больного можно выписать, если гарантировано последующее наблюдение за ним (малозначимая рекомендация; доказательства низкого уровня).
Последующие посевы крови
16. У детей с отчетливым клиническим улучшением нет необходимости проводить повторные посевы крови для подтверждения устранения пневмококковой бактериемии (малозначимая рекомендация; доказательства низкого уровня).
17. Повторные культуральные исследования крови для доказательства устранения бактериемии следует производить у детей с бактериемией, вызванной S.aureus, независимо от клинического состояния (значимая рекомендация; доказательства низкого уровня).
Окраска по Граму и культуральное исследование мокроты
18. У госпитализированных детей, отхаркивающих мокроту, следует взять образцы мокроты для окраски по Граму и культурального исследования (малозначимая рекомендация; доказательства низкого уровня).
Определение антигенов в моче
19. Для постановки диагноза пневмококковой пневмонии определение антигенов в моче не рекомендуется; ложноположительные результаты встречаются нередко (значимая рекомендация; доказательства высокого уровня).
Определение вирусов
20. При обследовании детей с ВП следует использовать чувствительные и специфичные тесты для быстрого выявления вируса гриппа и других респираторных вирусов. Обнаружение вируса гриппа может сократить потребность как в дополнительных диагностических исследованиях, так и в использовании антибиотиков и, с другой стороны, способствовать разумному использованию противовирусных препаратов в амбулаторных условиях и у госпитализированных больных (значимая рекомендация; доказательства высокого уровня).
21. Детям (и в амбулаторных условиях, и в стационаре) с положительными результатами теста на определение вируса гриппа не следует назначать антибиотики в отсутствие клинических, лабораторных и рентгенологических признаков бактериальной коинфекции (значимая рекомендация; доказательства высокого уровня).
22. Обнаружение респираторных вирусов, отличных от вируса гриппа, способно изменить лечение детей с предполагаемой пневмонией, поскольку таким больным в отсутствие клинических, лабораторных и рентгенологических признаков бактериальной коинфекции антибактериальные препараты обычно не нужны (малозначимая рекомендация; доказательства низкого уровня).
Определение атипичных бактерий
23. Детей с признаками возможной микоплазменной инфекции следует протестировать на предмет обнаружения Mycoplasma pneumoniae, что поможет при выборе антибиотиков (малозначимая рекомендация; доказательства среднего уровня).
24. Не рекомендуются диагностические исследования для выявления Chlamydophila pneumoniae — ввиду отсутствия в настоящее время достоверных и легкодоступных тестов (значимая рекомендация; доказательства высокого уровня).
Вспомогательные диагностические исследования
Клинический анализ крови
25. Нет необходимости в рутинном выполнении клинического анализа крови у всех детей с предполагаемой ВП, которые лечатся в амбулаторных условиях. Однако у детей с более тяжелым заболеванием этот анализ может оказаться полезным для оптимизации лечения (малозначимая рекомендация; доказательства низкого уровня).
26. У больных с тяжелой пневмонией следует провести развернутый клинический анализ крови и интерпретировать его в контексте результатов клинического исследования и других лабораторных и визуализирующих исследований (малозначимая рекомендация; доказательства низкого уровня).
Острофазовые реагенты
27. Острофазовые реагенты, такие как скорость оседания эритроцитов (СОЭ), С-реактивный белок (СРБ), либо концентрация прокальцитонина в плазме крови не могут использоваться в качестве единственных параметров, позволяющих дифференцировать вирусные и бактериальные ВП (значимая рекомендация; доказательства высокого уровня).
28. Острофазовые реагенты не следует рутинно определять у полностью привитых детей с ВП, которые лечатся в амбулаторных условиях, хотя при более тяжелых заболеваниях их определение может оказаться полезным (значимая рекомендация; доказательства низкого уровня).
29. При среднетяжелых и тяжелых заболеваниях, как, например, у больных, нуждающихся в госпитализации, или при возникновении осложнений, связанных с пневмонией, острофазовые реагенты можно использовать в совокупности с клиническими данными для оценки ответа на лечение (малозначимая рекомендация; доказательства низкого уровня).
Пульсоксиметрия
30. Пульсоксиметрию следует проводить у всех детей с пневмонией и предполагаемой гипоксемией. Выявление гипоксемии будет определяющим для решения о месте лечения пациента и последующих диагностических исследованиях (значимая рекомендация; доказательства среднего уровня).
Рентгенография органов грудной клетки
Начальная рентгенография органов грудной клетки: амбулаторные условия
31. Рутинная рентгенография органов грудной клетки не является необходимой для подтверждения предполагаемой нетяжелой ВП у детей, которые могут лечиться в амбулаторных условиях (после осмотра в кабинете врача, поликлинике или в приемном покое стационара) (значимая рекомендация; доказательства высокого уровня).
32. Рентгенографию органов грудной клетки в переднезадней и боковой проекциях следует провести у больных с предполагаемой или документированной гипоксемией либо тяжелым респираторным дистрессом, а также у детей, у которых стартовая антибактериальная терапия оказалась неэффективной — для верификации наличия или отсутствия осложнений пневмонии, в том числе парапневмонических выпотов, некротизирующей пневмонии и пневмоторакса (значимая рекомендация; доказательства среднего уровня).
Начальная рентгенография органов грудной клетки: стационар
33. Рентгенографию органов грудной клетки (в переднезадней и боковой проекциях) следует провести у всех госпитализированных детей с ВП для подтверждения наличия, характера и размеров паренхиматозных инфильтратов и идентификации осложнений пневмонии, которые могут привести к вмешательствам, выходящим за рамки антимикробной и поддерживающей медикаментозной терапии (значимая рекомендация; доказательства среднего уровня).
Повторная рентгенография органов грудной клетки
34. Повторные рентгенографические исследования органов грудной клетки обычно излишни у детей, выздоровевших без осложнений после эпизода ВП (значимая рекомендация; доказательства среднего уровня).
35. Повторные рентгенографические исследования органов грудной клетки следует проводить у детей, у которых отсутствует клиническое улучшение, у больных с прогрессирующими симптомами или клиническим ухудшением в течение 48–72 ч после начала антибактериальной терапии (значимая рекомендация; доказательства среднего уровня).
36. У детей с пневмонией, осложненной парапневмоническим выпотом, не рекомендуется рутинная ежедневная рентгенография органов грудной клетки после установки дренажа или торакоскопического хирургического вмешательства под визуальным контролем (ТХВВК), если они остаются клинически стабильными (значимая рекомендация; доказательства низкого уровня).
37. Повторные рентгенографические исследования органов грудной клетки следует проводить у детей с осложненной пневмонией, клинически нестабильных или с усугубляющимся респираторным дистрессом, либо с персистирующей лихорадкой, не поддающейся лечению свыше 48–72 ч (значимая рекомендация; доказательства низкого уровня).
38. Повторные рентгенографические исследования органов грудной клетки спустя 4–6 нед. после постановки диагноза ВП следует проводить у детей с рецидивирующей пневмонией, захватывающей ту же самую долю легкого, а также у детей со спадением (коллапсом) доли легкого при первичном рентгенографическом исследовании органов грудной клетки — для исключения анатомической аномалии, новообразований в грудной клетке и аспирации инородного тела (значимая рекомендация; доказательства среднего уровня).
Резюме рекомендаций
Быстрая и точная идентификация возбудителя ВП позволяет оптимизировать оказание помощи больным, назначить целенаправленную антимикробную терапию, использовать меньшее количество диагностических исследований, а у госпитализированных пациентов — возможно, сократить длительность пребывания в стационаре. К сожалению, для постановки диагноза ВП, в особенности бактериальной ВП, не существует какого-либо одного диагностического теста, который можно было бы рассматривать в качестве стандарта.
Микробиологические исследования
Микробиологические исследования, если они рекомендуются, используют для идентификации возбудителя, чтобы стало возможным назначить антимикробную терапию узкого спектра, направленную на специфические бактерии или вирусы. Идеальной считается терапия насколько возможно узкого спектра, которая почти всегда оказывает наименьшее давление в плане селекции резистентности, сопровождается меньшим числом побочных эффектов и характеризуется меньшей стоимостью.
Культуральное исследование крови у амбулаторных больных
Выделение возбудителя при посеве крови имеет важное клиническое и эпидемиологическое значение. Тем не менее большинство гемокультур, полученных у полностью иммунизированных детей с нетяжелой пневмонией, стерильно. Более того, при культуральном исследовании крови не выделяются многие значимые возбудители пневмоний у детей, в том числе M.pneumoniae и все вирусы. Поэтому посев крови помогает установить этиологию у меньшинства детей с ВП, которые лечатся в амбулаторных условиях.
Большинство современных исследований гемокультур у детей с ВП, которые лечились амбулаторно, были проведены в США после внедрения в клиническую практику конъюгированной вакцины против H.influenzae типа b, но до внедрения противопневмококковой вакцины. В этих исследованиях патогенные бактерии были выделены из крови в < 2 % случаев. В рандомизированном исследовании пневмококковой вакцины позитивные гемокультуры были у < 1 % привитых детей, у которых развилась пневмония. Частота обнаружения истинно-позитивных случаев бактериемии у детей с ВП, леченных амбулаторно, меньше частоты ложнопозитивных гемокультур, зарегистрированных в исследованиях у детей с ВП (1,0–8,2 %) и в исследованиях, в которых оценивали роль культурального исследования крови у лихорадящих детей дошкольного возраста в приемном покое больницы (1,2–2,8 %). Остается неясным, в какой мере данные факты обусловлены приемом антибиотиков до забора крови, нарушениями технологии при проведении культурального исследования крови, недостаточным объемом материала для исследования либо разными комбинациями перечисленных факторов. Количество крови в образце для культурального исследования, которое берется у детей, меньше такового у взрослых. В большинстве опубликованных исследований использовались одобренные FDA (Американская администрация по контролю качества продуктов питания и лекарственных средств) педиатрические диагностические тест-системы для посева крови, ориентированные на использование 2–3 мл крови, однако учитывались и результаты исследований у детей, у которых брали не более 0,5 мл крови.
Культуральное исследование крови у госпитализированных больных
У детей с ВП, нуждающихся в госпитализации, частота выделения возбудителей из крови выше и в большинстве исследований колеблется в пределах от 1,4 до 3,4 %. Однако в исследовании в штате Юта, где использовались строгие критерии диагностики бактериальной ВП, позитивные гемокультуры обнаружены в 11,4 % случаев, причем в половине из них был выявлен S.pneumoniae, серотип 1 (не включенный в 7-компонентную противопневмококковую вакцину (PCV7), но присутствующий в 13-компонентной (PVC13)).
В прежних исследованиях культуральное исследование крови проводили не у всех госпитализированных детей с ВП. Как правило, это исследование выполняли у детей с более тяжелым заболеванием. Следовательно, в прежних исследованиях, по-видимому, преувеличивалась истинная частота бактериемии у детей, госпитализированных с неосложненной ВП. Частота бактериемии у больных с пневмонией, осложненной парапневмоническим выпотом, колебалась от 13,0 до 26,5 %, а у детей с пневмония-ассоциированными осложнениями, включая сепсис и органную дисфункцию, составила 7,8 % (95% доверительный интервал 2,2–18,9 %).
Несмотря на небольшую частоту идентификации патогенов при посеве крови у госпитализированных детей, эта информация важна для выбора антибиотика, активного в отношении возбудителя заболевания. Выбор антибиотиков на основании результатов культуральных исследований может ассоциироваться с улучшением клинических исходов лишь у меньшинства больных детей, как это было показано в исследованиях у взрослых с ВП. Тем не менее, если у взрослых позитивные гемокультуры редко влияют на лечение пациента, в педиатрической практике это происходит чаще. Однако общее влияние посевов крови на лечение детей невелико из-за редкости бактериемии.
Если при посеве крови выделяются непатогенные бактерии-контаминанты (так называемые ложноположительные культуры), результаты исследования могут привести к необоснованному расширению спектра антимикробной терапии. Не всегда легко определить, внесла ли терапия более широкого спектра свой вклад в клиническое улучшение у пациента или привела к неадекватному длительному курсу лечения. Целесообразность получения образцов крови у всех детей, госпитализированных с ВП, с точки зрения анализа стоимость/эффективность остается неизвестной.
Окраска по Граму и культуральное исследование мокроты
Окраска по Граму и культуральное исследование выделяемой мокроты рекомендуется у взрослых, госпитализированных с ВП. Эти исследования нечасто производятся у детей с ВП, поскольку дети не всегда могут предоставить адекватный образец для анализа. Проведение окраски по Граму и культурального исследования выделяемой мокроты рекомендуется у детей старших возрастных групп и подростков с более тяжелым течением заболевания, включая госпитализированных больных и пациентов, у которых амбулаторная терапия оказалась неэффективной. Необходима разработка лучших диагностических тестов, в особенности для детей с нетяжелыми пневмониями, у которых польза от агрессивных, инвазивных диагностических вмешательств может не соответствовать риску для ребенка.
Определение антигенов в моче
У взрослых определение антигенов S.pneumoniae в моче коррелирует с выделением S.pneumoniae из мокроты, поэтому определение антигенов рутинно используется для диагностики пневмококковых пневмоний у взрослых. В одном из исследований у детей с долевой пневмонией результаты определения пневмококковых антигенов в моче были позитивными в 76 % случаев. Тем не менее значимость этих данных неясна, поскольку этиология заболевания не была подтверждена другими исследованиями. Более того, позитивные результаты были зарегистрированы у 15 % лихорадящих детей в отсутствие доказательств инвазивной пневмококковой инфекции. Осталось неизвестным, были эти результаты ложноположительными, обусловленными колонизацией носоглотки пневмококками, истинно положительными — в контексте начального этапа заболевания легких, которое еще не вызвало характерных рентгенологических изменений, или же они ассоциировались со спонтанным разрешением пневмококковой инфекции.
В другом исследовании не выявили существенных различий в доле позитивных результатов определения пневмококковых антигенов в моче (~ 35 %) у детей с пневмониями по сравнению с детьми с дерматитом или диареей, однако позитивные результаты четко ассоциировались с колонизацией пневмококками. Авторы других работ также объясняют позитивные результаты колонизацией носоглотки пневмококками у > 15 % детей. Таким образом, позитивные результаты определения пневмококковых антигенов в моче не позволяют уверенно отличать детей с пневмококковой пневмонией от тех, кто был только колонизирован. В настоящее время недостаточно информации о негативной предсказательной ценности этого теста, чтобы рекомендовать его использование для исключения пневмококкового заболевания.
Определение вирусов
Накоплена существенная доказательная база о низком риске тяжелой бактериальной инфекции у детей с лабораторно подтвержденной вирусной инфекцией. Тем не менее диффузное воспаление нижних дыхательных путей, вызванное вирусами, предрасполагает к бактериальной суперинфекции, что затрудняет исключение сопутствующей бактериальной пневмонии у детей с лабораторно подтвержденными вирусными инфекциями. В одном из исследований у госпитализированных детей с пневмониями вирусно-бактериальная коинфекция была установлена в 23 % случаев.
В рандомизированных клинических и проспективных исследованиях быстрого тестирования на вирус гриппа продемонстрировано значительное уменьшение объема дополнительных исследований и использования антибиотиков у детей, поступавших в приемные покои стационаров во время эпидемий гриппа. В одно из исследований включили 391 пациента (возраст 2 мес. — 21 год) с лихорадкой и гриппоподобным заболеванием. Всем больным произвели быстрое тестирование образцов из носоглотки на наличие вируса гриппа; позитивные результаты были получены в 52 % случаев. Затем больные были рандомизированы таким образом, что лечащий врач либо знал, либо не знал о результатах тестирования на вирус гриппа. Антибиотики были назначены 7,3 % пациентов, о результатах тестирования на вирус гриппа у которых лечащий врач был извещен, по сравнению с 24,5 % пациентов, когда о результатах тестирования лечащему врачу известно не было. Сходные различия были зарегистрированы и в частоте назначения рентгенологического исследования органов грудной клетки (долевых пневмоний не было выявлено ни в одном случае) и других дополнительных тестов.
В другом исследовании 957 детей, поступавших в стационар с гриппоподобным заболеванием, были рандомизированы в группы, где проводилось либо не проводилось быстрое тестирование на вирус гриппа; позитивные результаты установлены у 43 (8,9 %) пациентов. Антибиотики были назначены 32,6 % вируспозитивным пациентам по сравнению с 64,8 % вируснегативными; среди тех детей, которые были рандомизированы в группу, в которой не проводилось тестирование, 61,8 % больных получали антибиотики. Не выявлено различий между группами в частоте рентгенологических исследований органов грудной клетки (ОГК). В ретроспективном когортном исследовании госпитализированных взрослых с лабораторно подтвержденным гриппом положительный результат тестирования на вирус гриппа ассоциировался с в 6 раз большей вероятностью прекращения или отказа от назначения антибиотиков по сравнению с больными гриппом, у которых диагноз был поставлен с опозданием из-за несвоевременного сообщения о результатах полимеразно-цепной реакции (ПЦР).
В открытом рандомизированном контролируемом исследовании дети в возрасте 3–36 мес. были распределены в группы быстрого диагностического тестирования на многие вирусы (с помощью прямого иммунофлюоресцентного анализа (ИФА)) (n = 90) и обычного лечения (n = 110). Как минимум один вирус был выявлен у 66 % больных, рандомизированных в группу тестирования на вирусы. Различия в частоте назначения антибиотиков, рентгенологических исследований ОГК, назначении иных дополнительных исследований между вируспозитивными, вируснегативными или нетестировавшимися больными не достигли статистической значимости.
Тем не менее больные, которым было проведено тестирование на вирусы, реже получали антибиотики, когда обращались за помощью к участковым педиатрам по поводу того же самого заболевания в течение 1 нед. после выписки из приемного отделения стационара.
В ретроспективном обзоре документировано значительное сокращение назначений антибиотиков (внутривенного введения в стационаре и перорального приема при выписке) госпитализированным детям с позитивными результатами тестов на РСВ, вирусы парагриппа 1, 2, 3 либо аденовирусы по сравнению с детьми, у которых результаты тестов были негативными.
При всей значимости позитивных результатов тестирования на вирусы чувствительность и специфичность быстрых тестов на вирусы ниже 100 %, то есть бывают и ложнонегативные, и ложнопозитивные результаты. Чувствительность тестов на вирус гриппа зависит от их типа и способа получения образца для исследования, а применительно к быстрым тестам — может зависеть также от циркулирующего в данный период штамма. Например, чувствительность быстрых тестов на выявление вируса гриппа во время пандемии гриппа H1N1 в 2009 г. была хуже, чем при сезонном гриппе. Среди детей с гриппоподобным заболеванием в условиях документированной циркуляции вируса гриппа в регионе отрицательный быстрый тест на выявление гриппа у ребенка с ВП и симптоматикой, совместимой с заболеванием гриппом, скорее обусловлен недостатками теста, чем позволяет уверенно исключить вирус гриппа из числа патогенов. У детей, больных гриппом, в особенности тех, кто нуждается в искусственной вентиляции легких, первые результаты тестирования образцов из носоглотки на вирус гриппа могут быть отрицательными, даже при использовании ПЦР с обратной транскриптазой. Причинами могут быть плохое качество образца, получение образца из верхних, а не нижних дыхательных путей, длительный промежуток времени от начала заболевания до забора материала. Для постановки диагноза может потребоваться получение нескольких образцов на протяжении нескольких дней. Поскольку наибольшую пользу ребенку приносит раннее начало противогриппозной терапии, врачу следует начинать ее сразу после забора образцов из дыхательных путей для установления диагноза.
У детей вирусные инфекции нижних дыхательных путей (ИНДП) могут ассоциироваться с бактериальными ИНДП. По мнению ряда исследователей, бактериальная пневмония имеет место у і 20 % детей группы низкого риска с документированной ВП, вызванной РСВ, если у них развивается дыхательная недостаточность. В таких случаях возможна эмпирическая антибактериальная терапия на протяжении 24–48 ч, до получения результатов культурального исследования и исключения бактериальной инфекции. В то же время у детей раннего возраста без дыхательной недостаточности и любых других доказательств бактериальной коинфекции применение антибиотиков необоснованно, если у них документирован положительный быстрый тест на определение респираторного вируса.
Определение атипичных бактерий
Истинная роль тестирования и лечения у детей ИНДП, вызванных M.pneumoniae, остается неясной ввиду отсутствия качественных данных о естественном течении заболевания и значимости лечения. Особенно это касается детей младших возрастных групп, поскольку неизвестно, до какой степени лечение подтвержденной микоплазменной инфекции способно улучшить клинические исходы в этой популяции (см. резюме рекомендаций для п. 44). Применительно к лечению ВП у детей следует минимизировать неоправданное использование макролидов, которое может оказаться неадекватным для лечения инфекций, вызванных S.pneumoniae, при том что остается наилучшей формой помощи детям с ВП, вызванными M.pneumoniae. Тестирование на M.pneumoniae наиболее оправданно, если вероятность микоплазменной инфекции до проведения теста является умеренной или высокой. Возраст, при котором следует всерьез предполагать этиологическую значимость M.pneumoniae как возбудителя ВП, четко не определен. Частота серологически подтвержденной значимости M.pneumoniae как причины ИНДП повышается у детей ранних возрастных групп. Тестирование, скорее всего, излишне у детей с низкой вероятностью инфекции M.pneumoniae (например, у детей ранних возрастных групп, у которых симптоматика в большей мере совпадает с первичной вирусной инфекцией верхних дыхательных путей), у которых позитивная предсказательная значимость положительного теста может быть весьма умеренной (т.е. возможны ложноположительные результаты). Пожалуй, тестирование для выбора эмпирической антибиотикотерапии наиболее полезно у детей школьного возраста и подростков с клиникой заболевания, совместимой, но не соответствующей классической инфекции M.pneumoniae. В подобных случаях подтверждение диагноза микоплазменной инфекции указывает на необходимость соответствующего лечения, в то время как отрицательный результат исследования делает диагноз микоплазменной пневмонии маловероятным. Эпидемиологические аспекты микоплазменной инфекции и распространенные тесты для ее выявления суммированы ниже.
Сложный состав питательных сред и медленный рост M.pneumoniae на известных средах затрудняет идентификацию этой бактерии в большинстве лабораторий. Кроме того, результаты культурального исследования на M.pneumoniae недоступны в клинически оправданные промежутки времени. Наличие холодовых антител к эритроцитам в сыворотке больных с первичной атипичной пневмонией — хорошо известный факт. У ~ 75 % взрослых больных с микоплазменной пневмонией в остром периоде заболевания титр холодовых агглютининов < 1 : 64. Поскольку этот тест намного менее изучен у детей, его точность для определения респираторной микоплазменной инфекции неизвестна. Специфичность титра < 1 : 64 низкая, поскольку другие возбудители инфекций дыхательных путей могут провоцировать умеренное повышение холодовых агглютининов. Использование теста на определение титра холодовых агглютининов не соответствует жестким стандартам высокой чувствительности, специфичности и воспроизводимости, которые предъявляются в настоящее время к медицинским диагностическим тестам, и не рекомендуется ни в каких условиях.
Серологические методы включают в себя фиксацию комплемента, иммуносорбентные исследования связывания ферментов (ELISA) и быстрый иммуноферментный анализ. Ферментный анализ требует меньше времени, в связи с чем он в значительной степени заменил в лабораторных условиях тесты с фиксацией комплемента для определения иммуноглобулина (Ig) M. Быстрые серологические тесты обычно дают результаты в течение 10 мин. Прямое сравнение результативности иммуноферментного анализа и ПЦР в силу ряда причин затруднительно, однако ПЦР недоступна и непрактична для кабинетов врача, приемного покоя стационара или районной больницы, где используют доступные в настоящее время тест-системы.
Подводя итог сказанному, можно заключить, что тестирование на выявление микоплазменной инфекции важно для оптимизации использования макролидов у детей. Однако в настоящее время отсутствуют тесты, чувствительность и специфичность которых удовлетворяла бы врачебным потребностям в клинически оправданный промежуток времени. Следовательно, каждому клиницисту следует быть в курсе характеристик тех тестов, которые предлагают локальные лаборатории.
Ни один из множества доступных тестов для идентификации C.pneumoniae не был одобрен FDA для клинического использования. Для этих целей повсеместно использовались серологические исследования — в связи с их относительной простотой. К сожалению, многие из них не удовлетворяют требованиям по качеству; единственное одобренное тестирование — это микроиммунофлюоресценция. При первичной инфекции антитела класса IgM появляются спустя 2–3 нед. после начала заболевания. Антитела класса IgG могут не достигнуть диагностически значимого титра в течение 6–8 нед. после начала заболевания. Таким образом, для подтверждения острой инфекции требуется титр антител IgM 1 : 16 или больше либо 4-кратное увеличение титра антител класса IgG в сыворотке между образцами, полученными в острой фазе и в фазе реконвалесценции. В случае реинфекции антитела класса IgM могут не появиться, а титр антител класса IgG способен быстро повыситься в течение 1–2 нед. от начала повторной инфекции. Титры IgG 1 : 16 и выше совместимы с предшествующей экспозицией к этому возбудителю и наблюдаются примерно у половины взрослых. Следовательно, однократное повышение титра антител класса IgG не подтверждает диагноз инфекции, вызванной C.pneumoniae. Этот микроорганизм либо его ДНК невозможно непосредственно идентифицировать с помощью культурального исследования или ПЦР в образцах из носоглотки или мазках из горла, мокроте, крови или тканях. Таким образом, в настоящее время отсутствуют адекватные тесты для идентификации инфекции, вызванной C.pneumoniae.
Вспомогательные диагностические исследования
Клинический анализ крови
Результаты подсчета числа лейкоцитов и лейкоцитарной формулы могут влиять на лечение больных детей. Наличие лейкоцитоза, анемии или тромбоцитопении может быть признаком гемолитико-уремического синдрома — редкого осложнения пневмококковой пневмонии. Специфичность лейкоцитоза в постановке диагноза бактериальной пневмонии низкая. Хотя лейкоцитоз отмечается у многих детей с бактериальной пневмонией, его выраженность не позволяет отличить вирусную пневмонию от бактериальной.
У некоторых детей с лихорадкой и лейкоцитозом инфильтраты на рентгенограммах ОГК обнаруживают в отсутствие признаков инфекции НДП; значимость подобных находок «скрытой» пневмонии остается неясной. Вопросы «скрытых» пневмоний обсуждаются в резюме доказательств к рекомендации 31.
Острофазовые реагенты
Острофазовые реагенты, включая число лейкоцитов в периферической крови, лейкоцитарную формулу, СОЭ, СРБ и прокальцитонин, не позволяют четко разграничить вирусные и бактериальные инфекции, когда используются как единственный диагностический тест. В одном из исследований, выполненных в Финляндии, было установлено, что лейкоцитоз, СРБ и СОЭ у детей с пневмококковой пневмонией существенно выше, чем у больных с вирусными или атипичными пневмониями. Однако специфичность СРБ > 6,0 мг/дл или СОЭ > 35 мм/ч была всего лишь 26 и 25 % соответственно, хотя и возрастала при сочетании обоих параметров. Позитивная предсказательная ценность вышеуказанных показателей составила 43 и 38 % соответственно. Другая группа финских исследователей выявила широкую вариабельность в показателях лейкоцитоза, СРБ и СОЭ у детей с ВП вирусной и бактериальной этиологии; статистически значимые различия между группами отсутствовали.
Прокальцитонин, хотя и представляет собой многообещающий маркер тяжелых бактериальных инфекций, непригоден для дифференцировки нетяжелых бактериальных и вирусных пневмоний у детей из-за широкого разброса величин. Повышенная концентрация прокальцитонина у детей с документированной вирусной инфекцией позволяет предположить, что у некоторых из них вирусная пневмония в действительности обусловлена вирусно-бактериальной коинфекцией. С другой стороны, низкие величины прокальцитонина могут помочь в дифференцировке вирусных пневмоний и бактериальных пневмоний, ассоциирующихся с бактериемией.
Острофазовые реагенты могут измеряться при поступлении детей в стационар. Снижение СОЭ или концентрации прокальцитонина может коррелировать с улучшением клинической симптоматики и в перспективе — служить объективным показателем разрешения заболевания.
Пульсоксиметрия
Гипоксемия — хорошо известный фактор риска неблагоприятного исхода у детей с системными заболеваниями, в особенности дыхательных путей. Измерение насыщения крови кислородом — простой, достоверный и неинвазивный метод оценки оксигенации артерий. Аргументация в пользу рутинного использования пульсоксиметрии представлена в резюме доказательств к рекомендации 1.
Рентгенография органов грудной клетки (ОГК)
Начальная рентгенография ОГК
Рентгенограммы ОГК не позволяют четко дифференцировать вирусные и бактериальные пневмонии, а также пневмонии, вызванные различными бактериальными возбудителями. Следовательно, рентгенография ОГК не оказывает существенного влияния на клинические исходы. Кроме того, проведение рентгенографии не всегда оправданно. Согласно исследованиям среди детей с подозрением на инфекцию НДП, результаты рентгенографии ОГК приводили к изменению диагноза или назначению/отмене антибиотиков у ~ 25 % больных, осмотренных в амбулатории или приемном покое стационара, но редко влияли на решение о целесообразности госпитализации. В этих исследованиях наименьшую эффективность рентгенографии ОГК отмечали в случаях, когда анамнез и данные объективного исследования были совместимы с диагнозом пневмонии, что указывает на отсутствие необходимости в проведении этого исследования у амбулаторных пациентов, у которых диагноз ВП обоснован клиническими данными.
У ~ 5–19 % детей с лихорадкой обнаруживают инфильтраты на рентгенограммах ОГК в отсутствие одышки, гипоксемии, респираторного дистресса или признаков инфекции НДП. Этот феномен получил название скрытой пневмонии. После внедрения в клиническую практику вакцины против пневмококков доля детей младше 5 лет со скрытой пневмонией снизилась с 15 до 9 %. С повышенной вероятностью скрытой пневмонии ассоциируются следующие клинические признаки: кашель, лихорадка > 5 дней, температура тела > 39 °С и лейкоцитоз (число лейкоцитов в периферической крови > 20•109/л). Данные об исходах заболевания у детей, не получавших лечение антибиотиками, отсутствуют, что не позволяет оценить значимость диагноза скрытой пневмонии. Рентгенографию ОГК следует выполнять больным с длительной лихорадкой и кашлем, даже в отсутствие одышки и респираторного дистресса.
Частота рентгенологически подтвержденной пневмонии среди детей со свистящим дыханием невелика (4,9 %), в особенности в отсутствие лихорадки (2 %). У детей с лихорадкой и свистящим дыханием инфильтраты на рентгенограммах обнаруживают в 6,9 % случаев в отсутствие гипоксемии и 20,6 % — при гипоксемии (документированное насыщение крови кислородом < 92 %). Поэтому у детей со свистящим дыханием в отсутствие лихорадки или гипоксемии рутинное проведение рентгенографии ОГК для верификации пневмонии не рекомендуется.
Иногда доминирующей жалобой детей с ВП, в особенности в возрасте до 5 лет, является боль в животе. Обычно нет необходимости в рутинном проведении рентгенографии ОГК у детей с болями в животе, однако подобное исследование может понадобиться детям с необъяснимой болью в животе, в особенности при сопутствующих одышке, кашле или лихорадке.
Оценка рентгенограмм субъективна, в связи с чем существуют разногласия даже среди экспертов о наличии или отсутствии рентгенологических признаков, которые используются для верификации диагноза ВП. Наименьшие расхождения в отношении рентгенологических признаков пневмонии отмечаются при выявлении альвеолярной консолидации. Идентификация инфильтрата на рентгенограммах ОГК лечащими врачами по сравнению с рентгенологами далеко не всегда влечет за собой значимые различия в лечении и исходах заболеваний. Повсеместное одобрение стандартных определений рентгенологических находок облегчит сравнение будущих исследований у детей с пневмониями. Такие стандарты, в частности, были предложены рабочей группой рентгенологов из числа исследователей вакцин ВОЗ.
Повторные рентгенографии органов грудной клетки
Повторные рентгенографические исследования ОГК обычно излишни у детей, выздоровевших без осложнений после эпизода ВП. Разрешение рентгенологических изменений «запаздывает» по отношению к клиническому выздоровлению. При повторных рентгенологических исследованиях ОГК через 3–6 нед. после первичного исследования персистирующие или остаточные отклонения регистрируются у 10–30 % детей с рентгенологически подтвержденной ВП. Персистирующие отклонения чаще отмечаются у детей с клиническими признаками пневмонии во время повторного рентгенологического исследования (в одном из исследований — почти у 50 %). Тем не менее наличие подобных отклонений редко влияет на лечение пациентов. Исследования у детей с рентгенологическими отклонениями, которые выполнялись бы спустя более продолжительные периоды времени, немногочисленны. В одном из исследований при повторной рентгенографии ОГК спустя 3–7 нед. после эпизода рентгенологически подтвержденной ВП у 59 (30 %) из 196 детей были выявлены остаточные или новые отклонения. Чаще других обнаруживали персистирование интерстициальных инфильтратов или возникновение ателектазов. При повторном обследовании этих детей спустя 8–10 лет не было выявлено никаких заболеваний, которые были бы обусловлены первоначальным эпизодом ВП. В проспективном исследовании у взрослых, госпитализированных по поводу ВП, рентгенографию ОГК повторяли спустя 7 и 28 дней после поступления. В эти сроки соответственно у 75 и 47 % пациентов сохранялись отклонения. Замедленное разрешение рентгенологических отклонений ассоциировалось с мультилобарным поражением, тупостью при перкуссии во время осмотра, большими величинами СРБ и документированной пневмококковой инфекцией. Тем не менее замедленное разрешение рентгенологических отклонений не является показателем неэффективности антимикробной терапии или худшего клинического исхода.
Таким образом, рутинное проведение повторных рентгенологических исследований ОГК не приносит дополнительной клинической пользы, но представляет излишнюю лучевую нагрузку для детей. Отдельным категориям детей могут быть полезны повторные рентгенографии ОГК, например детям со спадением (коллапсом) доли легкого или с рецидивирующей пневмонией, захватывающей ту же самую долю легкого. Заболевание, захватывающее одну и ту же область, может быть обусловлено обструкцией просвета дыхательных путей в этой области, сужением или внешним сдавлением дыхательных путей, аномалиями в паренхиме (например, наличием разного рода масс в грудной клетке, которые могут напоминать пневмонию при визуализирующих исследованиях). Детальное обсуждение рецидивирующих пневмоний выходит за рамки данных рекомендаций.
IV. Какие дополнительные диагностические исследования следует использовать у детей с тяжелой или жизнеугрожающей ВП?
Рекомендации
39. У детей, нуждающихся в механической вентиляции легких, во время установки эндотрахеальной трубки врачу следует взять аспират трахеи для окраски по Грамму и культурального исследования, а также, при наличии клинических и эпидемиологических показаний, для вирусологического исследования, включая вирус гриппа (значимая рекомендация; доказательства низкого уровня).
40. Получение образцов для микробиологических исследований при бронхоскопии, с помощью защищенных щеток, при бронхоальвеолярном лаваже, с помощью чрескожной аспирации легких или биопсии открытого легкого следует оставить в резерве для детей с обычным уровнем иммунитета с тяжелой ВП, если предпринятые ранее диагностические тесты не дали результата (малозначимая рекомендация; доказательства низкого уровня).
Резюме рекомендаций
Многие инфекционные агенты способны вызвать ВП, причем спектр клинических признаков заболевания колеблется от легких до жизнеугрожающих. Врачу, имеющему дело с тяжелыми проявлениями ВП, следует взвешивать пользу от диагностических исследований, направленных на идентификацию специфического возбудителя, и их влияние на лечение заболевания. Целью диагностических исследований является установление этиологии заболевания, для того чтобы избежать излишнего использования антибиотиков и обеспечить оптимальное патоген-ориентированное лечение ребенка.
В педиатрических ОРИТ часто получают трахеальные аспираты из эндотрахеальной трубки с помощью стандартных катетеров для отсасывания содержимого и забора образца. Трахеальные аспираты, полученные вслепую, не всегда позволяют идентифицировать возбудителей, поскольку через катетер могут быть получены микроорганизмы не из инфицированного участка легкого, а те, которые колонизируют эндотрахеальную трубку или трахею. У детей с предполагаемой гриппозной этиологией ВП быстрое проведение ПЦР легочного секрета, полученного через эндотрахеальную трубку, может дать позитивные результаты, в то время как результаты тестирования отделяемого носоглотки оказываются негативными.
Количественные данные можно получить с помощью бронхоальвеолярного лаважа (БАЛ), однако проведение этой процедуры у детей затруднительно из-за малых размеров дыхательных путей, в особенности у младенцев. Гибкие бронхоскопы, в особенности новые ультратонкие бронхоскопы, позволяют получить образцы для исследований у детей, не нуждающихся в интубации, либо у детей с ранее установленной эндотрахеальной трубкой. В целом оптиковолоконная бронхоскопия или БАЛ в интересующей врача области хорошо переносятся детьми, находящимися на искусственной вентиляции легких (ИВЛ). БАЛ не приводит ни к значительному снижению соотношения PaO2/FiO2, ни к усугублению негативного влияния на pH крови или давление углекислого газа в артериальной крови (PaCO2).
В исследовании 25 детей, находящихся на ИВЛ, сначала получали трахеальные аспираты вслепую, а затем проводили БАЛ. Результаты выделения микроорганизмов, полученных с помощью обеих методик, не были конкордантными. Культуральные исследования аспиратов, полученных из трахеи вслепую, были позитивными в 22 из 25 случаев (88 %), в то время как негативные результаты БАЛ получены в 11 из 22 аспират-позитивных случаев (50 %). Только у 4 больных (36 %) микроорганизмы, выделенные с помощью обеих методик, оказались идентичными. По данным авторов исследования, у 50 % детей антимикробная терапия была изменена в соответствии с результатами культурального исследования материала, полученного при бронхоскопии. В другом исследовании у детей с различными диагнозами заболеваний легких позитивные или негативные результаты культурального исследования привели к изменению лечения у 23,4 % больных.
В проспективном исследовании 88 госпитализированных взрослых с ВП вслед за рутинным культуральным исследованием мокроты в течение последующих 8 дней после поступления больного в стационар производили бронхоскопию с забором материала с помощью защищенных щеток, а затем БАЛ. Наиболее чувствительным методом оказался БАЛ (73,8 % позитивных результатов), за ним следовали бронхоскопия с забором материала с помощью защищенных щеток и общепринятый посев мокроты (соответственно 64,7 и 37,5 % позитивных результатов). Превосходство инвазивных методик (бронхоскопии с забором материала с помощью защищенных щеток и БАЛ, последующим количественным микробиологическим исследованием) было документировано и в проспективном рандомизированном исследовании у 413 взрослых больных, находившихся на ИВЛ. Благодаря увеличению результативности микробиологических исследований и возможности проводить более патоген-специфичную терапию удалось снизить частоту использования антибиотиков и смертность. Использование инвазивных методик позволяет снизить число больных, неоправданно получающих антибиотики по поводу колонизации трахеи, и таким образом дает возможность использовать антибиотики более обоснованно.
Стандартные методы забора образцов с помощью защищенных щеток через бронхоскоп нечасто используют у детей на ИВЛ, поскольку для этого требуются бронхоскопы бόльших размеров и, соответственно, бόльшие эндотрахеальные трубки. Однако у детей с помощью защищенного БАЛ, произведенного вслепую, можно получить образцы для количественного и качественного анализа. У детей, находящихся на ИВЛ, не представляет трудностей выполнение этого исследования у постели пациента, а получаемые результаты отличаются хорошей воспроизводимостью. Тем не менее нередко встречаются осложнения, большинство из которых нетяжелые и преходящие, хотя могут быть и тяжелыми (пневмоторакс, требующий дренирования плевральной полости, и повышение внутричерепного давления). В одном из исследований использовали подобную методику у детей в возрасте 7 дней.
Еще одной методикой является получение материала из пораженного участка легких с помощью чрескожной игольчатой аспирации. В Финляндии у 34 детей с ВП проводили аспирацию у постели больного без визуального контроля с помощью КТ. Анализ аспиратов позволил установить этиологический диагноз у 20 (59 %) пациентов (всего были выделены 21 бактерия и 2 вируса). На рентгенограммах ОГК, сделанных после вмешательства, в 18 % случаев выявлен пневмоторакс, ни в одном случае не потребовавший дренирования плевральной полости и полностью разрешившийся у всех пациентов в течение 3 дней. Другую возможность получения образца непосредственно из инфицированной легочной ткани представляет чрескожная игольчатая аспирация под визуальным контролем (КТ или ультразвуковым).
Наконец, у детей с жизнеугрожающими ВП неизвестной этиологии полезной, хотя и сопровождающейся высоким риском диагностической процедурой может быть биопсия открытого легкого или торакоскопическая биопсия легкого. В ретроспективном обзоре у 31 ребенка, которым была произведена биопсия открытого легкого, установлено, что в 76 % случаев результаты исследования привели к соответствующему изменению лечения и в 80 %, после предшествующего неадекватного БАЛ, позволили поставить этиологический диагноз. Следует отметить, что частота осложнений при проведении биопсии открытого легкого составила 45 %, что ограничивает использование этого метода только контингентом больных, находящихся в критических ситуациях.
Противоинфекционная терапия
V. Какую противоинфекционную терапию следует проводить у ребенка с предполагаемой ВП как в амбулаторных условиях, так и в стационарах?
Рекомендации
Амбулаторные больные
41. Детям дошкольного возраста с ВП антимикробная терапия обычно не требуется, поскольку огромное большинство заболеваний вызывается вирусами (значимая рекомендация; доказательства высокого уровня).
42. Амоксициллин следует использовать в качестве препарата первой линии у ранее здоровых и должным образом вакцинированных детей раннего и дошкольного возраста с нетяжелой ВП предположительно бактериальной этиологии. Амоксициллин проявляет высокую активность в отношение Streptococcus pneumoniae, наиболее значимого инвазивного бактериального возбудителя. В табл. 2 перечислены предпочтительные антибиотики и альтернативные средства для детей с аллергией на амоксициллин (значимая рекомендация; доказательства среднего уровня).
43. Амоксициллин следует использовать в качестве препарата первой линии у ранее здоровых и должным образом вакцинированных школьников и подростков с нетяжелой ВП для воздействия на S.pneumoniae, наиболее значимого инвазивного бактериального возбудителя. При выборе лечения следует также учитывать атипичные бактериальные патогены (например, M.pneumoniae) и более редких возбудителей инфекций нижних дыхательных путей, которые упоминаются в разделе обсуждения доказательств (значимая рекомендация; доказательства среднего уровня).
44. Макролидные антибиотики следует назначать для лечения детей (прежде всего школьников и подростков) в амбулаторных условиях при выявлении признаков, совместимых с ВП, вызванной атипичными патогенами. Следует предпринять лабораторные исследования на предмет обнаружения M.pneumoniae, если они доступны в клинически оправданные временные рамки. В табл. 2 перечислены предпочтительные и альтернативные антибиотики для лечения заболеваний, вызванных атипичными возбудителями (малозначимая рекомендация; доказательства среднего уровня).
45. Противовирусную терапию в отношении вируса гриппа (табл. 3) следует назначить как можно быстрее детям со среднетяжелой и тяжелой ВП, клинически совместимой с гриппозной инфекцией, во время обширной локальной циркуляции вирусов гриппа, в особенности пациентам с клиническим ухудшением течения заболевания, документированным во время амбулаторного посещения. Поскольку максимальный эффект оказывает ранняя противовирусная терапия, лечение не следует откладывать до подтверждения диагноза с помощью соответствующих тестов. Отрицательные результаты диагностических исследований на выявление вируса гриппа, в особенности тестов на быстрое выявление антигенов, не позволяют окончательно исключить диагноз гриппа. Лечение, начатое спустя 48 ч после появления симптомов инфекции, все еще может принести клиническую пользу больным с более тяжелым течением заболевания (значимая рекомендация; доказательства среднего уровня).
Госпитализированные больные
46. У полностью привитых детей дошкольного и школьного возраста, госпитализированных по поводу ВП, следует применять ампициллин или бензилпенициллин, если локальные эпидемиологические данные свидетельствуют о незначительном распространении высокой резистентности к пенициллину среди инвазивных S.pneumoniae. Другие антимикробные средства для эмпирической терапии перечислены в табл. 4 (значимая рекомендация; доказательства среднего уровня).
47. Эмпирическую терапию парентеральными цефалоспоринами III поколения (цефтриаксон или цефотаксим) следует назначить госпитализированным детям, не полностью привитым, проживающим в регионах со значительной распространенностью высокой резистентности к пенициллину среди инвазивных штаммов пневмококков, либо детям с жизнеугрожающими инфекциями, включая больных с эмпиемой (табл. 4). Не-b-лактамные антибиотики, такие как ванкомицин, не превосходят по эффективности цефалоспорины III поколения при лечении пневмококковых пневмоний при распространении резистентности, сопоставимой в настоящее время с таковой в Северной Америке (малозначимая рекомендация; доказательства среднего уровня).
48. Эмпирическую комбинированную терапию b-лактамным антибиотиком и макролидом (внутрь или парентерально) следует назначить госпитализированному ребенку при подозрении на этиологическую значимость M.pneumoniae и C.pneumoniae; следует предпринять диагностические исследования, если они доступны в клинически оправданные временные рамки (табл. 4) (малозначимая рекомендация; доказательства среднего уровня).
49. К терапии b-лактамом следует добавить ванкомицин или клиндамицин (в соответствии с данными о локальной чувствительности), если клинические, лабораторные или визуализирующие признаки заболевания сопоставимы с инфекцией, вызванной S.aureus (табл. 4) (значимая рекомендация; доказательства низкого уровня).
Резюме рекомендаций
Результаты тестирования с помощью чувствительной ПЦР большинства детей дошкольного возраста с ВП на респираторные вирусы (такие как риновирус, РСВ, метапневмовирус человека, вирусы парагриппа, гриппа A и B, аденовирус, коронавирус и бокавирус человека) и бактерии (включая S.pneumoniae, H.influenzae и M.pneumoniae) чаще оказываются позитивными на респираторные вирусы, чем на бактерии. При этом следует иметь в виду, что чувствительность молекулярных тестов по выявлению вирусных возбудителей превышает таковую общепринятых микробиологических тестов для выявления бактериальных патогенов. У детей младшей возрастной группы при наличии клинических признаков, совместимых с вирусной инфекцией ВДП или НДП, применение антибиотиков излишне, может вызывать лекарственную токсичность и способствовать развитию резистентности к антибиотикам.
Детей с предполагаемой бактериальной ВП, достаточно тяжелой, чтобы они нуждались в госпитализации, следует рутинно лечить антибиотиками для парентерального введения — для обеспечения необходимых концентраций в крови и тканях (табл. 4). Если возбудителя удалось выделить из крови или адекватных образцов материала из дыхательных путей, можно назначить эффективное и безопасное лечение антибиотиком узкого спектра действия. До внедрения в клиническую практику пневмококковой конъюгированной вакцины у ~ 1 % детей с пневмококковой бактериемией имел место и бактериальный менингит. Следует помнить, что дозы большинства антимикробных препаратов, включая все b-лактамные антибиотики, у ребенка с менингитом превышают таковые у ребенка с пневмонией.
Бактериальные возбудители при ВП
Эмпирическая терапия антибиотиками для приема внутрь разработана для эффективного лечения бактериальных возбудителей, чаще всего вызывающих инфекции НДП, прежде всего S.pneumoniae, который не только является одним из наиболее распространенных бактериальных возбудителей, но и способен вызвать тяжелые последствия, если лечение было неадекватным или отсутствовало. Инфекции НДП, вызванные значительно более редкими возбудителями, такими как нетипируемые штаммы H.influenzae, не всегда нуждаются в назначении эмпирической терапии. Большего внимания заслуживают инфекции, вызванные S.aureus (включая внебольничные штаммы MRSA), при которых госпитализация и начальная парентеральная антибиотикотерапия могут снизить заболеваемость и смертность.
Бактериально-вирусные коинфекции документированы для вируса гриппа и S.pneumoniae, S.aureus (как для метициллиночувствительных, так и метициллинорезистентных штаммов) и стрептококков группы А. У некоторых детей может потребоваться одновременное применение и антибиотиков, и противовирусных средств.
Streptococcus pneumoniae
Бензилпенициллин представляет собой эффективное антимикробное средство с наиболее узким спектром для лечения пневмококковых инфекций. Несколько лет назад изменилась интерпретация тестов на чувствительность к пенициллину, в связи с тем что при парентеральном введении повышенных доз пенициллина тканевые концентрации антибиотика будут эффективными в отношении пневмококков с минимальной подавляющей концентрацией (МПК) вплоть до 2 мкг/мл, могут быть эффективными при МПК 4 мкг/мл и, вероятно, не будут эффективными при МПК і 8 мкг/мл. Однако из-за ограниченного после приема внутрь всасывания пенициллина и его солей из желудочно-кишечного тракта интерпретация значений МПК для пневмококков при использовании пенициллина per os не изменилась: МПК чувствительных к пенициллину штаммов < 0,06 мкг/мл, МПК умеренно резистентных штаммов 0,12–1,0 мкг/мл, МПК резистентных штаммов і 2,0 мкг/мл. По сравнению с пероральным пенициллином, фармакокинетический профиль и переносимость амоксициллина для приема внутрь более благоприятны. Дозы антибиотиков, которые рекомендуются для эффективного лечения, непосредственно зависят от чувствительности выделенного у пациента штамма S.pneumoniae.
Во время первых исследований амоксициллина в педиатрии (начало 1970-х гг.) подавляющее большинство изолятов были высокочувствительными, стандартное дозирование препарата (40–45 мг/кг/сут в равных дозах за 3 приема) было повсеместно эффективным. После возникновения и повсеместного распространения резистентности пневмококков к пенициллину в 1990-х гг. для преодоления резистентности тестировались высокие дозы амоксициллина (90 мг/кг/сут). Такое лечение оказалось эффективным у больных с острым средним отитом, причем суточная доза делилась на 2 приема. Период полувыведения амоксициллина из жидкости среднего уха составляет 4–6 ч по сравнению с 1 ч из плазмы, что позволяет обосновать прием препарата у больных с острым средним отитом 2 раза в сутки. Подобные проспективные сравнительные данные в поддержку 2-разового применения амоксициллина у детей с документированной пневмококковой пневмонией до настоящего времени не опубликованы.
Кратность приема имеет значение для создания адекватных концентраций амоксициллина в легких, инфицированных резистентными пневмококками с МПК 2,0 мкг/мл. Как свидетельствуют расчеты, при использовании дозы 90 мг/кг/сут, принятой за 3 приема, клинического и микробиологического излечения можно ожидать примерно у 90 % детей, в то время как при 2-кратном приеме той же суточной дозы эффект будет достигнут у 65 % детей. В то же время для лечения инфекций, вызванных чувствительными штаммами пневмококков, суточной дозы 90 мг/кг за 2 приема, как показано при остром среднем отите, будет достаточно.
После внедрения в клиническую практику 7-валентной пневмококковой вакцины документировано снижение частоты инвазивных пневмококковых инфекций и уменьшение выраженности резистентности к пенициллину среди циркулирующих штаммов. Это указывает на возможность возвращения адекватных дозировок амоксициллина к тем, которые рекомендовались в эру, предшествовавшую появлению прививок против пневмококков. Однако с появлением антибиотикорезистентных штаммов пневмококков серотипа 19A большинство экспертов полагает, что при пневмококковых пневмониях и возможности назначения антибиотиков внутрь предпочтение по-прежнему следует отдавать высоким дозам амоксициллина. Хотя серотип 19A включен в новую 13-валентную вакцину, оценивать ее влияние на инвазивные пневмококковые инфекции или на возникновение антибиотикорезистентности к серотипам, не охваченным этой вакциной, преждевременно.
Хотя спектр действия амоксициллина шире, чем у пенициллина, именно он рекомендуется для пероральной терапии пневмонии, вызванной S.pneumoniae. Это объясняется лучшим всасыванием амоксициллина из желудочно-кишечного тракта, что ведет к созданию более высоких концентраций в плазме крови (и возможности лечения инфекций, вызванных менее чувствительными бактериями), более длительным периодом полувыведения (что позволяет сократить частоту приемов внутрь), лучшими вкусовыми характеристиками и лучшей переносимостью у детей.
Ни один из цефалоспоринов для приема внутрь в дозах, которые изучены у детей, не обеспечивает активности в очаге инфекции, сопоставимой с таковой при использовании высоких доз амоксициллина. Большинство цефалоспоринов II–III поколений проявляют адекватную активность только в отношении 60–70 % штаммов пневмококков, которые выделяются в настоящее время. Клиндамицин в некоторых географических регионах проявляет активность in vitro в отношении 60–85 % пневмококков, в то время как левофлоксацин для приема внутрь и линезолид активны в отношении > 95 % штаммов. В амбулаторных условиях могут использоваться ежедневные внутримышечные инъекции цефтриаксона с документированной in vitro активностью в отношении > 95 % пневмококков. После достижения клинического ответа на парентеральное введение антибиотика рекомендуется перевод ребенка на ступенчатую терапию.
Из-за значительного распространения резистентности пневмококков к макролидам последние (эритромицин, азитромицин, кларитромицин) не рекомендуются для эмпирического лечения предполагаемой пневмококковой ВП. Более того, длительный период полувыведения и длительная экспозиция микроорганизмов на слизистой оболочке дыхательных путей к азитромицину ассоциируются с селекцией резистентных бактерий на поверхности слизистых у пациентов, получавших этот антибиотик. Высказываются опасения, что оттуда резистентные бактерии могут распространяться в обществе.
Лечение детей с анамнестическими указаниями на нетяжелые аллергические реакции на амоксициллин четко не разработано и должно быть индивидуализированным. Возможные варианты включают в себя пробное назначение амоксициллина под медицинским наблюдением после приема первой дозы либо назначение перорального цефалоспорина с выраженной активностью в отношении S.pneumoniae (цефподоксим, цефпрозил или цефуроксим), также под медицинским наблюдением. Если в анамнезе имели место более тяжелые аллергические реакции, включая анафилаксию, варианты лечения включают в себя респираторный фторхинолон, например левофлоксацин, линезолид, макролид (в США до 40 % внебольничных штаммов S.pneumoniae могут быть резистентными к антибиотикам этого класса), либо клиндамицин (при условии чувствительности возбудителя). У детей с пневмококковой пневмонией с бактериемией выбор альтернативы амоксициллину производится особенно тщательно, учитывая возможность вторичного очага инфекции, включая менингит.
Для парентерального лечения госпитализированных больных с инфекциями, вызванными нечувствительными штаммами пневмококков, используются повышенные дозы b-лактамов — по сравнению с дозами для лечения инфекций, вызванных чувствительными штаммами. В регионах со значительным ( > 25 %) распространением высокой резистентности к пенициллину (МПК > 8 мкг/мл) среди инвазивных штаммов могут использоваться повышенные дозы бензилпенициллина (до 300 000 МЕ/кг/сут каждые 4 ч) или ампициллина (до 400 мг/кг/сут каждые 6 ч), близкие к тем, которые без опасений используются для лечения менингита. Кратность введения пенициллина выше, чем ампициллина и других b-лактамов, потому что его период полувыведения составляет лишь 30–40 мин.
Альтернативой пенициллинам являются цефтриаксон или цефотаксим, которые применяются в стандартных «неменингитных» дозах, эффективность которых была продемонстрирована у взрослых с ВП, вызванных штаммами, считавшимися ранее резистентными к цефтриаксону. Цефтриаксон и цефотаксим in vitro проявляют существенно более высокую активность в отношении пенициллинорезистентных штаммов, чем бензилпенициллин. Не было сообщений о микробиологической неэффективности цефтриаксона у детей с пневмонией, вызванной пневмококками, с МПК цефтриаксона < 4,0 мкг/мл; в опубликованных сообщениях о лечении взрослых этот антибиотик рекомендуется для лечения инфекций, вызванных пневмококками с МПК цефтриаксона до 4,0 мкг/мл. При лечении инфекций, вызванных резистентными пневмококками, следует использовать с осторожностью другие парентеральные цефалоспорины — в связи с недостатком проспективных данных, которые бы подтверждали их эффективность. У детей не проводились проспективные сравнения внутривенного введения ампициллина или амоксициллина с цефтриаксоном. Ограниченные данные, полученные у взрослых, свидетельствуют, что внутривенное введение ампициллина и амоксициллина/клавуланата столь же эффективно, как цефтриаксон, при лечении пневмококковых инфекций, с МПК амоксициллина до 2,0 мкг/мл.
Хотя стоимость пенициллина и ампициллина ниже, чем других антимикробных препаратов, расходы больничных ресурсов и общая стоимость антибиотиков, которые вводятся каждые 4–6 ч, может быть выше, чем у лекарств, которые применяются 1–2 раза в сутки. Однако вопросы экономии не должны затенять того факта, что любой антибиотик с более широким спектром действия, чем пенициллин, в большей степени нарушает нормальную микробиоту и способен вызывать появление резистентности. У детей, лечение которых было начато антибиотиком широкого спектра действия, а материал для микробиологического исследования либо не был получен, либо взят после начала антибиотикотерапии, и возбудитель не установлен, перевод на прием амоксициллина внутрь по-прежнему остается адекватным действием.
По вопросу о соотношении парентеральной или пероральной эмпирической терапии ВП проспективных данных немного. До широкого внедрения в клиническую практику пневмококковой конъюгированной вакцины был опубликован ретроспективный обзор данных о 61 ребенке с ВП и пневмококковой бактериемией. У детей, получавших стартовую парентеральную антибиотикотерапию в приемном покое стационара перед выпиской домой, чаще отмечалось клиническое улучшение, включая меньший размах лихорадки, и они реже нуждались в госпитализации по сравнению с детьми, которые принимали антибиотики только внутрь. Значимость этих данных в современных условиях неизвестна, однако они указывают на то, что парентеральная терапия может ассоциироваться с более быстрым ответом на лечение.
Haemophilus influenzae
Применение в последние 25 лет в развитых странах мира конъюгированной вакцины против H.influenzae типа b привело к фактическому исчезновению этого патогена у детей. Поэтому он не входит в число типичных возбудителей ВП. Нетипируемые H.influenzae обычно также не рассматриваются в качестве возбудителя ВП у детей, за исключением случаев сопутствующих хронических заболеваний легких или возникновения хронической обструкции. Если такой штамм выделяют у ребенка с ВП и он трактуется как истинный возбудитель, при нетяжелой инфекции, вызванной штаммом, не вырабатывающим b-лактамазы, назначают амоксициллин. Если инфекция НДП вызвана штаммом, продуцирующим b-лактамазы, эффективны амоксициллин/клавуланат и пероральные цефалоспорины II (цефуроксим) и III поколения (цефдинир, цефиксим, цефподоксим или цефтибутен). Фторхинолоны обычно не используют у детей для лечения инфекций, вызванных H.influenzae, за исключением случаев тяжелой аллергии на все пероральные b-лактамы. Для лечения госпитализированных больных применяют ампициллин (в США активен в отношении фактически всех штаммов, не вырабатывающих b-лактамазы) и цефалоспорины II (цефуроксим) и III поколения (цефтриаксон, цефотаксим), которые активны в отношении штаммов, как не вырабатывающих, так и вырабатывающих b-лактамазы.
Стрептококки группы А
Пиогенные стрептококки (стрептококки группы А) нечасто вызывают педиатрические ВП, но могут вызвать тяжелую некротизирующую пневмонию. Резистентность этого патогена к пенициллинам или цефалоспоринам не описана. Резистентность к клиндамицину встречается редко и в большинстве географических регионов < 2 %. У госпитализированных больных используют бензилпенициллин в дозе 100 000–200 000 МЕ/кг/сут за 4–6 введений, хотя дозы 200 000–250 000 МЕ/кг/сут переносятся хорошо и могут назначаться при более тяжелых заболеваниях. Макролиды не относятся к антибиотикам выбора при лечении стрептококковых инфекций, поскольку резистентность к ним выше, чем к b-лактамам, а тканевые концентрации и переносимость эритромицина ниже. У детей с токсин-опосредованным заболеванием (наподобие синдрома токсического шока) ряд экспертов рекомендует комбинированную терапию b-лактамом и клиндамицином для снижения тяжести заболевания, предположительно вызванного стрептококковыми токсинами.
Staphylococcus aureus
Пневмония, предположительно вызванная S.aureus, чаще всего первоначально лечится в стационаре. В настоящее время в США циркулирует множество штаммов и клонов S.aureus с различной чувствительностью к антибиотикам. У госпитализированных детей с инфекцией, вызванной метициллиночувствительными S.aureus (MSSA), адекватна монотерапия внутривенно пенициллиназоустойчивым пенициллином (оксациллин или нафциллин) либо цефалоспорином I поколения (цефазолин). Комбинированная терапия с аминогликозидом (гентамицин) изучена недостаточно, хотя используется некоторыми экспертами, в особенности в первые дни лечения, до достижения клинического эффекта. При более тяжелых инфекциях может использоваться и комбинация b-лактама и рифампицина, в пользу которой свидетельствуют данные, полученные при тестировании in vitro многих, но не всех, штаммов. Однако и в этом случае качественные проспективные клинические данные отсутствуют.
Внебольничные метициллинорезистентные S.aureus (MRSA) представляют собой все возрастающую проблему во многих регионах США; в отдельных местностях их доля достигает > 50–70 % клинических изолятов. Все штаммы внебольничных MRSA, выделенные у детей, чувствительны к ванкомицину, который является препаратом выбора при тяжелых инфекциях. Внутривенное введение клиндамицина является альтернативой при инфекциях, вызванных чувствительными к нему штаммами MSSA и MRSA. При тяжелых инфекциях выбор препаратов определяется данными о локальной чувствительности и результатами определения чувствительности выделенного штамма в лаборатории. При выявлении у выделенного штамма стафилококков индуцибельной резистентности к клиндамицину не следует использовать данный антибиотик при инфекциях с высоким инокулюмом (например, эмпиеме), когда высок риск присутствия бактерий, конститутивно вырабатывающих метилазы. Ряд экспертов применяет клиндамицин и другие антибиотики, действующие на рибосомы бактерий, при токсин-опосредованных инфекциях, однако в настоящее время отсутствуют данные проспективных контролируемых исследований в поддержку такого подхода. То же самое можно сказать и о предложениях использовать гентамицин, клиндамицин или рифампицин в комбинации с ванкомицином для лечения жизнеугрожающих инфекций, вызванных внебольничными MRSA. Фактически все штаммы внебольничных MRSA чувствительны также к линезолиду, бактериостатическому антибиотику, который в настоящее время считается препаратом второго ряда. Линезолиду следует отдавать предпочтение у больных с дисфункцией почек либо получающих нефротоксические препараты. Даптомицин (в Украине не зарегистрирован) инактивируется сурфактантом легких и не показан для лечения стафилококковой пневмонии, хотя при микробиологическом исследовании может быть документирована чувствительность к этому антибиотику.
Детей с тяжелой гиперчувствительностью 1-го типа к b-лактамам, которые не переносят ванкомицин или клиндамицин, можно лечить линезолидом, хотя этот антибиотик обладает довольно неблагоприятным профилем безопасности. Снижение концентрации тромбоцитов и нейтрофилов, поражение периферических нервов регистрируются при лечении линезолидом чаще, чем при использовании b-лактамов, хотя большинство побочных эффектов развиваются не ранее конца 2-й недели терапии.
Атипичная пневмония
Mycoplasma pneumoniae
В литературе известны инфекции НДП, сопровождающиеся симптомами, которые ассоциируются с данным патогеном. Лучше всего эти заболевания описаны у школьников и взрослых. Однако у детей не было выполнено ни одного проспективного слепого рандомизированного плацебо-контролируемого исследования, где бы изучались именно микоплазменные инфекции НДП. Большинство исследований микоплазменных ВП у детей были ретроспективными, а количество пациентов в проспективных исследованиях с документированной микоплазменной инфекцией было недостаточным, чтобы сформулировать статистически значимые выводы о целесообразности использования антибиотиков. Появление в недавнем прошлом в Японии резистентных к макролидам M.pneumoniae дало возможность ретроспективно сравнить клинические исходы у получавших макролиды детей в зависимости от того, были ли они инфицированы макролидочувствительными (МЧ) (n = 47; средний возраст 7,5 года) или макролидорезистентными (МР) штаммами (n = 22, средний возраст 7,7 года). Резистентность к макролидам оценивалась в культуре микоплазм и методом микроразведений, и идентификацией посредством ПЦР мутаций, ранее связанных с возникновением резистентности к макролидам. В этом исследовании длительность лихорадки (1,5 дня) и кашля (7,0 дня) были статистически значимо меньше у детей, инфицированных МЧ-штаммами, чем при инфекциях, вызванных МР-штаммами (соответственно 4,0 и 11,4 дня, p < 0,01).
Данные, полученные в исследованиях у взрослых, свидетельствуют об умеренной пользе от лечения тетрациклинами и макролидами при нетяжелых микоплазменных инфекциях. По-видимому, в педиатрии назначение макролидов или тетрациклинов (детям старше 7 лет) оправданно при среднетяжелых и тяжелых заболеваниях. Эффективность респираторных фторхинолонов у взрослых не уступала таковой макролидов и тетрациклинов. У дошкольников при лечении микоплазменных инфекций НДП, документированных серологически, клиническая эффективность амоксициллина/клавуланата была эквивалентна таковой левофлоксацина при оценке частоты клинического излечения во время осмотра больных спустя 10–17 дней после приема последней дозы сравниваемых препаратов. Эти результаты свидетельствуют о высокой частоте спонтанного клинического разрешения микоплазменной инфекции и отсутствии необходимости в назначении антибиотиков в этой возрастной группе. С другой стороны, отсутствие различий в эффективности может объясняться тем фактом, что анализ проводился после завершения лечения, без сравнения результатов в более ранние промежутки времени.
Chlamydia trachomatis и C.pneumoniae
Chlamydia trachomatis чаще всего идентифицируется как причина афебрильных инфекций НДП у детей в возрасте 2–12 недель, рожденных матерями с генитальными инфекциями, в то время как C.pneumoniae вызывает атипичные пневмонии у школьников и подростков. Эффективность антибиотикотерапии при инфекциях НДП, вызванных C.pneumoniae у детей старших возрастных групп, определить затруднительно. Серологические методы диагностики плохо стандартизированы и слабо коррелируют с результатами культурального исследования. У детей с культурально подтвержденным диагнозом частота эрадикации хламидий при лечении макролидами составляет 70–80 %, однако сходная частота клинического излечения отмечается как у детей с персистирующей инфекцией, так и у микробиологически излеченных пациентов.
Вирусные возбудители при ВП
Вирус гриппа
В настоящее время доступна противовирусная терапия чувствительных штаммов вируса гриппа А с помощью адамантанов и ингибиторов нейраминидазы и чувствительных штаммов вируса гриппа В ингибиторами нейраминидазы. Резистентность штаммов вируса гриппа к любому классу противовирусных препаратов возникает и распространяется быстро, что связывают с генетическими вариациями, которые каждый год происходят с вирусом. Большинство штаммов вируса гриппа А, выделенных начиная с сезона 2005–2006 гг., резистентны к адамантанам; все штаммы вируса гриппа В обладают природной резистентностью к адамантанам. Данные о резистентности штаммов собираются и анализируются во время каждого сезона гриппа экспертами ВОЗ и CDC (Центров по контролю над заболеваниями, США). Дозы противовирусных препаратов, которые рекомендуются в настоящее время для лечения сезонного гриппа, разрабатывались для полностью чувствительных штаммов и оценивались в клинических исследованиях, где лечение начиналось в первые 48 ч от начала заболевания. Хотя наибольшую пользу получают больные при раннем начале терапии, пациенты с тяжелым течением заболевания, а также лица, у которых состояние продолжает ухудшаться спустя 48 ч после появления симптомов, по-видимому, тоже получат пользу от лечения. Выраженность позитивного эффекта в подобных ситуациях еще предстоит оценить.
Оптимальные дозы осельтамивира остаются неизвестными у больных с тяжелым течением гриппа, у лиц, инфицированных высокопатогенным птичьим гриппом А (H5N1), у пациентов, получающих экстракорпоральную мембранную оксигенацию, а также у больных с тяжелым иммунодефицитом, например у перенесших трансплантацию. Некоторые эксперты рекомендуют повышенные дозы (например, 150 мг внутрь каждые 12 ч для людей с массой тела > 40 кг). Однако не существует проспективных контролируемых данных для обоснования терапии повышенными дозами или более продолжительного лечения (свыше стандартного 5-дневного курса). В ряде стран доступны ингибиторы нейраминидазы для внутривенного введения при документированных инфекциях H1N1 во время вызванных этим вирусом пандемий, однако в настоящее время нет адекватных данных об их безопасности и эффективности, особенно у детей.
Бактериально-вирусные коинфекции хорошо документированы при инфицировании вирусом гриппа. Чаще других отмечались коинфекции с S.pneumoniae, S.aureus (как с MSSA, так и MRSA) и стрептококками группы А. У ребенка с тяжелой вирусной инфекцией НДП могут быть оправданными поиск бактериального возбудителя и эмпирическая антибактериальная терапия.
Респираторно-синцитиальный вирус
Сохраняются противоречия в мнениях об эффективности аэрозольной формы рибавирина в терапии у детей с ВП, вызванной РСВ. Рибавирин проявляет in vitro активность в отношении РСВ, однако не рекомендуется рутинное использование этого препарата при инфекциях НДП, вызванных данным вирусом, — из-за высокой стоимости, аэрозольной формы выпуска, возможных токсических воздействий на медработников, вдыхающих частицы аэрозоля, и сомнений в эффективности. Доступна эффективная профилактика инфекции РСВ с помощью паливизумаба, гуманизированных мышиных моноклональных антител, которые вводятся внутримышечно. В настоящее время продолжаются исследования моноклональных антител против РСВ, более мощных, чем паливизумаб.
Вирус парагриппа, аденовирус, метапневмовирус, риновирус, коронавирус и бокавирус
В настоящее время отсутствуют данные проспективных контролируемых исследований противовирусной терапии перечисленных вирусных инфекций, ассоциирующихся с педиатрическими ВП.
VI. Как можно минимизировать резистентность к антибиотикам?
Рекомендации
50. Прием антибиотиков способствует появлению резистентности к ним, следовательно, нужно стремиться к ограничению использования любого антибиотика, если это возможно (значимая рекомендация; доказательства среднего уровня).
51. Предпочтительно ограничивать спектр активности антибиотика тем, что необходимо для лечения выделенного возбудителя (значимая рекомендация; доказательства низкого уровня).
52. Важным для снижения развития резистентности является использование адекватных доз антибиотиков для достижения минимальной эффективной концентрации в очаге инфекции (значимая рекомендация; доказательства низкого уровня).
53. Минимальная эффективная длительность лечения будет минимизировать экспозицию и возбудителей, и нормальной микробиоты к антимикробным средствам и минимизировать селекцию резистентности (значимая рекомендация; доказательства низкого уровня).
Резюме рекомендаций
Данные нескольких обзоров по контролю применения антибиотиков свидетельствуют о позитивном влиянии сокращения использования антибактериальных средств на появление резистентности ко многим препаратам в госпиталях. Тем не менее существует мало доказательств того, что ограничение использования конкретного антибиотика в условиях отдельно взятого лечебного учреждения приводит к уменьшению распространения бактерий, резистентных к данному антибиотику. Более того, в большинстве анализов не оценивалось снижение у больных истинного числа инфекций, вызванных микроорганизмами, резистентными к конкретному антибиотику, после сокращения использования этого препарата. Еще меньше качественных данных доступно о педиатрических инфекциях, когда дети лечились амбулаторно. До настоящего времени нет доказательств в поддержку использования наименьшей эффективной экспозиции к антибиотику (дозы и длительность терапии) для предупреждения возникновения резистентности и последующих инфекций, вызванных резистентными микроорганизмами.
VII. Какова адекватная длительность антимикробной терапии ВП?
Рекомендации
54. Лучше всего изучены курсы антимикробной терапии длительностью 10 дней, хотя более краткие курсы могут быть столь же эффективными, особенно при заболеваниях легкой степени тяжести, которые лечатся в амбулаторных условиях (значимая рекомендация; доказательства среднего уровня).
55. Инфекции, вызванные некоторыми возбудителями, а именно внебольничными метициллинорезистентными Staphylococcus aureus (CA-MRSA), могут потребовать более длительного лечения по сравнению с пневмококковыми инфекциями (значимая рекомендация; доказательства среднего уровня).
Резюме рекомендаций
Длительность антимикробной терапии у детей в развитых странах мира изучалась в контексте регистрации новых антибиотиков, которые сравнивали с известными препаратами, стандартная длительность терапии которыми составляла 10 дней (5-дневное лечение азитромицином, фармакокинетика которого в тканях разительно отличается от b-лактамов). Краткие (3-дневные) курсы изучали в развивающихся странах, однако клиническая, лабораторная и рентгенологическая характеристика пациентов, включенных в такие исследования, хуже, чем это было в развитых странах, а данные о бактериальных возбудителях зачастую скудные. Подобные проспективные сравнительные исследования кратких курсов терапии с тщательным изучением этиологии в развитых странах не проводились. Хотя продолжительность курса антимикробной терапии обычно составляет 10 дней, зачастую для ускорения выписки пациента из стационара используется перевод его на прием препаратов внутрь, что позволяет снизить риск, связанный с внутривенным введением антибиотиков и сократить длительность контакта с нозокомиальными патогенами. Несмотря на отсутствие данных проспективных контролируемых исследований, ретроспективные обзоры подтверждают эффективность подобных подходов. Другой возможностью ранней выписки из больницы может быть перевод больного с внутривенного на ежедневное внутримышечное введение антибиотиков с длительным периодом полувыведения, особенно таких b-лактамов, как цефтриаксон или эртапенем. Такой подход оправдан в случаях, когда ребенок уже не нуждается в снабжении кислородом и помощи квалифицированного медицинского персонала, но сохраняется потребность в парентеральном введении антибиотиков. В регионах, где доступна квалифицированная педиатрическая медсестринская помощь в амбулаторных условиях, детям, нуждающимся в продолжительной парентеральной терапии, можно вводить антибиотики амбулаторно через постоянный центральный катетер с ежедневным контролем на дому квалифицированными педиатрическими медсестрами.
Длительность парентеральной терапии перед переводом на прием антибиотиков внутрь определяют исходя из тяжести начальных проявлений заболевания и сроков наступления улучшения. Решение о переводе на прием антибиотиков внутрь многие врачи принимают на основании снижения лихорадки, уменьшения кашля, одышки, потребности в снабжении кислородом, повышения активности и аппетита на фоне снижения лейкоцитоза в периферической крови и/или концентрации СРБ и других острофазовых реагентов. В отсутствие бактериемии, а также у детей с бактериемией, у которых очаги вторичной инфекции не были выявлены, перевод на пероральную терапию возможен спустя 2–3 дня после начала парентерального введения антибиотиков. В то же время данные в поддержку этой рекомендации получены главным образом в ретроспективных исследованиях.
Помимо амоксициллина, у детей с анамнестическими указаниями на аллергические реакции можно использовать другие антибиотики для приема внутрь — в зависимости от чувствительности возбудителя. Для некоторых антибиотиков характерно отличное всасывание из желудочно-кишечного тракта. Как полагают, они будут столь же эффективными, как и парентеральные антибиотики, при лечении выздоравливающего ребенка в семьях с высокой комплаентностью. К таким антибактериальным препаратам относятся фторхинолоны, линезолид, клиндамицин, триметоприм/сульфаметоксазол и азитромицин.
Инфекции, вызванные некоторыми возбудителями, а именно внебольничными метициллинорезистентными Staphylococcus aureus (CA-MRSA), могут потребовать более длительного лечения по сравнению с пневмококковыми инфекциями. При осложненных инфекциях с образованием парапневмонических выпотов, эмпиемы или абсцесса легких длительность терапии также может превышать 10 дней, однако проспективные рандомизированные исследования, в которых бы определялась продолжительность лечения в зависимости от особенностей возбудителя и заболевания, до настоящего времени не проводились. Одни эксперты предлагают лечить адекватно дренированные выпоты или эмпиему в течение 7–10 дней после нормализации температуры тела, в то время как другие рекомендуют назначать антибиотики на срок 4–6 недель. Абсцессы легких различаются по размерам и этиологии, поэтому длительность терапии следует определять индивидуально, опираясь на достигнутый клинический, лабораторный и визуализирующий ответ на антимикробную терапию.
VIII. Как следует оценивать ответ ребенка с ВП на лечение?
Рекомендации
56. У детей, которым назначена адекватная терапия, клинические и лабораторные признаки улучшения наступают в течение 48–72 ч. Детям, чье состояние после госпитализации и начала антимикробной терапии ухудшается, либо тем, у которых не наступает улучшение в течение 48–72 ч, следует провести дополнительное обследование (значимая рекомендация; доказательства среднего уровня).
Резюме рекомендаций
В соответствии с данными, полученными > 50 лет тому назад в плацебо-контролируемых исследованиях на заре антибиотической эры, улучшение клинической симптоматики, включая лихорадку, число дыхательных движений в 1 мин и оксигенацию (по данным пульсоксиметрии и потребности в снабжении кислородом), должно наступить в течение 48–72 ч. Клинические признаки ответа на лечение могут подтверждаться динамикой лабораторных маркеров воспаления (такими острофазовыми реагентами, как прокальцитонин или СРБ), хотя эти лабораторные тесты не были должным образом изучены в клинических исследованиях. Продолжение дискуссии по затронутой теме содержится в резюме доказательств к рекомендации 71.
Дополнительная хирургическая помощь и непротивоинфекционная терапия при педиатрических ВП
IX. Как идентифицируется парапневмонический выпот?
Рекомендации
57. Анамнез и физикальное исследование могут указывать на парапневмонический выпот у больного с предполагаемой ВП, однако для подтверждения наличия жидкости в плевральной полости следует провести рентгенологическое исследование. Если после рентгенологического исследования органов грудной клетки не представляется возможным сделать окончательное заключение, рекомендуется использование других визуализирующих методик — ультразвукового исследования грудной клетки или компьютерной томографии (КТ) (значимая рекомендация; доказательства высокого уровня).
Резюме рекомендаций
Парапневмонический выпот определяют как скопление жидкости в плевральной полости, ассоциирующееся с пневмонией. В крупном исследовании больных с ВП в Канаде парапневмонические выпоты имели место у ~ 9 % взрослых пациентов. В проспективных исследованиях ВП у детей, проведенных в Северной и Южной Америке, парапневмонические выпоты обнаруживали в 2–12 % случаев. Подобные выпоты регистрируют почти у 20 % больных с пневмониями, вызванными M.pneumoniae, и у і 10 % пациентов с вирусными пневмониями, однако в этих случаях они редко бывают настолько большими, чтобы потребовалось вмешательство. Чаще всего парапневмонические выпоты наблюдаются при бактериальных пневмониях и регистрируются в і 50 % случаях заболеваний, вызванных типичными бактериями, включая S.pneumoniae, S.pyogenes и S.aureus в странах, где широко используется вакцина против H.influenzae типа b.
Под парапневмонической эмпиемой понимают скопление гноя в плевральной полости, ассоциирующееся с пневмонией. Гной можно определить по внешнему виду, лейкоцитозу (> 50 ґ 109/л) или позитивному культуральному исследованию на выявление бактерий. Частота госпитализаций по поводу парапневмонической эмпиемы в США возрастает.
У детей с ВП наличие парапневмонического выпота можно заподозрить на основании анамнеза и результатов физикальнного исследования. Так, длительная лихорадка, боли в грудной клетке и в животе у детей с ВП ассоциируются с парапневмоническим выпотом. При физикальном исследовании можно выявить признаки скопления жидкости в плевральной полости, включая тупость при перкуссии, ослабленное дыхание, изменение качества звука при бронхофонии. Для подтверждения наличия жидкости в плевральной полости у ребенка с ВП следует прибегнуть к рентгенографии ОГК, включая исследования в боковых проекциях в положении лежа. При сохраняющихся сомнениях в наличии жидкости или паренхиматозного затемнения рекомендуется использовать другие визуализирующие методики — ультразвуковое исследование грудной клетки или компьютерную томографию (КТ). Ультразвуковое исследование считается более безопасной визуализирующей методикой, чем КТ, из-за отсутствия ионизирующего облучения.
X. Какие факторы имеют значение для определения потребности в дренировании парапневмонического выпота?
Рекомендации
58. Размеры выпота являются важным фактором, определяющим лечение (табл. 5, рис. 1) (значимая рекомендация; доказательства среднего уровня).
59. Выраженность дыхательной недостаточности у ребенка является важным фактором, определяющим лечение парапневмонического выпота (табл. 5, рис. 1) (значимая рекомендация; доказательства среднего уровня).
Резюме рекомендаций
Причины, по которым может потребоваться дренирование плевральной полости, бывают разными. У детей парапневмонические выпоты обусловлены инфекцией. При сомнении в инфекционном генезе выпота или подозрении на злокачественное новообразование с диагностической целью выполняют торакоцентез, а полученный материал направляют на цитологическое исследование. При обнаружении эмпиемы для адекватного лечения инфекции обычно требуется дренирование плевральной полости, что способствует снижению лихорадки, уменьшению признаков воспаления, длительности пребывания в стационаре. Размеры выпота и выраженность дыхательной недостаточности — важные факторы при планировании лечения. Лечение небольших выпотов (табл. 5) зачастую ограничивается одной только антибактериальной терапией. Выпоты средних и крупных размеров чаще вызывают дыхательную недостаточность, разрешаются медленно и нуждаются в дренировании (рис. 1).
Классификационные критерии размеров выпота у детей сопоставимы с таковыми у взрослых. Небольшие выпоты (уровень жидкости < 10 мм на боковой рентгенограмме в лежачем положении либо затемняет менее одной четвертой гемиторакса (половины грудной клетки) на рентгенограмме ОГК в положении стоя) обычно разрешаются самостоятельно и не нуждаются в дренировании. По данным 12-летнего ретроспективного исследования у детей с пневмонией и парапневмоническими выпотами, все больные с малыми выпотами выздоравливали только с помощью антибиотикотерапии. В отсутствие смещения средостения только 27 % (23 из 84) детей со средними плевральными выпотами нуждались в дренировании, в то время как из 94 детей с большими выпотами (затемнение более половины гемиторакса) такая потребность имела место у 62 (66 %).
При достаточно больших для дренирования выпотах на решение о тактике лечения влияет наличие осумкованной, или организованной, жидкости, поскольку одна только установка дренажной трубки в плевральную полость может оказаться неэффективной и потребуется дополнительная терапия. Выбор дополнительной терапии обсуждается ниже.
Ультрасонография ОГК является методом выбора для визуализации осумкования плевральной жидкости, хотя могут использоваться также рентгенография в боковой проекции в положении лежа и КТ ОГК. По некоторым данным, осумкованные парапневмонические выпоты ассоциируются с осложненным пребыванием в стационаре. В одном из исследований дети с осумкованными парапневмоническими выпотами, получавшие лечение антибиотиками в сочетании с установкой дренажной трубки в плевральную полость или без нее, дольше находились в стационаре, а течение заболевания у них было осложненным по сравнению с детьми с простыми (неосумкованными) выпотами, получавшими аналогичное лечение. В другом исследовании у взрослых с осумкованными парапневмоническими выпотами объемы выпотов и длительность пребывания в стационаре были больше, а торакостомия производилась чаще, чем у больных с неосумкованными выпотами. Однако связь между осумкованием выпотов и потребностью в дренировании плевральной полости у детей установлена не во всех исследованиях.
XI. Какие лабораторные исследования следует выполнить при наличии выпота в плевральной полости?
Рекомендации
60. Всякий раз при получении образца жидкости из плевры следует окрасить его по Граму и провести культуральное исследование плевральной жидкости (значимая рекомендация; доказательства высокого уровня).
61. Определение антигенов или амплификация нуклеиновых кислот посредством полимеразной цепной реакции (ПЦР) увеличивают частоту обнаружения патогенов в плевральной жидкости и могут быть полезными для лечения (значимая рекомендация; доказательства среднего уровня).
62. Анализ ряда параметров плевральной жидкости, таких как pH, концентрация глюкозы, белка, лактатдегидрогеназы, редко влияет на лечение больного и поэтому не рекомендуется (малозначимая рекомендация; доказательства очень низкого уровня).
63. Определение в плевральной жидкости числа лейкоцитов и лейкоцитарной формулы рекомендуется прежде всего для облегчения дифференциальной диагностики между бактериальной и микобактериальной этиологией выпота, а также его опухолевой природой (малозначимая рекомендация; доказательства среднего уровня).
Резюме рекомендаций
Результативность окраски по Граму и культурального исследования плевральной жидкости у больных с пневмониями, осложненными парапневмоническими выпотами, достигает 49 %, хотя в большинстве исследований < 25 %. Позитивные результаты определяют выбор антимикробной терапии. К сожалению, культуральное исследование большинства парапневмонических выпотов, предположительно вызванных патогенными бактериями, дает отрицательные результаты. В исследованиях в США и в Европе, выполненных с использованием разных методов определения нуклеиновых кислот и антигенов, было установлено, что культурально-негативные эмпиемы вызываются главным образом чувствительными к пенициллину S.pneumoniae, зачастую серотипами, которые не охватываются существующими вакцинами. Чувствительность этих методов превышает таковую традиционных культуральных методов и позволяет идентифицировать бактериальных возбудителей в 42–80 % случаев, в особенности у больных, уже получавших антибиотики. Тесты на определение антигенов и нуклеиновых кислот для выявления возбудителей парапневмонической эмпиемы, включая S.pneumoniae и S.aureus, продолжают разрабатываться, но могут с успехом использоваться в лечебных учреждениях, где они доступны.
У взрослых для дифференциальной диагностики между экссудативным выпотом и транссудатом зачастую производят ряд биохимических исследований плевральной жидкости. У детей подавляющее большинство выпотов обусловлены инфекцией. Биохимические исследования редко востребованы для установления причины выпота (инфекция, злокачественная опухоль или какая-то другая причина) и редко ассоциируются с изменениями в лечении больного. У взрослых, согласно результатам метаанализа, величина pH характеризуется самой высокой диагностической точностью при идентификации осложненных парапневмонических выпотов, нуждающихся в дренировании плевральной полости. Площадь под кривой рабочей характеристики (ПКРХ) pH составила 0,92 по сравнению с 0,84 глюкозы в плевральной жидкости и 0,82 лактатдегидрогеназы. Даже после исключения несомненно гнойной плевральной жидкости pH сохраняла высокую диагностическую точность (ПКРХ 0,89) с пороговыми величинами pH в пределах 7,21–7,29.
У детей значения pH < 7,2 ассоциировались с потребностью в дренировании. Биохимические исследования плевральной жидкости излишни у детей с парапневмоническими выпотами, ассоциирующимися с пневмонией. Однако некоторые эксперты рекомендуют определять pH плевральной жидкости, полученной во время начального дренирования, чтобы выяснить потребность в последующем дренировании.
Традиционно в плевральной жидкости подсчитывают число лейкоцитов и определяют лейкоцитарную формулу. На смену этому анализу для демонстрации бактериальной этиологии пришел молекулярный анализ. Ценность подсчета лейкоцитов и определения лейкоцитарной формулы для предсказания заболеваемости и исходов невелика. Однако при анализе лейкоцитоза, лейкоцитарной формулы и цитологических находок при исследовании плевральной жидкости можно получить некоторые подсказки о возможных более редких причинах выпота (туберкулез, злокачественное новообразование).
XII. Каким образом можно дренировать парапневмонические выпоты?
Рекомендации
64. Небольшие неосложненные парапневмонические выпоты не следует рутинно дренировать, их можно лечить с помощью одних только антибиотиков (значимая рекомендация; доказательства среднего уровня).
65. Парапневмонические выпоты средних размеров, ассоциирующиеся с респираторным дистрессом, крупные парапневмонические выпоты либо документированные гнойные выпоты следует дренировать (значимая рекомендация; доказательства среднего уровня).
66. И дренирование плевральной полости через торакостомическую трубку с добавлением фибринолитических средств, и ТХВВК являются эффективными методами лечения. Выбор способа дренирования зависит от квалификации персонала данного лечебного учреждения. Оба перечисленных способа ассоциируются со снижением заболеваемости по сравнению с одним только дренированием плевральной полости через трубку. Однако у больных с выпотами средних и более размеров со свободно смещаемой границей (отсутствие осумкования) установка дренажной трубки в плевральную полость без введения фибринолитиков является разумным первоначальным выбором (значимая рекомендация; доказательства высокого уровня).
Резюме рекомендаций
Выбор способа дренирования зависит от квалификации персонала данного лечебного учреждения. У больных с неосумкованным выпотом в плевре способом выбора является простое дренирование плевральной полости, хотя допускается и незамедлительный переход к дополнительной терапии. Осумкованные выпоты нуждаются в использовании дополнительной терапии. Эффективными способами лечения педиатрических парапневмонических выпотов являются и дренирование плевральной полости с инстилляциями фибринолитиков, включая урокиназу и тканевый активатор плазминогена, и ТХВВК. Какой из методов предпочтительнее при осложненных осумкованных выпотах, в настоящее время неизвестно. Режимы фибринолитической терапии, которые использовались у детей, представлены в табл. 8. Дренирование плевральной полости с инстилляциями фибринолитиков и ТХВВК улучшают исходы у больных, включая разрешение инфекции и сокращение длительности пребывания в стационаре, по сравнению с консервативным лечением (дренирование плевральной полости и антибиотикотерапия). В 2 одноцентровых исследованиях сравнивали фибринолитическую терапию и ТХВВК. Несмотря на различия в применявшихся фибринолитиках (урокиназа и альтеплаза), в обоих исследованиях исходы у больных были сходными (включая длительность пребывания в стационаре), при том что стоимость лечения парапневмонической эмпиемы фибринолитиками была меньшей. Еще в 1 небольшом исследовании (у 10 больных произведено ТХВВК, у 8 пациентов была установлена трубка в плевральной полости, а фибринолиз с помощью ретеплазы использовали только как «терапию спасения») длительность пребывания в стационаре оказалась меньшей у лиц из группы ТХВВК. Исходя из доступных в настоящее время данных, дренирование плевральной полости с введением фибринолитиков и ТХВВК рассматриваются как приемлемые способы начального дренирования.
XIII. Когда следует рассматривать возможность ТХВВК или открытой декортикации у больных с установленной в плевральной полости дренажной трубкой, получавших или не получавших фибринолитическую терапию?
Рекомендации
67. ТХВВК следует провести при персистировании выпотов средних и более размеров и сохраняющейся дыхательной недостаточности, несмотря на ~ 2–3 дня лечения с установленной в плевральной полости дренажной трубкой и завершенную фибринолитическую терапию. Другой возможностью ведения таких детей является открытое удаление некротизированных тканей с декортикацией, однако оно ассоциируется с большей заболеваемостью (значимая рекомендация; доказательства низкого уровня).
Резюме рекомендаций
Примерно 17 % детей с парапневмоническими выпотами, леченных посредством введения фибринолитиков через дренажную трубку, нуждаются в дальнейших вмешательствах для завершения дренирования плевральной полости. Кандидатами на ТХВВК, открытую торакотомию или декортикацию являются дети с персистирующим выпотом средних и более размеров и сохраняющейся дыхательной недостаточностью, несмотря на ~ 2–3 дня лечения с установленной в плевральной полости дренажной трубкой и получение фибринолитической терапии. Персистирование одной только лихорадки не является свидетельством неэффективности лечения. Для оценки адекватности дренирования плевральной полости и дифференцировки между скоплениями осумкованной жидкости и некротизирующим поражением паренхимы следует выполнить КТ ОГК. При неудаче в случаях использования дренажной трубки с введением фибринолитиков дренирование плевральной полости чаще всего завершают проведением ТХВВК. Потребность в открытой декортикации у детей возникает редко. Как правило, нет нужды в получении серий рентгенограмм ОГК после ТХВВК или установки дренажной трубки.
XIV. Когда следует удалять дренажную трубку: после первичного дренирования или ТХВВК?
Рекомендации
68. Дренажную трубку можно удалять при отсутствии пневмоторакса и в случае дренирования плевральной жидкости < 1 мл/кг/24 ч, объем которой обычно рассчитывается за последние 12 ч (значимая рекомендация; доказательства очень низкого уровня).
Резюме рекомендаций
Если дренажная трубка установлена — неважно, в качестве стартовой терапии или после ТХВВК, критерии для ее удаления включают в себя отсутствие пневмоторакса и дренирование < 1 мл/кг/24 ч плевральной жидкости, объем которой обычно рассчитывается за последние 12 ч, либо ~ 25–60 мл за 24-часовой промежуток времени. Обычно это происходит в течение 48–72 ч после операции или завершения фибринолиза.
XV. Какая антибактериальная терапия и какой продолжительности показана для лечения парапневмонического выпота/эмпиемы?
Рекомендации
69. Если при культуральном исследовании крови или плевральной жидкости выделен патогенный изолят, для определения антибактериального режима следует использовать результаты определения чувствительности к антибиотикам (значимая рекомендация; доказательства высокого уровня).
70. При культурально-негативных парапневмонических выпотах выбор антибиотиков должен базироваться на рекомендациях по лечению больных, госпитализированных по поводу ВП (см. резюме доказательств к рекомендациям 46–49) (значимая рекомендация; доказательства среднего уровня).
71. Длительность антибактериальной терапии зависит от адекватности дренирования и от клинического ответа на лечение, который индивидуален для каждого больного. У большинства детей адекватная продолжительность антибактериальной терапии — 2–4 нед. (значимая рекомендация; доказательства низкого уровня).
Резюме рекомендаций
Антибиотикотерапия парапневмонического выпота или эмпиемы такая же, как ВП без выпота. Бактериальные возбудители ВП, парапневмонического выпота или эмпиемы тоже одинаковые. В большинстве исследований чаще других выделяли S.pneumoniae, хотя S.aureus остается важным возбудителем эмпиемы, но реже встречается при неосложненных ВП. Когда только возможно, антибактериальная терапия должна быть направлена на возбудителя (на основании результатов культурального исследования крови или плевральной жидкости). К сожалению, посевы плевральной жидкости часто оказываются негативными из-за высокой частоты случаев применения антибиотиков до того, как был получен материал для исследований. В подобных случаях лечение базируется на локальных эпидемиологических данных и должно быть активным в отношении наиболее распространенных возбудителей (см. резюме доказательств к рекомендациям 46–49). Если используется молекулярное тестирование, культурально-негативные эмпиемы обычно вызваны S.pneumoniae и редко — S.aureus. Позитивные результаты бактериологического исследования при стафилококковых эмпиемах (в особенности вызванных CA-MRSA) отмечаются значительно чаще, чем при пневмококковых. В одном из исследований 63 образцов плевральной жидкости (посев + ПЦР) все случаи инфекции CA-MRSA обнаруживали с помощью обоих методов. Ни одного случая MRSA не было выявлено при ПЦР культурально-негативной плевральной жидкости. Тем не менее эти данные нуждаются в подтверждении в регионах с высокой распространенностью CA-MRSA.
Оптимальная длительность антибактериальной терапии парапневмонических выпотов или эмпиемы зависит от адекватности дренирования и может различаться при разных возбудителях, однако не была охарактеризована в рандомизированных контролируемых исследованиях. Обычно рекомендуется лечение на протяжении 2–4 недель; некоторые эксперты предлагают продолжать терапию в течение ~ 10 дней после нормализации температуры тела.
Ведение ребенка, не отвечающего на терапию
XVI. Каково адекватное ведение ребенка, не отвечающего на терапию ВП?
Рекомендации
72. Детей, не ответивших в течение 48–72 ч на стартовую терапию, следует лечить одним или несколькими нижеследующими способами:
а) провести клиническую и лабораторную оценку тяжести заболевания, чтобы определить потребность в оказании медицинской помощи более высокого уровня (значимая рекомендация; доказательства низкого уровня);
б) выполнить визуализирующие исследования для оценки выраженности и прогрессирования пневмонического или парапневмонического процесса (малозначимая рекомендация; доказательства низкого уровня);
в) произвести дополнительные исследования для выяснения, продолжает ли персистировать исходный возбудитель, развилась ли у него резистентность к используемому антибиотику или же появился новый вторичный инфекционный агент (малозначимая рекомендация; доказательства низкого уровня).
73. У ребенка, находящегося на искусственной вентиляции легких, с помощью бронхоальвеолярного лаважа (БАЛ) следует получить образцы для окраски по Граму и культурального исследования (значимая рекомендация; доказательства среднего уровня).
74. У длительно и тяжело болеющего ребенка, у которого прежние исследования не позволили поставить микробиологический диагноз, с помощью чрескожной аспирации легких следует получить образцы для окраски по Граму и культурального исследования (малозначимая рекомендация; доказательства низкого уровня).
75. У длительно болеющего ребенка, находящегося в критическом состоянии на искусственной вентиляции легких, у которого прежние исследования не позволили поставить микробиологический диагноз, следует получить образцы для окраски по Граму и культурального исследования с помощью биопсии открытого легкого (малозначимая рекомендация; доказательства низкого уровня).
Резюме рекомендаций
Решение трактовать пациента как не отвечающего на лечение бактериальной или вирусной ВП опирается на врачебную интерпретацию клинического течения заболевания и, иногда, лабораторные данные. В целом врач расценивает больного как не отвечающего на лечение при отсутствии улучшения в течение 48–72 ч от начала терапии или при значительном ухудшении в любое время после начала лечения.
Количество детей с ВП, не ответивших на лечение, оценивается в промежутке от ~ 5 до 15 % среди госпитализированных пациентов. Эти данные близки к результатам метаанализа проспективных рандомизированных исследований у взрослых, в котором изучали распространенность клинических неудач. Персистирующая лихорадка и ухудшение состояния пациента, потребовавшие изменения антибиотикотерапии, наблюдались, согласно данным метаанализа, у 16 % пациентов.
Краеугольным камнем утверждения об отсутствии ответа на лечение является клиническое суждение, хотя иногда на него влияют результаты лабораторных и/или визуализирующих исследований. Относительная значимость этих факторов варьирует в зависимости от возраста, условий лечения (амбулаторно/в стационаре/в ОРИТ), тяжести заболевания, степени клинического ухудшения и длительности отсутствия улучшения.
Следующие факторы влияют на трактовку пациента как не отвечающего на лечение спустя 48–72 ч от начала терапии:
А. Основные показатели состояния организма и насыщения крови кислородом:
1. Персистирование или усугубление лихорадки.
2. Учащенное дыхание, стонущее дыхание, втяжения на грудной клетке, цианоз.
3. Персистирующая тахикардия.
4. Насыщение кислородом < 90 % при дыхании комнатным воздухом, потребность в снабжении кислородом или вентиляции легких.
В. Системные или очаговые признаки:
1. «Токсическое состояние» (оценка по клиническим признакам или изменению психического статуса).
2. Боль в грудной клетке, наложение шины на грудную клетку.
3. Неспособность принимать жидкости внутрь.
4. Выраженность патологических шумов в легких или отсутствие шумов при аускультации либо тупость при перкуссии.
С. Лабораторные и/или рентгенологические данные:
1. Число лейкоцитов в периферической крови, количество и процентное содержание незрелых форм нейтрофилов.
2. Концентрации маркеров воспаления (например, прокальцитонина, СРБ).
3. Выделение возбудителя при культуральном исследовании; под возбудителями заболеваний, не отвечающих на лечение, понимают микроорганизмы, резистентные к проводимой терапии либо чувствительные к назначенным препаратам, но при неадекватном их количестве в инфицированных тканях, неадекватном дренировании эмпиемы или абсцесса либо неадекватной длительности терапии.
4. Обширное вовлечение паренхимы, наличие или увеличение количества жидкости в плевре либо возникновение абсцесса легких или некротизирующей пневмонии, что подтверждается визуализирующими методиками (рентгенография ОГК, ультрасонография, КТ).
У детей с не поддающейся лечению ВП следует повторно оценивать тяжесть заболевания, чтобы определить потребность в оказании медицинской помощи более высокого уровня, например госпитализации (в том числе в специализированное отделение) или перевода в ОРИТ. Следует мониторировать параметры, улучшение которых ожидается: температуру тела, частоту дыхания, респираторный дистресс (втяжения в грудной клетке, стонущее дыхание) и гипоксемию (с помощью пульсоксиметрии). Мониторируют также общий ответ ребенка: активность, аппетит, состояние гидратации. Некоторых детей, не отвечающих на лечение в амбулаторных условиях, следует госпитализировать (см. резюме доказательств к рекомендации 1), если не удается поддерживать адекватную оксигенацию или гидратацию либо появляются признаки чрезмерной работы аппарата дыхания или интоксикации. У детей, которых первоначально лечили пероральными антибиотиками по поводу предполагаемой бактериальной или атипичной ВП в амбулаторных условиях, возбудителями заболевания могут быть микроорганизмы, нечувствительные к стартовой терапии, в связи с чем потребуется назначение альтернативных или дополнительных антибактериальных или противовирусных средств.
У детей с ВП средней тяжести и выше, не отвечающих на лечение, следует провести рентгенологическое исследование, особенно при наличии клинических признаков повышения работы дыхательного аппарата, обширных областей легких, над которыми выслушиваются патологические шумы и хрипы, появлении тупости при перкуссии в местах, где она ранее отсутствовала. У амбулаторных больных предпочтение отдается рентгенографии ОГК в переднезадней и боковой проекциях. При подозрении на наличие выпота средних или крупных размеров показаны рентгенография ОГК в боковой проекции в положении лежа или ультрасонография ОГК (см. резюме доказательств к рекомендации 57). При подозрении на наличие образований в грудной клетке, абсцесса легких или некротизирующей пневмонии следует произвести КТ ОГК.
Детей с осложнениями пневмонии, включая выпоты средних и крупных размеров, следует проконсультировать у специалистов с опытом торакоцентеза и обеспечить дренирование с введением фибринолитиков и/или ТХВВК (см. резюме доказательств к рекомендациям 58 и 59).
Повторный анализ бактериальных возбудителей включает в себя посев мокроты у кашляющих детей, способных отхаркивать мокроту. У детей с парапневмоническими выпотами, не отвечающих на одну только антимикробную терапию, следует взять образцы плевральной жидкости для посева, окраски по Граму и, при возможности, ПЦР или выявления антигенов. Образцы также следует проанализировать на предмет наличия микобактерий и грибов — при наличии соответствующих клинических показаний. Необходимо оценить целесообразность дренирования или откачивания выпота. У тяжелых больных, нуждающихся в ИВЛ, могут быть полезными образцы для культурального исследования, полученные при бронхоскопии с использованием БАЛ, защищенных щеток, либо аспират трахеи.
У детей ВП обычно вызывается традиционными респираторными патогенами (см. раздел «Этиология»), хотя возбудителями могут быть и редкие микроорганизмы. При неэффективности стартовой эмпирической антибактериальной терапии, в особенности у детей, у которых на первых порах идентификация этиологии не рассматривалась среди приоритетов, следует предпринять настойчивые попытки установить возбудителей. Более того, следует выяснить, не обусловлено ли ухудшение состояния тем, что заболевание вызвано резистентными типичными бактериальными и вирусными патогенами или необычными возбудителями, включая грибы, микобактерии и паразитов. Следует исключить и вторичную бактериальную инфекцию из дыхательных путей, сдавленных снаружи или закупоренных изнутри.
При неуспехе стартовой терапии у госпитализированных больных может потребоваться расширение спектра антимикробной терапии. Возможные причины: возбудители не охватываются спектром действия назначенных антибиотиков; у них развилась резистентность в процессе лечения; произошла селекция субпопуляции патогенов, обладающих природной устойчивостью к назначенному препарату, причем эта субпопуляция не была выявлена во время начального бактериологического исследования. Например, больному, первоначально леченному ампициллином внутривенно, может потребоваться добавление оксациллина или цефазолина, чтобы гарантировать активность в отношении MSSA, клиндамицина (при нетяжелых инфекциях) или ванкомицина (при тяжелых и жизнеугрожающих инфекциях) для воздействия на MRSA. Другой пример: при длительном лечении ванкомицином инфекции, вызванной CA-MRSA, может произойти селекция «гетерорезистентности» к ванкомицину с повышением МПК, что потребует увеличения дозы антибиотика для достижения излечения. Больных, нуждающихся в разного рода вмешательствах для поддержания оксигенации крови или перфузии, например ИВЛ, кардиоваскулярной поддержке, экстракорпоральной мембранной оксигенации, следует перевести в ОРИТ.
Если неэффективность терапии предположительно обусловлена вирусной или вирусно-бактериальной коинфекцией, подтверждение значимости вирусов может быть полезным. Достоинством быстрого тестирования на наличие антигенов и ПЦР является малое время производственного цикла, однако ограниченная доступность и дороговизна ПЦР представляют собой сдерживающий фактор.
Клиническая неудача возможна и в случаях гриппозных ВП, когда возбудитель устойчив к эмпирической терапии осельтамивиром. Возможные альтернативы включают в себя занамивир и препараты, проходящие этап клинических испытаний. Дети с вирусной ВП, течение которой ухудшается, должны получать противовирусное лечение (если оно доступно); следует предпринять дальнейшие диагностические исследования, направленные на идентификацию ранее не обнаруженных бактериальных возбудителей (см. резюме доказательств к рекомендациям 28, 29, 39 и 40).
У детей с изначально вирусной ВП изредка возникает вторичная инфекция. Чаще это бывает у госпитализированных детей младших возрастных групп, особенно с гриппом или инфекцией РСВ, нуждающихся в лечении в ОРИТ. Если подозрение на вторичную бактериальную инфекцию обусловлено клиническим ухудшением и подтверждается лабораторными признаками усугубления системного воспаления, тогда оправдан поиск бактериальных возбудителей. В свою очередь, спектр антимикробной терапии должен быть расширен за счет распространенных бактериальных возбудителей с учетом данных о локальной резистентности. Изредка у детей в возрасте і 3–5 лет оправданно тестирование для выявления Mycoplasma pneumoniae и C.pneumoniae, в особенности при наличии билатеральных инфильтратов в прикорневой зоне и свистящего дыхания. Если результаты исследования приходится ожидать несколько дней, следует начать эмпирическую терапию с добавлением макролида, тетрациклина или фторхинолона (см. резюме доказательств к рекомендациям 44 и 48).
XVII. Как следует лечить ребенка с абсцессом легкого или некротизирующей пневмонией, если он не отвечает на терапию?
76. Абсцесс легкого или некротизирующая пневмония, установленные у больного, не отвечающего на терапию, сначала можно лечить с помощью внутривенного введения антибиотиков. Полностью сформировавшиеся периферические абсцессы, не связанные с бронхиальным деревом, можно дренировать под контролем визуализирующей техники либо путем аспирации, либо посредством установки дренажной трубки в нужное место. Тем не менее большинство абсцессов дренируются через бронхиальное дерево и излечиваются без хирургического или интервенционного вмешательства (малозначимая рекомендация; доказательства очень низкого уровня).
Резюме рекомендаций
Большинство абсцессов легких возникают в ранее здоровом легком в результате первоначальной пневмонии. Абсцесс и/или некроз ткани легкого могут обусловить неэффективность терапии. У больных, не отвечающих на лечение и имеющих на рентгенограммах ОГК признаки, не позволяющие исключить абсцесс или некротизирующую пневмонию, для решения этого вопроса следует провести КТ с контрастированием. Как правило, хирургического вмешательства следует избегать, поскольку большинство абсцессов разрешаются при назначении одних только антибиотиков. Однако при периферических абсцессах, не связанных с бронхами, разумной альтернативой будет дренирование под контролем КТ или установка катетера в полость абсцесса. Согласно ретроспективным данным, дренирование сокращает длительность пребывания в стационаре и ускоряет выздоровление. Следует провести микробиологическое исследование образцов материала, полученных при дренировании.
Детей с вторичными абсцессами, обусловленными аномалиями или повреждениями легких (например, врожденным кистозным аденоматоидным пороком развития, секвестрацией легких), следует проконсультировать у хирурга. Необходимо согласовать стратегию лечения выявленного повреждения и определить потребность в хирургической резекции легкого. Больных с некротизирующей пневмонией следует лечить медикаментами, поскольку хирургическое вмешательство и/или установка трубок в грудной клетке с помощью троакара повышает риск возникновения бронхоплевральной фистулы.
Критерии выписки
XVIII. Когда можно без риска выписывать госпитализированного ребенка с ВП?
Рекомендации
77. Больные являются кандидатами на выписку, если у них документировано всестороннее клиническое улучшение, включая уровень активности, аппетит и снижение лихорадки в течение не менее 12–24 ч (значимая рекомендация; доказательства очень низкого уровня).
78. Больные являются кандидатами на выписку, если у них при дыхании комнатным воздухом показатели пульсоксиметрии стабильно > 90 % в течение не менее 12–24 ч (значимая рекомендация; доказательства среднего уровня).
79. Больные являются кандидатами на выписку, только если у них стабильное и/или исходное психическое состояние (значимая рекомендация; доказательства очень низкого уровня).
80. Больные не являются кандидатами на выписку, если у них существенно повышена работа дыхания или имеется стойкая одышка или тахикардия (значимая рекомендация; доказательства высокого уровня).
81. Перед выпиской из стационара следует удостовериться, что больные способны переносить антиинфекционную терапию в домашних условиях, будь она пероральной или внутривенной, и дышать кислородом в домашних условиях, если это необходимо (значимая рекомендация; доказательства низкого уровня).
82. В случаях с детьми раннего возраста, нуждающихся в пероральной антибактериальной терапии в амбулаторных условиях, врачам до выписки следует убедиться, что родители способны применять антибиотики, а дети — адекватно их принимать (малозначимая рекомендация; доказательства очень низкого уровня).
83. Больных с дренажной трубкой в плевральной полости, соответствующих вышеперечисленным критериям, можно выписывать спустя 12–24 ч после удаления дренажной трубки, если отсутствуют признаки клинического ухудшения после удаления трубки либо при рентгенологическом исследовании органов грудной клетки, предпринятом по клиническим показаниям, не выявлено значительного повторного скопления парапневмонического выпота или пневмоторакса (значимая рекомендация; доказательства очень низкого уровня).
84. У детей с ограничениями для оказания медицинской помощи, включая сомнения в возможности тщательного наблюдения на дому, неспособность соблюдения предписанного режима терапии, трудности в контроле за отдаленными результатами, эти проблемы следует выяснить и разрешить до выписки (значимая рекомендация; доказательства очень низкого уровня).
Резюме рекомендаций
В настоящее время отсутствуют исследования, где бы наилучшим образом были описаны критерии выписки больных. В таких условиях обыкновенно ориентируются на следующие критерии: 1) у ребенка снижается температура тела; 2) пациент не нуждается в снабжении кислородом; 3) ребенок без затруднений принимал пищу и жидкости не менее 12–24 ч; 4) если у больного ранее была установлена дренажная трубка, после ее удаления признаки пневмоторакса отсутствовали не менее 12–24 ч. У взрослых улучшение при пневмонии определяется прежде всего снижением температуры тела, исчезновением одышки и тахикардии, улучшением систолического давления и устранением потребности в снабжении кислородом (по данным пульсоксиметрии). У детей критерии стабилизации состояния при пневмонии определены менее четко.
Лихорадка — чрезвычайно распространенный симптом пневмонии. Она может сохраняться в течение нескольких дней, несмотря на адекватную терапию, особенно у детей с осложненным течением заболевания. В исследовании у взрослых снижение порога «стабилизации» температуры тела не изменяло сроков выписки из стационара. Таким образом, по крайней мере у этой группы больных стабилизация температуры не является отправной точкой для решения о выписке. Поскольку устранение лихорадки — признак адекватного лечения бактериальной пневмонии, его можно использовать для подтверждения адекватности терапии, когда отсутствуют данные о возбудителе и чувствительности к антибиотикам.
Среди врачей существуют значительные разногласия в определении показателей пульсоксиметрии, при которых больных с пневмонией можно выписывать без опасений. При вирусных заболеваниях дыхательных путей пороговый уровень 90 % рекомендуется для снабжения кислородом.
Дети раннего возраста, которым назначены антибиотики с неприятным вкусом, склонны выплевывать медикаменты. Как полагают, для больных этой возрастной группы, принимающих медикаменты в жидком виде, вкус оказывает большее влияние на прием выписанных лекарств, чем интервал между приемами или длительность дозирования. Важно попробовать дать антибиотики внутрь до выписки, в особенности такие средства, как клиндамицин в жидком виде, который отличается неприятным вкусом. Вкусовые качества некоторых суспензий антибиотиков можно улучшить с помощью вкусовых приправ, имеющихся дома. Участковому педиатру следует убедиться, что ребенок по-прежнему переносит пероральную антимикробную терапию.
У детей с осложненной пневмонией нередко производятся хирургические вмешательства по дренированию скоплений жидкости в плевре. Почти в каждом третьем случае возникает потребность в повторном дренировании. Длительность пребывания в стационаре и вероятность повторного накопления жидкости значительно снижается после ТХВВК или фибринолиза через дренажную трубку, но не устраняется полностью (см. резюме доказательств к рекомендациям 64 и 65). При подготовке выписки пациента следует убедиться в отсутствии продолжающегося накопления жидкости в плевральной полости. В противном случае следует более консервативно подойти к критериям выписки. У больных, не получавших фибринолитическую терапию или ТХВВК, оправдан более длительный период наблюдения за возможным накоплением жидкости.
Разумно учитывать экономические и социальные условия, оказывающие влияние на комплаентность и безопасность выписки из стационара. Хотя влияние стоимости медикаментов для амбулаторного лечения на соблюдение режима терапии при педиатрических пневмониях не изучали, родители, принадлежащие к малообеспеченным слоям общества, менее склонны выполнять предписания врачей при разных заболеваниях.
В крупном канадском исследовании детей с пневмонией чаще госпитализировали только потому, что они происходили из семей с низким социально-экономическим статусом, вероятно, из-за невозможности своевременного обращения за квалифицированной помощью в амбулаторных условиях. В другом исследовании в США дети, госпитализированные с ВП, родом из семей, чей доход был ниже федерального порога бедности, составили 11 % пациентов, чьей госпитализации можно было избежать.
XIX. Когда в амбулаторных условиях в отличие от ступенчатой терапии показана парентеральная терапия?
Рекомендации
85. Амбулаторную парентеральную антибактериальную терапию следует предлагать семьям детей, которые более не нуждаются в квалифицированной медсестринской помощи в отделениях скорой и неотложной медицинской помощи, но у которых очевидна необходимость в продолжении парентеральной терапии (малозначимая рекомендация; доказательства среднего уровня).
86. Амбулаторную парентеральную антибактериальную терапию следует проводить при наличии квалифицированных педиатрических медсестер, выполняющих манипуляции на дому, либо посредством ежедневных внутримышечных инъекций в оборудованном педиатрическом амбулаторном учреждении (малозначимая рекомендация; доказательства очень низкого уровня).
87. Проведение, когда возможно, ступенчатой терапии с переводом больного на прием медикаментов внутрь предпочтительнее амбулаторной парентеральной терапии (значимая рекомендация; доказательства низкого уровня)
Резюме рекомендаций
Парентеральная антимикробная терапия с успехом применяется уже > 20 лет у детей и взрослых для лечения широкого круга инфекций, включая пневмонии. Если отсутствует необходимость в стационарном лечении и создан коллектив для ведения пациента в амбулаторных условиях (состоящий из педиатра, квалифицированной педиатрической медсестры и педиатрического фармацевта), возможна успешная парентеральная антибактериальная терапия ВП различными антибиотиками. Дети, которым может потребоваться продолжение парентеральной терапии в амбулаторных условиях, — это пациенты с неизлеченной пневмонией, нуждающиеся в создании высоких плазменных концентраций антибиотиков для достижения достаточных концентраций в инфицированных тканях при обширном поражении паренхимы легких, наличии парапневмонических выпотов или абсцессов легких. Специфические критерии идентификации таких пациентов не разработаны.
Исследования, в которых бы сравнивалась эффективность пероральной и парентеральной терапии в амбулаторных условиях у детей с ВП, не проводились. Риск побочных эффектов при приеме антибиотиков внутрь ниже, чем при внутривенном введении.
В ранних ретроспективных исследованиях была продемонстрирована эффективность ступенчатой терапии у детей, включая больных с ВП. В более поздних исследованиях ступенчатой терапии при остеомиелите, включая проспективные данные о больных детях, установлена безопасность и эффективность перорального амбулаторного лечения тяжелых бактериальных инфекций. В исследованиях также подчеркивается сравнительно высокая частота осложнений при введении с периферии центральных венозных катетеров. Это обстоятельство свидетельствует в пользу резервирования парентеральной терапии в амбулаторных условиях для детей, не способных переносить (либо принимать, либо абсорбировать) эффективные антибиотики для приема внутрь, а также для пациентов с инфекциями, вызванными резистентными бактериями, для лечения которых отсутствуют эффективные пероральные антибиотики.
Профилактика
XX. Можно ли предупредить педиатрическую ВП?
Рекомендации
88. Для предупреждения ВП детям следует сделать прививки против бактериальных патогенов, включая S.pneumoniae, Haemophilus influenzae типа b, и коклюша (значимая рекомендация; доказательства высокого уровня).
89. Всех детей в возрасте і 6 мес., включая подростков, для предупреждения ВП следует ежегодно прививать противогриппозной вакциной (значимая рекомендация; доказательства высокого уровня).
90. Родителей и лиц, ухаживающих за детьми в возрасте < 6 мес., беременных подростков следует привить противогриппозной и противококлюшной вакцинами, чтобы не допустить экспозиции детей к этим инфекциям (значимая рекомендация; доказательства низкого уровня).
91. Заболеваемость пневмококковыми постгриппозными ВП снижается после вакцинации против гриппа (значимая рекомендация; доказательства низкого уровня).
92. Детям группы высокого риска следует проводить иммунопрофилактику против респираторного синцитиального вируса (РСВ) специфическими моноклональными антителами для снижения риска тяжелой пневмонии, вызванной РСВ, и связанной с этим госпитализации (значимая рекомендация; доказательства высокого уровня).
В связи с серьезными различиями в системах оказания медицинской помощи в Украине и в США аргументация изложенных рекомендаций в данной работе не приводится. По этим же соображениям из изложения рекомендаций исключен раздел о направлениях будущих исследований и анализ стоимости лечения.
Подготовил И.Г. Березняков
1. Bradley J.S., Byington C.L., Shah S.S., Alverson B., Carter E.R., Harrison C. et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America // Clin. Infect. Dis. — Advance Access published August 30, 2011. — e1-e52.