Журнал «Здоровье ребенка» 5 (32) 2011
Вернуться к номеру
Хронический атрофический гастрит у детей
Авторы: Белоусов Ю.В. Харьковская медицинская академия последипломного образования
Рубрики: Педиатрия/Неонатология
Версия для печати
Обсуждаются вопросы дефиниции хронического атрофического гастрита у детей. Подчеркивается, что эта форма заболевания требует дифференцированного подхода к диагностике и лечению.
Хронический атрофический гастрит, критерии диагностики, дети.
Анализ имеющейся педиатрической литературы и многолетние собственные наблюдения невольно заставляют поставить вопрос: существует ли вообще хронический атрофический гастрит у детей, поскольку морфологическое понятие «атрофия слизистой оболочки» связывается прежде всего с патологией взрослых. Если нет, то это означает, что кроме деструктивных процессов слизистой оболочки желудка (СОЖ) (эрозивно-язвенные поражения) в детском возрасте других форм хронического воспалительного процесса в желудке (поверхностный гастрит) не встречается, т.к. все варианты эритематозной гастропатии (эндоскопическая характеристика состояния СО желудка), соответствующие понятию «хронический поверхностный гастрит», трактуются в настоящее время как проявления функциональной диспепсии. Это привело к практическому вытеснению диагноза «хронический поверхностный гастрит» и подмене его диагнозом «функциональная диспепсия» (ФД) [2, 3]. Нет нужды говорить, что с морфологической точки зрения это является нонсенсом. Чтобы более определенно трактовать сущность функциональной диспепсии, некоторые исследователи [5] предложили даже выделять две основные формы функциональной диспепсии: ФД без морфологических изменений и ФД с морфологическими изменениями.
Если принять во внимание, что хронический гастрит с морфологической (и клинической) точки зрения представляет собой стадийный процесс, который развивается от поверхностных до атрофических изменений и соответственно от повышенной до пониженной кислотности, то правомерно считать, что в детском возрасте преобладают начальные (поверхностные) формы заболевания, сопровождающиеся повышенной кислотностью, а у взрослых — атрофические формы с низкой кислотностью. Иными словами, во-первых, для формирования хронического атрофического гастрита (ХАГ) необходимо время, во-вторых — именно ХАГ является завершающей (классической) формой ХГ, тогда как остальные морфологические варианты (поверхностный, с поражением желез без атрофии) — промежуточными стадиями, которые необоснованно относят к ФД.
Итак, диагноз хронического гастрита в современных условиях можно поставить в двух случаях: при наличии эрозивных изменений слизистой оболочки (что в детском возрасте встречается не так уж редко) или атрофических изменений СО. При этом в первом случае диагноз может основываться на результатах эндоскопического исследования, во-втором — требуется морфологическое исследование биоптата СО желудка. Эндоскопическое исследование в педиатрической практике является рядовым, морфологическое — эксквизитным. Может быть, именно поэтому существует представление об отсутствии или исключительной редкости атрофического гастрита в детском возрасте.
Атрофия СО фундального отдела или тела желудка с позиций классической патоморфологии представляет собой «необратимую утрату желез желудка с замещением их фиброзной тканью или метаплазированным эпителием». Такое состояние формируется «на протяжении десятилетий, когда хронический гастрит переходит в гастрит атрофический» [14]. P. Sipponen [20] определил хронический гастрит как опосредованный возрастом прогрессирующий процесс, в результате которого происходит «постепенная утрата желез, завершающаяся тотальной атрофией слизистой оболочки»: В МКБ-10 атрофия СО желудка представлена всего лишь одной нозологической формой, имеющей название «хронический атрофический гастрит» (К.29.4).
Чаще всего атрофия является следствием разрушительного действия на слизистую оболочку желудка, париетальные и главные клетки длительного воспалительного процесса под влиянием инфекцииH.pylori, но может развиться в результате аутоиммунного процесса или длительно текущего рефлюкс-гастрита. Железистая ткань постепенно замещается фиброзной [18, 21]. Сопутствующими факторами на фоне Нр-инфекции являются несбалансированное питание (прежде всего избыток поваренной соли), прием нестероидных противовоспалительных препаратов, курение.
Уже простое перечисление этих факторов свидетельствует о том, что они играют свою роль также в детском и подростковом возрасте: H.pylori-инфекция распространена значительно — у детей с 12-летнего возраста инфицированность практически не отличается от инфицированности взрослых, аллергические и аутоаллергические процессы достаточно часты, дуоденогастральный рефлюкс нередко сопровождает гастродуоденальную патологию, да и курение не столь уж редко, особенно в подростковом возрасте.
Трудно предположить, что перечисленные факторы оказывают патогенное влияние и приводят к развитию атрофического гастрита у взрослых и не сказываются на детях. Следовательно, в детском возрасте имеются все условия для развития атрофического процесса СО желудка, и эти изменения необходимо только выявлять.
О.Я. Бабак [1] отмечает, что естественное течение атрофического гастрита может протекать по двум основным вариантам. Первый — длительно существующий ХГ приводит к значительному снижению кислотообразующей функции желудка, требующему заместительной терапии, без которой будут наблюдаться признаки нарушения пищеварительной функции. Второй вариант — в результате длительного хронического персистирующего воспаления в СО желудка, характерного для H.pylori-ассоциированного гастрита, происходит нарушение клеточного обновления в желудке, что способствует появлению клеток-мишеней для влияния на них канцерогенных веществ, в дальнейшем — к клеточным мутациям. В результате нормальный клеточный эпителий желудка замещается метапластическим, диспластическим и неопластическим. Иными словами, атрофический гастрит может по праву считаться предраковым состоянием. Детскому и подростковому возрасту, по-видимому, более присущ первый вариант с постепенным снижением кислотообразующей функции желудка.
Ю.А. Лысиков, Т.А. Малицына и Е.А. Рославцева [9] считают, что атрофические гастриты у детей являются актуальной клинической проблемой, которая до конца не решена по сей день. Авторы приходят к выводу, что микроатрофию различных отделов СО желудка у детей можно выявить только при морфологическом исследовании. Она выражается в уменьшении толщины СО, толщины зоны слизистого эпителия и глубины желез. Атрофия желез заключается в уменьшении численности клеток, продуцирующих пепсины, и париетальных клеток, выделяющих соляную кислоту. Атрофия может затрагивать одну или обе популяции клеток, что приводит к нарушению или уменьшению секреции пепсинов и соляной кислоты. Л.М. Мосийчук и М.Ю. Зак [11] показали, что использование в клинической практике определения уровня G-17 (гастрин) и РG-1 (пепсиноген-1) в сыворотке крови может способствовать (наряду с гастробиопсией) верификации атрофического процесса в желудке. Методика основывается на том, что гастрин-17 (G-17) синтезируется в G-клетках, расположенных в антральном отделе желудка и снижение его уровня в крови может свидетельствовать об атрофических процессах в антральном отделе желудка, Пепсиноген-1 (PG-1) синтезируется в главных клетках, расположенных в фундальном отделе желудка. Снижение уровня PG-1 может свидетельствовать об атрофических процессах в фундальном отделе желудка. Авторы подтверждают точку зрения F. Di Mario, L.G. Cavallaro [17], что на первом этапе больным с диспептическими жалобами необходимо проводить анализ серологических маркеров, а в случае изменения их содержания — эндоскопическое исследование с гастробиопсией. Последнее положение особенно интересно для педиатрической практики, т.к. позволяет ограничить, а иногда и исключить необходимость эндоскопического исследования.
Ряд исследователей [16, 17, 19] подтверждают взаимосвязь между снижением уровня в сыворотке крови G-17 и PG-1 и увеличением степени атрофии СО соответственно антрального отдела и тела желудка.
Выше уже подчеркивалось, что непременным условием верификации атрофического процесса является фиброскопия с гастробиопсией; при этом в терапевтической практике современные требования определяют необходимость взятия не менее пяти биоптатов — трех из антрального отдела и двух из тела желудка, хотя это далеко не всегда позволяет выявить атрофию, которая обычно носит очаговый характер и не всегда, даже при условии взятия пяти биоптатов, попадает в поле зрения патоморфолога [11].
Не это ли обстоятельство является ключевым в плане диагностики хронического атрофического гастрита у детей? Морфологическое исследование СО в педиатрической практике вообще является достаточно редким, проводится только в специализированных учреждениях по специальным показаниям. При этом обычно ограничиваются взятием двух (а иногда и одного) биоптатов. Неудивительно, что в таких условиях атрофия выявляется редко и диагноз «хронический атрофический колит» является эксквизитным. Иными словами, чтобы установить частоту развития хронического атрофического гастрита у детей, необходимы более массовые морфологические исследования с большим числом биоптатов в каждом случае, чего трудно ожидать в ближайшее время в силу хоть и минимальной, но все же инвазивности процедуры, с одной стороны, и необходимости достаточно дорогостоящих морфологических исследований — с другой.
Поделиться своими наблюдениями о выявлении ХАГ в детском возрасте могут только специализированные детские гастроэнтерологические отделения, годами наблюдающие детей с гастродуоденальной патологией и накопившие сведения об эндоскопических и (пусть в редких случаях) морфологических исследованиях. Однако таких сведений в педиатрической литературе явно недостаточно.
Наиболее полную информацию о состоянии проблемы хронического гастрита у детей, в том числе атрофического гастрита, можно получить при анализе ежегодных конференций «Актуальные вопросы абдоминальной патологии у детей», проводимых в Москве или Санкт-Петербурге, в которых принимают активное участие многие практикующие детские гастроэнтерологи России и стран СНГ и практически все профессора, занимающиеся изучением заболеваний пищеварительной системы у детей. По материалам этих конференций издаются солидные сборники, последний ХVII издан в 2010 году.
Анализ публикуемых сообщений показывает, что проблеме хронического гастрита (гастродуоденита) у детей уделяется значительное внимание. И если говорить о трансформации представлений о хроническом гастрите, то основным положением стал пересмотр трактовки минимальных (поверхностных) изменений слизистой оболочки желудка. Начальные поверхностные изменения, которые эндоскопически характеризовались как эритематозная гастропатия, а морфологически — как поверхностный гастрит, перестали считать доказательством наличия воспалительного процесса, полагая, что, поскольку клинические проявления заболевания определяются не наличием эритематозной гастропатии, последнюю следует расценивать как функциональную диспепсию. С точки зрения классической патоморфологии это нонсенс, и патоморфологи никогда не согласятся с подобной трактовкой, но такой подход привел практически к вытеснению диагноза «хронический поверхностный гастрит» из клинической практики. Однако, как ни относиться к подобной трактовке диагноза, очевидно, что к хроническому атрофическому гастриту это не имеет отношения.
О функциональной диспепсии (она же морфологически хронический поверхностный гастрит) пишут очень много, в то же время хроническому атрофическому гастриту посвящены лишь отдельные сообщения.
Л.Н. Малямова, А.М. Чередниченко, С.Ю. Медведева из Екатеринбурга [10], подчеркивая, что вопрос о возможности развития атрофических изменений слизистой оболочки желудка как завершающего этапа длительно текущего воспалительного процесса у детей остается дискуссионным, приводят результаты гистологического исследования СО антрального отдела желудка у 106 детей с хроническим гастритом (гастродуоденитом) с эрозиями, 84 детей — без эрозий и 50 больных с язвенной болезнью. Результаты исследования показали, что только у 3,3 % больных при гистологическом исследовании препаратов антрального отдела желудка атрофические изменения не выявлены. У 22,8 % детей атрофические изменения слизистой оболочки были выражены незначительно: склероз базальных отделов СО желудка имел очаговый характер, при этом объем железистого эпителия был сохранен. У большинства же больных (67,6 %) атрофические изменения СО трактовались как умеренно выраженные, при этом имели место так называемые стромальные изменения в виде гиперплазии ретикулиновых волокон, разрастания гладкомышечных клеток и редко — эластических волокон. Наряду с диффузным склерозом базальных отделов СОЖ имел место и интерстициальный (межуточный) склероз собственной пластинки, а также очаговая атрофия желез, сопровождающаяся уменьшением объема железистого эпителия. И наконец, в ряде случаев (6,2 %) гистологические изменения указывали на выраженную атрофию СО антрального отдела. Последнее касалось прежде всего железистого эпителия, объем которого был значительно уменьшен. Атрофические изменения слизистой оболочки желудка характеризовались не только развитием интерстициального склероза базальных отделов СО, но и замещением высокодифференцированного эпителия метапластическим эпителием, свидетельствующим о нарушении клеточной регенерации с развитием тонкокишечной метаплазии.
Авторы приходят к выводу, что многолетнее течение хронического гастрита (без эрозий, с эрозиями) сопровождается не только активным воспалительным процессом, но и атрофическими изменениями СО, которые сохраняются на фоне проводимой базисной терапии, что требует поиска более эффективных мер реабилитации этих больных.
Атрофические изменения СОЖ выявлены у 10 % наблюдаемых больных московскими исследователями И.В. Сичинавой и соавт. [15]. Атрофические изменения в антральном отделе желудка выявлены у 54,8 % больных и в фундальном — у 25 % детей, проживающих в условиях Курской магнитной аномалии [6]. Л.П. Парменова [13] отмечает, что клинические и морфологические проявления ХГ у детей зависят от основного этиологического фактора и длительности заболевания: при гипоацидности, декомпенсации ощелачивания в антральном отделе желудка при активном процессе атрофия СО антрального и фундального отделов желудка встречается у 30 % детей.
В то же время В.П. Новикова из Санкт-Петербурга [12] лишь у 2 больных из 51 выявила признаки атрофии СОЖ антрального отдела желудка, а белорусские авторы С.Э. Загорский и О.Н. Назаренко [8] из 44 детей с эрозивно-язвенными поражениями желудка и двенадцатиперстной кишки лишь у 1 выявили атрофические изменения СОЖ и у 1 — кишечную метаплазию, что позволило авторам сделать вывод о том, что атрофические и метапластические изменения СОЖ не характерны для детского и подросткового возраста. А.В. Бурлуцкая [4] выявила атрофический гастрит у 17 детей, что составило лишь 2,5 % от общего числа обследованных.
Таким образом, частота ХАГ в детском возрасте, по данным разных авторов, весьма вариабельна, но возможность развития этого заболевания в детском возрасте практически признается всеми авторами.
Имеющиеся в литературе немногочисленные свидетельства о возможности развития ХАГ в детском возрасте подтверждаются исследованиями кафедры педиатрической гастроэнтерологии и нутрициологии Харьковской медицинской академии последипломного образования, проведенными в последние годы [7].
Под наблюдением в детском городском гастроэнтерологическом отделении г. Харькова находились 79 больных, у которых на основании клинического и эндоскопического исследования был установлен диагноз хронического гастрита, в том числе у 2 детей — эрозивный процесс.
Во время проведения фиброгастроскопического исследования у всех детей проводилась прицельная биопсия с наиболее измененных участков антрального отдела желудка (обычно два биоптата).
Гистологическое исследование, проведенное на кафедре патологической анатомии ХМАПО, подтвердило наличие воспалительных изменений СО желудка у 74 из 79 больных (93 ± 3).
Из 74 детей у 25 (34 ± 6 %) отмечался поверхностный гастрит, который характеризовался наличием умеренной лимфоидно-плазматической инфильтрации с небольшим количеством макрофагов, эозинофилов, сегментоядерных лейкоцитов. Толщина СО и структура железистого слоя были сохранены. Активность процесса выявлена у 7 из 28 больных (25,0 ± 8,0 %). Это подтверждалось наличием инфильтрации эпителия и собственного слоя полиморфноядерными лейкоцитами на фоне свойственной хроническому гастриту инфильтрации плазматическими клетками и лимфоцитами, а также повреждением эпителия.
У остальных 49 детей (66 ± 6,0 %) морфологически выявлены различные формы атрофического гастрита, что свидетельствует о частоте этой формы заболевания у детей, даже при анализе биопсийного материала только СО антрального отдела желудка.
Начальный атрофический гастрит отмечался у 32 (65 ± 7 %) детей, у 29 из них (91 ± 5 %) выявлено активное воспаление.
При начальном атрофическом гастрите воспалительный инфильтрат локализовался между железами. В строме определялось значительное количество нейтрофильных лейкоцитов, лимфоцитов, плазмоцитов. Встречались отдельные эозинофильные лейкоциты. В поверхностном эпителии определялось снижение секреции мукоида. Наряду с дистрофическими процессами наблюдалась умеренно выраженная дисплазия, особенно в шеечной части желез. На фоне часто встречающейся фовеолярной гиперплазии у 28,3 % больных наблюдалась наиболее высокая степень обсеменения Нр (+++), которая сопровождалась значительной активностью воспалительного процесса.
Умеренная атрофия слизистой оболочки выявлена у 17 больных (35 ± 7 %), из них у 11 (65 ± 12 %) процесс носил активный характер. У больных отмечались патологические изменения в эпителии пилорических желез со снижением количества ШИК-положительных соединений. При этом уменьшалось и количество пилорических желез. В строме определялась инфильтрация лимфоцитами, плазмоцитами, незначительным количеством сегментоядерных лейкоцитов, выявлялись лимфоидные фолликулы.
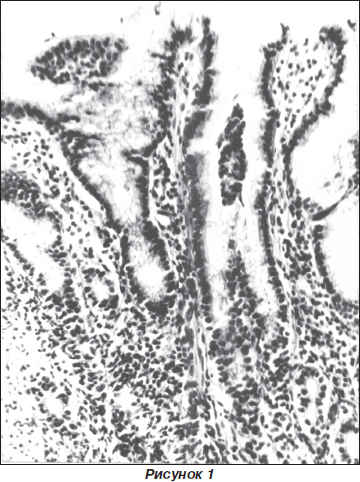
Сопоставление возраста детей и длительности заболевания с частотой выявления ХАГ показало, что заболевание чаще отмечается у детей старшего возраста, и его длительность составляет не менее 3 лет.
Выводы
1. Хронический атрофический колит у детей не является исключительно редким заболеванием, во всяком случае, встречается чаще, чем диагностируется. Частота ХАГ у детей увеличивается с возрастом и длительностью заболевания.
2. Частота выявления ХАГ зависит от уровня применяемых исследований. Эндоскопические признаки, которые считаются характерными для хронического атрофического гастрита (сглаженность складок слизистой оболочки, их отсутствие на определенных участках, уменьшение размеров желудка), малоинформативны и не дают достаточных оснований для диагностики этой формы заболевания.
3. ХАГ — диагноз морфологический, причем информативность гистологического исследования прямо коррелирует с наличием биопсионного материала из различных отделов желудка (три из антрального отдела и два из тела желудка), что в педиатрической практике практически не делается; диагноз устанавливается на основании одной, редко — двух биопсий, что, безусловно, снижает информативность заключения.
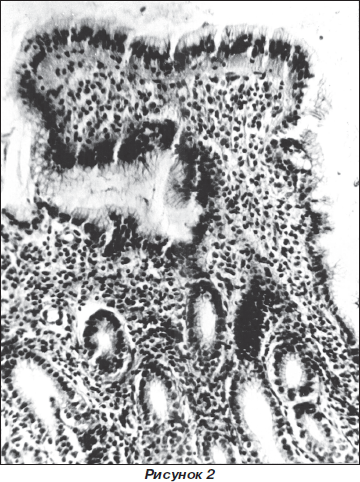
4. Морфологические изменения при ХАГ неоднородны. Умеренная степень атрофии характеризуется наличием не более одного конечного отдела главных желез, которые открываются в одну желудочную ямку, с увеличенным количеством добавочных клеток в составе главных желез, что приводит к развитию пилорической метаплазии желез. В собственной пластинке слизистой оболочки определяются воспалительные изменения и умеренно выраженный фиброз. В некоторых случаях наблюдается умеренная степень атрофии СО тела желудка одновременно с развитием кишечной метаплазии покровно-ямочного эпителия.
Выраженная атрофия СО тела желудка характеризуется резким снижением количества главных желез и удлинением желудочных ямок, что иногда сопровождается развитием фовеолярной гиперплазии СО. Качественный состав главных желез изменяется в сторону преобладания добавочных клеток с развитием пилоризации желез. В собственной пластинке СО наблюдаются воспалительные изменения и выраженный фиброз.
5. Перспективным для детской гастроэнтерологии в плане диагностики ХАГ следует считать определение гастрина-1 (G-17) и пепсиногена-1 (PG-1) в сыворотке крови. Информативность этих показателей в плане подтверждения наличия атрофического процесса в СО желудка доказана исследованиями зарубежных и отечественных гастроэнтерологов-терапевтов.
6. Патогенетические особенности ХАГ определяют необходимость дифференцированного подхода к лечению больных, которое должно отличаться от лечения поверхностных и деструктивных форм заболевания и быть направлено прежде всего на стимуляцию репаративных процессов и восстановление желудочной секреции.
1. Бабак О.Я. Атрофический гастрит: прогнозы и перспективы // Здоровье Украины. — 2006. — № 21 (1). — С. 1-3.
2. Белоусов Ю.В. Функциональная диспепсия или хронический гастрит // Здоровье Украины. — 2009. — № 6 (1). — С. 44-45.
3. Белоусов Ю.В., Белоусова О.Ю. Секреторно-моторные взаимосвязи органов гастродуоденальной зоны у детей // Врачебная практика. — 2002. — С. 84-88.
4. Бурлуцкая А.В., Карпенко Л.В., Левицкая Н.В. Структура заболеваемости верхних отделов желудочно-кишечного тракта у детей г. Краснодара по данным детского стационара // Актуальные проблемы абдоминальной патологии у детей. Материалы ХIII Конгресса детских гастроэнтерологов России. — Москва, 2006. — С. 104-105.
5. Волошин К.В. Функціональна диспепсія у дітей: критерії діагностики та диференційної діагностики: Автореф. дис… канд. мед. наук. — Харків, 2010. — 20 с.
6. Гурова М.М., Гусева С.П., Дутлова Е.Д., Ляляева Т.В. Эндоскопические и морфологические особенности хронических гастродуоденитов у детей, проживающих в условиях Курской магнитной аномалии // Актуальные проблемы абдоминальной патологии у детей. Материалы ХI Конгресса детских гастроэнтерологов России. — Москва, 2004. — С. 184-185.
7. Денисюк Т.А. Секреторно-моторні взаємозв’язки у дітей з хронічною Helicobacter pylory-асоційованою гастродуоденальною патологією та ефективність ерадикаційної терапії з використанням вітчизняних препаратів: Автореф. дис… канд. мед. наук. — Харків, 2010. — 20 с.
8. Загорский С.Э., Назаренко А.Н. Морфологические особенности эрозивно-язвенных поражений желудка и двенадцатиперстной кишки у детей и подростков // Актуальные проблемы абдоминальной патологии у детей. Материалы ХVII Конгресса детских гастроэнтерологов России и стран СНГ. — Москва, 2010. — С. 86-87.
9. Лысиков Ю.А., Малицына Т.А., Рославцева Е.А. Трудности в диагностике атрофических гастритов у детей // Педиатрия. — 2006. — № 6. — С. 1-3.
10. Малямова Л.Н., Чередниченко А.М., Медведева С.Ю. Дискуссионные вопросы прогрессирования морфологических изменений слизистой оболочки желудка у детей с хроническими заболеваниями гастродуоденальной области // Актуальные проблемы абдоминальной патологии у детей. Материалы ХI Конгресса детских гастроэнтерологов России. — Москва, 2004. — С. 132-134.
11. Мосійчук Л.М., Зак М.Ю. Оптимізація діагностики хронічного атрофічного гастриту сучасними неінвазивними методами // Сучасна гастроентерологія. — 2010. — № 4 (54). — С. 52-56.
12. Новикова В.П., Мельникова И.Ю., Струков Е.Л., Антонов П.В. Морфологическая картина слизистой оболочки желудка у детей с хроническим гастродуоденитом в сочетании с аутоиммунным тиреоидитом // Актуальные проблемы абдоминальной патологии у детей. Материалы 8-й конференции «Детская гастроэнтерология 2001». — Москва, 2001. — С. 72-73.
13. Парменова Л.П. Клинические и морфологические особенности хронического гастрита у детей // Актуальные проблемы абдоминальной патологи у детей. Материалы ХII Конгресса детских гастроэнтерологов России. — Москва, 2005. — С. 208-209.
14. Пюрвеева К.В., Лапина Т.Л., Ивашкин В.Т. Значение сывороточных показателей пепсиногена-1, пепсиногена-2 и гастрина-17 в диагностике атрофического гастрита // Российский журнал гастроэнтерол., гематолог., колопроктол. — 2005. — № 3. — С. 48-51.
15. Сичинава И.В., Новикова А.В., Каганов Б.С., Шерешевская А.Я. и соавт. Течение хронического гастрита у детей // Актуальные проблемы абдоминальной патологии у детей. Сборник материалов 7-й конференции «Детская гастроэнтерология-2000». — Москва, 2000. — С. 107-108.
16. Chae H., Lee J.H., Lim J. Clinical utility of serum pepsinogen levels as a screening Test of atrophic gastritis // Korean J. Lab. Med. — 2008. — Vol. 28 (3). — P. 201-206.
17. Di Mario E., Cavallaro L.J. Non-invasive tests in gastric disease // Dig. Liver. Dis. — 2008. — Vol. 40 (7). — P. 523-530.
18. Fox J.G., Wang T.S. Inflamattion, atrophy, and gastric cancer // J. Clin. Invest. — 2007. — Vol. 117. — P. 60-69.
19. Leverin C., Jacobsson S., Lindstedt G. Serum biomarkers for atrophic gastritis and antibodies against Helicobacter pylori in the elderly: Implications for vitamin B12, foliac acid and iron status and response to oral vitamin therapy // Scand. J. Gastroenterol. — 2008. — Vol. 43 (9). — P. 1050-1056.
20. Sipponen P. Atrophic gastritis as premalignant condition // Ann. Med. — 1989. — Vol. 21. — P. 287-290.
21. Vannelia L., Lahner E., Osborn J. Risk factor for progression to gastric neoplastic lesions in patients with atrophic gastritis // Aliment. Pharmacol. Thier. — 2010. — Vol. 18. — P. 33-37.
