Журнал «Медицина неотложных состояний» 3 (42) 2012
Вернуться к номеру
Заболевания и поражения системы дыхания
Авторы: Думанский Ю.В., чл.-корр. НАМН Украины, д.м.н., профессор Кабанова Н.В., д.м.н., профессор кафедры анестезиологии и интенсивной терапии ДонНМУ им. М. Горького Верхулецкий И.Е., зав. кафедрой хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького, д.м.н., профессор Синепупов Н.А., доцент кафедры хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького, к.м.н. Осипов А.Г., доцент кафедры хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького, к.м.н. Синепупов Д.Н., ассистент кафедры хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького
Рубрики: Семейная медицина/Терапия, Анестезиология-реаниматология, Медицина неотложных состояний, Хирургия
Разделы: Медицинское образование
Версия для печати
Актуальность. Будучи наиболее тяжелым проявлением бронхиальной астмы (БА), астматическое состояние (АС) дает весьма высокую летальность среди молодых, трудоспособных пациентов. Распространенность этого грозного состояния, по данным литературы, составляет от 17 до 79 % среди всех форм бронхиальной астмы, а летальность — от 17 до 16,5 % и более. Все это обусловливает не только медицинскую, социальную значимость этой проблемы, но и необходимость разработки рациональных методов профилактики и лечения астматического состояния. Тактические ошибки проведения медикаментозной терапии у пациентов с бронхиальной астмой почти у 70 % становятся причинами развития астматического состояния. Неоправданная или быстрая отмена глюкокортикостероидных препаратов является причиной астматического состояния у 17–24 % пациентов.
Утопление является одной из частых причин смерти людей молодого возраста. Так, по данным Всемирной организации здравоохранения, ежегодно в результате утопления в США погибают 7000 человек, в Англии — 1500, в Австралии — 500. Это говорит об актуальности проблемы оказания помощи при утоплении.
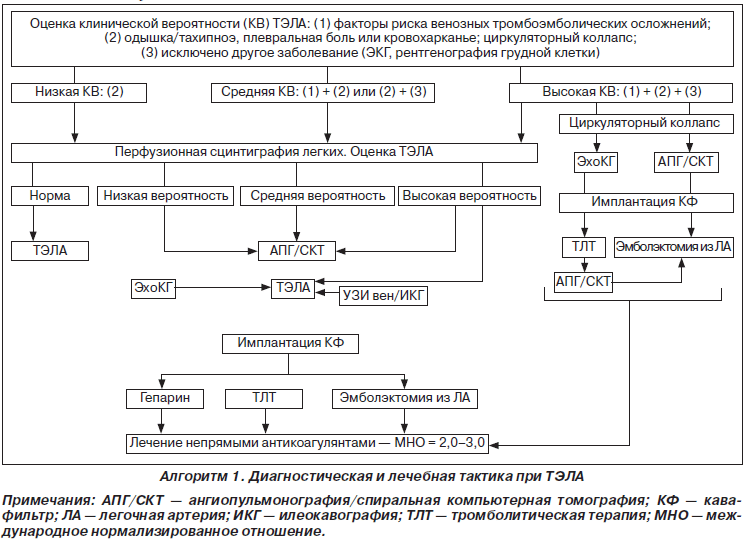
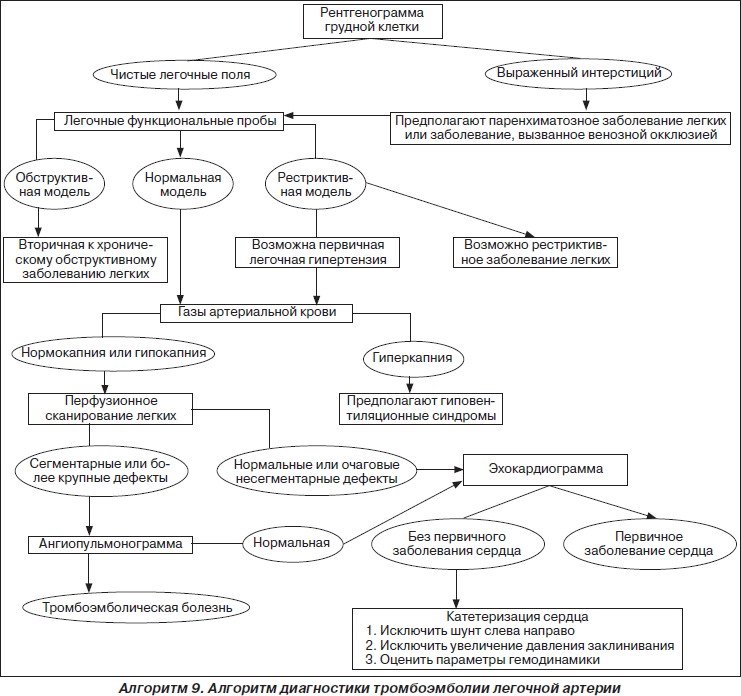
Проблема тромбоэмболии легочной артерии (ТЭЛА) является одной из наиболее актуальных в клинике заболеваний внутренних органов и в хирургической практике. В последние годы наблюдается существенное увеличение смертности от ТЭЛА, которая, по данным разных авторов, достигает 5–12 %. ТЭЛА — третья по частоте причина смерти населения в результате сердечно-сосудистой патологии (после ишемической болезни сердца (ИБС) и инсульта); распознанная ТЭЛА — причина госпитализаций около 250 тыс. пациентов (12 % всех госпитализаций), что приводит к летальному исходу у 50–140 тыс. пациентов в мире. В Украине ТЭЛА осложняет 0,1–0,3 % хирургических оперативных вмешательств и диагностируется в 12 % всех случаев аутопсий, у 20 % пациентов пожилого и старческого возраста по причине наличия сердечно-сосудистых заболеваний. Ежегодно от ТЭЛА умирает 0,1 % населения земного шара. Летальность среди пациентов, не получавших антитромботическую терапию, — 30–40 %; при массивных ТЭЛА — более 70 % даже при условии адекватной терапии. ТЭЛА — довольно сложная для диагностики патология, при жизни диагностируется лишь у 25 % пациентов; 18 % летальности приходится на хирургическую патологию, 82 % — на терапевтическую. По результатам патологоанатомических исследований даже в современных клиниках мира правильный диагноз устанавливается лишь у 25–28 % пациентов. Гипердиагностика ТЭЛА происходит у 65 % пациентов, летальный исход по причине отсутствия лечения достигает 30 %, при массивных ТЭЛА — 70 %, в случае рано начатой антикоагулянтной терапии снижается до 10 %. Вероятность рецидивов ТЭЛА у нелеченых пациентов — 50 %, половина из них умирают.
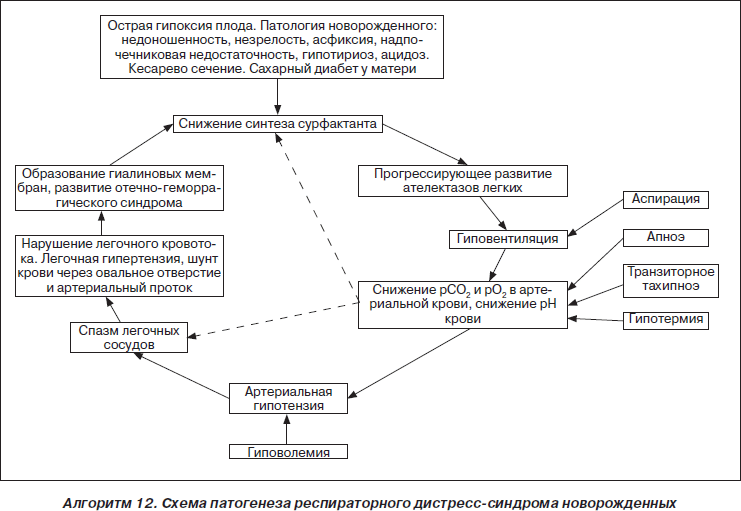
Среди заболеваний, приводящих к критическим состояниям у недоношенных новорожденных, одно из первых мест занимает респираторный дистресс-синдром (РДС), который является причиной развития тяжелой дыхательной недостаточности. Частота развития респираторного дистресса зависит от степени недонашивания и составляет в среднем 60 % у детей, родившихся при сроке беременности менее 28 нед., 15–20 % — при сроке 32–36 нед. и 5 % — 37 нед. и более. При рациональном выхаживании таких детей летальность приближается к 10 %.
В США на 100 000 населения регистрируют около 86 людей с респираторным дистресс-синдромом взрослых (РДСВ); в абсолютном выражении это составляет около 190 000 человек, из них умирают около 74 500 человек (около 41 %). Летальность от РДСВ до недавнего времени достигала 70–80 %. Проблема приобретает особую актуальность в связи с предполагаемой очередной эпидемией птичьего гриппа, при которой летальность превышала 40 %. Основная причина смертельных исходов — развитие синдрома острой дыхательной недостаточности как одного из проявлений респираторного дистресс-синдрома взрослых. Будущим организаторам здравоохранения это положение необходимо учитывать, планируя службу неотложной помощи.
Цель занятия общая: диагностировать синдром острой дыхательной недостаточности и проводить интенсивную терапию пациентам с острой дыхательной недостаточностью, обусловленной астматическим состоянием, отеком легких, утоплением, тромбоэмболией легочной артерии и ее ветвей, аспирационным синдромом, респираторным дистресс-синдромом взрослых.
Содержание обучения
I. Теоретические вопросы
1. Интенсивная терапия острой дыхательной недостаточности в отдельных патологических состояниях: послеоперационном периоде, при астматическом состоянии, отеке легких, утоплении, тромбоэмболии легочной артерии и ее ветвей, аспирационном синдроме, респираторном дистресс-синдроме взрослых и новорожденных.
II. Основные термины и их определения
Астматический статус — это необычный по тяжести астматический приступ, резистентный к обычной для больного терапии бронходилататорами. Формирование этой резистентности связано с прогрессирующей функциональной блокадой b-адренорецепторов. Кроме этого, большое значение в возникновении астматического статуса имеет выраженное расстройство мукоцилиарного транспорта (А.Г. Чучалин, 1997). Среди основных факторов, приводящих к развитию АС, выделяют: массивное воздействие аллергенов, бронхиальная или синусная инфекция, инфекционные болезни, ошибки в лечении пациентов, психоэмоциональные нагрузки (стрессы), неблагоприятные метеорологические влияния. Почти у половины пациентов не удается установить причину АС. АС диагностируют у половины пациентов, страдающих стероидозависимой бронхиальной астмой.
Клиническое течение АС делят на три стадии (А.Г. Чучалин, 1985).
I стадия (относительная компенсация) характеризуется развитием длительно не купирующегося приступа удушья. Пациенты находятся в сознании, адекватны. Одышка, цианоз, потливость умеренно выражены. Перкуторно — легочный звук с коробочным оттенком, аускультативно — дыхание ослабленное, проводится во все отделы, сухие рассеянные хрипы. В этой стадии чаще всего наблюдаются гипервентиляция, гипокапния, умеренная гипоксемия. Объем форсированного выдоха (ОФВ) снижается до 30 % от должной величины. Наиболее тревожный симптом — отсутствие выделения мокроты.
II стадия (декомпенсация или «немое» легкое) характеризуется дальнейшим нарастанием бронхообструкции (ОФВ < 20 % от должной величины), гипервентиляция сменяется гиповентиляцией, усугубляется гипоксемия, появляются гиперкапния и респираторный ацидоз. Аускультативно выслушиваются зоны «немого» легкого при сохранении дистанционных хрипов. Пациент не может сказать ни одной фразы не переводя дыхания. Грудная клетка эмфизематозно вздута, экскурсия ее почти незаметна. Пульс слабый, тахикардия, аритмия, артериальная гипотония.
III стадия (гипоксическая гииеркапническая кома) характеризуется крайне тяжелым состоянием, церебральными и неврологическими расстройствами. Дыхание редкое, поверхностное. Пульс нитевидный, артериальная гипотония.
Интенсивная терапия АС
Интенсивная терапия АС включает: кислородную, инфузионную и медикаментозную терапию.
1. Оксигенотерапия: непрерывная подача кислородно-воздушной смеси с содержанием кислорода 60–75 % со скоростью 4 л/мин через носовые канюли или лицевую маску для поддержания РаО2 выше 60 мм рт.ст.
2. Инфузионная терапия восполняет дефицит жидкости и устраняет гемоконцентрацию, способствует разжижению бронхиального содержимого, облегчает откашливание мокроты и уменьшает обструкцию бронхов. Во время приступа БА в среднем теряется около 5 % общего объема жидкости. Применяют кристаллоиды. Объем инфузионной терапии должен в первые сутки составлять 3–3,5 л и более, в последующие — около 1,6 л/м2 поверхности тела (около 2,5–2,8 л/сут).
3. При медикаментозном лечении АС резко ограничивают или исключают неселективные адреномиметики. Рекомендуется проведение ингаляций 0,5% раствора сальбутамола, 0,5 мл в 1–3 мл физиологического раствора или 5% раствора орципреналина, 0,2–0,3 мл в 1–3 мл физиологического раствора с помощью небулайзера. Если ингаляционные бронходилататоры неэффективны, вводят раствор адреналина 1 : 1000 (0,3 мл) или тербуталин (0,25 мг) подкожно, при необходимости инъекцию повторяют через 15–20 минут. Для усиления эффекта ингаляционные b2-адреностимуляторы назначают в сочетании с b-адреностимуляторами внутрь, например с тербуталином (2,5–5 мг) каждые 8 часов, сальбутамолом (2–4 мг) внутрь каждые 8 часов или орципреналином (10–20 мг) внутрь каждые 6 часов. Это лечение наиболее эффективно у пациентов с анафилактической формой АС.
В качестве бронхорасширяющих средств применяют метилксантины (эуфиллин и его аналоги). Эуфиллин снижает давление в малом круге кровообращения, уменьшает парциальное давление углекислого газа в крови и агрегацию тромбоцитов. Начальная доза эуфиллина должна составлять около 5–6 мг/кг массы тела при медленном в течение 20 минут капельном введении в вену (15 мл 2,4% раствора для человека массой 70 кг). После этого препарат вводят из расчета 0,5–0,9 мг/кг массы тела (приблизительно 2,5 мл 2,4% раствора в час) до улучшения клинического состояния пациента. Такую дозу оставляют в качестве поддерживающей в течение 6–8 часов. Обязательным компонентом лечения АС являются кортикостероиды. Ингибируя клеточные механизмы бронхообструкции, в том числе в результате непосредственного влияния на b2-адренорецепторы, кортикостероиды способствуют наряду с эуфиллином восстановлению чувствительности адренорецепторного аппарата бронхов. Кроме того, они обладают выраженным противоотечным действием, что улучшает проходимость дыхательных путей и облегчает бронхиальный дренаж. Кортикостероиды уменьшают воспалительную обструкцию бронхов, снижают гиперреактивность лаброцитов, базофилов и тормозят выделение ими гистамина и других медиаторов аллергии и воспаления, устраняют угрозу острой надпочечниковой недостаточности вследствие гипоксии. Кортикостероиды назначают внутривенно капельно или струйно каждые 4 часа из расчета 1 мг гидрокортизона на 1 кг массы тела в час. Так, доза гидрокортизона для взрослых колеблется от 200 мг 4 раза в сутки до 4–6 мг/кг каждые 4–6 часов внутривенно. Преднизолон (метилпреднизолон) — от 60 мг до 250 мг внутривенно каждые 4–6 часов. Если по достижению дозы 900–1000 мг преднизолона сохраняется АС, следует продолжить введение преднизолона по 250 мг каждые 3–4 часа в общей дозе 2000–3500 мг на протяжении 1–2 суток до достижения купирующего эффекта. Дексаметазон по 8–12 мг каждые 4–6 часов в суточной дозе 32–56 мг. После выведения больного из АС дозу стероидов ежесуточно уменьшают на 25 % до минимальной. Из-за опасности угнетения дыхания, подавления кашлевого рефлекса и естественных механизмов бронхиального дренирования противопоказаны препараты, обладающие седативным эффектом (морфин, промедол, пипольфен, оксибутират натрия и др.). На фоне увеличенной работы дыхания при АС не следует применять дыхательные аналептики (этимизол, кордиамин), так как они могут привести к истощению резервов дыхания и прогрессированию острой дыхательной недостаточности. Неэффективны при АС холинолитики (атропин). Для предупреждения тромбоэмболических осложнений, а также с целью улучшения реологических свойств крови назначают гепарин (до 20 тыс. ЕД/сут), фраксипарин, клексан. Из-за опасности усиления бронхиолоспазма у пациентов с АС не рекомендуется применять муколитические средства (ацетилцистеин, трипсин, химотрипсин). С осторожностью следует также относиться к методам механической санации дыхательных путей (назотрахеальные катетеризации для отмывания и аспирации мокроты).
При переходе АС во II стадию разовая доза преднизолона увеличивается в 1,5–3 раза, введение его осуществляется каждые 1–1,5 часа или непрерывно внутривенно капельно. На фоне кортикостероидной терапии продолжаются кислородная ингаляционная и инфузионная терапия, внутривенное введение эуфиллина, мероприятия по улучшению дренажной функции бронхов. Если проводимая терапия в течение 1,5–2 часов не ликвидирует картину «немого» легкого, необходимо переводить больного на искусственную вентиляцию легких (ИВЛ), которая обеспечивает необходимый объем вентиляции, облегчает удаление мокроты. При ИВЛ устраняется также непроизводительная работа дыхательных мышц, что облегчает проведение лаважа дыхательных путей.
В III стадии АС пациента переводят на ИВЛ, проводят бронхоскопическую санацию, посегментарный лаваж бронхиального дерева. Дозу преднизолона увеличивают до 120 мг внутривенно каждый час.
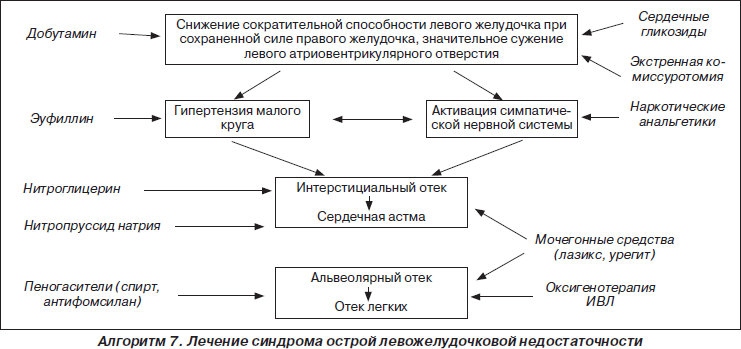
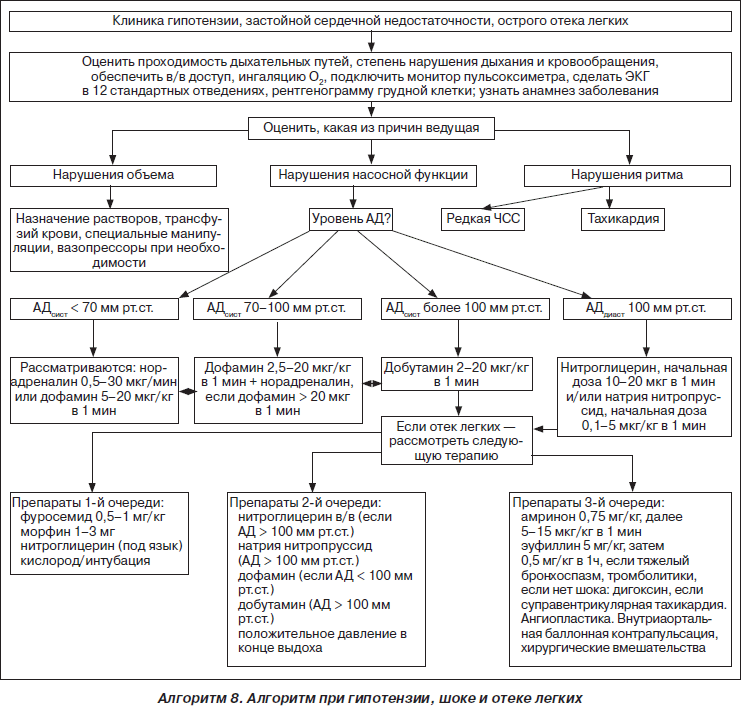
Различают гидростатический и мембраногенный отек легких, происхождение которых различно. Гидростатический отек легких возникает при заболеваниях, при которых внутрикапиллярное гидростатическое давление крови повышается до 7–10 мм рт.ст., что ведет к выходу жидкой части крови в интерстиций в количестве, превышающем возможность ее удаления через лимфатические пути. Мембраногенный отек легких развивается в случаях первичного повышения проницаемости капилляров легких, которое может возникать при различных синдромах.
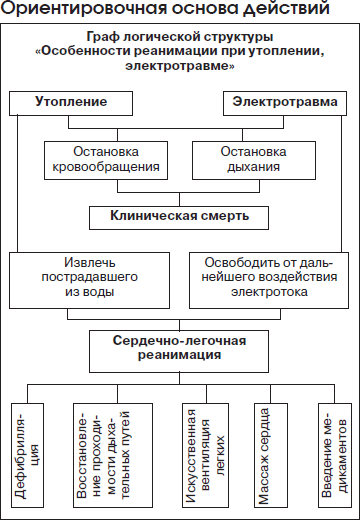
Утопление — острое патологическое состояние, развивающееся при случайном или преднамеренном погружении в жидкость, с последующим развитием признаков острой дыхательной и сердечной недостаточности, причиной возникновения которых является попадание жидкости в дыхательные пути. По виду и причинам различают первичное утопление — истинное, или «мокрое», а также асфиксическое, или «сухое», синкопальное утопление, смерть в воде, «криошок», а также вторичное утопление. Истинное утопление составляет 85–95 % от всех несчастных случаев на воде. В основе его лежит аспирация больших количеств воды с последующим нарушением газообмена на уровне альвеол при сохранении анатомической целостности системы внешнего дыхания.
Истинное утопление. В его основе лежит попадание воды в альвеолы. В зависимости от того, в какой воде произошло утопление (пресная или морская), будет различный патогенез. Пресная вода, в силу разности осмотического градиента с кровью, быстро покидает альвеолы и проникает в сосудистое русло. Это приводит к увеличению объема циркулирующей крови (ОЦК) и гемодилюции, отеку легких, гемолизу эритроцитов, уменьшению концентрации ионов натрия, хлора и кальция плазмы, а также белков плазмы. При утоплении в морской воде в результате разности осмотического градиента между кровью и морской водой, причем здесь отмечается явное преобладание градиента морской воды над кровью, часть плазмы выходит из сосудистого русла. В связи с этим уменьшается масса циркулирующей крови (до 45 мл/кг), увеличивается гематокрит. Асфиксическое утопление возникает без аспирации воды. В основе данной патологии лежит рефлекторный ларингоспазм. Голосовая щель не пропускает воду, но она же не пропускает и воздух. Смерть наступает от механической асфиксии.
Синкопальный тип утопления (смерть в воде) наступает в результате рефлекторной остановки сердечной деятельности и дыхания. Наиболее частый вариант данного типа утопления отмечается при внезапном погружении пострадавшего в холодную воду.
Клиника. При истинном утоплении следует различать утопление в пресной и морской воде, однако характер патологических изменений в организме пострадавшего при этом различен только в первые минуты после погружения в воду.
Пресная вода, являясь гипотоническим раствором солей, в силу законов осмоса уже через 2–3 мин из альвеол и терминальных бронхиол переходит в сосудистое русло, поступает в систему кровообращения. Это приводит к гиперволемии и гемодилюции, гемолизу, гиперкалиемии, гипонатриемии, гипокальциемии и гипохлоремии. Иногда наступает и фибрилляция желудочков сердца. Следует указать, что выраженная гиперкалиемия и остановка кровообращения вследствие фибрилляции желудочков отмечаются только при аспирации воды в легкие не менее 50 мл/кг массы тела пострадавшего. В среднем же в легкие человека при утоплении поступает 10–11 мл/кг массы тела, поэтому остановка кровообращения вследствие гиперкалиемии и фибрилляции желудочков сердца при утоплении в пресной воде не является ведущей в патогенезе развития терминального состояния.
Морская вода представляет собой 3,5% раствор солей, т.е. гипертонический раствор, и, попадая в альвеолы, по тем же законам осмоса берет на себя жидкость и белки из сосудистого русла, отдавая собственные электролиты. В результате этого в просвет альвеол поступает жидкая часть крови, белки плазмы, что сопровождается гемоконцентрацией, гиповолемией, снижением артериального и центрального венозного давления. Одновременно в кровь из морской воды поступают ионы калия, натрия, магния, кальция и хлора, что приводит к резкому увеличению их концентрации в сосудистом русле. Через несколько минут после поступления воды в легкие происходит выравнивание градиента коллоидно-осмотического давления в альвеолах и кровеносном русле малого круга кровообращения, и характер патологических изменений в организме (независимо от воды) сводится к отеку легких, гиперкалиемии, дыхательному и метаболическому ацидозу, гиповолемии и резкой степени гипоксии.
Отек легких при утоплении в морской воде наступает сразу же, в то время как при утоплении в пресной воде он возникает спустя некоторое время по мере нарастания гипоксии, увеличения перфузионного давления в малом круге кровообращения вследствие сердечной недостаточности и увеличения проницаемости альвеолярно-капиллярных мембран. Потеря жидкости организмом пострадавшего через легкие приводит к выраженной гиповолемии и гемоконцентрации независимо от вида утопления. Тяжелая гипоксия появляется уже с первых минут после утопления, сохраняется в течение нескольких суток и с трудом купируется даже ИВЛ чистым кислородом.
При истинном утоплении выделяют 3 периода: начальный, атональный и клинической смерти. Состояние сознания зависит от периода утопления и его вида. Нарушение дыхания возможно от шумного до атонального. Наблюдаются цианоз, озноб, гусиная кожа. При утоплении в пресной воде отмечается клиника отека легких, артериальная и венозная гипертензия, тахикардия, аритмия. Из верхних дыхательных путей может выделяться пена, иногда с розовым оттенком, в результате гемолиза эритроцитов. При утоплении в морской воде более характерны артериальная гипотензия, брадикардия.
Неотложная помощь. Вне зависимости от того, в какой воде произошло утопление, при остановке дыхания и сердечной деятельности пострадавшему необходимо проводить комплекс реанимационных мероприятий. Перед проведением искусственного дыхания следует освободить верхние дыхательные пути от воды и инородных тел (речной песок, водоросли, ил). В условиях стационара лечение носит синдромный характер и складывается из следующих направлений:
1. Проведение комплекса реанимационных мероприятий и перевод пациента на ИВЛ (по показаниям).
2. Санация трахеобронхиального дерева, терапия бронхиолоспазма, отека легких.
3. Купирование острой сердечной недостаточности.
4. Коррекция кислотно-основного равновесия (КОР) и электролитов.
5. Профилактика пневмонии и почечной недостаточности.
Аспирационные синдромы — наиболее часто возникают у пациентов с нарушениями сознания, заболеваниями пищевода, сопровождающимися рефлюксом, и при нарушенном мукоцилиарном клиренсе. Аспирация содержимого желудка может привести к разнообразным осложнениям.
Аспирационный пневмонит — это химическое повреждение ткани легкого, которое возникает в течение нескольких часов после аспирации и проявляется лихорадкой, повышением рО2 и легочными инфильтратами. При массивной аспирации может развиться респираторным дистресс-синдромом взрослых.
Аспирационная пневмония возникает в большинстве случаев через 2–5 сут. после аспирации и обычно вызывается полимикробной флорой. Определенные трудности представляет дифференциальная диагностика между бактериальной пневмонией и пневмонитом.
Аспирация инородных тел может вызвать обструкцию бронха и ателектаз. Для уточнения диагноза нередко показана срочная бронхоскопия. Синдром Мендельсона (кислотно-аспирационный синдром) является ятрогенным осложнением, характеризующимся тяжелым течением, высокой летальностью и нередко — юридическими последствиями. Аспирация пищевыми массами может привести к летальному исходу разными способами:
1. Обструкция дыхательных путей твердыми пищевыми массами с развитием асфиксии.
2. Развитие аспирационного гиперергического пневмонита, который называют синдромом Мендельсона. Пневмонит развивается при попадании желудочного содержимого с рН ниже 2,5 и объемом более 25 мл в трахею и бронхи.
3. Развитие тяжелых аспирационных пневмоний при попадании инфицированного желудочного и кишечного содержимого в легкие, даже при рН содержимого больше 2,5.
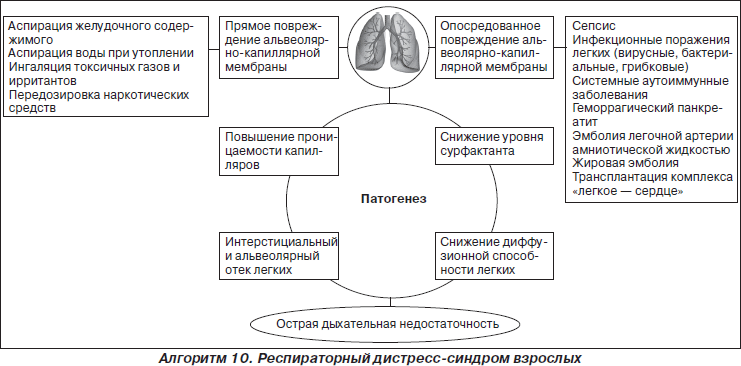
Острый респираторный дистресс-синдром взрослых — дыхательная недостаточность, возникающая вследствие острого повреждения легких, характеризующаяся интерстициальным и альвеолярным отеком легких, гипоксемией. Прямое или опосредованное повреждение альвеолярно-капиллярной мембраны части или всех ацинусов легких является основным фактором патогенеза РДСВ.
Основные причины прямого повреждения — аспирация желудочного содержимого, например, при синдроме Мендельсона; аспирация воды при утоплении; ингаляция токсических газов, передозировка наркотических веществ. Непрямое, опосредованное повреждающее действие оказывают активированные и агрегированные элементы крови при сепсисе, воспалительных вирусных и бактериальных пневмониях, системных аутоиммунных заболеваниях, травмах, ожогах, тяжелом панкреатите, жировой эмболии. В результате повреждения резко повышается проницаемость легочных капилляров и альвеолярной мембраны для жидкости и белка, вследствие чего развивается отек интерстиция легких, а затем и альвеолярный отек. Снижается продукция сурфактанта, что приводит к снижению растяжимости легких. Отек легких приводит к значительному снижению диффузионной способности легких для газов, развивается гипоксемия, на более поздних этапах — гиперкапния. Развивается острая дыхательная недостаточность. Клиническая картина РДСВ обусловлена признаками острой дыхательной и полиорганной недостаточности. Имеется определенная, не всегда четко выраженная стадийность клинических проявлений острой дыхательной недостаточности при РДСВ. На ранних стадиях появляется небольшая одышка, незначительно снижаются жизненная емкость легких (ЖЕЛ), рО2 и рСО2. Рентгенологически определяется небольшое усиление легочного рисунка в периферических отделах легких. Гипоксемия может быть устранена с помощью обычных ингаляций кислорода. По мере развития синдрома одышка усиливается, дыхание учащается, при аускультации отмечается ослабление везикулярного дыхания, появляются мелкопузырчатые влажные хрипы. Еще более снижается ЖЕЛ, напряжение кислорода в крови, возрастает альвеолоартериальная разница по кислороду. Возникает метаболический ацидоз. Рентгенологически — диффузная множественная пятнистость всех легочных полей. Гипоксемия не поддается обычной ингаляционной оксигенотерапии из-за нарастания альвеолярного шунтирования в легких. При прогрессировании процесса практически наблюдается удушье, дыхание клокочущее, выделяется пенистая розового цвета мокрота, в дыхании участвуют вспомогательные дыхательные мышцы, на всей поверхностью легких выслушиваются влажные мелко- и среднепузырчатые хрипы. При рентгенографии грудной клетки выявляются крупноочаговые тени. Нарастает гипоксемия, выявляются гиперкапния, метаболический и респираторный ацидоз. Гипоксемия может корригироваться только с помощью искусственной вентиляции легких. Полиорганная недостаточность проявляется сердечно-сосудистыми расстройствами в виде стойкой гипотонии, тахикардии, нарушениями сердечного ритма (желудочковая тахикардия и фибрилляция желудочков). Острая печеночная недостаточность диагностируется по наличию гипербилирубинемии, гиперферментемии, гипоальбуминемии, гипохолестеринемии; острая почечная недостаточность проявляется олигурией, азотемией. Острая церебральная недостаточность обусловлена гипоксией. В общем анализе крови отмечают лейкопению, реже лейкоцитоз, тромбоцитопению, признаки синдрома диссеминированного внутрисосудистого свертывания.
Интенсивная терапия РДСВ представляет собой комплекс мероприятий.
1. Лечение причины развития РДСВ с устранением по возможности всех факторов прямого повреждения легких, проведением антибактериальной терапии при сепсисе, бактериальных пневмониях. Осуществляют адекватное лечение травм, ожогов.
2. Устранение гипоксемии — основного компонента острой дыхательной недостаточности — правильно подобранным режимом оксигенотерапии и путем воздействия на звенья патогенеза, ведущие к нарушению диффузионной способности легких. Оксигенотерапию на ранних этапах развития РДСВ проводят с помощью ингаляций через носовые канюли, рото-носовую маску. Желателен динамический контроль при этом газов крови, особенно РО2. Величину его необходимо поддерживать на уровне 60 мм рт.ст., поскольку в этой ситуации насыщение гемоглобина кислородом (сатурация) равно примерно 90–92 %. Кислород при этом подается с относительно небольшой скоростью, и фракция его во вдыхаемом воздухе должна быть снижена до 0,5–0,6. Нарушение этих условий, в частности, повышенная концентрация кислорода, может, в свою очередь, приводить к повреждению легочной ткани и усугубить состояние пациента. Если на фоне указанных методов кислородотерапии не удается добиться адекватной оксигенации артериальной крови, показана интубация трахеи и проведение ИВЛ. ИВЛ целесообразно выполнять в режиме повышенного давления в конце выдоха. Контроль проводимой терапии происходит также с помощью метода пульсоксиметрии, который позволяет осуществлять мониторинг насыщения гемоглобина кислородом — SPО2. Весьма важным обстоятельством для повышения эффективности оксигенотерапии является выбор оптимального положения больного в постели. Степень выраженности изменений в различных частях легкого может быть разной, поэтому рекомендуется, чтобы больной лежал на боку и менее пораженное легкое было внизу. Это приводит к уменьшению внутрилегочного шунтирования в менее пораженном легком и улучшает оксигенацию. С целью улучшения диффузионной способности легких применяют ингаляции глюкокортикоидов, окиси азота, сурфактанта. Глюкокортикоиды обладают мощным противовоспалительным, противоотечным, бронхолитическим и антиаллергическим действием. Сурфактант, как смазка, выстилает поверхность альвеолы, обращенной к воздуху. Он снижает поверхностное натяжение, делает легкие более растяжимыми. Дефицит сурфактанта является одним из важных звеньев патогенеза РДСВ. Окись азота является мощным вазодилататором и в условиях продолжающейся оксигенотерапии способна повышать насыщение крови кислородом.
Инфузионная терапия имеет большое значение для коррекции основных факторов патогенеза РДСВ. Адекватное ее проведение возможно при контроле с помощью внутрисердечного катетера Свана — Ганца, который позволяет регистрировать давление в капиллярах малого круга кровообращения, так называемое давление заклинивания. Целесообразно проведение инфузионной терапии при уровне этого давления 12–15 мм рт.ст.
3. Лечение полиорганной недостаточности.

1. Анестезиология и реаниматология: Учеб. пособие / Под ред. О.А. Долиной. — М.: ГЭОТАР-Медиа, 2006. — 576 с.
2. Сумин С.А. Неотложные состояния. — М.: Медицинское информационное агентство, 2005. — 752 с.
3. Трещинский А.И., Глумчер Ф.С. Руководство по интенсивной терапии. Практическое пособие. — К., 2004. — 582 с.
4. Глумчер Ф.С., Трещинский А.И. Руководство по анестезиологии: Учебное пособие. — К., 2008.
5. Марино П.Л. Интенсивная терапия. — М.: Гэотар-Медицина, 1999. — 639 с.