Журнал «Здоровье ребенка» 4 (39) 2012
Вернуться к номеру
Клиническое наблюдение ребенка c врожденной гиперплазией коры надпочечниковых желез
Авторы: Сиренко Т.В., Хоценко А.А., Плахотная О.Н. - Харьковский национальный медицинский университет
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
В статье описаны особенности течения заболевания у новорожденного с врожденной гиперплазией коры надпочечниковых желез. Представленное клиническое наблюдение расширит знания врачей о редкой врожденной патологии.
У статті описані особливості перебігу захворювання в новонародженого з уродженою гіперплазією кори надниркових залоз. Надане клінічне спостереження розширить знання лікарів щодо рідкісної уродженої патології.
This article describes the features of congenital adrenogenital syndrome course in a newborn. We hope the description of this clinical case will add to the knowledge about this rare congenital disease.
новорожденный, адреногенитальный синдром, диагностика.
новонароджений, адреногенітальний синдром, діагностика.
newborn, adrenogenital syndrome, diagnosis.
Ребенок Т., девочка, родилась 24.10.2011, поступила в НОРИТ Харьковской ОДКБ № 1 25.10.11 в возрасте 1 суток. Ребенок переведен из родильного отделения ЦРБ г. Первомайска. Диагноз направившего учреждения: врожденный порок развития мочеполовой системы (атрезия уретры, влагалища).
Из анамнеза известно, что ребенок родился от II беременности, II родов. Настоящая беременность протекала гладко, роды в сроке гестации 39 недель, физиологические, оценка по Апгар 8/9 баллов. Масса при рождении — 3500 г, длина тела — 50 см, окружность головы — 36 см, окружность грудной клетки — 35 см.
При первичном осмотре в родильном зале у ребенка выявлено аномальное строение наружных половых органов. Ребенок консультирован врачомурологом, который диагностировал аномалию развития мочеполовых органов: мошоночная гипоспадия, двусторонний крипторхизм. Проведено УЗисследование, в брюшной полости обнаружена матка размером 21 ´ 16 мм и рудимент влагалища. Ребенок консультирован врачомгинекологом, который диагностировал врожденный порок развития мочеполовой системы: атрезия уретры, влагалища.
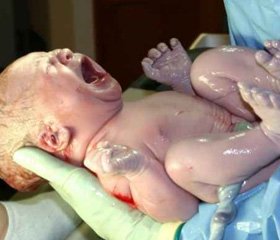
Для дальнейшего обследования и лечения ребенок переведен в НОРИТ Харьковской ОДКБ № 1, при поступлении у ребенка отмечена неврологическая симптоматика, которая проявлялась снижением спонтанной моторики, физиологических рефлексов, выраженной мышечной дистонией. Физикальные данные со стороны органов дыхательной и сердечнососудистой систем без отклонений от нормы. Живот был мягким. Печень пальпировалась на 1,5 см ниже края реберной дуги, селезенка не пальпировалась. Стул — меконий. Мочеиспускание свободное, до 7 раз в сутки. При осмотре половых органов отмечено увеличение клитора, на нижней поверхности которого имелось отверстие мочеиспускательного канала. Большие половые губы увеличены, по своей форме напоминали мошонку, но без яичек.
Ребенок консультирован проф. А.И. Кожемякой, который диагностировал врожденную дисфункцию коры надпочечников, адреногенитальный синдром. Дифференциальную диагностику проводили между вирильной и сольтеряющей формами. Ребенок консультирован врачамиспециалистами, заключения: невролог — «гипоксическиишемическое поражение ЦНС вследствие нарушения адаптационного периода»; генетик — назначено кариотипическое исследование; окулист — патологии не выявлено; эндокринолог — «врожденная дисфункция коры надпочечников — адреногенитальный синдром, вирильная форма».
Результаты лабораторноинструментальных исследований: анализ крови на 17ОНпрогестерон с интервалом в 15 дней: 1321,43 нг/мг — 123,2 нг/мг (норма 2,4–16,8 нг/л); суточный анализ мочи на 17КС — 12,8 мкмоль/л (норма 0,35–1,73 мкмоль/л); кариотипическое исследование — 46,XX; клинический анализ крови: эр. — 4,22 ´ 1012/л, Hb — 120 г/л, цв.п. — 0,84, лейк. — 8,2 ´ 109/л, э. — 1 %, п. — 1 %, с. — 45 %, л. — 49 %, м. — 4 %, СОЭ — 3 мм/ч; клинический анализ мочи — без отклонений от нормы; Ro ОГК — на рентгенограмме очаговоинфильтративных изменений в легких не выявлено. Ребернодиафрагмальные синусы свободные. Контуры купола диафрагмы ровные, четкие. Сердце в пределах возрастной нормы; УЗИ: надпочечники увеличены, структура не изменена. За мочевым пузырем лоцируется матка. Заключение: гиперплазия надпочечников; перивентрикулярное уплотнение. ЭКГ: синусовая аритмия со склонностью к тахикардии.
Лечение: инфузионная терапия 30 мл/кг — 5% глюкоза, физ. рр, Lлизин, преднизолон 5 мг/м2, цераксон 1 мл 1 раз в день.
В течение первых 7 дней состояние ребенка расценивалось как средней тяжести за счет умеренно выраженных неврологических расстройств. На 8й день состояние девочки ухудшилось, отмечалась двукратная рвота, сосание стало вялым, высасывала не больше 20,0–40,0 мл, потеряла в весе 40 г. На 9й день тяжесть состояния резко наросла: ребенок стал беспокоен, отмечались кратковременные клоникотонические судороги, мышечный тонус повышен, кожные покровы бледные, выражена мраморность кожи, тоны сердца приглушены, ЧСС 180 в мин, АД 60/30 мм рт.ст., аускультативно в легких пуэрильное дыхание, ЧДД 50 в 1 мин, живот вздут, печень на 2 см ниже края реберной дуги, селезенка не пальпируется. Стул кашицеобразный, желтый, 4 раза в сутки, без патологических примесей. Мочеиспускание задержано, мочевой пузырь пальпируется на 2 см ниже пупка. У ребенка диагностирована острая надпочечниковая недостаточность (ОНН), развившаяся на фоне адреногенитального синдрома.
При обследовании ребенка выявлены гиперкалиемия — 7,48 ммоль/л (норма 3,7–5,9 ммоль/л) — и гипонатриемия — 126,0 ммоль/л (норма 134,0–136,0 ммоль/л), снижение хлоридов — 75,9–94,3 ммоль/л (норма 95–110 ммоль/л), ЭКГ: тахикардия, признаки гиперкалиемии в виде высокого зубца Т в стандартных и грудных отведениях, нарушение реполяризации. При исследовании мочи — эритроцитурия (10–15 в п/зр), лейкоцитурия (25–30 в п/зр), белок — 0,183 г/л, умеренное количество слизи. УЗИ: надпочечники увеличены, структура не изменена, почки увеличены в размерах, стенки лоханок отечные. За мочевым пузырем лоцируется матка. Заключение: признаки пиелонефрита; гиперплазия надпочечников; перивентрикулярное уплотнение.
Совокупность клинических и лабораторноинструментальных исследований дала основание диагностировать у ребенка сольтеряющую форму врожденной дисфункции коры надпочечников, ОНН, пиелонефрит.
Состояние ребенка оставалось тяжелым в течение 4 дней. Тяжесть состояния была обусловлена надпочечниковой недостаточностью, интоксикацией и метаболическими нарушениями.
/117/117.jpg)
Лечение: гепацеф 60 мг/кг массы тела, амицил 15 мг/кг, этамзилат, 5% глюкоза, физ. рр 50 мл/кг, Lлизин, в ходе наблюдения дозы гормонов менялись: в первые дни гидрокортизон 5 мг/м2; затем при развитии ОНН гидрокортизон 4 мг/кг в/в; добавлен кортинефф 0,1 мг 2 раза в день; затем ребенку назначен преднизолон в таблетках в дозе 5 мг/м2.
В динамике наблюдения отмечено улучшение состояния: девочка стала активнее, количество смеси на кормление достигло 70,0–80,0 мл, ребенок прибавил в весе. Судороги не повторялись, мышечный тонус нормализовался, рефлексы периода новорожденности начали вызываться в полном объеме. Кожные покровы стали розовыми, нормализовались тургор и эластичность тканей. Тоны сердца ясные, ЧСС 120–132 в мин. В легких — пуэрильное дыхание. Живот мягкий, не вздут. Печень пальпировалась на 1,5 см ниже края реберной дуги. Селезенка не пальпировалась. Стул кашицеобразный, до 4–5 раз в сутки. Мочеиспускание свободное, до 12–15 раз в сутки.
Анализы мочи нормализовались, показатели калия и натрия крови, ЭКГ имели тенденцию к нормализации. Ребенок переведен в отделение патологии новорожденных, на 29й день жизни — в эндокринологическое отделение ОДКБ.
Таким образом, развитие интеркуррентного заболевания на фоне врожденной гиперплазии коры надпочечниковых желез привело к развитию ОНН, которая усугубляет тяжесть течения основного заболевания.
Краткая литературная справка
Врожденная гиперплазия коры надпочечниковых желез относится к группе наследственных нарушений биосинтеза стероидных гормонов. Процесс образования стероидов многоступенчатый. Каждая ступень катализируется соответствующим ферментом. Известно по меньшей мере 5 разновидностей наследственных дефицитов ферментов, обеспечивающих синтез стероидов (21гидроксилаза, холестеролдесмолаза, 3bгидроксистероиддегидрогеназа, 11bгидроксилаза, 17агидроксилаза). Все варианты этих нарушений наследуются по аутосомнорецессивному типу.
Наиболее распространена форма адреногенитального синдрома (90–95 % от всех случаев), обусловленная дефицитом фермента 21гидроксилазы (цитохром Р450с21), катализирующего превращение прогестерона в дезоксикортикостерон и 17гидроксипрогестерона в 11дезоксикортизол. Для разных клинических форм адреногенитального синдрома, как правило, характерны свои спектры мутаций. Причины широкой вариабельности клинических симптомов адреногенитального синдрома полностью не ясны. Одни и те же мутации, идентифицированные на молекулярногенетическом уровне, имеют разные клинические проявления. Это заболевание очень разнообразно по клиническим проявлениям. Известны два классических клинических варианта этой болезни — сольтеряющая и простая вирильная формы. Два других (неклассических) варианта называются поздней (неклассической) и латентной (бессимптомной) формами.
Сольтеряющая форма характеризуется полным дефицитом фермента и проявляется в нарушении солевого обмена (дефицит минералокортикоидов). Клиническая картина проявляется в первые дни внеутробной жизни. У новорожденного отмечаются срыгивание, рвота, симптомы недостаточности периферического кровообращения, сонливость, потеря массы тела. Обезвоживание вызывает повышенную жажду. Биохимическое исследование выявляет гиперкалиемию, гипонатриемию, ацидоз. Провоцирующими факторами развития ОНН служат интеркуррентные заболевания, травмы, операции, стрессовые ситуации.
Простая вирильная форма характеризуется прогрессирующей вирилизацией, ускоренным соматическим развитием, повышенной экскрецией гормонов коры надпочечников. У новорожденных девочек при кариотипе 46,ХХ отмечается различная степень маскулинизации (от умеренной гипертрофии клитора до полного срастания губномошоночных складок с формированием мошонки и пениса). Внутренние половые органы сформированы по женскому типу правильно. У мальчиков вирильная форма адреногенитального синдрома при рождении обычно не распознается (гениталии нормальные). Диагноз ставится лишь на 5–7м году жизни при появлении первых признаков преждевременного полового развития.
Диагноз устанавливают на основании результатов клинического обследования и определения полового хроматина, обнаружения повышенного выделения с мочой 17кетостероидов, высокого уровня в крови адренокортикотропного гормона, 17оксипрогестерона. Все новорожденные с неправильным строением наружных половых органов должны быть показаны эндокринологу.
Лечение всех форм синдрома состоит в заместительной терапии глюкокортикоидами, при сольтеряющей форме дополнительно назначают минералокортикоиды и хлорид натрия.
Прогноз сольтеряющей формы адреногенитального синдрома без лечения неблагоприятный. При правильном лечении, которое должно проводиться под контролем эндокринолога, больные с адреногенитальным синдромом сохраняют трудоспособность.
1. Гончаров Н.П. Биохимические маркеры врожденной дисфункции коры надпочечников и нарушений стероидогенеза / Н.П. Гончаров, Г.С. Колесникова // Проблемы эндокринологии. — 2007. — Т. 53, № 1. — С. 3033.
2. Петеркова В.А. Врожденная дисфункция коры надпочечников у детей (этиология, патогенез, клиника, диагностика, лечение): Пособие для врачей / В.А. Петеркова, Т.В. Семичева, Э.С. Кузнецова, М.А. Кареева, И.С. Яровая. — М., 2003. — С. 2934.
3. Петеркова В.А. Адреногенитальный синдром у детей: Пособие для врачей / В.А. Петеркова, Т.В. Семичева, А.Н. Тюльпаков, М.А. Карева. — М., 2006. — С. 317.