Журнал «Медико-социальные проблемы семьи» 3-4 (том 17) 2012
Вернуться к номеру
Особливості перебігу вагітності, профілактика та лікування її ускладнень при цитомегаловірусній інфекції у ВІЛ-інфікованих жінок
Авторы: Долгошапко О.М., Новікова І.В. - Донецький національний медичний університет ім. М. Горького
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
Стаття присвячена вирішенню задачі попередження інфікування цитомегаловірусом під час вагітності, зниження частоти ускладнень вагітності та пологів у ВІЛ-інфікованих жінок із цитомегаловірус-ною інфекцією (ЦМВІ) та випадків вертикальної трансмісії ЦМВІ та ВІЛ-інфекції від матері до плода шляхом розробки методичного підходу до вибору методів профілактики та лікування ЦМВІ у ВІЛ-інфікованих вагітних. Уперше у ВІЛ-інфікованих вагітних визначена частота гострої та хронічної ЦМВІ.
На підставі вивчення окремих імунних та гемостазіологічних показників, ускладнень вагітності та пологів, патології новонароджених у ВІЛ-інфікованих вагітних із гострою ЦМВІ, загостренням хронічної та латентною хронічною ЦМВІ або без неї були розроблені та впроваджені схеми антиретровірусної терапії (АРВТ) з імунопрофілактикою або імунотерапією.
Доведено, що запропонований комплексний метод використання імунотерапії разом з АРВТ у ВІЛ-інфікованих вагітних із гострою ЦМВІ чи загостренням хронічної ЦМВІ вірогідно знижує частоту загрози переривання вагітності в 2,86 раза; передчасних пологів — у 5 разів; синдрому затримки розвитку плода — в 9,99 раза; асфіксії новонароджених — в 7 разів; синдрому дихальних розладів — у 6 разів та перинатальної смертності — на 11,11 ‰, а також попереджає випадки інфікування.
Статья посвящена решению задачи предупреждения инфицирования цитомегаловирусом во время беременности, снижения частоты осложнений беременности и родов у ВИЧ-инфицированных женщин с цитомегаловирусной инфекцией (ЦМВИ) и случаев вертикальной трансмиссии ЦМВИ и ВИЧ-инфекции от матери к плоду путем разработки методического подхода к выбору методов профилактики и лечения ЦМВИ у ВИЧ-инфицированных беременных. Впервые у ВИЧ-инфицированных беременных определена частота острой и хронической ЦМВИ.
На основании изучения отдельных иммунных и гемостазиологических показателей, осложнений беременности и родов, патологии новорожденных у ВИЧ-инфицированных беременных с острой ЦМВИ, обострением хронической и латентной хронической ЦМВИ или без нее были разработаны и внедрены схемы антиретровирусной терапии (АРВТ) с иммунопрофилактикой или иммунотерапией.
Доказано, что предложенный комплексный метод использования иммунотерапии вместе с АРВТ у ВИЧ-инфицированных беременных с острой ЦМВИ или обострением хронической ЦМВИ достоверно снижает частоту угрозы прерывания беременности в 2,86 раза; преждевременных родов — в 5 раз; синдрома задержки развития плода — в 9,99 раза; асфиксии новорожденных — в 7 раз; синдрома дыхательных расстройств — в 6 раз и перинатальной смертности — на 11,11 ‰, а также преду-преждает случаи инфицирования.
The article deals with the task of prevention of cytomegalovirus infection during pregnancy, reducing the incidence of complications of pregnancy and childbirth in HIV-infected women with cytomegalovirus infection (CMVI) and the cases of vertical transmission of CMVI and HIV-infection from mother to fetus through the development of a methodological approach to the choice of methods of prevention and treatment of CMVI in HIV-infected pregnant women. For the first time in HIV-infected pregnant women there has been defined the frequency of acute and chronic CMVI.
On the basis of the study of specific immune and hemostatic parameters, complications of pregnancy and childbirth, newborn pathology in HIV-infected pregnant women with acute CMVI, aggravation of chronic and chronic latent CMVI or without it there were developed and implemented schemes of antiretroviral therapy (ARVT) with immunoprophylaxis or immunotherapy.
It is proved that the proposed method of using a comprehensive immunotherapy with ARVT in HIV-infected pregnant women with acute CMVI or exacerbation of chronic CMVI significantly reduces the incidence of threatened abortion in 2.86 times, premature birth — 5 times, fetal growth retardation syndrome — 9.99 times, newborn asphyxia — 7 times, respiratory distress syndrome — 6 times and perinatal mortality — by 11.11 ‰, and also it prevents contamination.
Цитомегаловірусна інфекція, ВІЛ-інфекція, імунні та гемостазіологічні показники, вагітність, профілактика, лікування, антиретровірусна терапія.
Цитомегаловирусная инфекция, ВИЧ-инфекция, иммунные и гемостазиолоческие показатели, беременность, профилактика, лечение, антиретровирусная терапия.
Cytomegalovirus infection, HIV-infection, immune and hemostasiologic indices, pregnancy, prevention, treatment, antiretroviral therapy.
Цитомегаловірусна інфекція (ЦМВІ) є найчастішою причиною внутрішньоутробної інфекції. За даними літератури, у 1–2 % усіх немовлят цитомегаловірус (ЦМВ) знаходять у сечі при народженні, до 1 року життя кількість таких дітей збільшується до 10–20 %, у дорослих до 35 років у 40 % має місце сероконверсія з появою антитіл до ЦМВ, а до 50 років майже всі дорослі люди інфіковані ЦМВ [1]. При скринінговому обстеженні немовлят вроджена ЦМВІ виявляється в 0,38–1 % спостережень [1, 2, 6–7]. За даними експертів ВООЗ, близько 1,5 % усіх немовлят інфіковані ЦМВ антенатально [1, 7]. При обстеженні під час вагітності серопозитивними щодо ЦМВ є 50–88 % жінок. При цьому антиген ЦМВ у сечі та крові виявляється у 3–11,4 % вагітних, специфічні імуноглобуліни (Ig) М — у 7–8 % пацієнток у різні терміни вагітності [8]; 20 % серопозитивних матерів мають ЦМВ у грудному молоці, 76 % їх немовлят є інфікованими [8, 9].
Імуносупресія — найважливіша особливість патогенезу цитомегалії. Це пов’язано с тим, що для ЦМВ характерна реактивація в умовах імунодефіциту. Різноманітність клініко-патогенетичних варіантів ЦМВІ пов’язана в більшості випадків із безсимптомним перебігом та поліморфізмом клінічних проявів. Діапазон клінічних варіантів досить широкий — від ледь помітного сіалоаденіту, мононуклеозоподібного захворювання зі сприятливим перебігом, до тяжких ушкоджень печінки, легенів та мозку [10, 11], а також шоку, який може викликати деструкція надниркових залоз при дисемінованій ЦМВІ [12, 13]. Останні форми ЦМВІ особливо часто зустрічаються в жінок, інфікованих вірусом імунодефіциту людини (ВІЛ) [14]. Поява ЦМВІ при ВІЛ розцінюється як погана прогностична ознака [12, 18]. До того ж вагітність сама по собі є тимчасовою «фізіологічною імуносупресією». У вагітних із загостренням хронічної чи латентної ЦМВІ, як правило, немає ніяких клінічних проявів, але в анамнезі є вказівки на звичне невиношування вагітності, завмерлі вагітності, мертвонародження та народження дітей із вадами розвитку. Первинна ЦМВІ у вагітних буває в 1-4 % випадків та супроводжується 50% ризиком внутрішньоутробного інфікування плода [15, 16]. У немовлят ЦМВІ найчастіше проявляється жовтяницею, тромбоцитопенічною пурпурою, гепатоспленомегалією, пневмонією та ураженням ЦНС [22]. У 10 % спостережень у внутрішньоутробно інфікованих дітей надалі мають місце порушення зору, слуху та інтелекту, а також інші неврологічні ураження [3–5, 20].
Надійної противірусної терапії при ЦМВІ до цього часу немає, хоча йдуть інтенсивні пошуки в цьому напрямку. Противірусні препарати можливо використовувати тільки поза вагітністю або при строку понад 36 тижнів вагітності. Використання з лікувальною метою інтерферонів при ЦМВІ малорезультативне, однак це питання також вивчається [19–21]. Залишається дискусійним питання профілактики гострої та активації хронічної ЦМВІ за допомогою специфічних високоочищених імуноглобулінів. На сьогодні немає однозначно розроблених та прописаних в акушерських протоколах схем лікування імуносупресії, наприклад, при вагітності у ВІЛ-інфікованих жінок. До того ж сама по собі ЦМВІ знижує й без того низький клітинний імунітет у ВІЛ-інфікованих.
Таким чином, залишається актуальним пошук нових методів профілактики та лікування ЦМВІ у ВІЛ-інфікованих вагітних, що дозволить, з одного боку, покращити імунний стан цих жінок та скоротити кількість кесаревих розтинів у них, а з іншого боку, — знизити внутрішньоутробне ураження немовлят ЦМВІ.
Мета дослідження: знизити частоту акушерських та перинатальних ускладнень у ВІЛ-інфікованих жінок із ЦМВІ шляхом удосконалення методичного підходу до вибору методів профілактики та лікування, знизити частоту інфікування ЦМВ «негативних» ВІЛ-інфікованих жінок під час вагітності шляхом розробки та впровадження науково обґрунтованих профілактичних заходів.
Матеріали та методи дослідження
Дана робота відповідає всім етичним вимогам, які встановлені щодо наукових робіт, на що був отриманий висновок комісії з питань біоетики при Донецькому національному медичному університеті ім. М. Горького МОЗ України (протокол № 65/16 від 29.04.2011 р.). Усі пацієнтки перед початком обстеження були проінформовані про характер клінічного дослідження, про застосування препаратів і можливі побічні ефекти. Дослідження проводилися після отримання згоди на участь у них. Робота виконувалася протягом 2006–2010 років на кафедрі акушерства, гінекології та перинатології факультету інтернатури та післядипломної освіти Донецького національного медичного університету ім. М. Горького, а також у Донецькому регіональному центрі охорони материнства та дитинства.
Для досягнення поставленої мети і вирішення завдань була розроблена програма досліджень, що передбачала етапність виконання роботи.
На першому етапі був проведений ретроспективний клініко-статистичний аналіз амбулаторних карт та історій пологів 1232 ВІЛ-інфікованих вагітних із метою виявлення поширеності ЦМВІ у них. Також було проведене анкетування 30 вагітних, 30 лікарів-курсантів акушерів-гінекологів та 27 сімейних лікарів-інтернів із метою визначення інформованості щодо ВІЛ-інфекції, ЦМВІ та їх співвідношення.
На другому етапі було проведене проспективне обстеження 180 ВІЛ-інфікованих вагітних із метою з’ясування особливостей імунних та гемостазіологічних показників, перебігу вагітності залежно від наявності у них ЦМВІ та її різновиду: 62 вагітні, які не мали антицитомегаловірусних антитіл в I триместрі вагітності (група А); 58 жінок, які мали гостру ЦМВІ чи загострення хронічної ЦМВІ протягом вагітності (група В), та 60 пацієнток із хронічною ЦМВІ, які не мали загострень під час вагітності (група С). Контрольну групу становили 30 здорових вагітних, які не мали ЦМВІ та ВІЛ-інфекції.
На третьому етапі була перевірена та порівняна ефективність профілактики інфікування ЦМВІ у 62 пацієнток, які не були інфіковані ЦМВ в I триместрі вагітності. Для оцінки її ефективності жінки були поділені на дві підгрупи: А основна (АО) — 42 пацієнтки, які з метою профілактики інфікування ЦМВ отримували в строк 9–12 тижнів вагітності антицитомегаловірусний імуноглобулін разом з антиретровірусною терапією (АРВТ), та А порівняння (АП) — 20 осіб, які отримували тільки АРВТ без специфічної імунопрофілактики.
На четвертому етапі була перевірена та порівняна ефективність розробленої лікувальної схеми в 58 вагітних із гострою та хронічною ЦМВІ з загостренням під час вагітності. Для оцінки її ефективності жінки були поділені на дві підгрупи: В основна (ВО) — 36 ВІЛ-інфікованих вагітних, які в комплексі з АРВТ отримували традиційну неспецифічну імунотерапію та противірусні препарати (імуноглобулін людини нормальний для внутрішньом’язового введення, свічки віферон після 28 тижнів, вальтрекс після 36 тижнів вагітності), та В порівняння (ВП) — 22 пацієнтки, які отримували тільки АРВТ без специфічної противірусної та імунотерапії.
Обстеження пацієнток проведене із застосуванням комплексу загальноприйнятих за наказами МОЗ України № 503 від 28.12.2002 р.; № 582 від 15.12.2003 р.; № 676 від 31.12.2004 р. і № 716 від 14.11.2007 р. та спеціальних методів дослідження.
Усім жінкам проводили обстеження з урахуванням соматичного та акушерсько-гінекологічного статусу. Особливу увагу приділяли збору та аналізу анамнестичних даних, таких як: вік, соціальний статус, давність та стадія ВІЛ-інфекції, час отримання та кількість препаратів АРВТ, наявність перинатальних інфекцій.
Діагноз ВІЛ-інфекції встановлювався лікарями-інфекціоністами Донецького обласного центру з профілактики та боротьби зі СНІДом на основі виявлення антитіл до ВІЛ за допомогою імуноферментного аналізу (ІФА) та імуноблоту. Стадія ВІЛ-інфекції встановлювалася відповідно до класифікації, з урахуванням клінічних та імунологічних проявів, згідно з наказом № 716 МОЗ України від 14.11.2007 р.
Вірусне навантаження визначали за допомогою генно-інженерних методів: полімеразно-ланцюгової реакції (ПЛР) та реакції гібридизації нуклеїнових кислот, що дозволяють виявити геном ВІЛ, вбудований у геном лімфоцитів.
Для підтвердження клінічного діагнозу ЦМВІ виявляли: антиген ЦМВ у цервікальному слизу, крові та слині вагітних методом ПЛР та специфічні антицитомегаловірусні антитіла в крові — Ig класів М та G методом ІФА.
Клітинний імунітет оцінювали за популяційним складом Т-клітин, таких як CD4+, CD8+, за допомогою моноклональних антитіл методом проточної цитометрії. Імунорегуляторний індекс обчислювали за співвідношенням CD4+/CD8+.
Гуморальний імунітет оцінювали за такими параметрами: неспецифічні Ig класів А, М и G в сироватці крові, які визначали за допомогою методу ІФА.
При вивченні системи гемостазу оцінювали кількість тромбоцитів і проводили візуальну оцінку їх агрегації експрес-методом за А.С. Шитиковою; оцінювали час згортання крові за Лі — Уайтом; протромбіновий індекс (ПІ) — за В.М. Туголуковим; тромбіновий час згортання — за R.M. Biggs et al.; активований частковий тромбопластиновий час (АЧТЧ) — за J. Caen et al.; концентрацію фібриногену — за Р.Р. Рутбергом; активність антитромбіну III (AT III) — за U. Abildgaard et al.; концентрацію розчинних фібрин-мономерних комплексів (РФМК) у плазмі — ортофенантроліновим тестом за В.А. Єликомовим зі співавторами; етаноловий тест — за H.G. Godal et al.
Для з’ясування вагінального біоценозу у вагітних проводили мікроскопічні та бактеріологічні дослідження: мікроскопію піхвового мазка, забарвленого за Грамом; посів виділень на факультативно-анаеробну групу мікроорганізмів і мікроаерофілів.
При оцінці стану фетоплацентарного комплексу використовували неінвазивні методи: ультразвукове сканування, допплерометрію та кардіотокографію плода.
Ультразвукове та допплерометричне дослідження проводили за допомогою апарату Pro-sound SSD-3500 фірми ALOKA (Японія), що працює в масштабі реального часу з використанням трансабдомінального і конвексного трансд’юсерів із частотою від 2,5 до 6 МГц. Зовнішню кардіотокограму виконували на апараті Feta Safe 6 фірми Kranzbьhler (Німеччина) зі строку 30 тижнів вагітності. Біофізичний профіль плода за критеріями, що були запропоновані A. Vintzileos, оцінювали в 0, 1 чи 2 бали.
Статистична обробка матеріалів проведена на персональному комп’ютері методами варіаційної статистики з використанням стандартного пакета прикладних програм Excel Windows XP Professional.
Результати дослідження та їх обговорення
Проведений клініко-статистичний аналіз 1232 амбулаторних карт та історій пологів у ВІЛ-інфікованих жінок із ЦМВІ або без неї. Встановлено, що від загального числа породіль (10 071) жінки з ВІЛ-інфекцією становили 12,23 %. Із них латентну хронічну ЦМВІ мали 982 (79,71 %), у 104 (8,44 %) спостерігалося загострення хронічної ЦМВІ під час вагітності, 84 (6,82 %) пацієнтки перенесли гостру ЦМВІ. У крові 62 (5,03 %) вагітних із ВІЛ-інфекцією антицитомегаловірусні антитіла були відсутні, отже, вони мали реальні шанси отримати гостру ЦМВІ під час вагітності.
Також у обстеженої групи вагітних мали місце асоціації ЦМВІ з іншими захворюваннями, що передаються статевим шляхом. Так, поєднання з токсоплазмозом було виявлене у 250 (20,29 %) жінок, із ВПГ-інфекцією — у 119 (9,66 %), із хламідіозом — у 52 (4,22 %), 42 (3,41 %) вагітні мали асоціації трьох інфекцій.
У більшості ВІЛ-інфікованих вагітних — 1017 (86,92 %) ЦМВІ перебігала безсимптомно, тільки у 153 (13,08 %) жінок мав місце респіраторний синдром під час гострої чи реактивації хронічної ЦМВІ.
У вагітних із III клінічною стадією ВІЛ-інфекції частіше відбувалося загострення хронічної ЦМВІ — у 64 (61,54 %) та мала місце гостра ЦМВІ — у 60 (71,43 %); з II клінічною стадією — у 32 (30,77 %) та 17 (20,24 %) відповідно; з I стадією — у 8 (7,69 %) та 7 (8,33 %) жінок відповідно.
Ускладнений перебіг вагітності мали практично всі 1149 (93,26 %) ВІЛ-позитивних жінок, до того ж кількість ускладнень збільшувалася залежно від стадії ВІЛ-інфекції. У пацієнток із III клінічною ста-дією ВІЛ-інфекції частіше спостерігалися ускладнення вагітності — у 296 (100 %) випадках, з II — в 372 (94,90 %), з I — в 486 (89,34 %) випадків (p < 0,05). Найчастіше виникала загроза переривання вагітності — у 854 (74,33 %) випадках, причому в I триместрі — у 519 (60,77 %), в II — у 245 (28,69 %), в III — у 90 (10,54 %). Друге місце посідало багатоводдя — у 768 (66,84 %), третє місце — анемія вагітних — у 641 (55,79 %) випадках. Іншими ускладненнями вагітності були: плацентарна дисфункція, яка становила 515 (44,82 %) випадків, блювота вагітних — 364 (31,68 %), прееклампсія — 285 (24,80 %), маловоддя — 32 (2,79 %).
Усього відбулося 987 пологів (у 4 випадках — пологи двійнею): своєчасних пологів — 878 (88,96 %), передчасних — 109 (11,04 %). Нормальними пологи були в 624 (63,22 %), патологічними — у 363 (36,78 %) жінок. Природним пологовим шляхом відбулося 747 (75,68 %) пологів, шляхом планового кесаревого розтину — 185 (18,74 %), шляхом кесаревого розтину за невідкладними показаннями — 55 (5,57 %) пологів. Антенатально загинуло 20 (2,02 %) плодів. Рання неонатальна загибель — 32 дитини (3,23 ‰), пізня — 2 дитини (0,2 ‰).
При анкетуванні було виявлено, що більшість вагітних та лікарів-інтернів не знають про те, що ЦМВІ — дуже небезпечна опортуністична інфекція при ВІЛ. Вагітні лише в 50,00 % випадків знають про статевий шлях передачі, тільки 23,33 % з них знають про можливість зараження свого немовляти при грудному вигодовуванні й передачі вірусу від матері до плода при гострій чи реактивації хронічної ЦМВІ. Про поширеність та небезпеку ЦМВІ для плода при позитивному ВІЛ-статусі у вагітної не знали більшість лікарів (63,33 %), інтернів (88,89 %) та вагітних (93,33 %).
Клініко-анамнестичний аналіз був проведений у 30 здорових вагітних, які не мали ЦМВІ та ВІЛ-інфекції, та у 180 ВІЛ-інфікованих вагітних, поділених на 3 групи: 62 вагітні, які не мали клініко-лабораторних ознак ЦМВІ (група А), 58 жінок, які мали гостру ЦМВІ чи реактивацію хронічної ЦМВІ під час вагітності (група В), 60 пацієнток, які мали хронічну ЦМВІ без загострень під час вагітності (група С). До складу груп не включалися пацієнтки з тяжкими автоімунними та соматичними захворюваннями; з гострими перинатальними інфекціями чи загостренням хронічних, окрім ЦМВІ; з ізосенсибілізацією за Rh-фактором та/або за системою АВ0; з IV клінічною стадією ВІЛ-інфекції (зі СНІДом).
Пацієнтки були взяті під наше спостереження в різні строки вагітності: від 6 до 12 тижнів: у I триместрі — 51 (82,25 %) жінок групи А, 48 (82,76 %) — групи В та 49 (81,67 %) — групи С; у II триместрі — 11 (17,74 %), 10 (17,24 %) та 11 (18,33 %) відповідно.
У пацієнток групи В самовільні аборти спостерігалися в 2,50; в 2,25 та в 3,94 раза частіше, ніж у жінок груп А, С та контрольної групи (p < 0,05). Відповідно кількість вагітностей, що закінчилися пологами, у жінок групи А була на 5,67 % більше, ніж у вагітних групи В; на 0,47 % більше, ніж у вагітних групи С, та на 1,32 % менше, ніж у пацієнток конт-рольної групи. Кесарів розтин проводився в 2,2–2,4 раза частіше в жінок групи В порівняно з іншими ВІЛ-інфікованими вагітними та в 3,5 раза частіше порівняно зі здоровими вагітними з групи контролю (p < 0,05).
У породіль із групи В у 4–5 разів частіше народжувалися мертві діти порівняно з обстеженими з груп А та С (p < 0,05), у групі контролю мертвонароджень не спостерігалося. Серед новонароджених від матерів групи С та контрольної групи ранньої неонатальної смертності не було в жодному випадку. У групі В спостерігалися найбільші загальні репродуктивні втрати, якими закінчилися 25,00 % бажаних вагітностей.
Результати обстеження підтверджуються даними інших авторів (С.В. Жаворонок, Т.М. Захаренкова, І.Ф. Крот, Є.І. Барановська, 2004; О.А. Орлова, 2006; А.В. Балдін, 2007; Г.Б. Матейко, 2008; R. Pusztai, 2009; E. Duryea, P. Sanchez, J. Sheffield, 2010; G. Nigro, 2011) і свідчать про те, що і ВІЛ-інфекція, і ЦМВІ кожна поодинці, а тим більше разом через свої патогенетичні особливості мають безпосереднє відношення до розвитку гестаційних ускладнень. Відомо, що основна дія обох інфекцій спрямована на імунну систему людини, особливо на фоні імуносупресії, обумовленої вагітністю.
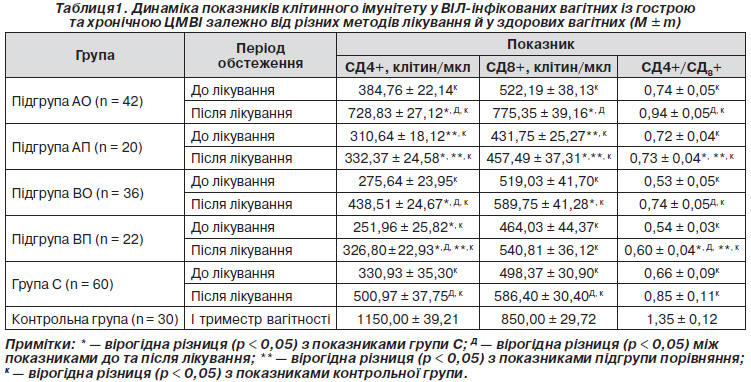
У вагітних групи А порівняно з групою C встановлене вірогідне перевищення абсолютної кількості Т-лімфоцитів-хелперів (СД4+) та зменшення Т-супресорів (СД8+) (p < 0,05), у контрольній групі вміст СД4+ та СД8+ вірогідно перевищував такий в усіх обстежених групах. Цим пояснюється зменшення в обстежених жінок групи А імунорегуляторного індексу (СД4+/СД8+) в 1,85 раза порівняно з групою контролю та збільшення в 1,11 раза порівняно з групою С. У вагітних групи В порівняно з конт-рольною групою та групою С встановлено вірогідне зменшення абсолютної кількості Т-лімфоцитів-хелперів (СД4+) та Т-супресорів (СД8+), тому в групі В імунорегуляторний індекс (СД4+/СД8+) був в 2,5 та 1,2 раза меншим, ніж у групі контролю та групі С (p < 0,05). При порівнянні групи А з групою В встановлено вірогідне перевищення абсолютної кількості Т-лімфоцитів-хелперів (СД4+) та зменшення Т-супресорів (СД8+), тому в групі А імунорегуляторний індекс (СД4+/СД8+) був в 1,3 раза більшим, ніж у групі В (p < 0,05). Отже, найкращий показник імунорегуляторного індексу серед ВІЛ-інфікованих вагітних відмічався в жінок, які не були інфіковані ЦМВ. Усі вивчені нами показники клітинного та гуморального імунітету покращилися з початком прийому вагітними АРВТ, але найгірше зростання показників було в жінок із підгрупи ВП, які мали гостру чи загострення хронічної ЦМВІ під час вагітності та не отримували в комплексі з АРВТ неспецифічної імунотерапії (табл. 1). Погіршення показників клітинного та гуморального імунітету залежно від стадії ВІЛ-інфекції спостерігалося однаково як до, так і після лікування.
Концентрація неспецифічних Ig всіх класів (А, М та G) була найбільшою в здорових вагітних із групи контролю. Концентрація неспецифічних Ig A та G у сироватці крові у вагітних групи С вірогідно перевищувала їх рівень у вагітних груп А та В. Однак неспецифічні IgМ найбільш високі були в сироватці крові у вагітних групи В. Вміст IgA в крові жінок групи А вірогідно перевищував цей показник в групі В, однак кількість Ig М та G була вірогідно знижена в групі А (p < 0,05).
Середній показник ВН до лікування був найбільш високим у вагітних із групи В (54903,38 ± 3280,79 копії/мл крові), тобто з гострою чи загостренням хронічної ЦМВІ, та перевищував такий показник групи А (20219,73 ± 1013,26 копії/мл крові) в 2,72 раза та групи С (39760,70 ± 1542,73 копії/мл крові) в 1,38 раза (p < 0,05). У групі С цей показник був також високим (39760,70 ± 1542,73 копії/мл крові) та перевищував аналогічний у групі А в 1,97 раза (p < 0,05) (рис. 1).
Патогенетичні особливості перебігу інфекційного процесу при ЦМВІ зумовлені високим ступенем толерантності ЦМВ як до клітин крові, так і до ендотелію судинної стінки, що й визначає можливість виникнення в таких вагітних порушень системи гемостазу. За нормокоагуляцію нами була прийнята гіперкоагуляція, властива в нормі здоровим вагітним.
В усіх обстежених групах переважала нормокоагуляція, однак у контрольній групі вона визначалася у 86,67 % жінок, в групі А — у 64,52 %, в групі С — у 60,00 % і тільки в 44,83 % — у групі В (p < 0,05). Гіперкоагуляція була виявлена майже в кожної 4-ї вагітної з груп А та С — у 25,81 та 23,33 % відповідно — та в 13,33 % випадків у групі контролю. У групі В гіперкоагуляція зустрічалася в 41,38 % випадків, майже з такою ж частотою, як і нормокоагуляція, що було в 3,10; 1,60 та 1,77 раза частіше, ніж у групі контролю, групах А та С відповідно (p < 0,05). Серед здорових вагітних контрольної групи явищ гіпокоагуляції не спостерігалося. Однак гіпокоагуляція в групі С визначалася частіше, ніж у групах А та В — 16,66; 9,68 та 13,80 % відповідно. Тобто поєднан-ня ВІЛ-інфекції та ЦМВІ в хронічній або гострій формі частіше веде до зміни згортання крові у бік гіпокоагуляції. I стадія ДВЗ-синдрому була виявлена в 54 (30,00 %) ВІЛ-інфікованих вагітних з усіх обстежених груп. У групі А спостерігалося зниження кількості тромбоцитів в 1,11 раза, скорочення часу згортання — майже в 1,77 раза (p < 0,05); збільшення вмісту ПІ — в 1,25 раза (p < 0,05), фібриногену — в 1,49 раза та РФМК — в 1,99 раза (p < 0,05); зменшення показників АЧТЧ — в 1,19 раза, тромбінового часу — в 1,30 раза та АТ III — в 1,25 раза (p < 0,05). У групі В спостерігалося зниження вмісту тромбоцитів в 1,25 раза; скорочення часу згортання — в 2,18 раза; збільшення вмісту ПІ — в 1,37 раза, фібриногену — в 2,02 раза та РФМК — в 2,26 раза; зменшення показників АЧТЧ — в 1,26 раза; тромбінового часу — в 1,46 раза та АТ III — в 1,36 раза (p < 0,05). У групі С спостерігалося зниження кількості тромбоцитів в 1,21 раза; скорочення часу згортання — в 1,85 раза; збільшення ПІ — в 1,31 раза, фібриногену — в 1,71 раза та РФМК — у 2,10 раза; зменшення показників АЧТЧ — в 1,23 раза, тромбінового часу — в 1,39 раза та АТ III — у 1,26 раза (p < 0,05).
У 24 (13,33 %) обстежених ВІЛ-інфікованих вагітних мали місце зсуви показників гемостазіограми в бік гіпокоагуляції, тобто розвилася II стадія ДВЗ-синдрому. У групі А спостерігалося: зниження кількості тромбоцитів в 1,35 раза; подовження часу згортання — в 1,24 раза; зменшення ПІ — в 1,29 раза та фібриногену — в 1,30 раза; збільшення РФМК — у 2,36 раза, АЧТЧ — у 1,30 раза, тромбінового часу — в 1,45 раза та АТ III — в 1,27 раза (p < 0,05). У групі В спостерігалося: зниження вмісту тромбоцитів у 1,50 раза; подовження часу згортання майже в 1,70 раза; зменшення ПІ — в 1,40 раза та фібриногену — в 1,56 раза; збільшення РФМК — в 2,45 раза; АЧТЧ — в 1,50 раза, тромбінового часу — в 1,59 раза та АТ III — в 1,47 раза (p < 0,05). У групі С спостерігалося: зниження кількості тромбоцитів в 1,44 раза; подовження часу згортання — в 1,50 раза; зменшення ПІ — в 1,37 раза та фібриногену — в 1,51 раза; збільшення РФМК — в 2,37 раза, АЧТЧ — в 1,37 раза; тромбінового часу — в 1,49 раза та АТ III — в 1,36 раза (p < 0,05).
Нами був розроблений комплексний підхід до профілактики та лікування ЦМВІ у ВІЛ-інфікованих вагітних залежно від наявності чи відсутності ЦМВІ до початку АРВТ, а також від форми ЦМВІ — гострої, загострення хронічної або латентної хронічної без загострень під час вагітності. Для цього всі жінки в групах А та В були поділені на 2 підгрупи залежно від того, отримували вони лікування та профілактику чи ні. До підгрупи АО (А основна) увійшли 42 ВІЛ-інфіковані вагітні без антицитомегаловірусних антитіл, які отримували в комплексі з АРВТ специфічну профілактику антицитомегаловірусним імуноглобуліном, до підгрупи АП (А порівняння) — 20 ВІЛ-інфікованих вагітних, які отримували тільки АРВТ і не отримували ніякої специфічної імунотерапії. До підгрупи ВО (В основна) увійшли 36 ВІЛ-інфікованих вагітних із гострою чи загостренням хронічної ЦМВІ, які отримували в комплексі з АРВТ традиційну неспецифічну імунотерапію, до підгрупи ВП (В порівняння) — 22 вагітні, які отримували тільки АРВТ і не отримували ніякої імунотерапії. До групи контролю С увійшли 60 ВІЛ-інфікованих вагітних, які мали хронічну ЦМВІ без загострень під час вагітності, а також отримували тільки АРВТ і не отримували ніякої імунотерапії.
Для лікування гострої чи загострення хронічної ЦМВІ використовували таку традиційну схему: внутрішньом’язове введення імуноглобуліну людини нормального по 3,0 мл (2 дози) через 2 доби на 3-тю тричі на курс; інтерферон віферон у вигляді ректальних свічок по 500 тисяч ОД двічі на добу протягом 10 днів після 28 тижнів вагітності; противірусний препарат вальтрекс у дозі по 0,5 г (по 1 таблетці) двічі на день протягом 5 днів після 36 тижнів вагітності. Для санації пологових шляхів застосовували цитеал.
Профілактика проводилася за допомогою антицитомегаловірусного імуноглобуліну людини, який вводили внутрішньом’язово у строки від 9 до 12 тижнів вагітності по 1,5 мл (1 доза) 1 раз на 5 діб, курсом 5 ін’єкцій. На метод використання антицитомегаловірусного імуноглобуліну людини з метою профілактики інфікування ЦМВ під час вагітності нами отриманий патент на корисну модель № 46872 України, МПК, А61К 39/395 «Спосіб профілактики первинної цитомегаловірусної інфекції у серонегативних щодо цитомегаловірусу вагітних».
Паралельно з імунітетом у вагітних ми вивчали вплив методів лікування та профілактики на систему гемостазу. Встановлено, що після початку АРВТ збільшилася кількість вагітних, чиї гемостазіологічні показники наблизилися до норми: в групі А — в 1,30 раза; в групі контролю С — в 1,31 раза та в групі В — в 1,33 раза (p < 0,05). Кількість вагітних з патологічною гіперкоагуляцією зменшилася в усіх групах: на 16,13 % — в групі А, на 10,35 % — в групі В та на 6,66 % — у групі контролю С. Випадків гіпокоагуляції після початку лікування в групі А зафіксовано в 2,00 раза менше, в групі контролю С частота гіпокоагуляції зменшилася в 5,01 раза, а в групі В — тільки в 1,33 раза (p < 0,05). До того ж частота II стадії хронічного ДВЗ-синдрому в групі В після початку терапії була в 8,19 раза більше, ніж у контрольній групі С (p < 0,05).
Інтегральним показником ефективності заходів лікування та профілактики є завершення вагітності. У 4 (18,18 %) вагітних підгрупи ВП вагітність завершилася самовільним абортом при строку вагітності 19–21 тижні. У підгрупі ВО групи В, у жодній із підгруп групи А, у групі С та групі контролю самовільних абортів не було.
Клінічні ефекти профілактики та різних методів лікування, окрім АРВТ, оцінені в 42 (67,74 %) жінок групи А та у 36 (62,07 %) групи В, які спостерігалися нами до моменту розродження. Також до моменту пологів під нашим наглядом знаходилися 20 (32,26 %) жінок групи А, 22 (37,93 %) з групи В та 60 (100 %) пацієнток групи С, які отримували тільки АРВ-препарати без будь-якої імунотерапії, а також 30 здорових вагітних, які не отримували ніякого лікування. У всіх цих вагітних мали місце гестаційні ускладнення. Так, незважаючи на профілактику антицитомегаловірусним імуноглобуліном, після початку АРВТ явища загрози переривання вагітності збереглися у 2 (4,76 %) жінок підгрупи АО, що було менше, ніж у жінок підгрупи АП, які отримували тільки АРВТ, у 12,61 раза; ніж у жінок підгрупи ВО, які отримували АРВ-препарати разом із неспецифічною імунотерапією — в 4,67 раза; ніж у жінок підгрупи ВП та групи С, які отримували тільки АРВТ — в 13,37 та 5,60 раза відповідно (p < 0,05); серед здорових вагітних такого ускладнення не було. За нашими даними, у жодної з обстежених 210 пацієнток не було такого ускладнення вагітності, як прееклампсія. Частота багатоводдя після початку АРВТ зменшилася в усіх групах та підгрупах, але тільки в підгрупі АО воно зовсім не спостерігалося, у групі контролю С та в підгрупі ВП мало місце найчастіше — у 8 випадках (13,33 та 36,36 % відповідно), в підгрупі АП та в підгрупі ВО — по 6 випадків (30,00 та 16,67 % відповідно), у групі контролю — у 2 випадках (6,67 %) (p < 0,05).
Пологи були своєчасними в усіх жінок підгрупи АО, у 14 (70,00 %) — підгрупи АП, у 32 (88,89 %) — підгрупи ВО та у 8 (44,44 %) — підгрупи ВП (p < 0,05). Відповідно передчасні пологи відбулися в підгрупі АП у 6 (30,00 %) жінок, що більше, ніж у групі С — 6 (10,00 %) — у 3 рази та в підгрупі ВО — 4 (11,11 %) — в 2,70 раза, але менше, ніж у підгрупі ВП — 10 (55,56 %) — в 1,85 раза (p < 0,05).
Природним шляхом пологи відбулися у 29 (96,67 %) жінок контрольної групи, у 36 (85,71 %) — підгрупи АО, у 6 (30,00 %) — підгрупи АП, у 30 (83,33 %) — підгрупи ВО та у 8 (44,44 %) — підгрупи ВП групи В (p < 0,05). Основним ускладненням пологів було несвоєчасне відходження навколоплідних вод — у 1 (3,33 %), 2 (4,76 %), 2 (10,00 %), 4 (11,11 %) та 14 (77,78 %) відповідно. На високу частоту цього ускладнення (до 35 %) вагітних з ЦМВІ вказують багато дослідників, пояснюючи це здатністю ЦМВ викликати запальний процес і некроз плодових оболонок (Н. Долгушина, 2006; А.П. Никонов, 2006; Г.Б. Матейко, 2008).
За допомогою операції кесаревого розтину народили 1 (3,33 %) жінка з групи контролю, 6 (14,29 %) — з підгрупи АО, 14 (70,00 %) — з підгрупи АП, 6 (16,67 %) — з підгрупи ВО та 10 (55,56 %) — з підгрупи ВП. Основним показанням до операції було високе вірусне навантаження (ВН): у жінок підгрупи АП — 8 (57,14 %) та у підгрупі ВП — 6 (60,00 %), у пацієнток підгруп АО та ВО груп А та В було невисоке ВН у строк 36–37 тижнів вагітності. Таким чином, ми вважаємо, що комбіноване призначення АРВТ та імунотерапії покращує стан імунітету у ВІЛ-інфікованих вагітних та зменшує ВН у крові перед розродженням, що зменшує кількість оперативних пологів за допомогою елективного кесаревого розтину та зменшує інфікованість немовлят від цих матерів.
Пологи в усіх жінок завершилися народженням живих дітей, причому недоношеними народилися: 6 (30,00 %) дітей у жінок підгрупи АП, 4 (11,11 %) — в підгрупі ВО та 10 (55,56 %) — у підгрупі ВП, у жінок підгрупи АО та контрольної групи не було передчасних пологів (p < 0,05).
Синдром дихальних розладів новонароджених частіше мав місце в немовлят від матерів підгрупи ВП — 12 (66,67 %), що вірогідно більше, ніж від матерів підгрупи ВО, у 6 разів — 4 (11,11 %); ніж у підгрупі АП, в 2,22 раза — 6 (30,00 %) (p < 0,05); СЗРП зустрічався частіше також у немовлят від матерів підгрупи ВП — 10 (55,56 %), що більше, ніж у підгрупі ВО, у 9,99 раза — 2 (5,56 %), ніж у підгрупі АП, в 2,77 рази — 4 (20,00 %). У новонароджених від матерів контрольної групи та підгрупи АО таких ускладнень не було зовсім.
Гіпоксичне ураження центральної нервової системи відмічалося в 1 (3,33 %) новонародженого від матері з групи контролю, у 2 (4,76 %) — з підгрупи АО, у 6 (30,00 %) — з підгрупи АП, у 2 (5,56 %) — від матерів з підгрупи ВО, у 8 (44,44 %) — з підгрупи ВП та у 14 (23,33 %) — з групи С. Кон’югаційна жовтяниця спостерігалася у 2 (6,67 %), 4 (9,52 %), 6 (30,00 %), 8 (22,22 %), 12 (66,67 %) та 10 (16,67 %) відповідно. У новонароджених з групи В наші дані виявили більший відсоток ускладнень, ніж дають літературні джерела (В.В. Тетерін, 2001; О.А. Пояркова, 2003; Н.М. Підзолкова, 2009).
За даними пренатального обстеження, у 6 (33,33 %) немовлят від жінок з підгрупи ВП, які отримували ізольовану АРВТ без імунотерапії, запідозрили внутрішньоутробне інфікування ЦМВІ. При загальному клініко-лабораторному обстеженні в першу добу життя тільки у 3 (16,67 %) із цих новонароджених були прояви внутрішньоутробного інфікування, а саме внутрішньоутробна пневмонія. Проте методом ПЛР в слині та сечі трьох інших малюків був виділений антиген ЦМВ, у зв’язку з чим їм проведено профілактичне лікування.
У жодній з підгруп групи А, у підгрупі ВО групи В, у контрольній групі та групі С випадків перинатальної смертності не було. Однак 2 немовляти з підгрупи ВП померли в ранньому неонатальному періоді (термін гестації при пологах — 28 та 30 тижнів, причина смерті — синдром дихальних розладів (СДР)).
Серед дітей від матерів групи А на даний час здорові 54,84 %; «негативна» ПЛР на ВІЛ у 30,65 %; не обстежені — 14,52 %. Серед дітей від матерів із групи В ці показники становили відповідно: 51,92; 23,08 і 17,31 %; «позитивна» ПЛР на ВІЛ — у 3,85 %; діагноз ВІЛ-інфекції встановлений у 3,85 % дітей. Серед дітей від матерів контрольної групи С за теперішнього часу здорові — 50,00 %; «негативна» ПЛР на ВІЛ — у 36,67 %; не обстежені — 10,00 %; діагноз ВІЛ-інфекції встановлений у 3,33 % дітей.
Отже, аналіз клініко-лабораторних даних, отриманих при застосуванні різних методів лікування, доводить перевагу обстеження всіх ВІЛ-інфікованих вагітних до початку АРВТ на наявність антицитомегаловірусних антитіл у крові. Надалі треба обирати профілактичне введення антицитомегаловірусного імуноглобуліну людини в I триместрі вагітності для жінок, не інфікованих ЦМВ, та комплексну АРВТ разом із засобами неспецифічної імунотерапії (імуноглобулін людини нормальний для внутрішньом’язового введення, інтерферон у вигляді свічок) та противірусними препаратами після 36 тижнів при гострій чи загостренні хронічної ЦМВІ.
Розроблені нами схеми лікування та профілактики дозволяють підвищити імунітет, попередити інфікування ЦМВ під час вагітності, зменшити кількість ускладнень вагітності та пологів, знизити ВН у крові, тим самим скоротити число елективних кесаревих розтинів та зменшити інфікування новонароджених ВІЛ та ЦМВІ.
Висновки
1. У ВІЛ-інфікованих вагітних в 94,97 % випадків зустрічається ЦМВ-інфекція, у тому числі: гостра — у 6,82 %, хронічна без загострень — у 79,71 %, загострення — у 8,44 %. 5,03 % вагітних із ВІЛ-інфекцією не інфіковані ЦМВ. Перебіг вагітності у ВІЛ-інфікованих жінок із гострою та загостренням хронічної ЦМВІ характеризується: загрозою переривання вагітності — у 96,81 %, плацентарною дисфункцією — у 86,70 %, багатоводдям — у 67,02 % та анемією вагітних — у 66,49 % випадків (р < 0,05).
2. У ВІЛ-інфікованих вагітних із гострою чи загостренням хронічної ЦМВІ спостерігається зменшення абсолютної кількості Т-лімфоцитів-хелперів (СД4+) та Т-супресорів (СД8+) (р < 0,05), імунорегуляторного індексу (СД4+/СД8+) в 2,50 раза, ніж у здорових вагітних; у 1,22 раза (р < 0,05), ніж у жінок із хронічною ЦМВІ без загострень під час вагітності, та в 1,35 раза менше (р < 0,05), ніж у вагітних, не інфікованих ЦМВ. У вагітних із гострою чи загостренням хронічної ЦМВІ кількість СД4+-клітин в 1,97 раза нижче при III стадії ВІЛ-інфекції, ніж при I стадії (р < 0,05).
3. Середній показник ВН до призначення АРВТ найбільш високий у вагітних із гострою чи загостренням хронічної ЦМВІ (54903,38 ± 3280,79 копії/мл крові) і перевищує такий показник у вагітних, не інфікованих ЦМВ (20219,73 ± 1013,26 копії/мл крові), у 2,72 раза (р < 0,05) та в жінок з хронічною ЦМВІ без загострень під час вагітності (39760,70 ± 1542,73 копії/млкрові) — в 1,38 раза (р < 0,05).
4. У 25,81 % вагітних із ВІЛ-інфекцією без ЦМВІ реєструються явища гіперкоагуляції, за наявності хронічної ЦМВ-інфекції без загострень — у 23,33 %. У групі жінок із гострою чи реактивацією хронічної ЦМВІ гіперкоагуляція зустрічається в 3,10 раза частіше, ніж серед здорових вагітних; в 1,60 раза частіше, ніж серед жінок без ЦМВІ, та в 1,77 раза частіше, ніж серед вагітних із латентною персистуючою ЦМВІ (р < 0,05). Гіпокоагуляція у вагітних із хронічною ЦМВІ без реактивації визначається у 16,66 % випадків; у пацієнток, не інфікованих ЦМВ, — у 9,68 %; з гострою чи реактивацією хронічної ЦМВ-інфекції — у 13,80 %.
5. Використання антицитомегаловірусного імуноглобуліну людини внутрішньом’язово у ВІЛ-інфікованих вагітних в строк 9–12 тижнів гестації, які не мають антитіл до ЦМВ в I триместрі вагітності, у строк 36–37 тижнів гестації збільшує кількість СД4+-клітин в 1 мкл крові в 1,89 раза, СД8+-клітин — в 1,48 раза, ВН в крові знижується в 11,66 раза (р < 0,05). Кількість СД4+- та СД8+-клітин у вагітних, які не отримують імунопрофілактику, майже не змінюється, ВН ВІЛ зменшується тільки в 7,59 раза (р < 0,05).
6. Запропонований комплексний метод використання імунотерапії разом із АРВТ у ВІЛ-інфікованих вагітних із гострою чи загостренням хронічної ЦМВІ вірогідно знижує частоту загрози переривання вагітності в 2,86 раза; передчасних пологів — в 5 разів; синдрому затримки розвитку плода — в 9,99 раза; асфіксії новонароджених — у 7 разів; СДР — у 6 разів та перинатальної смертності — на 11,11 ‰, а також попереджає випадки інфікування.
1. Адиева А.А. Роль цитомегаловирусной инфекции в патологии плода и новорожденного. Поиск новых противовирусных средств: Автореф. дис... д-ра биол. наук: 03.00.06 / А.А. Адиева [Место защиты: Науч.-исслед. ин-т вирусологии им. Д.И. Ивановского РАМН]. — Москва, 2009. — 49 с.
2. Баскаков П.М. Особливості перебігу і наслідків вагітності та пологів у жінок при загостренні латентних форм асоційованих генітальної герпесвірусної та цитомегаловірусної інфекцій / П.М. Баскаков, І.С. Глазков, Т.Г. Романеско // Одеський медичний журнал. — 2003. — № 6. — С. 44 -46.
3. Боровкова Б.И. Взаимодействие возбудителей инфекции с организмом беременной как фактор риска внутриутробного инфицирования плода / Б.И. Боровкова, И.С. Сидорова // Акушерство и гинекология. — 2005. — № 2. — С. 20-24.
4. Влияние урогенитальных инфекций на течение беременности и состояние плода и новорожденного / Т.В. Габидулина, Е.Л. Тимошина, С.Ю. Юрьев, А.Ш. Махмутождаев // Бюллетень сибирской медицины. — 2002. — Т. 1, № 1. — С. 84-88.
5. Врожденные перинатальные и неонатальные инфекции / П.А. Туки, К.С. Бекхем. — М., 2000. — Гл. 6: Цитомегаловирус. — С. 59-73.
6. Диагностика цитомегаловирусной инфекции у ВИЧ-инфицированных беременных женщин и определение факторов риска антенатального и интранатального заражения плода цитомегаловирусом / В.И. Шахгильдян, О.Ю. Шипулина, В.В. Сильц [и др.] // Акушерство и гинекология. — 2005. — № 2. — С. 24-29.
7. Кистенева Л.Б. Цитомегаловирусная инфекция как проблема перинатальной патологии: классификация, клинические проявления, дифференциальный диагноз, лечение, профилактика / Л.Б. Кистенева // Российский вестник перинатологии и педиатрии. — 2003. — Т. 48, № 5. — С. 52-56.
8. Кистенева Л.Б. Цитомегаловирусная инфекция как проблема перинатальной патологии: этиология, патогенез, диагностика / Л. Б. Кистенева // Российский вестник перинатологии и педиатрии. — 2003. — Т. 48, № 4. — С. 55-59.
9. Клинические, морфологические и цитологические критерии диагностики врожденной инфекции / О.А. Пустотина, Н.И. Бубнова, Б.Л. Гуртовой, Т.Б. Младковская // Акушерство и гинекология. — 2002. — № 1. — С. 13-16.
10. Клінічний перебіг вагітності, пологів та стан новонародженого у жінок, інфікованих цитомегаловірусом / С.М. Толкач, О.А. Пояркова, А.А. Писарєв, Г.Ф. Медведенко // Перинатологія та педіатрія. — 2002. — № 3. — С. 19-21.
11. Коломійцева А.Г. Цитомегаловірусна інфекція та вагітність / А.Г. Коломійцева, В.В. Тетерін // Перинатологія та педіатрія. — 2001. — № 3. — С. 51-55.
12. Корчинська О.О. Проблема цитомегаловірусної інфекції в сучасному акушерстві / О.О. Корчинська // Репродуктивное здоровье женщины. — 2008. — № 2. — С. 190-193.
13. Кузьмин В.Н. Цитомегаловирусная инфекция у беременных и новорожденных / В.Н. Кузьмин // Лечащий врач. — 2001. — № 10. — С. 55-58.
14. Лабораторная диагностика цитомегаловирусной инфекции у детей первых месяцев жизни / С.А. Коченгина, С.Н. Теплова, Н.Н. Русанова [и др.] // Журнал микробиологии. — 2000. — № 2. — С. 116-118.
15. Матейко Г.Б. Герпетична і цитомегаловірусна інфекції у вагітних: особливості перебігу, діагностики, лікування: Автореф. дис... д-ра мед. наук: 14.01.13 / Г.Б. Матейко [Івано-Франків. держ. мед. ун-т]. — Івано-Франківськ, 2008. — 21 c.
16. Никонов А.П. Инфекции в акушерстве и гинекологии: Практическое руководство по диагностике и антимикробной химиотерапии / А.П. Никонов, О.Р. Асцатурова // Гинекология. — 2006. — Т. 8, № 2. — С. 4-7.
17. Никонов А.П. Цитомегаловирусная инфекция и беременность / А.П. Никонов, О.Р. Асцатурова // Герпес. — 2006. — № 2. — С. 20-25.
18. Новиков А.И. Оппортунистические инфекции: эпидемиологические, иммунологические аспекты и качество жизни / А.И. Новиков, Ю.В. Редькин, Т.И. Долгих // Гинекология. — 2004. — Т. 6, № 4. — С. 169-173.
19. Определение активности антител к цитомегаловирусу в препаратах иммуноглобулинов для внутреннего введения методом параллельных линий / А.Г. Исрафилов, Л.Р. Давлетбаева, Р.Ш. Магазов и др. // Вестник Российской академии медицинских наук. — 2007. — № 1. — С. 26-28.
20. Особенности течения цитомегаловирусной инфекции у детей первого года жизни / И.П. Баранова, Ж.Н. Керимова, О.А. Жеворченкова, А.Е. Сосновский // Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. — 2008. — № 3. — С. 84-87.
21. Перший вітчизняний препарат для лікування цитомегаловірусної інфекції у вагітних / С.П. Писарєва, Н.С. Дяченко, С.М. Толкач [та ін.] // Здоровье женщины. — 2002. — № 3. — С. 49-51.
22. Профилактика перинатального заражения детей от ВИЧ-инфицированных матерей: предварительные результаты / И.А. Попова, А.Г. Рахманова, В.А. Цинзерлинг [и др.] // Педиатрия. — 2000. — № 3. — С. 26-32.