Газета «Новости медицины и фармации» 3 (444) 2013
Вернуться к номеру
Механизмы развития, принципы диагностики и современные методы лечения метаболического синдрома
Авторы: Т.Д. Звягинцева, д.м.н., профессор, И.М. Плутенко, Харьковская медицинская академия последипломного образования
Рубрики: Кардиология, Эндокринология
Разделы: Справочник специалиста
Версия для печати
 Метаболический синдром (МС) является одной из актуальных проблем современной медицины, что обусловлено тремя обстоятельствами. Вопервых, его распространенностью в популяции взрослого населения. Метаанализ эпидемиологических исследований показывает, что в индустриально развитых странах 15–25 % лиц в возрасте 40–70 лет имеют все основные компоненты метаболического синдрома. По прогнозам, в 2025 году ожидается увеличение числа больных с метаболическим синдромом на 50 % [1, 7]. Вовторых, риск развития сердечнососудистых заболеваний, связанных с атеросклерозом и сахарным диабетом (CД), в 2–3 раза выше по сравнению как с отдельно взятыми факторами риска, так и их сочетанием [2]. И втретьих, метаболический синдром имеет причинноследственную связь и ассоциацию с другими часто встречающимися заболеваниями (гипертоническая болезнь, ожирение, жировая дистрофия печени, синдром поликистозного яичника, эректильная дисфункция, подагра и др.) [3, 8].
Метаболический синдром (МС) является одной из актуальных проблем современной медицины, что обусловлено тремя обстоятельствами. Вопервых, его распространенностью в популяции взрослого населения. Метаанализ эпидемиологических исследований показывает, что в индустриально развитых странах 15–25 % лиц в возрасте 40–70 лет имеют все основные компоненты метаболического синдрома. По прогнозам, в 2025 году ожидается увеличение числа больных с метаболическим синдромом на 50 % [1, 7]. Вовторых, риск развития сердечнососудистых заболеваний, связанных с атеросклерозом и сахарным диабетом (CД), в 2–3 раза выше по сравнению как с отдельно взятыми факторами риска, так и их сочетанием [2]. И втретьих, метаболический синдром имеет причинноследственную связь и ассоциацию с другими часто встречающимися заболеваниями (гипертоническая болезнь, ожирение, жировая дистрофия печени, синдром поликистозного яичника, эректильная дисфункция, подагра и др.) [3, 8].
Метаболический синдром — понятие, объединяющее ряд факторов сердечнососудистого риска, а именно: артериальную гипертензию (АГ), абдоминальное ожирение, дислипидемию и инсулинорезистентность.
Эксперты Национальной образовательной программы по холестерину (NCEP ATP III) из США выделяют следующие критерии МС, при этом диагноз может быть установлен при наличии по крайней мере трех или более перечисленных признаков:
- уровень глюкозы в плазме крови > 6,1 ммоль/л;
- гипертриглицеридемия — уровень триглицеридов > 1,7 ммоль/л;
- снижение уровня холестерина липопротеидов высокой плотности (ЛПВП): у мужчин < 1,0 ммоль/л, у женщин < 1,0 ммоль/л;
- артериальное давление (АД) > 135/85 мм рт.ст. или антигипертензивная терапия;
- центральное (абдоминальное, висцеральное) ожирение — окружность живота (талии): у мужчин > 102 см, у женщин > 88 см.
Ориентировочно можно диагностировать МС при наличии не менее трех следующих симптомов:
- объем талии > 88 см у женщин и 102 см у мужчин;
- АД ≥ 130/85 мм рт.ст.;
- уровень сахара в крови натощак ≥ 6,1 ммоль/л;
- повышение уровня триглицеридов крови ≥ 1,7 ммоль;
- снижение уровня липопротеидов высокой плотности (ЛПВП): > 1 ммоль/л у мужчин, > 1,3 ммоль/л у женщин.
Для оценки избыточной массы тела предлагается использовать показатель окружности талии, а не индекс массы тела (ИМТ) — отношение массы тела к росту в квадрате (кг/м2), на котором базируется классификация массы тела и степени ожирения. Это связано с тем, что клиническим признаком метаболического синдрома является именно центральное ожирение, а показатель окружности талии, тесно коррелируя с ИМТ, отражает тип распределения жировой ткани в организме. Данные эпидемиологических исследований свидетельствуют о том, что риск сердечнососудистых заболеваний зависит не только от ИМТ, но и от типа отложения жира в организме: он выше при центральном (мужском) типе ожирения, нежели при нижнем (женском).
Основу МС составляет инсулинорезистентность (ИР), то есть снижение реакции инсулиночувствительных тканей (жировой, мышечной, печени) на физиологические концентрации инсулина. Показано, что инсулинорезистентность — результат взаимодействия генетических и внешних факторов. Среди последних наиболее важные — избыточное потребление жира и гиподинамия [6, 10].
Американский комитет по выявлению, диагностике и лечению повышенного артериального давления в своем VII докладе предлагает использовать в клинической практике критерии диагностики метаболического синдрома, предложенные национальными институтами здоровья США в 2001 году. В рекомендациях ВОЗ (1998) предложены несколько иные критерии для установления диагноза «метаболический синдром» [12].
В соответствии с этими рекомендациями метаболический синдром диагностируется при наличии двух из перечисленных факторов у пациента:
- с сахарным диабетом;
- нарушенной толерантностью к глюкозе (НТГ);
- нормальной толерантностью к глюкозе при наличии инсулинорезистентности, которая определяется по HOMAиндексу.
Приемлемыми для использования в практической работе врача представляются клинические критерии МС, рекомендованные Американским комитетом по выявлению, диагностике и лечению повышенного артериального давления, представленные выше. Распространенность метаболического синдрома, по данным американских исследователей, составляет 23,7 %. У мужчин с МС в 4 раза возрастает риск фатальной ишемической болезни сердца, в 2 раза — цереброваскулярных заболеваний и смерти от всех причин. МС у женщин сопровождается повышением риска ишемической болезни сердца. Кроме того, у пациентов с МС в 5–9 раз чаще возникает сахарный диабет [15, 16].
Развитие метаболического синдрома во многом зависит от массы тела и коррелирует с ИМТ как у мужчин, так и у женщин. Среди лиц с избыточной массой тела распространенность МС варьирует в пределах 22–28 %, среди лиц с ожирением — 50–60 %. В ближайшее время ученые прогнозируют увеличение количества больных с метаболическим синдромом, прежде всего за счет лиц с ожирением. Распространенность этого синдрома имеет четкую возрастную зависимость: среди лиц в возрасте от 20 до 29 лет она составляет 7 %, а среди людей старше 60 лет достигает 40 %.
До настоящего времени нет единого мнения о первопричине метаболических нарушений в патогенезе МС. Выявлено, что наследственная предрасположенность к ИР и ожирению в сочетании с низкой физической активностью и избыточным питанием определяют развитие ожирения, тканевой инсулинорезистентности и, как следствие, компенсаторной гиперинсулинемии (ГИ) с последующим развитием НТГ и формированием МС [9]. То есть пусковым моментом в развитии МС является возникновение инсулинорезистентности.
У больных с ИР после приема углеводосодеpжащей пищи через 20–30 минут в крови начинает повышаться уровень глюкозы, что приводит к повышению уровня ее метаболизма, в том числе к синтезу маннозы. Увеличение концентрации глюкозы активизирует выведение инсулина из bклеток поджелудочной железы. Инсулин переносится с кровью к клеткам печени, мышечной ткани, но вступить во взаимодействие с неправильно построенными рецепторами клеток печени, мышечной ткани он не может, поскольку рецепторы, которые отвечают за распознавание инсулина, имеют другую углеводочувствительную структуру, где в гликопротеинах происходит замена маннозы и фрукозы на другие моносахариды. В результате этого избыток глюкозы в крови не может превратиться в гликоген. Поэтому увеличение содержания глюкозы в крови при ожирении продолжается, и к 60й минуте превышает нормальные показатели. Чтобы не было гипергликемии, организм вынужден метаболизировать глюкозу в жирные кислоты с последующим синтезом жира и отложением его в жировых клетках (адипоцитах) больного организма. Очевидно, что метаболические процессы в организме больных с ИР могут отличаться от таковых у здорового человека. Таким образом, в 90 % случаев увеличение жировой ткани образуется изза избыточного поступления углеводов, а не изза употребления жиров. Отложение жира в клетках организма — это вынужденный энергетический резервный запас глюкозы при нарушении рецепции инсулина в организме человека. Так, в жировой ткани, особенно в адипоцитах висцерального жира, при пониженной чувствительности к инсулину возрастает липолиз. Некоторые исследователи существенное место в развитии ИР адипоцитов отводят туморнекротизирующему фактору, который тормозит тирозинкиназную активность рецепторов [4, 11].
Таким образом, формируется ИР, которая представляет собой неспособность инсулинозависимых тканей усваивать часть глюкозы при нормальном содержании инсулина в организме. Она может быть обусловлена дефектом рецепторов к инсулину, синтез которых находится под контролем гена INSR, и нарушением механизмов пострецепторного транспорта глюкозы в клетку через клеточную мембрану генетически запрограммированными дефектами, а также внутриклеточного ее метаболизма. Среди других причин, вызывающих ИР, можно назвать нарушение секреции инсулина bклетками поджелудочной железы и наличие в крови антагонистов инсулина. Поэтому существует значительное число лиц с врожденной резистентностью мышечной и жировой ткани к действию инсулина. В большинстве случаев при достаточной физической активности, оптимальном питании состояние выраженной ИР либо вообще не проявляется в течение жизни, либо проявляется в глубокой старости и является одной из причин смерти. Считается, что ИР связана с генотипом, возрастом, массой тела, физической активностью, наличием АГ, других заболеваний сердечнососудистой системы и т.д. Наиболее выражена ИР в скелетных мышцах, и адекватная физическая активность может ее уменьшить. Низкая физическая активность способствует раннему проявлению сопротивляемости клеток к инсулину.
Основными причинами ИР могут быть: гормональные и метаболические факторы; антитела к инсулину; антитела к рецепторам; измененная молекула инсулина; измененная структура рецептора. Существует ряд заболеваний и состояний, при которых возможно снижение количества рецепторов к инсулину (ожирение, акромегалия, болезнь Иценко — Кушинга, СД 2го типа, глюкокортикоиды и др.). При СД 2го типа уменьшается количество не только рецепторов к инсулину, но и транспортеров глюкозы. Основными инсулиночувствительными органамимишенями являются скелетные мышцы, жировая ткань и печеночные клетки. Экспериментальные исследования выявили также достаточно высокую чувствительность к инсулину миокарда и гладких мышц сосудов. Известно, что ИР развивается постепенно, в первую очередь в мышцах и печени, а на фоне накопления большого количества поступающих с пищей глюкозы и жира происходит увеличение размеров и количества адипоцитов, что сопровождается уменьшением плотности инсулиновых рецепторов на их поверхности и развитием ИР в жировой ткани. Уже после 30 лет клетки начинают терять чувствительность к инсулину. Наличию ИР жировой ткани способствует ГИ, необходимая для преодоления порога сниженной чувствительности к инсулину. Так как в условиях ИР усвоение глюкозы (в комплексе с инсулином и переносчиком) нарушено, то клетки, для функционирования которых необходимо присутствие инсулина, посылают сигналы в головной мозг о недостатке инсулина и организм начинает его вырабатывать в еще больших количествах, что поддерживает ГИ. При МС количество инсулина в крови больного ожирением может повышаться до 90–100 мкЕД/мл при норме у здорового человека 5–15 мкЕД/мл, то есть в десятки раз. Это позволяет утверждать, что нарушение рецепции инсулина у больных ожирением связано с нарушением углеводного обмена в организме. Возникшая ГИ некоторое время поддерживает нормогликемию. С другой стороны, ГИ подавляет распад жиров, что способствует прогрессированию ожирения. Развивается порочный круг: ИР — ГИ (способствующая ожирению за счет подавления распада жиров) — ожирение — ИР и т.д. Постоянная ГИ истощает секреторный аппарат bклеток поджелудочной железы, что приводит к развитию НТГ.
Существует и другая гипотеза, которая предполагает, что центральный тип ожирения является причиной развития ИР, ГИ и других метаболических нарушений. Адипоциты висцеральной жировой ткани секретируют ряд веществ, в том числе неэстерифицированные жирные кислоты (НЭЖК), цитокины, ингибитор активатора плазминогена (РАI1) и адипонектин, непосредственно в воротную вену печени. При повышении содержания НЭЖК в плазме наблюдается избыточное поступление липидов в мышечную ткань и печень, которое усиливает инсулинорезистентность. Высокие концентрации НЭЖК подавляют поглощение инсулина печенью, что приводит к ГИ и относительной ИР. Высокие уровни Среактивного белка, наблюдающиеся при ожирении, могут отражать секрецию цитокинов и наличие воспаления, в то время как РАI1 участвует в развитии протромботического состояния. Тесная связь ожирения с факторами риска позволяет рассматривать метаболический синдром как сочетание метаболических осложнений ожирения [9, 13, 14].
По последним данным, ИР выявляется задолго (минимум за 15 лет) до появления клиники СД. Следует иметь в виду, что гликилированный гемоглобин натощак, ГИ, нарушение инсулинового ответа, ИР, дислипидемия, абдоминальное ожирение, АГ, макроангиопатия, микроальбуминурия, протеинурия и ретинопатия появляются задолго до клиники и установления диагноза СД 2го типа.
Основной принцип терапии при метаболическом синдроме — это коррекция модифицируемых причинных факторов данного состояния, которая заключается в изменении образа жизни.
В соответствии с рекомендациями Американского общества по выявлению, диагностике и лечению повышенного АД к основным направлениям в терапии метаболического синдрома относятся:
- снижение избыточной массы тела и лечение ожирения;
- повышение физической активности;
- лечение АГ;
- коррекция НТГ и лечение СД 2го типа;
- лечение дислипопротеинемии.
Латиноамериканское соглашение по лечению сахарного диабета при АГ, принятое в сентябре 2003 года в БуэносАйресе, рекомендует следующий подход к терапии при метаболическом синдроме.
Немедикаментозное лечение:
- аэробные упражнения продолжительностью не менее 150 мин/нед;
- отказ от курения;
- план питания: снижение массы тела на 5 % в течение первых 6 мес.; ограничение в рационе жиров животного происхождения (менее 10 % от общего калоража);
- уменьшение потребления соли до 6 г в день и алкоголя до 30 г в день.
Медикаментозное лечение применяют для предотвращения развития сахарного диабета в случае неэффективности нелекарственной терапии у пациентов с метаболическим синдромом и нарушенной толерантностью к глюкозе: метформин, акарбоза, орлистат.
Антигипертензивную терапию следует начинать с приема антагонистов кальция, ингибиторов ангиотензинпревращающего фермента и блокаторов ангиотензина II.
В настоящее время первым препаратом выбора для достижения хорошего метаболического контроля глюкозы при недостаточной эффективности диеты и расширения физических нагрузок у больных метаболическим синдромом с избыточной массой тела и ожирением является метформин.
Положительные эффекты метформина отражены в многочисленных научных исследованиях [12–17]. Он обладает анорексигенным действием в отношении легкоусвояемых углеводов. Замедляя всасывание углеводов, метформин не приводит к резкому увеличению сахара в крови после еды и увеличению массы тела, а, напротив, способствует ее стабилизации. Лечение метформином больных с избыточной массой тела приводит к умеренному снижению веса в среднем на 5–7 кг за 3–4 месяца.
Метформин не стимулирует выброс инсулина из bклеток поджелудочной железы, поэтому не приводит к гиперинсулинемии, не вызывает гипогликемий, которые особенно опасны у больных СД 2го типа за счет возможного развития острой сердечнососудистой патологии — инфаркта или инсульта. Замедленное всасывание глюкозы в кровь под влиянием метформина облегчает функционирование поджелудочной железы и предохраняет ее от перенапряжения и истощения. Установлено, что метформин повышает чувствительность периферических тканей к инсулину, что способствует стабилизации и/или снижению массы тела. При длительном применении он приводит к выравниванию суточной гликемической кривой, снижению среднесуточного уровня гликемии, уменьшению уровня гликемии натощак, а также снижению и нормализации уровня гликированного гемоглобина (HbA1c), что способствует профилактике поздних осложнений сахарного диабета.
Метформин снижает уровень сахара в крови не за счет стимуляции секреции инсулина bклетками поджелудочной железы, а за счет увеличения поглощения глюкозы клетками периферических тканей, прежде всего мышцами, где он повышает уровень глюкозных транспортеров 4го типа. То есть метформин действует на основное звено патогенеза метаболического синдрома и сахарного диабета 2го типа — на инсулинорезистентность, что имеет особое значение. Снижая постпрандиальную гипергликемию, метформин уменьшает риск развития атеросклероза у больных с гиперинсулинемией и инсулинорезистентностью. Проведенные научные исследования показали, что метформин эффективно снижает аппетит, массу тела и инсулинорезистентность уже на стадии только избыточной массы тела, предотвращая или значительно уменьшая риск развития нарушения толерантности к глюкозе и перехода предиабета в СД 2го типа.
Поскольку при МС страдает и печень, то назначение aлипоевой кислоты, благодаря ее свойствам восстанавливать запасы глутатиона, предотвращать повреждение митохондрий, высвобождение цитохрома и гибель клеток, обусловленную воздействием фактора некроза опухоли, нашло широкое применение в гастроэнтерологии, эндокринологии, кардиологии.
Свойства aлипоевой кислоты подавлять некротические реакции в печени и антиоксидантный эффект способствуют торможению развития фиброза и снижают риск злокачественной трансформации гепатоцитов.
Гистохимические исследования показали, что введение aлипоевой кислоты увеличивает содержание гликогена в печени, не изменяя его содержания в мышцах. Изучение влияния aлипоевой кислоты на печеночный кровоток показало, что ее применение способствует повышению внутрипеченочного кровотока на 10–20 %, в то время как под влиянием других веществ не наблюдалось улучшения кровообращения в печени.
К основным биологическим свойствам aлипоевой кислоты относят:
- улучшение трансмембранного транспорта глюкозы с активацией процессов окисления глюкозы;
- снижение интенсивности процессов гликозилирования белка;
- антиоксидантный эффект;
- снижение концентрации жирных кислот в плазме;
- подавление процессов липолиза;
- снижение содержания общего холестерина и его эфиров в крови;
- увеличение уровня протеинов в сыворотке крови;
- радиопротекторное действие (за счет антирадикальных свойств);
- повышение устойчивости клеток к гипоксии;
- предупреждение ингибирования активности NO;
- потенцирование противовоспалительного действия глюкокортикоидов;
- желчегонный, детоксицирующий и спазмолитический эффекты;
- способность к обратимому связыванию молекул ДНК.
Благодаря этому aлипоевая кислота нашла широкое применение при лечении заболеваний печени, атеросклероза, гипертонической болезни, диабетических поражений органов и тканей, интоксикаций.
Нами было проведено обследование пациентов с целью выявления МС и его коррекции. У 28 пациентов (из них 18 женщин и 10 мужчин в возрасте 45,0 ± 1,4 года) диагностирован МС при наличии трех и более из пяти нижеперечисленных компонентов: 1) абдоминальное ожирение — окружность талии у мужчин > 102 см, у женщин > 88 см; 2) гипертриглицеридемия > 1,6 ммоль/л; 3) низкий уровень ЛПВП < 1 ммоль/л у мужчин и < 1,3 ммоль/л у женщин; 4) артериальная гипертензия — уровень АД > 130/85 мм рт.ст.; 5) НТГ — уровень сахара в венозной плазме натощак 5,6–6,5 ммоль/л.
В клинической картине исследуемых преобладали слабость (42,6 %), утомляемость (85,7 %), снижение работоспособности (71,4 %), нарушение сна (64,3 %), головная боль (53,6 %), лабильность настроения (100 %), боли ноющего и колющего характера по ходу толстой кишки (60,7 %), вздутие и урчание в животе (39,3 %), запоры или чередование запоров и поносов (78,6 %), снижение аппетита, отрыжка, плохая переносимость жирной и жареной пищи, продуктов, содержащих растительную клетчатку (67,9 %), горечь во рту (35,7 %), периодически — тошнота (60,7 %). Также было отмечено изменение размеров печени, у 22 пациентов она была умеренно увеличена, край гладкий, безболезненный.
Диагноз был верифицирован во время ультразвукового исследования, по данным которого у пациентов было выявлено повышение эхогенности ткани печени, носившее диффузный характер и расцененное как стеатогепатоз.
У всех больных было выявлено нарушение липидного обмена, толерантности к глюкозе, установлено наличие астеноневротического, болевого и диспептического синдромов.
С целью коррекции МС больным был назначен метформин в дозе 500 мг/сут и aлипоевая кислота в дозе 300 мг/сут внутривенно капельно на 200 мл изотонического раствора на протяжении трех недель в составе комплексной терапии.
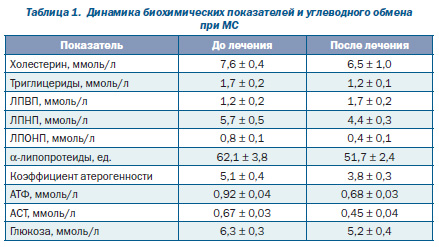
В результате проведенного лечения состояние больных улучшилось: значительно уменьшилась выраженность клинических симптомов, а также показатели липидного и углеводного обмена. В частности, на фоне проводимого лечения отмечалось статистически достоверное увеличение содержания ЛПВП от исходного уровня с 1,2 ± 0,2 до 1,7 ± 0,2 ммоль/л, р < 0,05. Наблюдалась общая тенденция к снижению уровня холестерина (с 7,6 ± 0,4 до 6,5 ± 1,0 ммоль/л), триглицеридов (с 1,7 ± 0,2 до 1,2 ± 0,1 ммоль/л) и ЛПНП (с 5,7 ± 0,5 до 4,4 ± 0,3 ммоль/л). Уровень глюкозы в крови также достоверно снизился (с 6,3 ± 0,3 до 5,2 ± 0,4 ммоль/л, р < 0,05).
Комплексная терапия с включением aлипоевой кислоты и метформина привела к улучшению качества жизни пациентов с метаболическим синдромом. Так, у 25 пациентов улучшилось общее самочувствие, у 21 улучшился сон, у 15 повысилось настроение; 14 больных отмечали значительное снижение слабости, 8 — уменьшение физического истощения и слабости.
Выводы
1. Комплексная терапия метаболического синдрома с использованием метформина и aлипоевой кислоты приводит к достоверному снижению уровня гликемии до нормальных цифр у всех обследуемых больных. Уровень сахара натощак снижается незначительно, случаи гипогликемии не зарегистрированы.
2. Выявлено достоверное снижение концентрации триглицеридов, уровня общего холестерина, липопротеидов низкой плотности и увеличение концентрации липопротеидов высокой плотности.
3. Применение комплексной терапии привело к повышению качества жизни лиц с метаболическим синдромом: улучшились общее самочувствие, сон, снизилась частота приступов головной боли, диспептического и болевого синдромов.
Список литературы находится в редакции

