Журнал «» 1 (27) 2013
Вернуться к номеру
Тривалість сну як фактор ризику серцево-судинних захворювань
Авторы: Візір В.А., Садомов А.С., Деміденко О.В., Запорізький державний медичний університет
Рубрики: Семейная медицина/Терапия, Кардиология, Неврология, Терапия
Разделы: Справочник специалиста
Версия для печати
В оглядовій статті широко обговорюється взаємозв’язок між тривалістю сну і серцево-судинними захворюваннями. Недостатня тривалість сну є загальним явищем у розвинених країнах, існують докази того, що люди в західних країнах сплять у середньому всього 6,8 години на добу, що на 1,5 години менше, ніж сто років тому. Хоча вплив депривації сну на організм людини не повністю з’ясований, останні епідеміологічні дослідження виявили взаємозв’язок між недосипанням та артеріальною гіпертензією, ішемічною хворобою серця і цукровим діабетом. Підвищення активності симпатичної нервової системи та зміни секреції мелатоніну розглядаються як основні патофізіологічні механізми, що беруть участь у становленні та прогресуванні серцево-судинних захворювань у осіб із недостатньою тривалістю нічного сну. Адекватна тривалість сну може бути важливою для профілактики серцево-судинних захворювань у сучасному суспільстві.
В обзорной статье широко обсуждается взаимосвязь между продолжительностью сна и сердечно-сосудистыми заболеваниями. Недостаточная продолжительность сна является общим явлением в развитых странах, существуют доказательства того, что люди в западных странах спят в среднем всего 6,8 часа в сутки, что на 1,5 часа меньше, чем сто лет назад. Хотя влияние депривации сна на организм человека не полностью объяснимо, последние эпидемиологические исследования выявили взаимосвязь между недосыпанием и артериальной гипертензией, ишемической болезнью сердца и сахарным диабетом. Повышение активности симпатической нервной системы и изменения секреции мелатонина рассматриваются в качестве основных патофизиологических механизмов, участвующих в становлении и прогрессировании сердечно-сосудистых заболеваний у лиц с недостаточной продолжительностью ночного сна. Адекватная продолжительность сна может быть важной для профилактики сердечно-сосудистых заболеваний в современном обществе.
In a review article there has been widely discussed the relationship between sleep duration and cardiovascular diseases. Lack of sleep is a common phenomenon in the developed countries, there is evidence that people in the Western countries sleep in average of 6.8 hours per day, which is 1.5 hours less than a hundred years ago. Although the effect of sleep deprivation on the human body is not fully explained, recent epidemiological studies have shown the relationship between sleep loss and hypertension, coronary heart disease and diabetes mellitus. Increased activity of the sympathetic nervous system and the changes in melatonin secretion are considered as main pathophysiological mechanisms involved in the development and progression of cardiovascular disease in patients with insufficient duration of nighttime sleep. An adequate amount of sleep may be important for the prevention of cardiovascular diseases in modern society.
серцево-судинні захворювання, тривалість сну, артеріальна гіпертензія, гострий інфаркт міокарда, ішемічна хвороба серця, цукровий діабет, мелатонін.
сердечно-сосудистые заболевания, продолжительность сна, артериальная гипертензия, острый инфаркт миокарда, ишемическая болезнь сердца, сахарный диабет, мелатонин.
cardiovascular disease, sleep duration, arterial hypertension, acute myocardial infarction, coronary heart disease, diabetes mellitus, melatonin.
Сон, в сущности, заимствуется у смерти для поддержания жизни; он есть срочный процент смерти, которая сама представляет собою уплату капитала. Последний взыскивается тем позже, чем выше проценты и чем аккуратнее они вносятся.
Артур Шопенгауэр
У наш час серцевосудинні захворювання (ССЗ) викликають майже 40 % усіх випадків смерті серед населення більшості розвинутих країн Європи [1]. У формуванні сучасних негативних медикодемографічних тенденцій в Україні ССЗ відіграють провідну роль та істотно впливають на основні показники здоров’я: захворюваність, смертність, інвалідність, тривалість і якість життя населення [2].
В Україні, за даними Державної служби статистки, ССЗ у 2011 році зумовили 63,3 % усіх смертей, при цьому понад 60 % припадає на осіб пенсійного віку [3]. В Україні смертність від хвороб системи кровообігу більше ніж у 2 рази перевищує показники інших розвинутих країн. За відносним показником летальність від ССЗ в нашій державі у 2011 р. становила 963,4, тоді як у країнах Європейського Союзу та США — менше 400 і 251 на 100 тис. населення відповідно [4]. Для працездатного населення з 2004 року хвороби серця і судин як причина смерті вперше в історії нашої країни вийшли на перше місце. За останні 10 років смертність від ССЗ зросла майже на 20 %, причому її рівень підвищився в більшості вікових груп [1]. Вкрай незадовільною в Україні залишається і ситуація щодо захворюваності на ССЗ. Так, станом на 2010 р. було зареєстровано 25 896 126 осіб із хворобами системи кровообігу, що становить понад половину населення країни. Вже в 2011 р. кількість нових випадків ССЗ збільшилася на 2346 тис. [3].
У наш час загальновизнано, що епідемія хронічних неінфекційних захворювань, у тому числі й серцевосудинних, значною мірою пов’язана зі способом життя й виникненням унаслідок цього фізіологічних факторів ризику. Статистично вірогідне зниження смертності від хвороб системи кровообігу серед населення більшості економічно розвинутих країн дослідники пов’язують саме зі зниженням кількості та рівня основних факторів ризику: паління, загального холестерину й артеріального тиску [5]. У той же час продовжується активний пошук нових факторів ризику ССЗ, корекція яких сприятиме зниженню індивідуального ризику за рахунок впливу на такі біологічні чинники, як надлишкова маса тіла та ожиріння, артеріальна гіпертензія (АГ), порушення жирового і вуглеводного обміну тощо.
За умов феномену соціальнопсихологічної глобалізації скорочення тривалості нічного сну притаманне населенню більшості розвинутих країн світу [6]. З іншого боку, проведені в останні роки великі епідеміологічні дослідження продемонстрували взаємозв’язок між тривалістю сну, інсомнією та АГ, ішемічною хворобою серця (ІХС) і цукровим діабетом II типу (ЦД) [7, 8]. Однак патогенетичні механізми, що є підґрунтям таких взаємозв’язків, дотепер залишаються до кінця не з’ясованими та потребують подальшого ретельного вивчення.
У 1980 році, на піку японського економічного буму, виснажлива праця та депривація сну були звинувачені у зростанні рівня летальності. У більшості випадків «каросі» (у перекладі з японської — смерть, що настала від перевтоми або зайвої нервової напруги, пов’язаних із працею) зумовлювало настання гострих серцевосудинних подій [9]. Аналогічним чином у Сполучених Штатах Національний фонд сну оприлюднив відомості, згідно з якими багато американців довгостроково позбавлені сну [10]. Лише близько однієї третини населення (37 %) повідомили, що отримують 8 годин сну на добу, у той же час у 31 % опитаних добова тривалість сну становила менше 6 годин [11]. Зменшення тривалості нічного сну є загальновизнаною тенденцією у сучасному суспільстві. Сьогодні існують переконливі докази того, що люди сплять у середньому всього 6,8 години на добу, що на 1,5 години менше, ніж сто років тому [12, 13].
Перед тим як безпосередньо перейти до аналізу наявності взаємозв’язку між тривалістю сну та ССЗ, вважаємо за доцільне стисло викласти сучасні уявлення про фізіологію сну та навести міжнародну класифікацію розладів сну.
Сучасне визначення сну виглядає таким чином: сон — це «особливий генетично детермінований стан організму людини (і теплокровних тварин, тобто ссавців і птахів), що характеризується закономірною послідовною зміною певних поліграфічних картин у вигляді циклів, фаз і стадій» [14].
Цикл нічного сну — це півторагодинний (у дорослої людини) період, за час якого сплячий послідовно проходить чотири стадії, починаючи від дрімоти (стадія 1) і закінчуючи найбільш глибоким, так званим дельтасном (стадії 3 і 4), що становлять у сумі фазу звичайного сну, яка потім різко змінюється фазою парадоксального сну, після закінчення якої починається новий цикл або людина пробуджується. За ніч спостерігаються 4–6 подібних циклів, що мають різну структуру. У першій половині переважає глибокий дельтасон, а під ранок — легкий сон (стадія 2) і фаза швидкого сну.
Система регуляції неспаннясну досить складна, але дотепер вже достатньо вивчена. Вона включає в себе наступні ключові механізми: неспання, повільний сон, швидкий сон та внутрішньодобова ритміка. На сьогодні відомо близько 10 систем тонічної деполяризації, або активації мозку (умовно — центрів неспання). Вони розташовані на всіх рівнях мозкової осі: у ретикулярній формації ствола, у ділянці блакитної плями та дорзальних ядер шву, задньому гіпоталамусі та базальних ядрах переднього мозку. Нейрони цих відділів як молекулипосередники виділяють глютамат та аспартат, ацетилхолін, норадреналін, дофамін, серотонін та гістамін. Центр сну знаходиться біля основи мозку, у так званому вентролатеральному преоптичному ядрі гіпоталамусу, нейрони якого секретують ГАМК — головну гальмівну речовину мозку. Неспання можна пояснити станом тонічної деполяризації нейронів. Навпаки, звичайний сон обумовлений тонічною гіперполяризацією нейронів. Періоди тонічної деполяризації та гіперполяризації повинні періодично змінювати один одного для збереження сталості внутрішнього середовища головного мозку та нормального функціонування таламокортикальної системи — субстрата вищої нервової діяльності людини [14].
Американська академія медицини сну у своєму офіційному виданні наводить наступну Міжнародну класифікацію розладів сну [15]:
1. Дисомнії:
А. Ендогенні розлади сну (нарколепсія, синдром обструктивного апное сну та ін.).
Б. Екзогенні розлади сну (синдром недосипання, синдром нічної їжі/пиття та ін.).
В. Розлади сну, пов’язані з порушеннями циркадних ритмів (синдром зміни часових поясів та ін.).
2. Парасомнії:
А. Розлади активації (сноходіння, нічні жахи).
Б. Порушення переходу «сон — неспання» (хвороба ритмічних рухів, нічні судоми ніг).
В. Парасомнії, пов’язані з RЕМстадією сну (нічні кошмари, порушення нічної ерекції та ін.).
Г. Інші парасомнії (бруксизм, нічний енурез та ін.).
3. Порушення сну, пов’язані з психічними, неврологічними або іншими захворюваннями:
А. Асоційовані з психічними захворюваннями (психози, депресії, панічні атаки та ін.).
Б. Асоційовані з неврологічними захворюваннями (дегенеративні захворювання головного мозку, хвороба Паркінсона та ін.).
В. Асоційовані з іншими захворюваннями (нічна ішемія міокарда, астма, пов’язана зі сном, виразка шлунка та ін.).
4. Передбачувані порушення сну (синдром неповного пробудження, пітливість уві сні та ін.).
T.G. Pickering та співавт. довели, що зменшення тривалості сну є незалежним фактором ризику розвитку АГ, ІХС та ЦД [8]. З точки зору якості сну не можна не брати до уваги синдром обструктивного апное сну, роль якого достатньо висвітлена щодо низки ССЗ, зокрема АГ [16], ІХС [17] та ЦД [18].
Ще у 80х роках минулого сторіччя D.L. Wingard та L.F. Berkman, аналізуючи ризик загальної смертності, асоційований із різною тривалістю сну, у 6928 дорослих протягом 9 років, дійшли висновку, що смертність від ІХС, раку, інсульту та інших причин була найнижчою у когорті осіб, що спали 7–8 годин на добу. При цьому залежність між тривалістю сну і смертністю носила Uподібний характер [19].
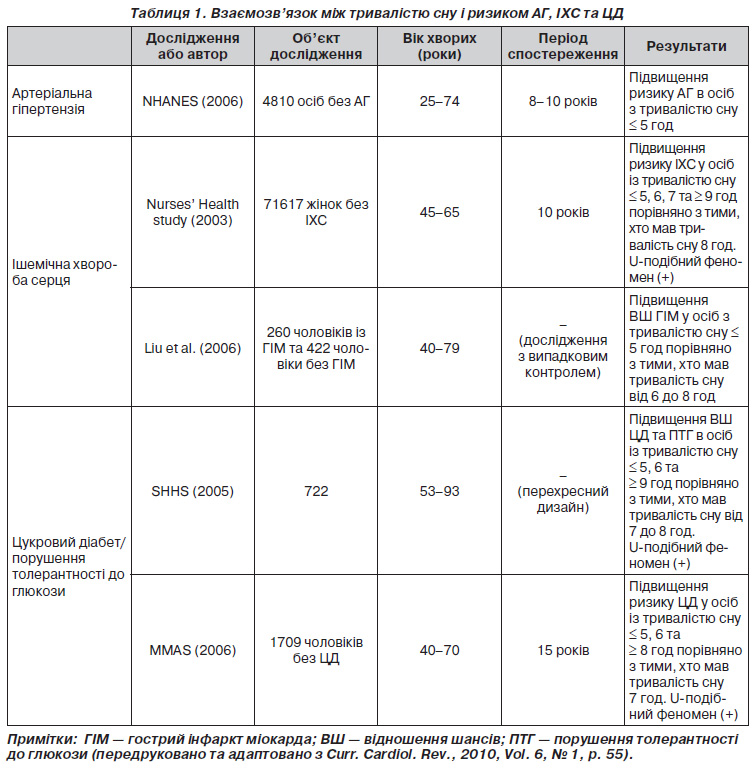
Короткий опис досліджень, що продемонстрували наявність взаємозв’язку між тривалістю сну і ризиком АГ, ІХС та ЦД, наведений у табл. 1.
Тривалість сну та АГ
Поширеність АГ збільшилася за останнє десятиліття, незважаючи на поліпшення обізнаності, лікування і контролю щодо даного захворювання [20]. За той же період середня тривалість сну в США неухильно знизилася [21].
У Першому національному дослідженні здоров’я і харчування (NHANES) J.E. Gangwisch і співавт. провели поздовжній аналіз тривалістю від 8 до 10 років за участю 4810 осіб віком від 25 до 74 років, щоб визначити, чи дійсно коротка тривалість сну викликає збільшення випадків АГ. У 647 осіб діагностували АГ. Тривалість сну ≤ 5 годин на добу була пов’язана зі значним збільшенням ризику АГ у пацієнтів віком від 32 до 59 років. Однак вірогідно значущого взаємозв’язку не було знайдено в осіб віком від 60 до 86 років [22].
Розглянемо основні патогенетичні механізми розвитку АГ під час гострої депривації сну.
Скорочення тривалості сну супроводжується частковою автономною дисфункцією з порушенням симпатовагального балансу та підвищенням симпатичного тонусу. У дослідженнях із застосуванням 24годинного амбулаторного моніторування артеріального тиску (ДМАТ) було продемонстровано тенденцію до зростання артеріального тиску (АТ) на наступний день після позбавлення сну як у нормотоників, так і в гіпертензивних осіб [23, 24]. Подібні результати були отримані й O. Tochikubo та ін., які показали значне збільшення АТ, співвідношення симпатовагального індексу (LF/HF) та екскреції норадреналіну, переважно у вечірній час, на наступний день після депривації сну у 18 чоловіків — технічних працівників віком від 23 до 48 років [25]. Ці дані вказують на те, що нестача сну може збільшувати активність симпатичної нервової системи наступного дня. Zhong та ін. оцінювали серцевосудинну вегетативну модуляцію протягом 36 годин тотального позбавлення сну у 18 здорових суб’єктів. LF вірогідно збільшувався через 12 та 24 годин, в той час як HF була знижена лише через 12 годин позбавлення сну. Зазначені зміни вегетативної регуляції призводили до підвищення співвідношення LF/HF лише через 12 годин після початку експерименту [26].
M.R. Irwin та M. Ziegler досліджували, чи викликає позбавлення сну диференційовані серцевосудинні та симпатичної реакції, вимірюючи частоту серцевих скорочень (ЧСС), АТ та рівень циркулюючих катехоламінів у 36 алкогользалежних чоловіків та 36 здорових осіб групи контролю, що були повністю порівнянні за віком, статтю та етнічною приналежністю. Хоча базові ЧСС, АТ та плазмовий рівень циркулюючих катехоламінів вірогідно не відрізнялися в обох групах, часткова депривація нічного сну призводила до більш значного збільшення ЧСС і рівня циркулюючих норадреналіну та адреналіну в алкогользалежних осіб порівняно з контрольною групою [27].
Як відомо, імунне запалення судин при супутньому при АГ атеросклерозі сприяє подальшому підвищенню АТ. J. Born і співавт. показали, що стимульована ex vivo продукція інтерлейкіну2 є вищою під час сну, і припустили, що цей ефект є сонзалежним [28, 29]. Навпаки, часткове позбавлення сну вночі призводить до зменшення продукції стимульованих інтерлейкіну2 та NKклітин [30, 31]. Отже, автори зробили припущення, що збільшення тривалості сну асоціюється з елевацією інтерлейкіну2 та прискоренням процесів атерогенезу.
Підвищення концентрації в плазмі крові Среактивного білка (СРБ) є індикатором системного запалення. Циркулюючий СРБ є репрезентативним маркером прогресування судинного ремоделювання. З огляду на це елевація СРБ у сироватці крові позитивно корелює з рівнем АТ. H.K. MeierEwert та співавт. вимірювали високочутливий Среактивний білок (hsСRP), зібраний кожні 90 хвилин упродовж 5 днів у 10 здорових дорослих, які не спали протягом 88 годин поспіль. Дослідження продемонструвало вірогідне збільшення концентрації hsСRP та систолічного АТ під час періоду спостереження [32].
Надмірне неспання додатково спонукає до розвитку довготривалого психосоціального стресу. Останнім часом було встановлено, що стрес самостійно призводить до збільшення споживання солі та гальмування екскреції натрію нирками [33]. Ці процеси можуть додатково бути пов’язані з розвитком АГ через перевантаження об’ємом та структурнофункціональну перебудову артеріальних судин.
Тривалість сну та ІХС
Проспективне дослідження, проведене в США, показало, що стандартизований за віком показник смертності від ІХС був найвищим серед тих, хто працює 67 годин або більше на тиждень [34]. Результати подібних випробувань із випадковим контролем у Нідерландах, Данії та Швеції також продемонстрували, що тривалий робочий час був пов’язаний із підвищенням ризику розвитку гострого інфаркту міокарда (ГІМ). Аналогічне дослідження в Японії встановило значне збільшення шансів щодо ГІМ у тих, хто працював понад 11 годин на день [35–38].
Наведені дані дають підстави вважати, що зниження тривалості сну, викликане понаднормовою працею, пов’язане з підвищеним ризиком ГІМ. Проведене Американським товариством раку дослідження показало, що чоловіки, які спали 4 години або менше на добу, характеризувалися більш високим показником смертності від ІХС порівняно з тими, хто проводив у ліжку 7–7,9 години [39]. Результати даного дослідження цілком узгоджуються з висновками інших авторів [19, 40].
Y. Liu і співавт. досліджували взаємозв’язок між ризиком ГІМ та тривалістю робочого часу і сну. Виявилося, що збільшення кількості робочих годин пов’язане з більш короткою тривалістю сну. Одночасно було встановлено, що праця понад 60 годин призводить до збільшення ризику захворюваності на ГІМ у 2 рази порівняно з 40годинним робочим тижнем. Досліджувані, які відпочивали не більше 5 годин на добу, мали в 2,3 раза більший ризик розвитку нефатального інфаркту міокарда порівняно з тими, хто отримував 6–8 годин сну [41].
У дослідженні Nurses’ Health Study досліджували взаємозв’язок між самооціненою тривалістю сну і захворюваністю на ІХС у 71 617 жінок медичних працівників віком 45–65 років. Загалом було документовано 934 коронарні події (271 фатальну та 663 нефатальних) протягом 10 років спостереження. Скоригований за віком відносний ризик ІХС для 5 і менше, 6 та 7 годин сну становив 1,82, 1,30 і 1,06 відповідно. Слід зазначити, що збільшення тривалості сну до 9 годин асоціювалося зі зростанням відносного ризику ІХС до 1,57 [42].
Ці повідомлення підтверджують думку, що коротка або довга тривалість сну незалежно пов’язана зі збільшенням ымовірності коронарних подій. Таким чином, існує Uподібна залежність між тривалістю сну і частотою виникнення нових випадків ІХС.
Тривалість сну та ЦД
K. Spiegel і співавт. оцінили діяльність гіпоталамогіпофізарнонадниркової системи та симпатовагальний баланс в 11 молодих чоловіків під впливом двох різних режимів: після обмеження часу в ліжку до 4 годин на добу протягом 6 ночей поспіль та у відновлювальному періоді, коли учасникам було дозволено проводити в ліжку 12 годин на добу протягом 6 ночей підряд. Більш значне зниження толерантності до глюкози, висока концентрація кортизолу ввечері та підвищена активність симпатичної нервової системи були отримані в експерименті під час депривації сну порівняно з періодом відпочинку [43].
У дослідженні Sleep Heart Health Study (SHHS) за участю 722 чоловіків і 764 жінок віком від 53 до 93 років був виявлений перехресний взаємозв’язок між звичною тривалістю сну та розвитком ЦД і ПТГ. Порівняно з тими, хто спав від 7 до 8 годин на добу, досліджувані з тривалістю сну ≤ 5 та 6 годин мали відношення шансів 2,51 и 1,66 для ЦД та 1,33 и 1,58 для ПТГ відповідно [44].
Дизайн дослідження Massachusetts Male Aging Study (MMAS) передбачав спостереження за когортою чоловіків без ЦД впродовж 15 років. Група контролю мала достатній 7годиннний сон. Результати випробування засвідчили, що в чоловіків, які відпочивали ≤ 5, 6 та > 8 годин на добу, було відповідно в два та в три рази більше шансів захворіти на ЦД порівняно з контрольною групою. При цьому слід зауважити, що ризики залишалися практично незмінними після врахування віку, наявності АГ, паління, самооцінки стану здоров’я, рівня освіти та окружності талії [46].
Таким чином, коротка або довга тривалість сну збільшує ризик розвитку ЦД незалежно від супутніх чинників. Це означає, що існує Uподібна залежність між тривалістю сну і захворюваністю на ЦД.
Завершуючи огляд основних експериментальних досліджень, присвячених встановленню наявності й характеру взаємозв’язку між тривалістю нічного сну та ризиком виникнення ССЗ, слід зупинитися на ролі мелатоніну (МТ) як центрального регулятора симпатичної активності ЦНС, що ініціює порочне коло (рис. 1).
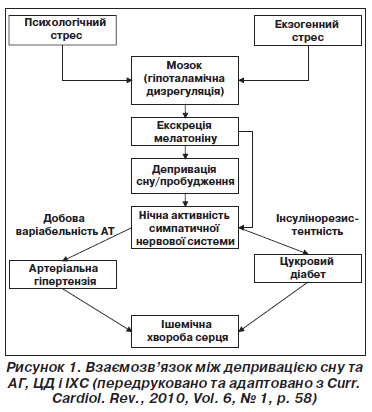
У людей єдиним джерелом МТ, що виконує роль фоторегулятора циркадних біоритмів усього організму, є епіфіз, що є структурою епіталамуса проміжного мозку.
Будучи залозою нейрогліального походження, епіфіз пов’язаний з багатошаровою ділянкою епендими задньої стінки III шлуночка (субкомісуральним органом).
Основними секреторними клітинами епіфіза є пінеалоцити. Ними утворюється й секретується в кров і цереброспінальну рідину гормон МТ (назву отримав завдяки здатності змінювати забарвлення шкіри й луски у земноводних і риб). МТ є похідним амінокислоти триптофану, він забезпечує регулювання біоритмів ендокринних функцій та метаболізму для пристосування організму до різних умов освітленості. Епіфіз має нервові зв’язки з лімбічними структурами, однак основна регуляторна інформація надходить в епіфіз із верхнього шийного вузла по симпатичних волокнах, що формують шишкоподібний нерв. Однак МТ виробляється не тільки в епіфізі, його синтез виявлений майже у всіх органах: у сітківці ока, Гардеровій залозі і шлунковокишковому тракті, тимусі, імунних клітинах, серці, статевих залозах, антральних фолікулах. Дія екстрапінеального МТ, як правило, має авто і/або паракринний характер [47].
Синтез і секреція МТ залежать від освітленості — надлишок світла гальмує його утворення. Шлях регуляції секреції починається від сітківки ока ретиногіпоталамічним трактом, з проміжного мозку по прегангліонарних волокнах інформація надходить у верхній шийний симпатичний ганглій, потім відростки постгангліонарних клітин повертаються в мозок і доходять до епіфіза. Зниження освітленості підвищує виділення на закінченнях симпатичного шишкоподібного нерва норадреналіну і, відповідно, синтез і секрецію МТ. У людини на нічні години припадає 70 % добової продукції гормону. У процесі онтогенезу максимальна активність синтезу, секреції та концентрації МТ в крові визначається в дитячому та пубертатному віці. Рівень його починає стрімко знижуватись у 22 роки, а в 55–60 років стає мінімальним. Враховуючи цей чинник, МТ прийнято розглядати як гормон молодості [48].
Фізіологічні ефекти МТ інтенсивно вивчаються, хоча чіткої систематизації молекулярних та фізіологічних механізмів ще не існує. Серед відомих слід зазначити: вплив на пігментний обмін, пристосування до сезонних та поясних зміщень, узгодження біохімічних процесів із циркадними змінами освітленості, тривалості дня та географічної широти, антигонадотропний ефект, модифікацію лактаційної функції, затримку формування сексуальної поведінки та статевого дозрівання тварин, індукцію нічного сну зі збереженням нормального співвідношення його фаз, антистресові, седативні ефекти, антипроліферативний ефект (вплив на гормонозалежні пухлини), імуномодулювальні та імуностимулюючі властивості, що виявляється у регенерації та реактивації тимуса й відновленні його функції, антиноцицептивний ефект за рахунок впливу на центральні ланки больової чутливості головного мозку, антиоксидантну та цитопротекторну дії [49, 50].
Механізм дії МТ полягає у впливі на тканиниефектори за рахунок активації МТрецепторів завдяки лігандрецепторній взаємодії. Вони визначають специфічність та дозозалежність ефектів гормону на клітинимішені. Інші ефекти викликані особливістю молекулярної будови МТ як універсального антиоксиданта зі знешкодженням вільних радикалів (скевенджерфункція) [51].
У клінічному аспекті МТ становить інтерес для спеціалістів різних профілів через свої різноспрямовані властивості.
За допомогою мічених атомів вдалося встановити, що регуляція циркадних ритмів здійснюється не тільки опосередковано, завдяки вивільненню таких біологічно активних субстанцій, як МТ, кортикостерон, статеві гормони та гормони щитоподібної залози, внаслідок стимуляції супрахіазматичних ядер (СХЯ) гіпоталамусу, але й шляхом безпосереднього впливу нервової системи на діяльність різних органів та систем [52–55].
Стан СХЯ визначає секрецію гормонів і чутливість до них органівмішеней через нейронні механізми. У фізіологічних умовах вплив на СХЯ стимулює секрецію інсуліну в підшлунковій залозі, глюкози в печінці та одночасно сприяє засвоєнню глюкози іншими тканинами [56].
Довготривалі фізіологічні дослідження показали, що пацієнти, які страждають від АГ та ЦД, демонструють порушення циркадного ритму [57, 58]. Значне зниження рівня декількох нейромедіаторів СХЯ у хворих на АГ постає анатомічним підґрунтям збою біологічного годинника [59]. Інтригуючими є і результати експериментальних досліджень, у яких були встановлені анатомічні дефекти СХЯ у спонтанних гіпертензивних щурів (SHR), а трансплантація гіпоталамусу від останніх нормотензивним щурам індукувала розвиток АГ [60]. Результати 5річного спостереження переконливо свідчать про те, що порушення циркадних ритмів можуть передувати виникненню АГ [61].
F. Simko та L. Paulis узагальнили потенційну роль МТ у схемі антигіпертензивного лікування. Нічна секреція МТ призводить до зниження АТ у гіпертензивних осіб. Призначення МТ призводило до зниження АТ у деяких модельованих тварингіпертоніків, здорових чоловіків і жінок, а також у пацієнтів з АГ. Найбільш перспективні результати були досягнуті у хворих із недостатнім нічним зниженням АТ (nondipper). Авторами розглянуто декілька можливих механізмів зниження АТ, обумовлених призначенням МТ. Останній завдяки його скевенджер та антиоксидантним властивостям здатний покращувати ендотеліальну функцію через підвищення біодоступності оксиду азоту, що призводить до вазодилатації. Додатковий вплив МТ на периферичну та центральну нервову системи сприяє зниженню тонусу адренергічної та стимуляції холінергічної систем [62].
Отже, проведений огляд існуючих літературних джерел свідчить про те, що депривація сну тісно асоціюється з розвитком цілої низки ССЗ: АГ, ІХС та ЦД тощо. Наявна залежність при цьому має Uподібний характер. Підвищення активності симпатичної нервової системи та зміни секреції МТ розглядаються як основні патофізіологічні механізми, що беруть участь у становленні та прогресуванні ССЗ в осіб із недостатньою тривалістю нічного сну. Поряд із досягнутими на сьогодні успіхами існує й багато невирішених питань, зокрема: як довго ми повинні спати і які медикаменти для покращення тривалості та якості сну слід вживати.
Недостатня тривалість нічного сну є потенційно модифікованим фактором ризику АГ, ІХС та ЦД, остаточна роль якого в становленні та прогресуванні ССЗ може бути з’ясована шляхом проведення подальших міжнародних багатоцентрових рандомізованих клінічних досліджень.
1. Горбась І.М. Ішемічна хвороба серця: епідеміологія і статистика / І.М. Горбась // Здоров’я України. — 2009. — № 2/1. — С. 3435.
2. Горбась І.М. Фактори ризику серцевосудинних захворювань: поширеність і контроль / І.М. Горбась // Здоров’я України. — 2007. — № 21/1. — С. 6263.
3. Захворюваність населення (1990–2011 рр.) [Електронний ресурс] / Держ. служба статистки України. — Режим доступу: http://www.ukrstat.gov.ua/.
4. Богатирьова Р.В. Артеріальна гіпертензія: державна стратегія профілактики, лікування і упередження ускладнень [Електронний ресурс]: презентація / Р.В. Богатирьова. — 2012. — Режим доступу: http://moz.gov.ua/ua/portal/pre_20120510_2.html.
5. Goya Wannamethee S. Physical activity and mortality in older men with diagnosed coronary heart disease / S. Goya Wannamethee, G. Shaper, M. Walker // Int. Med. J. — 2002. — Vol. 3. — Р. 201207.
6. Глобальні трансформації. Політика, економіка, культура / [Д. Гелд, Е. МакГрю, Д. Голдблатт, Д. Перритон]. — К.: Фенікс, 2003. — 584 с.
7. Nagai M. Sleep disorder and hypertension / M. Nagai, K. Kario // Nihon Rinsho — 2012. — Vol. 70(7). — Р. 11881194.
8. Pickering T.G. Could hypertension be a consequence of the 24/7 Society? The effects of sleep deprivation and shift work / T.G. Pickering // J. Clin. Hypertens. (Greenwich) — 2006. — Р. 819822.
9. Uehata T. Long working hours and occupational stressrelated cardiovascular attacks among middleaged workers in Japan / T. Uehata // J. Hum. Ergol. — 1991. — Vol. 20. — Р. 147153.
10. National Sleep Foundation Sleep Survey. Washington, DC: National Sleep Foundation. — 2001.
11. Bonnet M.H. We are chronically sleep deprived / M.H. Bonnet, D.L. Arand // Sleep. — 1995. Vol. 18. — Р. 908911.
12. Webb W.B. Are we chronically sleep deprived? / W.B. Webb, H.W. Agnew // Bull Psychon. Soc. — 1975. — Vol. 6. — Р. 4748.
13. National Sleep Foundation. Sleep in America Poll 2003. — Washington, DC: National Sleep Foundation, 2003.
14. Ковальзон В.М. Обучение и сон / В.М. Ковальзон // Природа. — 2009. — № 3. — С. 311.
15. American Academy of Sleep Medicine. International classification of sleep disorders, revised: Diagnostic and coding manual. — Chicago, Illinois: American Academy of Sleep Medicine. — 2001. — P. 15.
16. Wolk R. Obesity, sleep apnea, and hypertension / R. Wolk, A.S. Shamsuzzaman, V.K. Somers // Hypertension. — 2003. — Vol. 42. — Р. 10671074.
17. Leung R.S. Sleep apnea and cardiovascular disease / R.S. Leung, T.D. Bradley // Am. J. Respir. Crit. Care Med. — 2001. — Vol. 164. — P. 21472165.
18. Punjabi N.M. Disorders of glucose metabolism in sleep apnea / N.M. Punjabi, V.Y. Polotsky // J. Appl. Physiol. — 2005. — Vol. 99. — Р. 19982007.
19. Wingard D.L. Mortality risk associated sleeping patterns among adults / D.L. Wingard, L.F. Berkman // Sleep. — 1983. — Vol. 6. — Р. 102107.
20. Hajjar I. Trends in prevalence, awareness, treatment, and control of hypertension in the United States, 1988–2000 / I. Hajjar, T.A. Kotchen // JAMA. — 2003. — Vol. 290. — Р. 199206.
21. National Sleep Foundation. 2002 «Sleep in America» Poll. — Washington, DC: National Sleep Foundation, 2002.
22. Short sleep duration as a risk factor for hypertension. Analyses of the First National Health and Nutrition Examination Survey / J.E. Gangwisch, S.B. Heymsfield, B. BodenAlbala [et al.] // Hypertension. — 2006. — Vol. 35. — P. 833899.
23. Effects of a restricted sleep regimen on ambulatory blood pressure monitoring in normotensive subjects / P. Lusardi, A. Mugellini, P. Preti [et al.] // Am. J. Hypertens. — 1996. — Vol. 9. — P. 503505.
24. Effects of insufficient sleep on ambulatory blood pressure in hypertensive patients: A 24h study / P. Lusardi, A. Zoppi, P. Preti [et al.] // Am. J. Hypertens. — 1999. — Vol. 12. — P. 6368.
25. Effect of insufficient sleep on blood pressure monitored by a new multibiomedical recorder / O. Tochikubo, A. Ikeda, E. Miyajima [et al.] // Hypertension. — 1996. — Vol. 27. — P. 13181324.
26. Increased sympathetic and decreased parasympathetic cardiovascular modulation in normal humans with acute sleep deprivation / X. Zhong, H.J. Hilton, G.J. Gates [et al.] // J. Appl. Physiol. — 2005. — Vol. 98. — P. 20242032.
27. Irwin M.R. Sleep deprivation potentiates activation of cardiovascular and catecholamine responses in abstinent alcoholics / M.R. Irwin, M. Ziegler // Hypertension. — 2005. — Vol. 45. — P. 252257.
28. Effects of sleep and circadian rhythm on human circulating immune cells / J. Born, T. Lange, K. Hansen [et al.] // J Immunol. — 1997. — Vol. 158. — P. 44544464.
29. Effects of sleep on the production of cytokines in humans / D. Uthgenannt, D. Schoolmann, R. Pietrowsky [et al.] // Psychosom Med. — 1995. — Vol. 57. — P. 97104.
30. Partial sleep deprivation reduces natural killer cell activity in humans / M. Irwin, A. Mascovich, J.C. Gillin [et al.] // Psychosom. Med. — 1994. — Vol. 56. — P. 493498.
31. Partial night sleep deprivation reduces natural killer and cellular immune responses in humans / M. Irwin, J. McClintick, C. Costlow [et al.] // FASEB J. — 1996. — Vol. 10. — P. 643653.
32. Effect of sleep loss on Creactive protein, an inflammatory marker of cardiovascular risk / H.K. MeierEwert, P.M. Ridker, N. Rifai [et al.] // J. Am. Coll. Cardiol. — 2004. — Vol. 43. — P. 678683.
33. Folkow B. Mental stress and its importance for cardiovascular disorders; physiological aspects, «frommicetoman» / B. Folkow // Scand. Cardiovasc. J. — 2001. — Vol. 35. — P. 163172.
34. Buell P. Mortality from coronary heart disease in California men who work long hours / P. Buell, L. Breslow // J. Chorn. Dis. — 1960. — Vol. 11. — P. 615626.
35. Falger P.R. Exhaustion, psychological stressors in the work environment, and acute myocardial infarction in adult men / P.R. Falger, E.G.W. Schouten EGW // J. Psychosom. Res. — 1992. — Vol. — 36. — P. 777786.
36. Relation between job strain and myocardial infarction: a case control study / B. Netterstrom, F.E. Nielsen, T.S. Kristensen [et al.] // Occup. Environ. Med. — 1999. — Vol. 56. — P. 339342.
37. Theorell T. Behavior and life satisfactions characteristics of Swedish subjects with myocardial infarction / T. Theorell, R.H. Rahe // J. Chron. Dis. — 1972. — Vol. 25. — P. 139147.
38. Sokejima S. Working hours as a risk factor for acute myocardial infarction in Japan: casecontrol study / S. Sokejima, S. Kagamimori // BMJ. — 1998. — Vol. 317. — P. 775–780.
39. Short and long sleep and sleeping pills / D.F. Kripke, R.N. Simons, L. Garfinkel [et al.] // Arch. Gen. Psychiatry. — 1979. — Vol. 36. — P. 103116.
40. Sleep disorders in relation coronary heart disease / M. Partinen, P.T. Putkonen, J. Kaprio [et al.] // Acta Med. Scand. — 1982. — Vol. 660. — P. 6983.
41. Liu Y. The Fukuoka Heart Study Group. Overtime work, insufficient sleep, and risk of nonfatal acute myocardial infarction in Japanese men / Y. Liu, H.Tanaka // Occup. Environ. Med. — 2002. — Vol. 59. — P. 447451.
42. A prospective study of sleep duration and coronary heart disease in women / N.T. Ayas, D.P. White, J.E. Manson [et al.] // Arch. Intern. Med. — 2003. — Vol. 163. — P. 205209.
43. Spiegel K. Impact of sleep dept on metabolic and endocrine function / K. Spiegel, R. Leproult, E. Van Cauter // Lancet. — 1999. — Vol. 354. — P. 435439.
44. Association of sleep time with diabetes mellitus and impaired glucose tolerance / D.J. Gottlieb, N.M. Punjabi, A.B. Newman [et al.] // Arch. Intern. Med. — 2005. — Vol. 165. — P. 863867.
45. Yaggi H.K. Sleep duration as a risk factor for the development of type 2 diabetes / H.K. Yaggi, A.B. Araujo, J.B. McKinlay // Diabetes Care. — 2006. — Vol 29. — P. 657661.
46. Insulin resistance, body fat distribution, and sex hormones in men / S.M. Haffner, P. Karhapaa, L. Mykkanen [et al.] // Diabetes. — 1994. — Vol. 43. — P. 212219.
47. Мелатонин: теория и практика / [Беспятых А.Ю., Бродский В.Я., Бурлакова О.В. и др.]; под ред. С.И. Рапопорта, В.А. Голиченкова — М.: ИД «МедпрактикаМ», 2009. — 99 с.
48. Анохіна С.І. Вплив мелатоніну на гемостаз, плазмовий фібриноліз і фібринолітичну активність тканин внутрішніх органів білих щурів / С.І. Анохіна, Є.М. Горбань // Бук. мед. вісн. — 2002. — Т. 6, № 3–4. — С. 117120.
49. Chu S.C. Naproxen, meloxicam and methylprednisolone inhibit urokinase plasminogen activator and inhibitor and gelatinases expressionduring the early stage of osteoarthritis / S.C. Chu, S.F. Yang, K.H. Lue // Clin. Chim. Acta. — 2008. — Vol. 388(1–2). — P. 234.
50. Hardeland R. Circadian Rhythms, Oxidative Stress and Antioxidative Defense mechanisms / R. Hardeland, A. CotoMontes, B. Poeggeler // Chronobiology International. — 2003. — Vol. 20, № 6. — P. 921962.
51. Kinetic radicalscavenging activity of melatonin / S. Fujisawa, Y. Kadoma, M. Ishihara [et al] // In Vivo. — 2006. — Vol. 20(2). — P. 215220.
52. CNS structures presumably involved in vagal control of ovarian function / I. Gerendai, I.E. Toth, Z. Boldogkoi [et al] // J. Auton. Nerv. System. — 2000. — Vol. 80. — P. 4045.
53. Polysynaptic neural pathways between the hypothalamus, including the suprachiasmatic nucleus, and the liver / S.E. La Fleur, A. Kalsbeek, J. Wortel [et al] // Brain Res. — 2000. — Vol. 871. — P. 5056.
54. Parasympathetic and sympathetic control of the pancreas: a role for the suprachiasmatic nucleus and other hypothalamic centers that are involved in the regulation of food intake / R.M. Buijs, S.J. Chun, A. Niijima [et al] // J. Comp. Neurol. — 2001. — Vol. 431. — P. 405423.
55. Selective parasympathetic innervation of subcutaneous and intraabdominal fat — functional implications / F. Kreier, E. Fliers, P.J. Voshol [et al] // J. Clin. Invest. — 2002. — Vol. 110. — P. 12431250.
56. A daily rhythm in glucose tolerance: a role for the suprachiasmatic nucleus / S.E. La Fleur, A. Kalsbeek, J. Wortel [et al] // Diabetes. — 2001. — Vol. 50. — P. 12371243.
57. Pickering T.G. The clinical significance of diurnal blood pressure variations. Dippers and nondippers / T.G. Pickering // Circulation. — 1990. — Vol. 81. — P. 700702.
58. Impaired diurnal cardiac autonomic function in subjects with type 2 diabetes / M. Yamamoto, Y. Yamasaki, M. Kodama [et al.] // Diabetes Care. — 1999. — Vol. 22. — P. 20722077.
59. Neuropeptide changes in the suprachiasmatic nucleus in primary hypertension indicate functional impairment of the biological clock / V.D. Goncharuk, J. van Heerikhuize, J.P. Dai [et al] // J. Comp. Neurol. — 2001. — Vol. 431. — P. 320330.
60. Hypertension induced by hypothalamic transplantation from genetically hypertensive to normotensive rats / R. Eilam, R. Malach, F. Bergmann [et al] // J. Neurosci. — 1991. — Vol. 11. — P. 401411.
61. Predictors of stable hypertension in young borderline subjects: a fiveyear followup study / C. Borghi, F.V. Costa, S. Boschi [et al] // J. Cardiovas. Pharmacol. — 1986. — Vol. 8 (Suppl. 5). — P. 138141.
62. Simko F. Melatonin as a potential antihypertensive treatment / F. Simko, L. Paulis // J. Pineal. Res. — 2007. — Vol. 42. — P. 319322.