Журнал «Травма» Том 14, №2, 2013
Вернуться к номеру
Вплив початку тромбопрофілактики на частоту геморагічних та тромботичних ускладнень у хворих iз травмою
Авторы: Кучин Ю.Л., Глумчер Ф.С., Сташкевич А.В., Тарасенко С.О., Національний медичний університет ім. О.О. Богомольця, м. Київ
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
У статті розглядаються питання тромбопрофілактики у хворих із травмою, наведені результати проспективного когортного дослідження з визначення ефективності та безпечності різних режимів тромбопрофілактики — з перед- або післяопераційним початком. Встановлено, що післяопераційний старт із використанням низькомолекулярних гепаринів (за інструкцією такий режим дозволено для беміпарину) так само ефективний та безпечний, як і передопераційний початок, але у травматичних хворих із підвищеними ризиками періопераційних геморагічних ускладнень слід надавати перевагу післяопераційному початку тромбопрофілактики.
В статье рассматриваются вопросы тромбопрофилактики у больных с травмой, представлены результаты проспективного когортного исследования по определению эффективности и безопасности разных режимов тромбопрофилактики — с пред- или послеоперационным началом. Установлено, что послеоперационный старт с использованием низкомолекулярных гепаринов (по инструкции такой режим разрешен для бемипарина) такой же эффективный и безопасный, как и предоперационное начало, но для травматических больных с повышенными рисками периоперационных геморрагических осложнений нужно отдавать предпочтение послеоперационному началу тромбопрофилактики.
The article deals with the questions of thromboprophylaxis in patients with trauma, the results of a prospective cohort study to determine the efficacy and safety of different modes of thromboprophylaxis — with pre- or post-operative initiation — are presented. It is found that postoperative initiation using low molecular weight heparins (under the instruction this mode is allowable for bemiparin) is just as effective and safe as the preoperative start, but for trauma patients with increased risk of perioperative bleeding complications, the priority shoulde be given to early postoperative thromboprophylaxis.
тромбопрофілактика, травма, ризик.
тромбопрофилактика, травма, риск.
thromboprophylaxis, injury, risk.
Вступ
Частота нових тромботичних ускладнень щорічно становить, за різними даними, від 60 до 160 випадків на 100 000 населення, з яких на частку тромбоемболії легеневої артерії припадає 30–60 на 1 000 000 [1–3]. Тому питання проведення тромбопрофілактики залишається актуальним, незважаючи на постійне вдосконалення її стандартів. Найбільш новими стандартами щодо тромбопрофілактики на сьогодні є рекомендації Британського інституту клінічних стандартів (NICE) [23].
Відповідно до цих стандартів початок тромбопрофілактики повинен бути якомога раніше від моменту появи ризиків тромботичних ускладнень і процедура повинна продовжуватись до тих пір, поки існують фактори, що підвищують ризик ускладнень. Однак ці ж самі рекомендації містять положення про те, що слід застосовувати фармакологічну тромбопрофілактику у хворих, які мають ризики значимих кровотеч, а саме протипоказання мають у тому числі пацієнти, яким заплановано діагностичну люмбальну пункцію або проведення спінальної анестезії. Більшість існуючих рекомендації визначають застосування антикоагулянтів (у тому числі низькомолекулярних гепаринів (НМГ)) як найбільш значимий ризик геморагічних ускладнень нейроаксіальної анестезії (спінальної чи епідуральної) та «великих» периферичних блоків. Це підтверджено узагальненими даними доказової медицини [24]. Крім того, травматичні хворі часто потребують оперативних втручань із підвищеним ризиком значної крововтрати, включаючи закриті техніки (інтрамедулярний остеосинтез тощо). Таким чином, введення низькомолекулярних гепаринів перед операцією у травматичних хворих може значно підвищувати ризики геморагічних ускладнень [6, 7]. У той же час травматичні хворі — це хворі середнього та високого ризику тромботичних ускладнень, які потребують адекватної тромбопрофілактики [10, 13, 14].
Для розв’язання цього протиріччя у пацієнтів із підвищеним ризиком геморагічних ускладнень багатьма авторами з різним ступенем аргументованості пропонувалося проведення тромбопрофілактики з початком уже після закінчення оперативного втручання. Різні дослідження продемонстрували можливість проведення такої тромбопрофілактики у різних груп хворих без збільшення частоти тромботичних ускладнень [4, 11]. Ряд досліджень показали не тільки відсутність відмінностей у виникненні тромботичних ускладнень, але і зменшення ризику геморагічних ускладнень при післяопераційному (ПО) початку [8].
Післяопераційне введення антикоагулянта може не тільки зменшити ризики геморагічних ускладнень, але й скоротити перебування хворого в стаціонарі, що несе додаткові економічні вигоди [16, 17]. Такий режим введення НМГ допускається сучасними рекомендаціями з тромбопрофілактики: рекомендаціями Американського коледжу торакальних лікарів (ACCP), Європейської асоціації анестезіологів (ESA), а також Протоколом із тромбопрофілактики МОЗ України [7–9]. Це зовсім не означає те, що пацієнтам із відстроченими оперативними втручаннями, яким показана тромбопрофілактика, слід відкладати її початок, поки не буде виконано оперативне втручання.
Ґрунтуючись на фармакологічних властивостях, серед низькомолекулярних гепаринів для тромбопрофілактики з післяопераційним початком дозволено використання препарату 2-ї генерації НМГ — беміпарину [13, 16]. Однак загалом опубліковані на сьогодні дані рандомізованих контрольованих досліджень не дають остаточної відповіді на те, чи обов’язковим є передопераційне введення НМГ, чи воно може бути відкладене на післяопераційний період [12, 15, 16], тому нами було заплановано проведення дослідження ефективності та безпечності тромбопрофілактики у травматичних хворих.
Матеріали і методи дослідження
Нашою метою було визначення ефективності та безпечності різних режимів тромбопрофілактики — з перед- або післяопераційним початком. Для цього було проведено проспективне когортне дослідження.
Критерії включення:
— Вік пацієнта 18 років або більше.
— Пацієнт дав згоду на участь у дослідженні, доступний для розмови.
— Пацієнту планується виконання травматологічного оперативного втручання з приводу перелому(ів) кінцівки(ок).
— Пацієнту планується тромбопрофілактика беміпарином у профілактичних дозах (2500 або 3500 МО залежно від ступеня ризику).
Критерії невключення:
— Вік пацієнта молодше 18 років.
— Пацієнт не контактний або не дав згоду на участь у дослідженні.
— Пацієнт має протипоказання до застосування беміпарину.
Дані були зібрані проспективно дослідниками перед операцією, на 1-шу, 3-тю та 5-ту післяопераційну добу з використанням стандартизованої анкети. Анкета включала такі блоки:
1. Демографічні та анамнестичні дані, що стосуються хвороби, оперативного втручання та супутньої патології, що може потенційно впливати на кровоточивість чи тромботичні ускладнення та оцінку ризику тромботичних ускладнень.
2. Оцінку реалізації ризиків кровотечі/кровоточивості, пов’язаних з оперативним втручанням (крововтрати під час оперативного втручання та в післяопераційному періоді тощо).
3. Оцінку реалізації ризиків кровотечі/кровоточивості, не пов’язаних з оперативним втручанням (великі та клінічно значимі кровотечі/кровоточивості).
Основним критерієм оцінки була крововтрата під час та після операції та наявність великих або клінічно значимих кровотечі/кровоточивості, не пов’язаних із оперативним втручанням, а також частота тромботичних ускладнень. Показники були стратифіковані таким чином:
— Крововтрата за дренажами в ПО-періоді: 0 — звичайна для цієї операції; 1 — значно більша для цієї операції; 2 — критично більша (у тому числі потребувала хірургічного втручання).
— Кровоточивість рани: 0 — звичайна для цієї операції; 1 — значно більша для цієї операції; 2 — критично більше (у тому числі потребувала хірургічного втручання).
— Додаткова терапія через кровоточивість: 0 — не проводилась; 1 — проводилась.
— Зміни в коагулограмі, кількості тромбоцитів: 0 — не було; 1 — були, клінічно не значимі; 2 — були, клінічно значимі.
— Крововтрата згрупована: 0 — звичайна для цієї операції; 1 — значимо більша для цієї операції; 2 — критично більша для цієї операції (у тому числі потребувала незапланованої трансфузії препаратів крові).
— Кровотечі/крововиливи у ПО-період: 0 — не було; 1 — були кровотечі/крововиливи, що відповідають критеріям малих; 2 — були кровотечі/крововиливи, що відповідають критеріям клінічно значимих або великих.
— Клінічні ознаки тромботичних ускладнень: 0 — не було; 1 — були клінічні ознаки ТГВ; 2 — були клінічні ознаки ТЕЛА.
Кровотечі/крововиливи, що підпадали під критерії великих: симптоматичні кровотечі у критичних ділянках чи органах (ретроперитонеальні, внутрішньочерепні, внутрішньоочні, спінальні, внутрішньопередсердні або перикардіальні, внутрішньом’язові з ознаками компартмент-синдрому) або інша відкрита кровотеча з клінічно серйозними наслідками (фатальна, така, що призвела до зниження гемоглобіну більш ніж на 20 г/л, або що потребувала трансфузії двох та більше доз еритроцитарної маси). Кровотечі/крововиливи, що підпадали під критерії клінічно значимих: інша кровотеча, що була розцінена як клінічно значима, але відповідає критеріям великої; кровотеча, що потребувала відміни антикоагулянта; спонтанна гематома по поверхні шкіри ≥ 25 см2; спонтанна кровотеча з носа/рота/глотки тривалістю 5 та більше хвилин; спонтанна шлунково-кишкова кровотеча або ректальна кровотеча, кровотеча з ясен довше 5 хвилин. Кровотечі/крововиливи, що підпадали під критерії малих: невеликі кровотечі/крововиливи, що не підпадають під критерії великих або клінічно значимих. Вторинними результатами були зміни в лабораторних показниках: коагулограмі та загальному аналізі крові. У частини пацієнтів було виконано поглиблене вивчення показників гемостазу — визначали рівень анти-Ха-активності плазми, антитромбіну ІІІ (АТ III), розчинних фібрин-мономерних комплексів (РФМК), протеїну С (PtC) та рівень Д-димеру, що дозволило прослідкувати коагулологічні зміни, пов’язані як із оперативним втручанням, так і з профілактичним використанням низькомолекулярних гепаринів.
Пацієнти були розподілені на групи залежно від початку тромбопрофілактики: до 1-ї групи були зараховані хворі, тромбопрофілактику яким починали через 6 годин після операції, до пацієнтів 2-ї групи — пацієнти, яким тромбопрофілактику почали за 12 годин до операції та раніше.
Статистичний аналіз
Частота небажаних явищ, пов’язаних із геморагічними ускладненнями, а також частота тромботичних ускладнень були проаналізовані відповідно до досліджуваної групи пацієнтів. Порівнювали частоту цих небажаних явищ за допомогою оцінки шансів їх розвитку залежно від початку тромбопрофілактики. Для оцінки статистичної значимості різниці використовували двобічний критерій Фішера.
Зміни в лабораторних показниках до операції, на 1-шу, 3-тю та 5-ту добу дослідження у групах порівнювали за допомогою критерію Манна — Уїтні.
У табл. 1, 2 наведені: частота випадків у групах — у вигляді пропорції частоти до загальної кількості у групах, дані лабораторних показників — у вигляді медіани з квартильним розмахом. Відношення шансів розвитку небажаних подій подане як відношення шансів із 95% довірчим інтервалом. Статистичну значимість оцінювали за двобічним критерієм Фішера. Статистично значимим вважали результат при ймовірності помилки 1-го типу менше 5 % (p < 0,05).
Результати та їх обговорення
За період із лютого 2010 по грудень 2011 року у дослідження було включено 329 пацієнтів, які відповідали критеріям включення. Всі хворі відповідали критеріям високого ризику з точки зору тромботичних ускладнень, тому їм було призначено НМГ у дозі понад 3400 ОД (беміпарин 3500). Відповідно до режиму тромбопрофілактики пацієнти були розподілені на 2 групи: до 1-ї групи зарахували 227 хворих, у яких перше введення низькомолекулярного гепарину було через 6 годин після закінчення оперативного втручання, до 2-ї групи — 102 хворих, у яких тромбопрофілактику НМГ було розпочато за 12 годин до операції. Не спостерігалось значимої різниці між групами за віком, статтю, анестезіологічним ризиком (2–3-й ступінь за ASA) та спектром оперативних втручань.
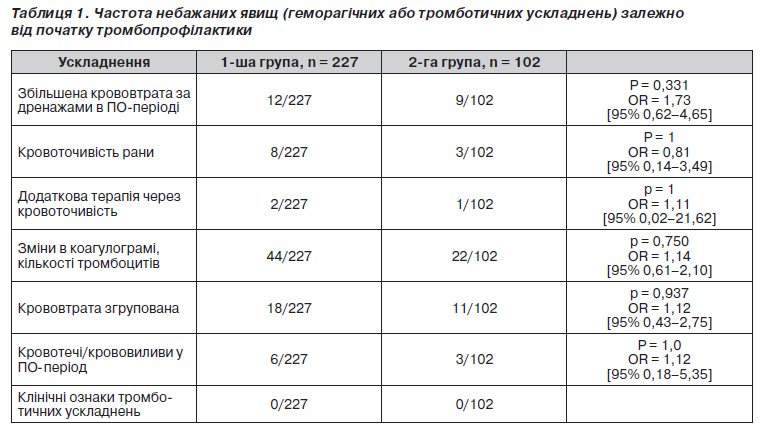
У табл. 1 наведені дані щодо частоти небажаних явищ (геморагічних або тромботичних ускладнень) у групах.
Наведені в табл. 1 дані свідчать про відсутність статистично значимої різниці в частоті розвитку як геморагічних ускладнень, включаючи інтраопераційну крововтрату, кровоточивість рани, крововтрату за дренажами, так і кровотеч чи крововиливів, що не пов’язані з оперативним втручанням між пацієнтами, яким введення низькомолекулярних гепаринів починали через 6 годин після оперативного втручання чи за 12 годин до його початку. Не було суттєвої різниці у клінічно значимих відхиленнях показників коагулограми та потребі у додатковій терапії у зв’язку з підвищеною кровоточивістю. Відношення ризиків (95% довірчий інтервал) розвитку всіх перерахованих ускладнень становило 1, що свідчило про однаково велику можливість розвитку цих подій у будь-якій із груп.
В обох групах спостереження в жодного пацієнта не спостерігали клінічних ознак тромботичних ускладнень, що свідчило про ефективність тромбопрофілактики п/ш введення низькомолекулярних гепаринів (беміпарин 3500 ОД) як при режимі з передопераційним початком тромбопрофілактики, так і з початком тромбопрофілактики через 6 годин після закінчення оперативного втручання.
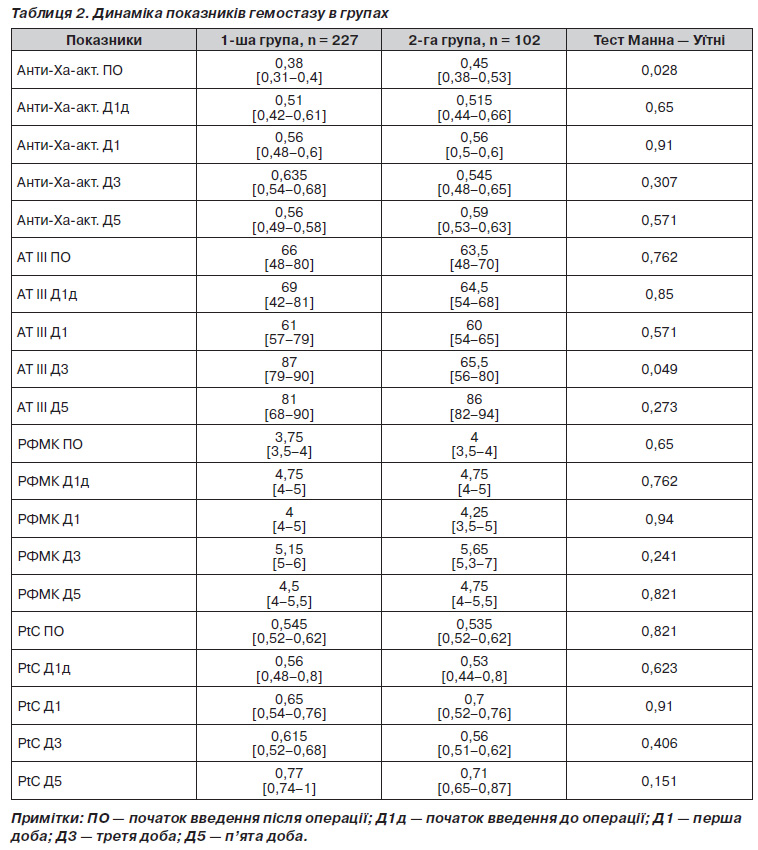
Динаміка лабораторних змін сироваткової анти-Xa-активності, антитромбіну ІІІ, розчинних фібрин-мономерних комплексів та протеїну С продемонстрована в табл. 2.
Дані, наведені в табл. 2, демонструють, що протягом лише 5 діб спостереження відсутня клінічно значима різниця в показниках гемостазу між групами. Анти-Ха-активність сироватки, що є головним показником ефективності профілактики низькомолекулярними гепаринами, перед операцією була статистично значимо вищою в групі з передопераційним початком уведення, оскільки пацієнти цієї групи отримали НМГ перед операцією, але в групі з післяопераційним стартом значення були в межах нормальних показників. Це свідчить про те, що природний рівень анти-Ха-активності в пацієнтів без вихідних порушень гемостазу ймовірно може бути достатнім за відсутності додаткових факторів ризику. Вже за добу від початку тромбопрофілактики анти-Ха-активність зростала в обох групах, що відповідало фармакокінетиці низькомолекулярних гепаринів, і зберігалась підвищеною в обох групах без значимих відмінностей. Привертає увагу те, що при цьому жодних змін не спостерігалось у показниках стандартної коагулограми (протромбіновий час, тромбіновий час, активований частковий тромбопластиновий час). Цей факт указує на те, що клінічно ефективна доза низькомолекулярних гепаринів (що підтверджується змінами анти-Ха-активності сироватки) не призводить до змін у цих показниках, отже, коагулограма не може бути використана для контролю ефективності тромбопрофілактики низькомолекулярними гепаринами. Рівні антитромбіну ІІІ, розчинних фібрин-мономерних комплексів та протеїну С значимо не відрізнялися у групах протягом усього періоду спостереження, різниця рівня антитромбіну ІІІ на 3-тю добу хоча і була статистично значимою, але в обох групах ці показники лишалися в межах референтних значень. Підвищений рівень фібрин-мономерних комплексів протягом усього післяопераційного періоду свідчив про збільшену небезпеку тромботичних ускладнень і необхідність продовження тромбопрофілактики, але значимої різниці між групами у значеннях цього показника не було.
В усіх групах пацієнтів на всіх етапах дослідження показники Д-димеру були від’ємними (до 0,12 мг/мл), що підтверджує ефективність тромбопрофілактики.
Висновки
1. Післяопераційний старт із використанням низькомолекулярних гепаринів (за інструкцією такий режим дозволено для беміпарину) так само ефективний та безпечний, як і передопераційний початок, що підтверджується як динамікою ревалентних лабораторних показників, так і клінічними результатами лікування травматичних хворих.
2. Моніторинг стандартних показників коагулограми не дозволяє контролювати ефективність введення профілактичних доз низькомолекулярних гепаринів, лише визначення рівня сироваткової анти-Ха-активності дозволяє лабораторно підтвердити ефект від їх застосування.
3. У травматичних хворих із підвищеним ризиком періопераційних геморагічних ускладнень (травматичне оперативне втручання, нейроаксіальні методи знеболювання, виконання потенційно небезпечних щодо гематом блоків нервів та сплетень) слід надавати перевагу післяопераційному початку тромбопрофілактики.
- Geerts W.H. et al. Prevention of Venous Thromboembolism // Chest. — 2001. — 119. — 132-175.
- Caprini J.A., Arcelus J.L. et al. State-of-the-Art Venous Thromboembolism Prophylaxis // Scope. — 2001. — 8. — 228-240.
- Oger E. Incidence of Venous Thromboembolism: A Community-based Study in Western France // Thromb. Haemost. — 2000. — 657-660.
- Turpie A.G., Bauer K.A., Eriksson B. et al. Fondaparinux vs. Enoxaparin for the Prevention of Venous Thromboembolism in Major Orthopedic Surgery: A Meta-analysis of 4 Randomized Double-Blind Studies // Arch. Intern. Med. — 2002. — 162 (16). — 1833-40.
- Rosenberg A.F., Zumberg M., Taylor L., Harris N. The Use of Anti-Xa Assay to Monitor Intravenous Unfractionated Heparin Therapy // Journal of Pharmacy Practice. — 2010. — 23(3). — 210-216.
- Hirsh J., Chair P., Guyatt G. Antithrombotic and Thrombolytic Therapy. — 7th ed. — ACCP Guidelines // Chest. — 2004. — 126. — 172-173.
- Hirsh J., Chair P., Guyatt G. Antithrombotic and Thrombolytic Therapy. — 8th ed. — ACCP Guidelines// Chest. — 2008. — 133. — 71-109.
- Llau J., Andres J., Gomar C. et al. Anticlotting drugs and regional anaesthetic techniques: comparative update of the safety recommendations // EJA. — 2007. — 24. — 387-398.
- www.moz.gov.ua
- Samama C., Albaladejo P., Benhamou D. et al. Venous thromboembolism prevention in surgery and obstetrics: clinical practice guidelines // EJA. — 2006. — 23. — 95-116.
- Venous Thromboembolism Reducing the risk of venous thromboembolism (deep vein thrombosis and pulmonary embolism) in inpatients undergoing surgery / Ed. by T. Treasure. — National Collaborating Centre for Acute Care at the Royal College of Surgeons of England, WC2A 3PE.
- Planes A. Review of bemiparin sodium — a new second-generation low molecular weight heparin and its application in venous thromboembolism // Expert. Opin. Pharmacother. — 2003. — 4(9). — 1551-1561.
- Planes A., Vochelle N., Gonzalez M. et al. Profilaxis antitrombotica pos cirugia ortopeica con bemiparina, heparina de bajo peso molecular de segunda generacion//Rev. Anestesiol. Reanim. — 2001. — 48. — 258-263.
- Abad J., Gomez-Qutes A., Martinez-Gonzales J. et al. Observational study of bemiparin, first dose administered 6 hours after surgery, in hip or knee replacement surgery // Pathophysiol. Haemost. Thromb. — 2007. — 36(suppl. 1).
- Gomez-Qutes A., Lecumberri R., Rocha E. Optimal timing of initiation of bemiparin thromboprophylaxis in total hip/knee replacement // Pathophysiol. Haemost. Thromb. — 2007. — 36(suppl. 1).
- Navarro Quilis A., Castellet E., Rocha E. et al. Efficacy and safety of bemiparin compared with enoxaparin in the prevention of venous thromboembolism after knee arthroplasty: a randomized, double blind clinical trial // J. Thromb. Haemost. — 2003 Mar. — 1(3). — 425-32.
- Chapman T.M., Goa K.L. Bemiparin: a review of its use in the prevention of venous thromboembolism and treatment of deep vein thrombosis // Drugs. — 2003. — 63 (21). — 2357-2377.
- Kolde H.J. Haemostasis. Physiology, pathology, i diagnostics. — 2nd ed.— Basel: Pentapharm Ltd., 2004. — P. 164.
- Righini M., Perrier A., De Moerloose P., Bounameaux H. D Dimer for venous thromboembolism diagnosis: 20 years later // Journal of thrombosis and haemostasis. — 2008. — Vol. 6, № 7. — 1058-1071.
- Баркаган З.С. Диагностика и контролируемая терапия нарушений гемостаза / З.С. Баркаган, А.П. Момот. — М.: Ньюдиамед, 2001. — 296 с.
- Вавилова Т.В. Антитромботическая терапия и методы ее лабораторного контроля / Т. В. Вавилова // Клин. лаб. диагностика. — 2004. — № 12. — С. 21-32.
- Долгов В.В. Лабораторная диагностика нарушений гемостаза / В.В. Долгов, П.В. Сверин. — М.; Тверь: ООО «Триада», 2005. — 227 с.
- Treasure T., Hill J. NICE guidance on reducing the risk of venous thromboembolism in patients admitted to hospital // J. R. Soc. Med. — 2010. — Vol. 103(6). — 21021-2.
- Macintyre P.E., Walker S.M. The scientific evidence for acute pain treatment // Curr. Opin. Anaesthesiol. — 2010. — Vol. 23(5). — 623-8.