Журнал «» 3 (29) 2013
Вернуться к номеру
Эффективность моксонидина в лечении артериальной гипертензии у больных с метаболическим синдромом
Авторы: Срожидинова Н.З., Тухтаев А.А., Республиканский специализированный центр кардиологии, г. Ташкент, Узбекистан
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Цель исследования: оценить антигипертензивную и органопротективную эффективность моксонидина и его влияние на липидный и углеводный обмен у больных с артериальной гипертензией (АГ) и метаболическим синдромом (МС).
Материалы и методы исследования. В исследование были включены 46 мужчин с АГ 1–2-й ст. и МС. МС устанавливали согласно критериям IDF (2005). Всем больным проводились ЭхоКГ, тест с реактивной гиперемией, пероральный тест толерантности к глюкозе, определение толщины комплекса интима-медиа (КИМ), липидов, инсулина и мочевой кислоты крови. Все больные принимали моксонидин в дозе 0,4 мг/сут в течение 12 недель.
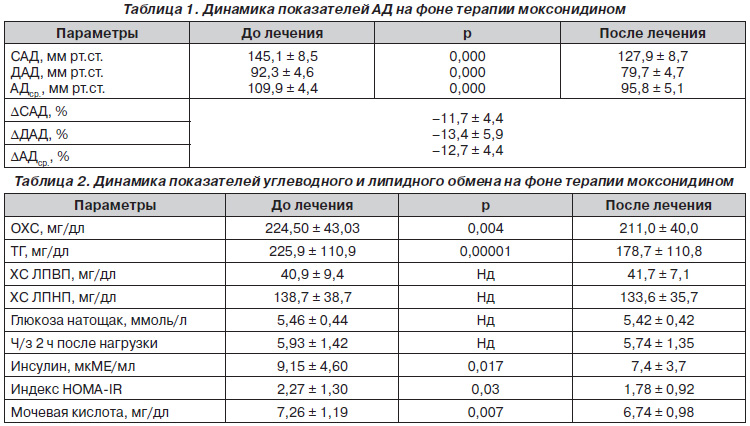
Результаты исследования. На фоне монотерапии моксонидином достигнут хороший антигипертензивный эффект: степень снижения ΔСАД составила –11,7 ± 4,4 %, ΔДАД — –13,4 ± 5,9 %. 69,5 % больных достигли целевых значений АД. На фоне 3-месячной терапии отмечалась достоверная регрессия гипертрофии левого желудочка (ЛЖ) и улучшение диастолической функции ЛЖ. Также отмечалось достоверное уменьшение толщины КИМ сонной артерии, улучшение эндотелийзависимой вазодилатации (ЭЗВД) на фоне 12-недельной монотерапии моксонидином. Анализ липидного спектра показал, что отмечалось достоверное снижение уровня общего холестерина и тиреоглобулина. Применение моксонидина приводило к достоверному снижению уровня инсулина, что сопровождалось достоверным снижением индекса НОМА. На фоне монотерапии моксонидином отмечалось достоверное снижение уровня мочевой кислоты.
Заключение. Монотерапия моксонидином оказывает хороший антигипертензивный эффект и способствует регрессии гипертрофии ЛЖ, улучшению диастолической функции ЛЖ и ЭЗВД, снижает инсулинорезистентность у больных с АГ и МС.
Ціль дослідження: оцінити антигіпертензивну й органопротективну ефективність моксонідину і його вплив на ліпідний і вуглеводний обмін у хворих із артеріальною гіпертензією (АГ) і метаболічним синдромом (МС).
Матеріали й методи дослідження. У дослідження були включені 46 чоловіків з АГ 1–2-го ст. і МС. МС установлювали відповідно до критеріїв IDF (2005). Усім хворим проводилися ЕхоКГ, тест із реактивною гіперемією, пероральний тест толерантності до глюкози, визначення товщини комплексу інтима-медіа (КІМ), ліпідів, інсуліну й сечової кислоти крові. Усі хворі приймали моксонідин у дозі 0,4 мг/добу протягом 12 тижнів.
Результати дослідження. На фоні монотерапії моксонідином досягнутий хороший антигіпертензивний ефект: ступінь зниження ΔСАТ склала –11,7 ± 4,4 %, ΔДАТ — –13,4 ± 5,9 %. 69,5 % хворих досягли цільових значень АТ. На фоні 3-місячної терапії відзначалася достовірна регресія гіпертрофії лівого шлуночка (ЛШ) і поліпшення діастолічної функції ЛШ. Також відзначалося достовірне зменшення товщини КІМ сонної артерії, поліпшення ендотелійзалежної вазодилатації (ЕЗВД) на фоні 12-тижневої монотерапії моксонідином. Аналіз ліпідного спектра показав, що відзначалося достовірне зниження рівня загального холестерину і тиреоглобуліну. Застосування моксонідину приводило до достовірного зниження рівня інсуліну, що супроводжувалося достовірним зниженням індексу НОМА. На фоні монотерапії моксонідином відзначалося достовірне зниження рівня сечової кислоти.
Висновок. Монотерапія моксонідином справляє добрий антигіпертензивний ефект і сприяє регресії гіпертрофії ЛШ, поліпшенню діастолічної функції ЛШ і ЕЗВД, знижує інсулінорезистентність у хворих з АГ і МС.
Objective of the study: to evaluate hypertensive and organ-protective efficiency of moxonidine and its impact on lipid and carbohydrate metabolism in patients with arterial hypertension (AH) and metabolic syndrome (MS).
Material and Methods of Study. We have examined 46 male patients with I–II stages AH and MS. MS was defined according to IDF (2005) criteria. All patients underwent echocardiography, a test with reactive hyperemia, an oral glucose tolerance test, determining the thickness of the intima-media complex (IMC), lipids, insulin and uric acid levels. All patients received moxonidine 0.4 mg/day for 12 weeks.
Results of the Study. Against the background of moxonidine monotherapy, a good antihypertensive effect has been achieved: the degree of reduction ΔSAD was –11.7 ± 4.4 %, ΔDBP — –13.4 ± 5.9 %. 69.5 % of patients reached the target BP levels. On the background of 3-month therapy there was a significant regression of left ventricular (LV) hypertrophy and the improvement of LV diastolic function. Also, there was a significant decrease in thickness of carotid artery IMC, improved endothelium-dependent vasodilation (EDVD) due to a 12-week monotherapy with moxonidine. Analysis of the lipid profile showed that there was a significant reduction in total cholesterol and thyroglobulin levels. The use of moxonidine resulted in a significant decrease in insulin levels, which was accompanied by a significant decrease in HOMA index. Against the background of moxonidine monotherapy, there was observed significant decrease in uric acid levels.
Conclusion. Moxonidine monotherapy has a good antihypertensive effect and promotes regression of LV hypertrophy, improvement of diastolic function of LV and EDVD, reduces insulin resistance in patients with AH and MS.
метаболический синдром, артериальная гипертензия, моксонидин.
метаболічний синдром, артеріальна гіпертензія, моксонідин.
metabolic syndrome, arterial hypertension, moxonidine.
Метаболический синдром (МС) можно назвать заболеванием нового мира, поскольку отмечается увеличение его распространенности среди молодого и взрослого населения индустриально развитых стран [1–3]. Распространенность МС в популяции доходит до 20 % и в ближайшие 25 лет ожидается увеличение темпов ее роста на 50 % [4, 5]. Не случайно МС признан Всемирной организацией здравоохранения (ВОЗ) «неинфекционной пандемией ХХI века» в связи с его широкой распространенностью, высоким риском развития сердечнососудистых заболеваний, ранней инвалидизацией больных и преждевременной смертностью.
МС — это симптомокомплекс, который состоит из следующих компонентов: абдоминальновисцерального ожирения, артериальной гипертонии (АГ), дислипидемии, инсулинорезистентности (ИР) [6, 7]. Сочетание этих компонентов, даже умеренно выраженных, обусловливает значительно более высокий общий риск, чем наличие одного, даже высокого по уровню фактора. По данным Kuopio Ischaemic Heart Disease Risk Factors Study, среди больных с МС риск развития ишемической болезни сердца (ИБС) оказался в 2,9–4,2 раза выше, смертность от ИБС — в 2,6–3,0 и от других причин — в 1,9–2,1 раза выше по сравнению с пациентами без метаболических нарушений [8].
АГ является одним из ведущих компонентов МС, который неблагоприятно влияет на прогноз этого синдрома [9]. По мнению многих исследователей, патогенез АГ при МС связан с ИР и компенсаторной гиперинсулинемией (ГИ) [10]. ГИ путем активации симпатоадреналовой и ренинангиотензинальдостероновой систем приводит к вазоконстрикции, что способствует становлению и прогрессированию АГ [11]. Также ГИ, способствуя нарушению жирового обмена, приводит к ожирению и гиперлипидемии с преимущественным повышением уровня триглицеридов в крови [12].
При выборе терапии АГ у больных с МС необходимо учитывать ее нейтральность по отношению к другим компонентам МС [12–14]. Одной из наиболее перспективных групп антигипертензивных средств для лечения АГ у пациентов с МС могут стать агонисты I2имидазолиновых рецепторов (моксонидин), которые были включены в Российские рекомендации по лечению АГ в список препаратов первой линии для лечения АГ [16]. Действие этого препарата объясняется тем, что, стимулируя I1имидазолиновые рецепторы, расположенные в ростровентролатеральной области продолговатого мозга, он подавляет активность симпатической нервной системы (СНС), которая является связывающим звеном между компонентами МС [17, 18]. В ряде исследований (CAMUS, MERSY, ALMAZ) доказана его способность повышать чувствительность к инсулину и улучшать показатели углеводного и липидного обмена.
Цель исследования: изучение антигипертензивной и органопротективной эффективности моксонидина и его влияние на липидный и углеводный обмен у больных АГ с МС.
Материалы и методы
В исследование были включены 46 больных мужчин с АГ I–II степени с МС. Средний возраст больных составил 41,7 ± 9,1 года. МС определяли согласно рекомендациям IDF, 2005. Исходно и на 12й неделе терапии проводили измерения антропометрических показателей (масса тела, окружность талии). Офисное измерение АД проводилось методом Короткова. Всем больным проводилось ультразвуковое исследование сердца и сосудов с оценкой структурнофункциональных показателей миокарда (EnVisorC®, Philips, Нидерланды) и общих сонных артерий с измерением толщины комплекса интимамедиа (КИМ ОСА). Для изучения эндотелийзависимой вазодилатации (ЭЗВД) проводился тест с реактивной гиперемией. Наряду с этим проводились пероральный тест толерантности к глюкозе, определение уровня липидов и мочевой кислоты крови. Уровень инсулина определяли методом иммуноферментного анализа (ИФА) наборами Beckman Coulter™. Для определения инсулинорезистентности использовали индекс НОМА. При индексе НОМА > 2,77 пациентов считали инсулинорезистентными.
Больным наряду с изменением образа жизни (физическая активность, гипокалорийная диета) была назначена монотерапия моксонидином (физиотенз, Abbott Laboratories, США) в фиксированной дозе 0,4 мг/сут в течение 12 недель.
Статистическую обработку материала выполняли с использованием программы Statistica 6.0. Определяли: выборочное среднее арифметическое X; выборочное среднее квадратичное (стандартное) отклонение — SD. Результаты представлены в виде X ± SD. Статистически значимыми считали различия при р < 0,05.
Результаты
Среди обследованных больных 17,4 % имели избыточный вес, 67,4 % — ожирение I степени, 13 % — ожирение II степени и 2,2 % — ожирение III степени. Средний индекс массы тела (ИМТ) составил 32,1 ± 2,7 кг/м2, объем талии (ОТ) — 109,1 ± 10,1 см. АГ 1й степени отмечалась у 82,6 % больных, АГ 2й степени — у 17,4 %. Гипертрофия левого желудочка (ГЛЖ) выявлена у 47,8 %, диастолическая дисфунция ЛЖ (ДДЛЖ) — у 32,6 % больных. 73,9 % пациентов имели нарушенную эндотейзависимую вазодилатацию. У 47,8 % больных наблюдалась гиперурикемия.
Анализ антигипертензивной эффективности моксонидина показал, что препарат был высокоэффективным. Так, САД снизилось с 145,1 ± 8,5 мм рт.ст. до 127,9 ± 8,7 мм рт.ст.; р = 0,000, ДАД — с 92,3 ± 4,6 мм рт.ст. до 79,7 ± 4,7 мм рт.ст.; р = 0,000, АДср. — со 109,9 ± 4,4 мм рт.ст. до 95,8 ± 5,1 мм рт.ст.; р = 0,000. При этом степень снижения DСАД составила –11,7 ± 4,4 %, DДАД — –13,4 ± 5,9 %, DАДср. — –12,7 ± 4,4 % (табл. 1). Целевые значения САД были достигнуты в 73,9 % случаев, ДАД — в 80,4 %. Достижение же целевых значений и САД ДАД одновременно наблюдалось в 69,5 % случаев. Следует отметить, что переносимость препарата была хорошей, побочные эффекты не наблюдались.
Необходимо сказать, что на фоне 12недельной терапии моксонидином отмечено достоверное снижение ИМТ до 30,8 ± 2,8 кг/м2 (р = 0,000) и уменьшение ОТ до 105,9 ± 9,9 см (р = 0,000).
Анализ липидного спектра показал, что отмечалось достоверное снижение уровня ОХС и ТГ, но требуемые целевые значения достигнуты не были. По уровню ХС ЛПНП и ХС ЛПВП достоверных изменений не отмечалось (табл. 2). К концу терапии моксонидином уровень гликемии натощак и через 2 ч после приема глюкозы не изменился. При этом применение моксонидина приводило к достоверному снижению уровня инсулина с 9,15 ± 4,60 мкМЕ/мл до 7,4 ± 3,7 мкМЕ/мл; р = 0,017, что сопровождалось достоверным снижением индекса НОМА с 2,27 ± 1,30 до 1,78 ± 0,92 (р = 0,03). Кроме того, на фоне монотерапии моксонидином отмечалось достоверное снижение уровня мочевой кислоты (с 7,26 ± 1,19 мг/дл до 6,74 ± 0,98 мг/дл; р = 0,007).
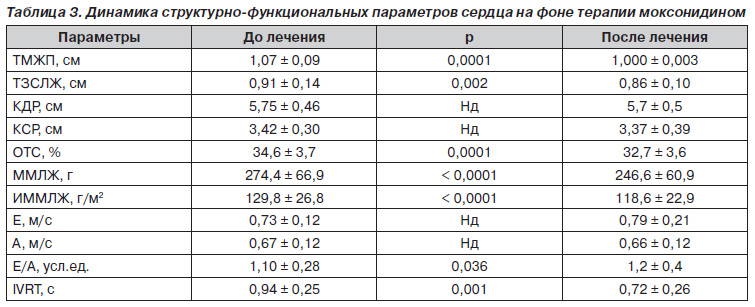
По результатам исследования терапия моксонидином у больных АГ с МС привела к улучшению структурнофункциональных показателей сердца. Так, на фоне антигипертензивной эффективности отмечалась достоверная регрессия гипертрофии ЛЖ и улучшение диастолической функции ЛЖ (табл. 3). Масса миокарда левого желудочка (ММЛЖ) снизилась с 274,4 ± 66,9 г до 246,6 ± 60,9 г; р < 0,0001, индекс массы миокарда левого желудочка (ИММЛЖ) — с 129,8 ± 26,8 г/м2 до 118,6 ± 22,9 г/м2; р < 0,0001. Отмечалось улучшение диастолической функции ЛЖ, что выражалось в увеличении соотношения пиков раннего и позднего наполнения левого желудочка (Е/А) с 1,10 ± 0,28 до 1,2 ± 0,4 усл. ед., р = 0,036, и уменьшении времени изоволюмического расслабления левого желудочка (IVRT) с 0,94 ± 0,25 с до 0,85 ± 0,15 с; р = 0,016.
Терапия моксонидином сопровождалась улучшением ЭЗВД. При этом наблюдался достоверный прирост диаметра плечевой артерии: с 8,3 ± 3,5 % до 11,1 ± 3,9 %; р = 0,0003. Также отмечалось достоверное уменьшение толщины КИМ ОСА (с 0,79 ± 0,25 мм до 0,72 ± 0,26 мм; р = 0,001) на фоне 12недельной монотерапии моксонидином.
Обсуждение
Проблема рациональной терапии АГ при МС остается актуальной. В последнее время большое значение придается влиянию антигипертензивных препаратов на состояние углеводного и липидного обмена у пациентов с МС.
Одними из препаратов, позитивно влияющих на метаболический профиль пациентов с МС, являются агонисты имидазолиновых рецепторов, а именно моксонидин. Результаты нашего исследования показали хороший антигипертензивный эффект моксонидина. Целевых значений АД достигли 69,5 % больных. Это согласуется с результатами исследования MERSY [20], в котором продемонстрирован хороший гипотензивный эффект комбинированной антигипертензивной терапии, основанной на моксонидине, у пациентов с МС. Почти половина пациентов достигли целевого уровня АД после добавления к терапии моксонидина. В группе женщин в постменопаузе целевой уровень АД был достигнут в 41 % случаев, тогда как у пациенток с МС и сохранной менструальной функцией эта цифра была существенно выше — 73 %. В исследовании TOPIC также показана высокая клиническая эффективность моксонидина, который вызывал выраженное снижение АД более чем у половины пациентов при назначении в качестве монотерапии [19].
На фоне терапии моксонидином, низкокалорийной диеты и физических упражнений выявлено достоверное улучшение показателей липидного обмена — снижение уровня общего холестерина с 224,50 ± 43,03 мг/дл до 211,0 ± 40,0 мг/дл; р = 0,004, ТГ — с 225,9 ± 110,9 мг/дл до 178,7 ± 110,8 мг/дл; р = 0,00001. ХС ЛПВП, ХС ЛПНП, уровень глюкозы существенно не изменились. Данные о влиянии моксонидина на метаболический статус были продемонстрированы в ряде исследований. Так, в исследовании MERSY [20] терапия моксонидином сопровождалась улучшением показателей липидного обмена — снижением уровня общего ХС на 8 %, ХС ЛПНП на 9 % и ТГ на 24 %, что также может свидетельствовать в пользу повышения чувствительности к инсулину. Имеющиеся экспериментальные данные свидетельствуют, что через воздействие на имидазолиновые I1рецепторы в печени моксонидин тормозит синтез и секрецию триглицеридов печенью — более чем на 75 % от исходного [21].
Показательно, что на фоне лечения моксонидином отмечено также уменьшение массы тела в среднем на 2 кг, ОТ — на 3 см. Полученные результаты сопоставимы с результатами проведенных многоцентровых исследований и данными литературы. Так, по данным исследования CAMUS, помимо гипотензивного эффекта, моксонидин достоверно уменьшал массу тела пациентов. В зависимости от исходного индекса массы тела максимальное уменьшение отмечено в группе больных с ожирением III степени и составило в среднем 4 кг [22]. Кроме того, в исследовании MERSY (24 недели) на фоне лечения моксонидином отмечено уменьшение массы тела в среднем на 3,6 кг, ОТ на 3,4 см [20]. Это объясняется тем, что данный препарат уменьшает симпатическую активность, что ведет к снижению гидролиза жиров, содержания жирных кислот, сокращению доли инсулинорезистентных (тип IIВ) волокон в скелетных мышцах, усилению переноса и метаболизма глюкозы [23]. Все это повышает чувствительность к инсулину и улучшает липидный профиль.
На фоне применения моксонидина отмечено достоверное снижение уровня инсулина и индекса НОМА. Эти результаты подтверждают данные Sanjuliani и соавт. [24], а также исследования ALMAZ [25], свидетельствующие об уменьшении инсулинорезистентности на фоне лечения моксонидином. В российском проспективном исследовании ALMAZ сравнивалось влияние моксонидина и метформина на уровень гликемии у пациентов с умеренной артериальной гипертензией, избыточной массой тела и нарушением толерантности к глюкозе или сахарным диабетом, не требующим медикаментозной коррекции [25]. На фоне лечения моксонидином у больных с метаболическим синдромом отмечено повышение чувствительности к инсулину при проведении стандартного перорального теста толерантности к глюкозе, что проявлялось снижением уровня инсулина плазмы. Этот эффект был наиболее выраженным у пациентов с исходно повышенной активностью симпатической нервной системы.
В нашем исследовании на фоне терапии моксонидином наблюдалась нормализация ЭЗВД, по данным пробы с реактивной гиперемией. Восстановление адекватного дилатационного ответа сосудов в пробе с реактивной гиперемией — необходимое звено в цепи эффективного терапевтического воздействия, направленного на снижение сердечнососудистого риска. В исследовании Т.Ю. Демидовой также было отмечено возрастание ЭЗВД с 4,86 ± 5,08 % до 8,72 ± 3,72 % (р < 0,001) через 16 недель терапии моксонидином. ЭЗВД нормализовалась, по данным пробы с реактивной гиперемией, у 30,76 %, улучшение отмечено у 34,61 % пациентов [26].
На фоне терапии моксонидином отмечена достоверная регрессия ГЛЖ и улучшение его диастолической функции. Сходное благоприятное влияние моксонидина на показатели центральной гемодинамики также отмечено в ряде исследований [27, 28]. Так, в исследовании, проведенном Е.Н. Амосовой, терапия моксонидином способствовала оптимизации показателей диастолического наполнения ЛЖ и ПЖ [28].
Выводы
1. 12недельная монотерапия моксонидином оказывает хороший антигипертензивный эффект.
2. Применение моксонидина у больных АГ с МС способствует снижению веса и уменьшению ОТ.
3. Терапия моксонидином на фоне изменения образа жизни улучшает липидный профиль, уменьшает выраженность гиперинсулинемии и инсулинорезистентности и снижает гиперурикемию.
4. Применение моксонидина приводит к регрессии ГЛЖ и улучшению диастолической функции ЛЖ.
1. Zimmet P. et al. The Metabolic Syndrome: A Global Public Health Problem and A New Definition // Journal of Atherosclerosis and Thrombosis. — 2005. — 12. — 295300.
2. Ройтберг Г.Е. Метаболический синдром. — М.: МЕДпрессинформ, 2007.
3. Чазова И.Е., Мычка В.Б. Метаболический синдром. — М.: Mеdia Medica, 2004. — 163.
4. Ford E.S., Giles W.H., Dietz W.H. Prevalence of Metabolic syndrome among US Adults. Findings from the Third National Health and Nutrition Examination Survey // JAMA. — 2002. — 287. — 356539.
5. Isomaa B., Almgren P., Tuomi T. et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome // Diabetes Care. — 2001. — 24. — 6839.
6. Reaven G.M. Banting lecture 1988: role of insulin resistance in human disease // Diabetes. — 1988. — 37. — 15951607.
7. Zimmet P., Alberti K.G., Kaufman F. et al. The IDF consensus worldwide definition of the metabolic syndrome.
8. Lakka H.M., Laaksonen D.E., Lakka T.A., Niskanen L.K., Kumpusalo E., Tuomilehto J., Salonen J.T. The metabolic syndrome and total and cardiovascular disease mortality in middleaged men // JAMA. — 2002. — 288. — 27092716.
9. Haffner S. Insulin and blood pressure in the San Antonio heart study: a review // Cardiovasc. — Risk Factors. — 1993. — 1. — 1827.
10. Fontbonne A., Charles A., Thiebult N. et al. Hyperinsulinemia as predictor of CHD mortality in a healthy population: The Paris prospective study, 15year followup // Diabetologia. — 1991. — 34. — 35661.
11. De Fronzo R.A., Ferranini E. Insulin resistance: a multifaceted syndrome responsible for NIDDM, obesity, hypertension, dyslipidemia, and atherosclerotic disease // Diabetes Care. — 1991. — 14. — 17394.
12. Гинзбург М.М., Крюков Н.Н. Ожирение. Влияние на развитие метаболического синдрома. Профилактика и лечение. — М.: Медпрактика, 2002.
13. Митченко Е.И. Метаболический синдром: состояние проблемы и лечебные подходы // Практична ангіологія. — 2006. — 1. — 1418.
14. Grundy S.M. Drug therapy of the metabolic syndrome: minimizing the emerging crisis in polypharmacy // Nat. Rev. Drug. Discov. — 2006. — 5. — 295309.
15. Задионченко В.С., Адашева Т.В., Демичева О.Ю., Порывкина О.Н. Метаболический синдром: терапевтические возможности и перспективы // Consilium medicum. — 2005. — 7. — 725733.
16. Российское медицинское общество по артериальной гипертонии (РМОАГ), Всероссийское научное общество кардиологов (ВНОК). Диагностика и лечение артериальной гипертензии. Российские рекомендации (четвертый пересмотр). — 2010.
17. Ernsberger P. Pharmacology of moxonidine. An I1imidazoline receptor antagonist // J. Cardiovasc. Pharmacol. — 2000. — 35. — S2741.
18. Моисеев С.В. Симпатическая нервная система и метаболический синдром // Клин. фармакол. и терапия. — 2004. — 4. — 7074.
19. Waters J., Ashford J., Jager B., Verboom C.N., Wonnacott S. Use of moxonidine as initial therapy and in combination in the treatment of essential hypertension — results of the TOPIC (Trial Of Physiotens In Combination) Study // Journal of Clinical and Basic Cardiology. — 1999. — 2 (2). — 219224.
20. Чазова И.Е., Мычка В.Б., Ратова Л.Г. (от лица исследовательской группы). Место агонистов имидазолиновых рецепторов в лечении артериальной гипертензии: результаты исследования MERSY в России // Системные гипертензии. — 2009. — № 3.
21. Velliquette R.A., Kossover R., Previs S.F., Ernsberger P. Lipidlowering Akt Insulin Response Sensitized by Imidazoline actions of imidazoline antihypertensive agents in metabolic syndrome X // NaunynSchmiedeberg’s Arch. Pharmacol. — 2006. — 372. — 300312.
22. Sharma A.M., Wagner T., Marsalek P. Moxonidine in the treatment of overweight and obese patients with the metabolic syndrome: a postmarketing surveillance study // Journal of Human Hypertension. —2004. — Vol. 18, Issue 9. — P. 669.
23. Borchard U. The role of the sympathetic nervous system in cardiovascular disease // J. Clin. Basic Cardiol. — 2001. — 4. — 175177.
24. Sanjuliani A.F., GenelhuFagunde V., Barroso S.G. et al. Effect of imidazoline agonist on sympathetic activity and components of the insulin resistance syndrome in obese hypertensive Brazilian patients // J. Hypertens. — 2002. — 20. — S206.
25. Chazova I., Almazov V.A., Shlyakhto E. Moxonidine improves glycaemic control in mildly hypertensive, overweight patients: a comparison with metformin // Diabetes Obes. Metab. — 2006. — Vol. 8. — P. 456465.
26. Демидова Т.Ю., Аметов А.С., Смагина Л.В. Моксонидин в коррекции метаболических нарушений и эндотелиальной дисфункции у больных сахарным диабетом типа 2, ассоциированным с артериальной гипертензией // Артериальная гипертензия. — 2004. — Т. 10, № 2.
27. Мамедов М.Н., Горбунов В.М., Киселева Н.В., Оганов Р.Г. Особенности структурнофункциональных изменений миокарда и гемодинамических нарушений у больных с метаболическим синдромом: вклад артериальной гипертонии в формирование суммарного коронарного риска // Кардиология. — 2005. — 11. — 116.
28. Амосова Е.Н., Мясников Г.В., Бойчак М.П., Медведь Я.И., Сидорова Н.Н. Структурнофункциональные изменения желудочков сердца у пациентов с гипертонической болезнью в сочетании с метаболическим синдромом и возможности их коррекции с помощью агониста имидазолиновых рецепторов моксонидина // Укр. кардіол. журн. — 2002. — № 2. — С. 6064.