Газета «Новости медицины и фармации» 13 (464) 2013
Вернуться к номеру
Несприятливі події після імунізації
Авторы: САХНЮК О., директор Департаменту медичних імунобіологічних препаратів та мунопрофілактики
ДП «Державний експертний центр МОЗ України»;
МАТВЄЄВА О., директор Департаменту післяреєстраційного нагляду ДП «Державний експертний центр МОЗ України»;
МОЙСЕЄВА Г., заступник директора Департаменту медичних імунобіологічних препаратів та імунопрофілактики ДП «Державний експертний центр МОЗ України»;
ВАСИЛЬЄВА В., начальник відділу клінічних випробувань та моніторингу МІБП Департаменту медичних імунобіологічних препаратів та імунопрофілактики ДП «Державний експертний центр МОЗ України»;
БАШКАТОВА Т., провідний фахівець відділу клінічних випробувань та моніторингу МІБП Департаменту медичних імунобіологічних препаратів та імунопрофілактики ДП «Державний експертний центр МОЗ України»
Рубрики: Инфекционные заболевания, Иммунология
Разделы: Справочник специалиста
Версия для печати
Несприятливі події після імунізації (далі НППІ) — усі захворювання, які зареєстровані у щепленого протягом післявакцинального періоду.
Сучасний світ уже неможливо уявити без імунопрофілактики, що дозволила ліквідувати віспу і взяти під контроль більшість інфекційних хвороб, що обумовлювали високу захворюваність і смертність, у першу чергу, у дитячому віці. Припинення щеплень або навіть тимчасове зниження охоплення ними загрожує розвитком епідемій. Тому до основних завдань системи охорони здоров’я в будьякій країні належать: розробка календаря щеплень та оптимальний вибір вакцин. Але, як відомо, абсолютно безпечних вакцин не існує, тож без належного моніторингу безпеки вакцин неможливо реалізувати поставлені завдання.
У цьому матеріалі будуть подані основні засади, на яких здійснюється такий моніторинг в Україні, визначення, що використовуються в процесі моніторингу, а надалі — аналіз летальних випадків, що сталися у 2012 р., за часом збігаються з уведенням вакцини, алергену туберкульозного та не мають зв’язку з їх застосуванням.
Беззаперечна користь імунопрофілактики
На сьогодні для забезпечення відповідного стану здоров’я суспільства імунопрофілактика є найбільш ефективним заходом боротьби з інфекційними хворобами.
Підтвердженням цього є статистичні дані щодо кількості хворих осіб на те чи інше інфекційне захворювання і його наслідки, а також порівняння показників захворюваності у періоди до проведення вакцинації та після впровадження специфічної профілактики керованих інфекцій.
Так, довакцинальна історія кору підтверджує надзвичайну актуальність цієї хвороби — протягом десятиріччя, що передувало впровадженню імунопрофілактики (1957–1966 рр.), показник захворюваності на кір становив 154,0–802,5 на 100 тис. населення. Після введення вакцинопрофілактики у віці 12 міс. захворюваність на кір знизилась у 25 разів та продовжувала знижуватись. У 1998 р. Європейський регіон ВООЗ оголосив пріоритетним напрямок елімінації кору до 2007 р. (елімінація — відсутність місцевих випадків кору в країні та відсутність поширення вірусу в разі завозу з інших територій). Але, незважаючи на багаторічні успіхи імунопрофілактики кору, у 2011 р. почалася епідемія кору в Західній Європі, яка не оминула й Україну. На даний час ситуація, що склалася, свідчить про неможливість досягнення елімінації кору як в Україні, так і в Європейському регіоні (Мойсеєва Г.В. Концепція елімінації кору в умовах України: Авторефер. дис... д.м.н. — К., 2011).
На момент прийняття у 1988 р. Глобальної програми ліквідації поліомієліту число ендемічних з цієї інфекції країн становило 125, наприкінці 2001 р. — 10. Кількість випадків зменшилась відповідно з близько 350 тис. до 537 випадків. У 2002 р. Європейський регіон ВООЗ було сертифіковано як територію, вільну від циркуляції «дикого» поліовірусу (http://www.who.int; Поліомієліт: імунопрофілактика та її вплив на еволюцію епідемічного процесу за редакцією Задорожної В.І. — Київ, 2012).
Профілактика дифтерії та правця проводиться комплексними дифтерійноправцевими препаратами і потребує системного контролю специфічного імунітету населення. Епідемія дифтерії, яка виникла на території України та за її межами на початку 90х років, поширилась як серед щепленого населення, так і серед нещепленого прошарку. Після проведення масової імунізації проти дифтерії в Україні зареєстровано зниження захворюваності більше ніж у 10 разів, а у 1999 р. офіційно оголошено про припинення епідемії. Протягом 2000–2006 рр. в умовах проведення масової кампанії серед дорослого населення захворюваність продовжувала знижуватись і у 2005 р. досягла рівня доепідемічного періоду (0,21 на 100 тис. населення) (Литвиненко Л.М. Удосконалення епідеміологічного нагляду за дифтерією і правцем за результатами серологічних досліджень: Автореф. дис... канд. мед. наук. — К., 2009).
Кашлюк має значне поширення в усьому світі та становить серйозну загрозу, оскільки може бути причиною тяжких ускладнень, а інколи і летальних випадків серед дітей раннього віку. У світі щороку хворіє на кашлюк приблизно 1 млн людей, помирає близько 340 тис. дітей, переважно до одного року життя. У нашій країні завдяки вакцинації рівень захворюваності в останні десятиріччя коливається від 2,3 до 13,3 на 100 тис. населення (Романенко Т.А. Системний аналіз сучасного епідемічного процесу кашлюку та удосконалення епідеміологічного нагляду: Автореф. дис... дра мед. наук. — К., 2012).
Як будьякий лікарський засіб вакцина повинна бути ефективною та безпечною. Тому контрольованими є процеси розробки її технології виробництва, проведення доклінічних, клінічних досліджень. При початку реалізації серій вакцини на ринках різних країн контроль технологічного процесу на виробництві стає ще більш жорстким та обов’язково проводиться подальший моніторинг її безпеки та ефективності. Під час широкого медичного застосування вакцин здійснюється фармаконагляд та епідеміологічний нагляд за несприятливими подіями після імунізації та реєстрація випадків інфекційних захворювань в осіб, які раніше були щеплені проти відповідної інфекції.
Абсолютно безпечних вакцин не існує
Світовий досвід проведення імунізації свідчить, що на сьогодні не існує абсолютно безпечних вакцин. З одного боку, введення вакцини активізує роботу імунної системи щепленого, що призводить до так званої імітації інфекційної хвороби, проти якої людина була вакцинована. З іншого боку, вакцини можуть спричиняти виникнення побічних реакцій, пов’язаних з особливостями відповіді організму на введення лікарських засобів або зумовлених їх складовими. Будьякі розлади здоров’я у післявакцинальному періоді законодавчо визначені як несприятливі події після імунізації (НППІ).
До НППІ належать: ускладнений перебіг післявакцинального періоду та післявакцинальні реакції й ускладнення. Реакції та ускладнення об’єднуються єдиним поняттям — «побічні реакції» (п. 3 Інструкції щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного (наказ МОЗ України від 16.09.2011 р. № 595)).
Ускладнений перебіг післявакцинального періоду
Виникнення гострого (або загострення) хронічного захворювання у післявакцинальному періоді, що за часом збігається з уведенням вакцини та не має зв’язку із щепленням (п. 3 Інструкції щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного (наказ МОЗ України від 16.09.2011 р. № 595)).
Післявакцинальні реакції (далі — реакції)
Клінічні ознаки нестійких патологічних (функціональних) змін в організмі, що виникають у зв’язку з проведенням щеплення (п. 3 Інструкції щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного (наказ МОЗ України від 16.09.2011 р. № 595)).
Післявакцинальні ускладнення (далі — ускладнення)
Стійкі функціональні та морфологічні зміни в організмі, що виходять за межі фізіологічних коливань і призводять до значних порушень у стані здоров’я (п. 3 Інструкції щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного (наказ МОЗ України від 16.09.2011 р. № 595)).
Відмінності між післявакцинальними реакціями та ускладненнями полягають у тому, що післявакцинальні реакції порівняно з ускладненнями мають менш виражені клінічні прояви, короткочасний перебіг та минають без наслідків.
Ті побічні реакції, про виникнення яких зазначено в інструкції та в наказі МОЗ України від 16.09.2011 р. № 595, слід ідентифікувати як передбачені. У разі, якщо клінічні прояви побічної реакції не зазначені в інструкції та вищезгаданому наказі, побічні реакції розцінюються як непередбачені.
Побічні реакції також бувають серйозні та несерйозні, про що зазначено в наказі МОЗ України від 27.12.2006 р. № 898 та йшлося в попередніх публікаціях Державного підприємства «Державний експертний центр МОЗ України».
Моніторинг безпеки вакцин
В Україні завдяки створеній та діючий системі фармаконагляду та епідеміологічного нагляду за НППІ постійно проводиться відстеження та аналіз частоти виникнення усіх видів побічних реакцій з аналізом використання серії(й) певного виробника в різних регіонах України.
Згідно з положеннями наказу МОЗ України від 27.12.2006 р. № 898 «Про затвердження Порядку здійснення нагляду за побічними реакціями лікарських засобів, дозволених до медичного застосування» у разі виникнення побічної реакції, медичний працівник (лікар, медична сестра, фельдшер, акушер, провізор чи фармацевт), пацієнт чи його представник повинен повідомити про це Департамент післяреєстраційного нагляду ДП «Державний експертний центр МОЗ України» (далі — Центр), заповнивши картуповідомлення (це можна зробити в електронному вигляді. Інтерактивна форма картиповідомлення розташована на сайті Центру: www.dec.gov.ua у рубриці «Фармаконагляд» на сторінці «Картаповідомлення про побічну реакцію та/або відсутність ефективності лікарського засобу, що заповнюється лікарем») у терміни, встановлені чинним законодавством (про це ми також писали у попередніх публікаціях).
Аналіз моніторингу за НППІ в Україні здійснює Департамент імунобіологічних препаратів та імунопрофілактики (далі — Департамент) Центру (п. 1 розділу 3 Інструкції щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного, затвердженої наказом МОЗ України від 16.09.2011 р. № 595).
Згідно з чинним законодавством України кожен випадок порушення стану здоров’я дітей або дорослих у 30денний термін після отримання щеплення або проведення проби Манту підлягає розслідуванню. У разі госпіталізації або летального випадку в першу чергу з’ясовується, чи застосовувалась до пацієнта протягом останніх 30 діб вакцинація або туберкулінодіагностика. При підтвердженні даного факту головний лікар ЛПЗ в перші 24 години подає коротку (оперативну) інформацію про випадок (додаток 1 Положення про оперативне реагування на несприятливі події після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного у разі госпіталізації або летального випадку (наказ МОЗ України від 16.09.2011 р. № 595)) до Департаменту.
Протягом 24 годин створюється група оперативного реагування зі спеціалістів різного профілю (склад групи формується з фахівців профільних спеціальностей залежно від патологічного стану, який виник у післявакцинальному періоді) для проведення ретельного та всебічного розслідування.
На період розслідування Державна служба України з лікарських засобів (далі — Держлікслужба), згідно з чинним законодавством тимчасово забороняє реалізацію (торгівлю) та застосування відповідної серії вакцини, анатоксину або алергену туберкульозного, що направляються в карантин. До проведення розслідування та встановлення причиннонаслідкового зв’язку вакцина/анатоксин/алерген туберкульозний вважається підозрюваним лікарським засобом. Остаточне рішення щодо подальшого обігу тимчасово заборонених лікарських засобів приймається Держлікслужбою на підставі заключного висновку групи оперативного реагування або висновків щодо відповідності якості лікарських засобів. Контроль якості серій вакцин, які знаходяться під забороною, здійснюється лише в разі встановлення причиннонаслідкового зв’язку між клінічною ситуацією та застосування вакцини. Ті серії вакцин/анатоксинів/алергену туберкульозного, термін придатності яких вичерпався під час перебування у карантині, знищуються. Інколи летальні випадки виникають при одночасному застосуванні декількох вакцин/анатоксинів/алергену туберкульозного, у цьому разі всі вони забороняються до встановлення причини.
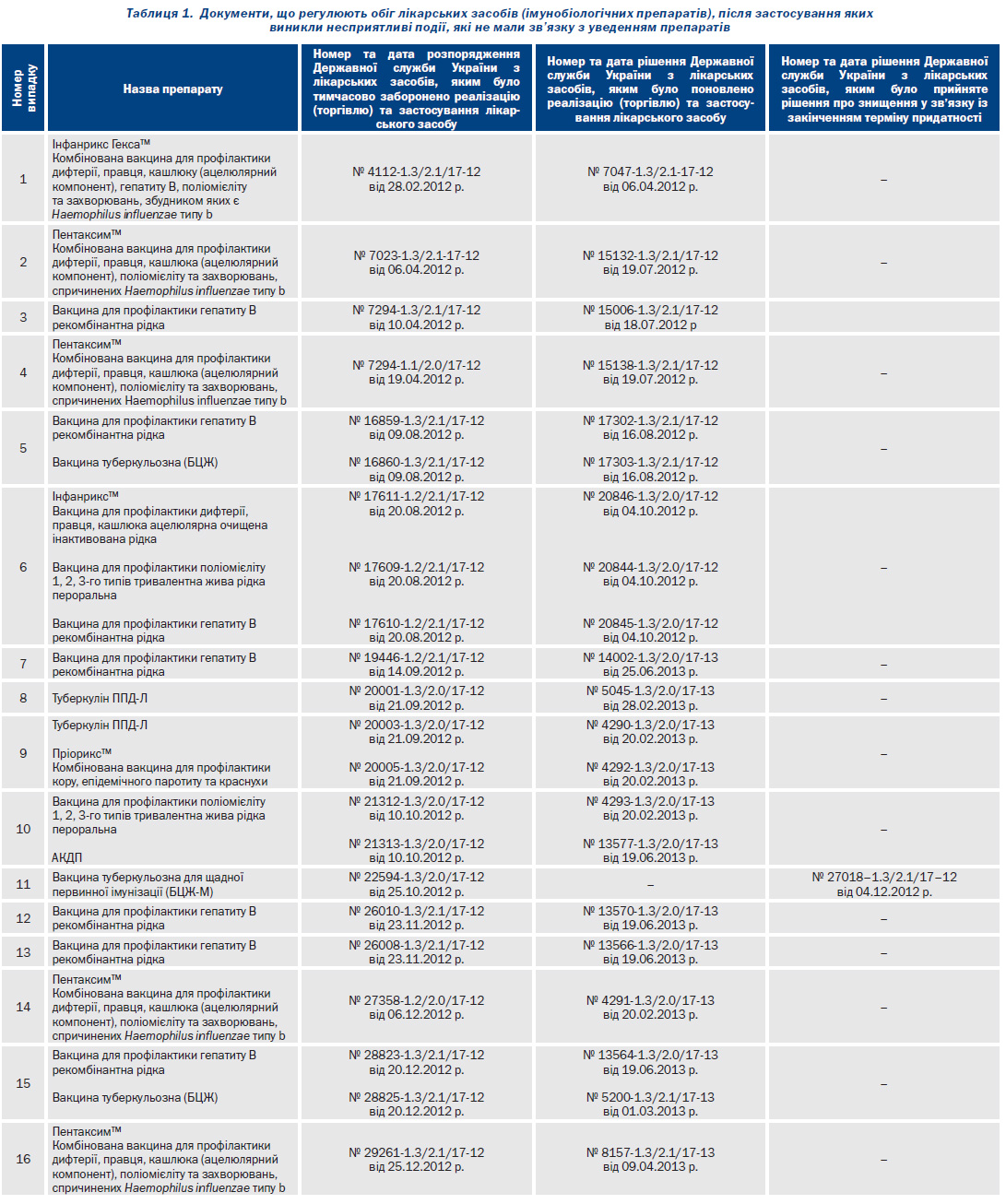
У табл. 1 представлено препарати, застосування яких було тимчасово призупинено через реєстрацію випадків НППІ (летальні випадки) у післявакцинальному періоді.
Період розслідування повинен тривати не більше 30 діб з моменту реєстрації випадку. При розслідуванні здійснюється аналіз низки даних, що можуть відігравати вирішальну роль у виникненні смерті/госпіталізації щепленого та допомогти визначити її причину. Аналізуються дані анамнезу життя, перенесених захворювань, прищеплювального анамнезу, результати медичного огляду перед щепленням, епідеміологічне оточення, відповідність дотримання медичних показань та протипоказань щодо щеплення, процедурі імунізації. Також аналізуються: умови температурного режиму зберігання та транспортування вакцин, анатоксинів та алергену туберкульозного, оперативна інформація щодо кількості використаних доз підозрюваної серії вакцини по ЛПЗ/району/області, наявність або відсутність зареєстрованих післявакцинальних реакцій/ускладнень, їх частота.
Після проведення розслідування група оперативного реагування надає до Департаменту Центру попередню довідку по результатах проведеного розслідування.
Після отримання результатів лабораторних та інструментальних досліджень (при госпіталізації) або даних патологоанатомічного діагнозу з результатами гістологічних, вірусологічних, бактеріологічних, токсикологічних досліджень (у разі летального випадку) не пізніше 30 днів з моменту реєстрації випадку, група оперативного реагування встановлює або спростовує зв’язок патологічного стану з проведеним щепленням або туберкулінодіагностикою та надає заключний висновок (додаток 2 Положення про оперативне реагування на несприятливі події після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного у разі госпіталізації або летального випадку (наказ МОЗ України від 16.09.2011р. № 595)) до Департаменту Центру.
Як диференціювати ускладнення після вакцинації з іншими захворюваннями
Порушення стану здоров’я, що виникають після вакцинації, не слід одразу зараховувати до побічної реакції, доки не буде встановлено її причиннонаслідковий зв’язок зі щепленням. Хоча батьки першими спостерігають за розладами здоров’я щепленого, однак лише лікар може встановити причину їх розвитку. Це має велике значення для встановлення правильного діагнозу та призначення своєчасного й адекватного лікування.
Відомо, що переважна кількість щеплень припадає на перший рік життя дитини. Таким чином, дитина весь цей проміжок часу перебуває в післявакцинальному періоді. При цьому не виключено, що в цей час дитина може хворіти на гострі респіраторні захворювання та інші хвороби інфекційного чи неінфекційного генезу. Приєднання будьяких захворювань може спостерігатися в різні проміжки післявакцинального періоду. Тому будьяке захворювання в післявакцинальному періоді може бути розцінено як можлива побічна реакція (реакція/ускладнення) на введення вакцини. Отже, необхідно проводити збір анамнезу та диференційну діагностику між побічними реакціями на щеплення та захворюваннями, які лише в часі пов’язані з імунізацією. Особливо важливо виключити у щепленого наявність таких захворювань, як менінгіт, сепсис, пневмонія, наявність екстреної хірургічної патології, оскільки зволікання їх лікування є небезпечним для життя.
Лише в разі виключення ролі інших чинників у погіршенні стану здоров’я щепленого слід розглядати питання про його зв’язок зі щепленням. При вирішені цього питання важливо враховувати час виникнення патологічних клінічних проявів та його співвідношення з проведеним щепленням.
Коли йдеться про виникнення побічних реакцій, то в основному вони пов’язані з індивідуальними особливостями імунної відповіді організму на щеплення та властивостями вакцини. У переважній більшості післявакцинальні реакції мають місцеві та/або загальні прояви. Місцевими проявами можуть бути гіперемія, інфільтрат, набряк та болючість у місці введення вакцини. Вони спостерігаються одразу після введення вакцин, як живих, так і інактивованих, та тривають протягом декількох діб. Загальні реакції проявляються підвищенням температури тіла, головним болем, порушенням сну, апетиту тощо, як правило, їх тривалість становить від 1 до 3 діб.
Для живих та інактивованих вакцин існують характерні клінічні прояви післявакцинальних реакцій та строки їх розвитку. Так, для інактивованих вакцин загальні реакції реєструються в перші 72 години, а для живих вакцин — не раніше ніж через 4–5 діб від моменту щеплення.
Вичерпний перелік можливих проявів побічних реакцій та строки їх розвитку наведені в інструкціях про застосування вакцини (далі — Інструкція) відповідної вакцини/анатоксину/алергену туберкульозного та в додатках 1, 2 Інструкції щодо організації епідеміологічного нагляду за несприятливими подіями після імунізації при застосуванні вакцин, анатоксинів та алергену туберкульозного, затвердженої наказом МОЗ України від 16.09.2011 р. № 595.
Можливі причини летальних наслідків вакцинації
На особливу увагу заслуговує розгляд питання причин летальних випадків у післявакцинальному періоді, коли існує зв’язок між смертю щепленого й використанням вакцини. Однак слід зазначити, що в певних випадках такого наслідку можна було б уникнути, а в інших — ні.
До останніх належать особливості індивідуальної відповіді організму на введення вакцини та виникнення реакції гіперчутливості до будьякого компонента вакцини. Для профілактики цього перед щепленням збирається анамнез життя відповідно до п. 10 «Положення про організацію і проведення профілактичних щеплень та туберкулінодіагностики» (наказ МОЗ України від 16.09.2011 р. № 595). За імунізованою особою в закладі охорони здоров’я, де відбулося щеплення, повинно здійснюватися спостереження протягом 30 хвилин після вакцинації, оскільки цей проміжок часу є найбільш небезпечним щодо виникнення реакцій гіперчутливості (п. 16 «Положення про організацію і проведення профілактичних щеплень та туберкулінодіагностики» (наказ МОЗ України від 16.09.2011 р. № 595)). У разі виникнення реакції гіперчутливості щепленому своєчасно надається невідкладна медична допомога відповідно до затвердженого МОЗ протоколу.
Серйозним ускладненням при введенні вакцини є розвиток інфекційнотоксичного шоку, який може мати летальні наслідки та пов’язаний із застосуванням вакцини. Зазвичай причиною такого ускладнення є медична помилка, коли розведена напередодні жива вакцина використовується на наступний день, що є категорично неприпустимим. Згідно з інструкцією, живу вакцину в мультидозових флаконах можна використати після розведення (відновлення) лише протягом 6–8 годин. Зберігати таку вакцину необхідно лише у холодильнику при температурі +2–8 °С. Наприкінці робочого дня розведена жива вакцина повинна бути знищена. Порушення зазначених правил може коштувати життя щепленому.
Також причиною смерті в післявакцинальному періоді, що пов’язана з використанням вакцини, може бути розведення вакцини розчинником, що не входить до комплекту з нею. Наприклад, використання як розчинника будьяких лікарських засобів у рідкій лікарській формі. У літературі описані випадки використання як розчинника інсуліну та нейролептика. Такі події розцінюються як медична помилка, і їх можна уникнути за дотримання медичними працівниками вимог інструкції про застосування вакцини.
У 2012 р. до Департаменту Центру надійшло 1643 оперативних повідомлення про випадки підозри на побічну реакцію після застосування вакцин та алергену туберкульозного. Проведений аналіз дозволив встановити, що 1455 випадків мали причиннонаслідковий зв’язок з уведенням вакцин чи алергену туберкульозного (післявакцинальні реакції/ускладнення), 134 не мали зв’язку (ускладнений перебіг післявакцинального періоду) та не можливо було оцінити зв’язок у 54 випадках (недостатньо даних). Оперативні повідомлення включали всі випадки підозри на побічні реакції з госпіталізацією або без неї та летальні випадки.
У 2012 році до Департаменту Центру надійшло 16 повідомлень про летальні випадки в післявакцинальному періоді. Переважна більшість летальних випадків зареєстрована на першому році життя. Після ретельного розслідування кожного випадку було встановлено, що клінічна подія, яка виникла протягом 30 діб після щеплення, не мала причиннонаслідкового зв’язку з попереднім використанням підозрюваної серії вакцини або алергену туберкульозного. Тобто причиною смерті не була вакцина як така. В усіх 16 випадках смерть щеплених наступила з інших причин і лише в часі збіглася із проведеною вакцинацією.
Підтвердженням цього є прозора інформація, представлена нижче, що демонструє реальні клінічні ситуації, які виникли у післявакцинальному періоді, та їхній аналіз, проведений групами оперативного реагування на несприятливу подію після імунізації.
НППІ 1
Хлопчик, 2010 р.н., народився від VІ вагітності (у 12 тижнів — загроза переривання вагітності), ІІ пологів шляхом кесарева розтину в терміні 37–38 тижнів з оцінкою за шкалою Апгар 8–8 балів. З анамнезу життя відомо, що у віці 3 місяців виявлено затримку психомоторного розвитку та встановлено діагноз: гіпоксичноішемічна енцефалопатія, гіпертензійнолікворний синдром. У віці 6 місяців він перехворів на гострий обструктивний бронхіт, із дихальною недостатністю І–ІІ ступеня. Щеплювався з порушенням календаря — БЦЖ отримав на 14ту добу життя, першу дозу комбінованої вакцини ІнфанриксГекса — у віці 9 місяців, другу дозу — в 1 рік 5 місяців (20.02.2012 р.). Реакції на щеплення не було. На 4ту добу (24.02.2012 р.) після щеплення під час денного відпочинку стан дитини різко погіршився, з’явилась задуха, ціаноз носогубного трикутника, потім відбулась зупинка дихання. Лікарем швидкої медичної допомоги було констатовано біологічну смерть.
Причина смерті: нейрофіброма серця з локалізацією у ділянці лівого шлуночка, що підтверджено гістологічними дослідженнями.
За висновком регіональної групи оперативного реагування: смерть дитини пов’язана з захворюванням — нейрофібромою серця з локалізацією у ділянці лівого шлуночка. Розростання пухлини призвело до порушення функції скорочення серця, зменшення порожнини лівого шлуночка, розвитку загальної тканинної гіпоксії та гострої серцевосудинної недостатності. Дана несприятлива подія збіглася за часом з уведенням вакцини та не має зв’язку зі щепленням.
НППІ 2
Дівчинка, 2011 р.н., народилась від І вагітності, І пологів у термін 35–36 тижнів, з оцінкою за шкалою Апгар 6–8 балів. У пологовому будинку не отримала щеплення вакциною для профілактики гепатиту В та БЦЖ у зв’язку з підозрою на вроджену ваду серця. У віці 19 діб була щеплена проти туберкульозу вакциною БЦЖ. Фізичний та психоневрологічний розвиток дитини відповідав віку. Не хворіла. Дані за наявність спадкових захворювань відсутні. З 3 місяців життя дитина знаходилася на штучному вигодовуванні з використанням цільного коров’ячого молока. У 4 місяці 5 днів (04.04.2012 р.) дитина отримала першу дозу комбінованої вакцини Пентаксим. Протягом 30 хвилин реакції на щеплення не було. Наступного дня (05.04.2012 р.) о 8й годині ранку мати знайшла дитину мертвою. Смерть дитини констатовано фельдшером бригади швидкої медичної допомоги.
Причина смерті: стійка гіперплазія вилочкової залози. Тиміколімфатичний статус. За результатами гістологічного дослідження мають місце такі зміни: гіперплазія тимуса, гіпоплазія надниркових залоз, ознаки гіперплазії лімфоїдної тканини в міжфолікулярній зоні лімфатичних вузлів брижі, ознаки «спустошення» білої пульпи в селезінці.
За висновком регіональної групи оперативного реагування: смерть дитини не пов’язана з уведенням вакцини Пентаксим.
Відповідно до даних епідеміологічного спостереження за несприятливими подіями після імунізації протягом 2012 року в Україні на 17 000 використаних доз серії комбінованої вакцини Пентаксим зареєстровано 1 летальний випадок — дитина з групи ризику щодо синдрому раптової смерті на фоні тиміколімфатичного статусу.
НППІ 3
Дівчинка, 2012 р.н., народилась від ІІ вагітності, ІІ термінових пологів. У пологовому будинку на 1й добі життя отримала першу дозу вакцини для профілактики гепатиту В. Щеплення вакциною БЦЖ проведено на 10й добі. Другу дозу вакцини для профілактики гепатиту В отримала у 2 місяці 11 днів (04.04.2012 р.). На 3й добі (07.04.2012 р.) приблизно о 18й годині 30 хвилин мати звернула увагу на те, що дитина довго спить, і виявила її мертвою.
Причина смерті: синдром раптової смерті на фоні тимомегалії, лімфатикогіпопластичного діатезу і фетопатії.
За висновком регіональної групи оперативного реагування: смерть дитини на 3тю добу після імунізації вакциною для профілактики гепатиту В обумовлена синдромом раптової смерті немовляти на фоні тимомегалії, лімфатикогіпопластичного діатезу і фетопатії. Причиннонаслідковий зв’язок даної події зі щепленням відсутній.
Відповідно до даних епідеміологічного спостереження за несприятливими подіями після імунізації протягом 2012 року в Україні на 28 800 використаних доз серії вакцини для профілактики гепатиту В зареєстровано 1 летальний випадок — дитина з синдромом раптової смерті на фоні тимомегалії, лімфатикогіпопластичного діатезу й фетопатії.
Опубліковані в літературних джерелах результати досліджень щодо можливого зв’язку синдрому раптової смерті з уведенням комбінованої гексавакцини, до складу якої входив компонент гепатиту В, підтверджують відсутність асоціації зі щепленням, що передувало розвитку несприятливої події на 14 днів. У дослідженнях вивчалось співвідношення 307 випадків синдромів раптової смерті та 921 випадкуконтролю.
НППІ 4
Хлопчик, 2011 р.н., народився від ІІ вагітності, ІІ фізіологічних пологів, з оцінкою за шкалою Апгар 7–8 балів. Дитина росла та розвивалась за віком. Неврологічний анамнез без особливостей. У віці 4 місяців розпочато вакцинальний комплекс комбінованою вакциною Пентаксим, другу дозу цієї ж серії вакцини дитина отримала у 5 місяців (12.04.2012 р.). Реакції на щеплення не було. На 3тю добу (15.04.2012 р.) після щеплення дитина померла вдома. Батьки дитини за медичною допомогою не зверталися. Про даний випадок повідомили чергового райвідділу міліції.
Причина смерті: гостра пневмонія.
За висновком регіональної групи оперативного реагування: причиннонаслідковий зв’язок несприятливої події зі щепленням відсутній. Причиною летального випадку, що зареєстрований у післявакцинальному періоді, є приєднання гострої інфекції.
НППІ 5
Дівчинка, 2012 р.н., народилась від ІІ вагітності, ІІ термінових пологів, з оцінкою за шкалою Апгар 8–9 балів. Щеплена в пологовому будинку відповідно до календаря профілактичних щеплень вакциною для профілактики гепатиту В (05.08.2012 року), через 2 доби (07.08.2012 року) зроблено щеплення вакциною БЦЖ. У цей же день мати дитину залишила без догляду, не сповістивши про це медичних працівників, а коли повернулась, дитина була мертвою.
Причина смерті: механічна асфіксія, зумовлена їжею.
За висновком регіональної групи оперативного реагування: несприятлива подія після імунізації, що за часом збігається з уведенням вакцин, не має зв’язку зі щепленнями, а належить до нещасних випадків.
НППІ 6
Дівчинка, 2010 р.н., народилась від ІІ вагітності, ІІ пологів. Росла та розвивалась із затримкою статокінетичного розвитку — синдром рухових порушень унаслідок гіпоксичноішемічного ураження центральної нервової системи, до 1 року відмічалась анемія, діагностований лімфатикогіпопластичний діатез (тимомегалія). У віці 2 роки 2 місяці (27.07.2012 року) у дитячій поліклініці дівчинка отримала щеплення вакцинами: ОПВ, Інфанрикс та вакциною для профілактики гепатиту В. Вакцинація проведена поза строками календаря профілактичних щеплень. З анамнезу відомо, що дитина захворіла 07.08.2012 р. Вранці мати відзначила млявість, відмову від їжі, підвищення температури тіла 37,2 °С — за медичною допомогою не звертались. До вечора дитина стала більш млява, відмічалось похолодіння кінцівок, холодний піт, мати давала нурофен. Вночі дівчинка була неспокійна, скаржилась на спрагу. Зранку 08.08.2012 р. було одноразове блювання, ціаноз кінцівок, адинамія, загальмованість. Зі слів матері, 07–08.08.2012 р. біля ліжка дитини працював фумігатор Raid. Батьки дитини 08.08.2012 р. викликали швидку медичну допомогу, і дитина була госпіталізована. При надходженні стан оцінений як дуже тяжкий. Тяжкість обумовлена периферичними гемодинамічними порушеннями, печінковонирковою недостатністю, енцефалітною реакцією (сопор). З 10.08.2012 р. дівчинка знаходилась на замісній штучній вентиляції легень, антибіотикотерапії, гемостатичній та замісній терапії. Після обстеження та консиліуму спеціалістів встановлено клінічний діагноз: сепсис: гнійний етмоїдит, гайморит, гнійний ендобронхіт, ССЗВ; СПОП (НГМ — кома, ДН 3го ступеня, ДВЗсиндром, ГНН, стадія олігоанурії, токсичний гепатит), полісерозит, судомний синдром, вторинна анемія 3го ступеня, тромбоцитопенія; екзогенна інтоксикація токсичною речовиною? Протягом усього часу перебування у стаціонарі стан дитини був дуже тяжкий із негативною динамікою за рахунок прогресування поліорганних порушень (ДВЗсиндром, дихальна недостатність, гостра ниркова недостатність із розвитком олігоурії). Незважаючи на проведену терапію, на 21шу добу після щеплень дитина померла.
Причина смерті: сепсис, лептоменінгіт, бронхіоліт, дрібновогнищева пневмонія, десквамаційний гастроентерит.
За висновком центральної групи оперативного реагування: причиннонаслідковий зв’язок між станом, що розвинувся в післявакцинальному періоді, та отриманими щепленнями відсутній.
Дана подія збіглася за часом із проведеною вакцинацією та обумовлена приєднанням інтеркурентної інфекції.
НППІ 7
Хлопчик, 2012 р.н., народився від I вагітності, I пологів, з оцінкою за шкалою Апгар 7–8 балів. При народженні встановлений діагноз: загроза реалізації внутрішньоутробної інфекції (навколоплідні води зелені). Щеплений відповідно до календаря профілактичних щеплень, на першу добу вакциною для профілактики гепатиту В (16.07.2012 р.), на 4ту добу — вакциною для профілактики туберкульозу (19.07.2012 р.). Післявакцинальний період без ускладнень. У віці 1 місяць 19 днів (03.09.2012 р.) зроблено другу дозу вакцини для профілактики гепатиту В. Напередодні перед щепленням (02.09.2012 р.) у нічний час батьки відмічали занепокоєння дитини, яке утримувалось після щеплення наступного дня (04.09.2012 року). Протягом 05.09.2012 року з’явилась млявість, випорожнення було 1 раз за добу. Наступного дня 06.09.2012 року приєдналась задишка. До 07.09.2012 р. батьки за медичною допомогою не зверталися. Лише на 4ту добу після щеплення та 5ту добу від початку клінічних симптомів дитина була госпіталізована з попереднім діагнозом: гостра кишкова інфекція, вроджена вада серця, двобічна пневмонія, ДН3. Тяжкість стану була обумовлена інтоксикацією, дихальними розладами (температура тіла 35,2 °С, частота дихання — 72 на хвилину, частота серцевих скорочень — 148 ударів на хвилину). 11.09.12 р. дитину переведено на неінвазивну штучну вентиляцію легень, з подальшою інтубацією і переводом на штучну вентиляцію в режимі PCV. О 12:10 зафіксована зупинка кровообігу, розпочаті реанімаційні заходи згідно з протоколом. Незважаючи на проведені заходи, о 12:40 констатована смерть дитини.
Причина смерті: гостра кишкова інфекція невстановленої етіології — катаральноерозивний ентероколіт з явищами токсикозу та ексикозу (за клінічними та морфологічними даними). Вроджена вада серця — гіпоплазія лівих відділів із формуванням кардіомегалії.
За висновком регіональної групи оперативного реагування: причиннонаслідковий зв’язок між смертю дитини та проведеним щепленням відсутній.
Несприятливу подію, що виникла у післявакцинальному періоді, можна було попередити, у разі ретельного збору анамнезу та оцінки стану здоров’я дитини перед щепленням, своєчасного звернення батьків по медичну допомогу.
НППІ 8
Хлопчик, 2012 р.н., від І доношеної вагітності, І пологів у 40 тижнів. У пологовому будинку не отримав щеплення вакциною БЦЖ у зв’язку з ускладненим неонатальним періодом: тяжка інтранатальна асфіксія, гіпоксичне ураження ЦНС, судомний синдром, шийна мієлопатія. Згідно з календарем профілактичних щеплень, перед вакцинацією БЦЖ, після 2 місяців життя необхідно зробити пробу Манту. Туберкулінодіагностику алергеном туберкульозним хлопчику проведено у віці 2 місяці 3 дні (04.09.2012 року) у кабінеті щеплень міської дитячої лікарні. Реакції не спостерігалось. Облік проби Манту проведений 07.09.2012 р. — результат негативний, стан дитини задовільний. Заплановано щеплення БЦЖ на 14.09.2012 р. планово, враховуючи чергу для раціонального використання вакцини. На 9ту добу (13.09.2012 року) після туберкулінодіагностики дитина померла.
Причина смерті: механічна асфіксія, удушення внаслідок аспірації шлунковим вмістом.
За висновком регіональної групи оперативного реагування: причиннонаслідковий зв’язок смерті дитини з уведенням алергену туберкульозного відсутній. Несприятлива подія виникла внаслідок нещасного випадку.
НППІ 9
Хлопчику, 2011 р.н., відповідно до календаря профілактичних щеплень проведено туберкулінодіагностику (10.09.2012 р.) та щеплення вакциною КПК (13.09.2012 р.). Ввечері 13.09.2012 р. батьками відмічено підвищення температури тіла до 39 °С, кашель. Наступного дня звернулись в поліклініку ЦРЛ до лікаря зі скаргами на непродуктивний кашель, підвищення температура тіла до 37,2 °С. Після медичного огляду встановлено діагноз «гостра респіраторна вірусна інфекція», призначено лікування: фенкарол, аугментин, інстаріл. Від запропонованої госпіталізації батьки відмовились. Призначену терапію було розпочато 15.09.2012 р. о 20:00 при відсутності батьків. Через 30 хв після прийому вищезгаданих лікарських препаратів дитина закашлялась і посиніла. Відразу була доставлена в реанімаційне відділення ЦРЛ, де о 22:00 після неефективного проведення реанімаційних заходів зафіксована біологічна смерть. Летальний випадок стався на 5ту добу після застосування алергену туберкульозного та на 2гу добу після проведеного щеплення.
Причина смерті: гостре отруєння кофеїном на фоні гострої алкогольної інтоксикації, що підтверджено токсикологічними дослідженнями — у внутрішніх органах виявлена речовина — кофеїн, при обстеженні крові — етиловий алкоголь у кількості 0,88 ‰.
За висновком регіональної групи оперативного реагування: дана подія збіглася за часом із застосуванням алергену туберкульозного, вакцини КПК та обумовлена токсичною дією хімічних речовин (кофеїну та етилового спирту), що підтверджено морфологічними ознаками секційного матеріалу, гістологічними та токсикологічними дослідженнями.
НППІ 10
Дівчинка, 2012 р.н., у віці 7 місяців та 23 дні отримала щеплення 25.09.2012 р. вакциною АКДП та ОПВ з порушенням календаря профілактичних щеплень. З анамнезу життя відомо, що протягом перших п’яти місяців життя дитина 4 рази хворіла на гостре респіраторне вірусне захворювання. На другий день після щеплень дитина була відвідана медичною сестрою — стан задовільний, реакції на щеплення немає. На 5ту добу післявакцинального періоду (30.09.2012 р.) о 16:10 мати звернулась по медичну допомогу зі скаргами на висип на шкірі, млявість, сонливість, часту блювоту, підвищення температури тіла до 39 °С. Дитину госпіталізовано в реанімаційне відділення у тяжкому стані. Тяжкість стану обумовлена загальномозковою неврологічною симптоматикою: відсутність свідомості та реакції на больові подразники, рефлекси пригнічені. Шкірні прояви блідосірого кольору, на шкірі геморагічний зірчастий висип темнобордового кольору з некрозом в центрі, краї рвані, висип не зникає при натисканні. Носогубний трикутник ціанотичний, пульс на периферичних артеріях не визначається. Дитина була інтубована, проводилась інтенсивна терапія. Незважаючи на проведені реанімаційні заходи, о 17:45 було зафіксовано біологічну смерть.
Причина смерті: генералізована менінгококова інфекція. Блискавична форма. Менінгококцемія. Синдром Уотерхауза — Фридериксена. Менінгококовий менінгіт, що підтверджено бактеріологічним дослідженням.
За висновком регіональної групи оперативного реагування: причиннонаслідковий зв’язок з проведеними щепленнями відсутній. В даному випадку мало місце виникнення гострого інтеркурентного захворювання, що проявилось у післявакцинальному періоді та збіглося за часом із уведенням вакцин.
НППІ 11
Дівчинка, 2012 р.н., народилась від ІІ термінових пологів шляхом кесаревого розтину з масою тіла 3100 г, оцінкою за шкалою Апгар 8–8 балів. Через 3 години після народження стан дитини погіршився, діагностовано перинатальне ураження центральної нервової системи, синдром пригнічення, затримку внутрішньоутробного розвитку, гіпоксичну форму 2го ст.. Вроджений стридор. Внутрішньоутробна інфекція? У зв’язку з обтяженим неонатальним періодом щеплення вакциною БЦЖ в пологовому будинку не проводилося. Імунізацію вакциною для щадної первинної імунізації БЦЖМ було проведено 26.09.2012 р. на 12ту добу життя. Реакції на щеплення не відмічалось. У віці 1 місяця 4 днів (18.10.2012 р.) після огляду лікаремпедіатром виявлено зниження маси тіла на 200 г — дані рекомендації щодо годування. 21.10.2012 р. о 15:30 дитина з матір’ю бригадою швидкої допомоги доставлена до територіального медичного об’єднання з кишковими кольками, де була оглянута лікарем приймального відділення, запропоновано годування молочною сумішшю (дитина на штучному вигодовуванні) з ріжка, яку дівчинка з’їла з апетитом, а після цього заснула. Від госпіталізації мати категорично відмовилась у письмовій формі. 22.10.2012 р. після годування молочною сумішшю «Нутрилон» приблизно о 22:00 мати відзначала збудження дитини, різку слабкість, зупинку дихання. Була викликана бригада швидкої медичної допомоги о 22:35, яка після приїзду о 22:45 констатувала біологічну смерть дитини.
Причина смерті: синдром раптової смерті.
За висновком регіональної групи оперативного реагування: причиннонаслідковий зв’язок несприятливої події в післявакцинальному періоді з проведеним щепленням відсутній.
НППІ 12
Хлопчик, 2012 р.н., народився від ХІІ вагітності, V передчасних пологів (в термін гестації 36 тижнів) з оцінкою за шкалою Апгар 7–8 балів. Мати на обліку у жіночій консультації не перебувала. З 4го дня життя дитина перебувала у відділенні недоношених новонароджених з діагнозом: пренатальне гіпоксичногеморагічне ураження ЦНС, синдром церебрального пригнічення, неонатальна жовтяниця неуточненого генезу, недоношеність. На 5ту добу життя (12.09.2012 р.) дитина отримала щеплення проти туберкульозу вакциною БЦЖМ. У віці 1 місяць та 26 днів 02.11.2012 р. дитина була оглянута дільничним лікарем, дано дозвіл на імунізацію, щеплена вакциною для профілактики гепатиту В с.311007/04 виробництва ПАТ «ФармстандартБіолік», Україна. На 13ту добу післявакцинального періоду 15.11.2012 р. приблизно о 18:00 дитина стала різко неспокійною, пронизливо плакала — мати дала 16 крапель боботіка, дитина заспокоїлася. Через 15 хв крик та неспокій повторився, була викликана бригада швидкої медичної допомоги. Ще до приїзду лікарів мати дала 1 чайну ложку блідорожевого розчину перманганату калію. Фельдшером швидкої медичної допомоги після приїзду відзначено мармуровість шкірних покривів, тотальний ціаноз. О 20:10 дитина була доставлена у відділення інтенсивної терапії для дітей з інфекційною патологією, при надходженні стан термінальний, незважаючи на реанімаційні заходи протягом 35 хвилин, о 20:45 констатована смерть.
Причина смерті: генералізована вірусна інфекція. Серозна проміжна пневмонія, катаральний бронхіт, гострий серозний менінгіт, катаральний ентероколіт.
За висновком регіональної групи оперативного реагування: причиннонаслідковий зв’язок між несприятливою подією та щепленням відсутній. Дана подія збіглася за часом з проведеною вакцинацією та обумовлена приєднанням гострої інтеркурентної вірусної інфекції.
НППІ 13
Дівчинка, 2012 р.н., народилась від ІV пологів з оцінкою за шкалою Апгар 7–8 балів. В умовах пологового будинку при задовільному загальному стані здоров’я дівчинка отримала щеплення вакциною для профілактики гепатиту В та туберкульозу. При плановому медичному огляді у віці 1 місяць дитина була соматично здорова, знаходилася на змішаному вигодовуванні (вага 3800 г), діагностовано пелюшковий дерматит. У віці 1 місяць 30 днів (09.11.2012 р.) дівчинка була оглянута лікаремпедіатром, визнана здоровою, дозволено друге щеплення проти гепатиту В. При огляді через 30 хвилин на першу і другу добу післявакцинального періоду скарг не було, стан задовільний. На 10у добу післявакцинального періоду (19.11.2012 р.) дитина померла вдома.
Причина смерті: синдром раптової смерті.
За висновком регіональної групи оперативного реагування: причиннонаслідковий зв’язок несприятливої події у післявакцинальному періоді з проведеним щепленням відсутній.
НППІ 14
Дівчинка, 2012 р.н., народилась від ІІ пологів у термін 40 тижнів гестації. Вагітність та пологи перебігали без ускладнень. Період новонародженості без особливостей, розвивалась відповідно до віку. Згідно з календарем профілактичних щеплень у пологовому відділені отримала щеплення вакциною для профілактики гепатиту В та туберкульозу. Післявакцинальний період без ускладнень. Першу дозу вакцини Пентаксим отримала за віком у 3 місяці (27.11.2012 року) у лікувальнопрофілактичному закладі за місцем проживання. Ввечері (30.11.2012 р.) на 3тю добу після щеплення мати з дитиною знаходилася у гостях, після годування дитина через кілька хвилин посиніла та перестала дихати.
Причина смерті: синдром раптової смерті.
За висновком регіональної групи оперативного реагування: летальний випадок виник унаслідок синдрому раптової смерті. З проведенням щеплення та розвитком синдрому раптової смерті немовля має місце часовий зв’язок.
НППІ 15
Хлопчик, 2012 р.н., народився від ІV вагітності, ІV пологів (передчасне відходження навколоплідних вод) з оцінкою за шкалою Апгар 8–8 балів. У пологовому будинку на 3тю добу життя був щеплений вакциною для профілактики гепатиту В та на 5ту добу — вакциною БЦЖ. Зі слів матері 18.12.2012 року ввечері після годування поклала дитину спати з собою в ліжко, а о 05:50 19.12.2012 року виявила дитину мертвою. О 6й годині 10 хвилин лікар бригади швидкої медичної допомоги констатував біологічну смерть дитини.
Причина смерті: синдром раптової смерті.
За висновком регіональної групи оперативного реагування: причиннонаслідковий зв’язок між смертю дитини та проведеним щепленням відсутній.
НППІ 16
Дівчинка, 2012 р.н., народилась від ІІІ вагітності, ІІ пологів з оцінкою за шкалою Апгар 8–9 балів. У пологовому будинку на 4ту добу життя була щеплена вакциною БЦЖ. Перше щеплення вакциною Пентаксим отримала з порушенням календаря у віці 6 місяців (30.10.2012 року). Післявакцинальний період без ускладнень. Друге щеплення цією вакциною однієї серії проведено у 7,5 місяця (17.12.2012 року). Через 30 хвилин та наступного дня після щеплення стан дитини задовільний, реакції немає. На 4ту добу (21.12.2012 р.) після щеплення дитина померла вдома.
Причина смерті: гостра інфекція верхніх дихальних шляхів з множинними локалізаціями.
За висновком регіональної групи оперативного реагування: виникнення гострого захворювання у післявакцинальному періоді не має причиннонаслідкового зв’язку зі щепленням, лише за часом збігається з уведенням вакцини.
Вакцинація — одне з найбільш вагомих та корисних досягнень людства. Її широке застосування дозволяє щорічно зберігати мільйони людських життів, запобігати інвалідизації населення, у сотні разів знижувати інфекційну захворюваність, впливати на рівні вродженої патології та тієї соматичної захворюваності, яка є наслідком перенесених інфекційних хвороб.
Низька прихильність населення до вакцинації надзвичайно небезпечна! Адже зменшення охоплення щепленнями знаходиться у пропорційній залежності до збільшення захворюваності на керовані інфекційні хвороби.
Кожна дитина будьякої національності і будьякої соціальної групи має право бути вакцинованою тому, що це право належить до фундаментального права на життя.