Газета «Новости медицины и фармации» Гастроэнтерология (473) 2013 (тематический номер)
Вернуться к номеру
Абдоминальный ишемический синдром
Авторы: Губергриц Н.Б., д.м.н., профессор, Агапова Н.Г. - Донецкий национальный медицинский университет им. Горького
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Нет редких болезней — есть редкие диагнозы.
Рейнберг С.А., выдающийся рентгенолог
Абдоминальный ишемический синдром (АИС) — диагноз, который крайне редко ставится в гастроэнтерологической практике, хотя в 75,5 % случаев при аутопсии умерших от ИБС, гипертонической болезни, атеросклероза церебральных артерий, артерий нижних конечностей и от их осложнений выявляется атеросклероз брюшного отдела аорты и его ветвей (Лазебник Л.Б. с соавт., 2003). То есть диагностика АИС практически не проводится, несмотря на возможность использования в клинической практике не только инвазивных (ангиография), но и неинвазивных (допплерография) методов. Одна из основных причин такой ситуации — неспецифичность клинических проявлений заболевания, недостаточные знания врачей о нем. В связи с этим соответствующие методы исследования не назначаются, правильный диагноз не ставится, и поэтому лечение оказывается неэффективным. Еще одним следствием недостаточной диагностики АИС является то, что более чем в половине случаев диагноз ставится только при развитии острого нарушения мезентериального кровообращения, то есть при его тяжелом нарушении. На более ранних стадиях, когда АИС следует лечить, чтобы не допустить острой хирургической ситуации, диагностика не проводится.
История изучения АИС начинается с сообщения Despre (1834) об инфаркте кишечника с его предшествующей ишемией. С того времени АИС описывали под различными названиями: «интермиттирующая анемическая дисперистальтика», «перемежающаяся ангиосклеротическая диспрагия», «интестинальная ангина», «брюшная ангина», «брюшная жаба», «висцеральная ангина», «хроническая ишемия кишечника», «ишемическая болезнь органов пищеварения» (Лазебник Л.Б. с соавт., 2003). В МКБ10 АИС или его синонимы не имеют шифра; собственные шифры имеют лишь атеросклероз аорты (I 70.0), аневризма брюшной аорты без упоминания о разрыве (I 71.4), эмболия и тромбоз брюшной аорты (I 74.0), синдром компрессии чревного ствола брюшной аорты (I 77.4), сосудистые болезни кишечника (К 55.0 — острые сосудистые болезни кишечника; К 55.1 — хронические сосудистые болезни кишечника; К 55.2 — ангиодисплазия ободочной кишки; К 55.8 — другие сосудистые болезни кишечника; К 55.9 — сосудистые болезни кишечника неуточненные).
При АИС нарушен кровоток в брюшном отделе аорты и/или в ее непарных висцеральных ветвях, первой из которых является чревный ствол (от него отходят селезеночная, общая печеночная и левая желудочная артерии), второй — верхняя и третьей — нижняя брыжеечные артерии.
Классификация причин АИС представлена на рис. 1.
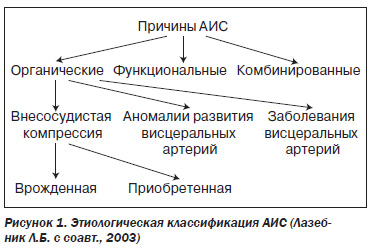
Врожденные факторы компрессии — аномалии отхождения и положения висцеральных ветвей, давление серповидной связки диафрагмы или медиальных ножек диафрагмы (чревный ствол расположен между этими ножками), элементов (ганглиев) солнечного сплетения.
К приобретенным компрессионным факторам относят опухоли, аневризмы брюшной аорты, периартериальный или ретроперитонеальный фиброз, спаечный процесс, давление увеличенных соседних органов (например, головки поджелудочной железы при ее увеличении).
Аномалии развития висцеральных ветвей, приводящие к АИС: аплазия или гипоплазия артерий, фибромускулярная дисплазия, врожденные гемангиомы и свищи.
К развитию АИС приводят заболевания артерий: атеросклероз, неспецифический аортоартериит, посттравматические аневризмы и артериовенозные свищи, артерииты (Калинин А.В. с соавт., 2003).
Особым вариантом АИС считают синдром Лериша, развивающийся при хронической окклюзии бифуркации брюшной аорты и подвздошных артерий, обычно связанный с атеросклеротическим поражением. Обычно при этом синдроме в клинике доминируют проявления ишемии нижних конечностей, однако в некоторых случаях может развиваться ишемия в бассейне нижней брыжеечной артерии (Логинов А.С. с соавт., 2000).
Факторы, вызывающие внесосудистую компрессию артерий, называют экстравазальными; они являются причиной АИС в 10–38 % случаев. Основные этиологические факторы (заболевания, аномалии развития и положения артерий) считают интравазальными; они вызывают АИС в 62–90 % случаев. Причем самой частой причиной АИС является атеросклероз (в 52,2–88,3 % случаев) (Лазебник Л.Б. с соавт., 2003; Логинов А.С. с соавт., 2000).
В патогенезе АИС участвуют нарушение реологических и коагуляционных свойств крови, дислипидемии (особенно типа IIА), интенсификация перекисного окисления липидов (ПОЛ) и т.д. (Лазебник Л.Б. с соавт., 2003).
В патогенезе АИС выделяют 4 стадии (Ойноткинова О.Ш. с соавт., 2001). В первую стадию включаются основные патогенетические факторы с развитием ишемии органов и тканей, нарушениями в дыхательной цепи митохондрий, избытком катехоламинов. Вторая стадия — это стадия развития дефицита АТФ, ингибирования цикла трикарбоновых кислот, гликолиза, АТФзависимых катионных насосов и накопления жирных кислот; в результате формируются существенные изменения в липидном бислое клеточных мембран. Третья стадия — формирование липидной триады (активация липаз, фосфолипаз + активация детергентного действия избытка жирных кислот и лизофосфолипидов на мембраны + активация ПОЛ). Четвертая стадия — некробиоз клеток и тканей.
АИС приводит к морфологическим и функциональным нарушениям всех органов брюшной полости, причем при интравазальной этиологии (при атеросклерозе) изменения обычно выражены в большей степени, чем при экстравазальной. Это объясняют тем, что при атеросклерозе одновременно поражается несколько артериальных бассейнов.
Обращает на себя внимание высокая частота эрозивноязвенных изменений слизистой гастродуоденальной зоны у пациентов с АИС, причем чаще поражается слизистая желудка в антральном отделе и в области малой кривизны. Так, в 44,0 % случаев при АИС выявляют язвы желудка, в 24,8 % случаев — язвы дуоденальной локализации, в 11,1 % случаев — язвы и желудка, и двенадцатиперстной кишки, в 16,5 % случаев — эрозии антрального отдела желудка, в 4,6 % случаев — эрозии в луковице двенадцатиперстной кишки. При этом Helicobacter pylori определяется редко — лишь у трети пациентов (Лазебник Л.Б. с соавт., 2003). Столь частые эрозивноязвенные изменения объясняют снижением продукции и изменением качественного состава желудочной слизи, нарушением ощелачивающей функции антрального отдела желудка. Доминирующим гистологическим признаком при АИС является прогрессирующая атрофия слизистой желудка, преимущественно в антральном отделе, что связано с особенностями васкуляризации и чувствительности к гипоксии. У 78,9 % пациентов с АИС имеет место гипоацидность, у 67,8 % — нарушения моторной и эвакуаторной функций желудка (Лазебник Л.Б. с соавт., 2003; Ойноткинова О.Ш. с соавт., 2001).
При пункционной биопсии печени больных с АИС в подавляющей части случаев определяется жировой гепатоз (обычно крупнокапельный стеатоз), перигепатоцеллюлярный, перипортальный и центральный фиброз, баллонная дистрофия гепатоцитов, умеренно выраженный портальный (перипортальный) гепатит. Частота жировой дистрофии гепатоцитов обусловлена гипер и дислипидемией у больных атеросклерозом как причиной АИС, а также собственно гипоксией печени. У части больных определяется повышение АЛТ, АСТ, щелочной фосфатазы в 1,5–2 раза. В 21,7 % случаев имеет место гипербилирубинемия до 30 мкмоль/л. При тяжелом течении АИС снижается белковосинтетическая функция печени (уменьшение показателей альбуминов, протромбина, фибриногена в крови) (Лазебник Л.Б. с соавт., 2003).
При ишемии тонкой и толстой кишки возможно развитие их инфаркта и гангрены с распространением некроза на все слои кишки. При преходящих нарушениях (синдром исчезающего колита) морфологические изменения касаются только поверхностных слоев слизистой кишки (изъязвления, очаги атрофии и деструкции) (Коломойская М.Б. с соавт., 1986; Лэпедат П., 1975). Для хронического варианта АИС характерны следующие морфологические изменения слизистой оболочки тонкой кишки (Логинов А.С. с соавт., 2000; Парфенов А.И., 2002):
— атрофия ворсин и крипт;
— уменьшение количества крипт;
— уменьшение количества бокаловидных клеток;
— наличие гипопорообразных крипт и извитых ворсин или низких ворсин неправильной формы, участков слизистой с отсутствием ворсин и атрофией крипт.
В результате в 15,0 % случаев развивается мальабсорбция со снижением массы тела вплоть до кахексии, диареей, стеатореей. Важнейшими морфологическими признаками ишемических колитов являются следующие (Лазебник Л.Б. с соавт., 2003):
— частая локализация в селезеночном изгибе;
— поверхностный некроз слизистой с сохранением эпителия крипт на большом протяжении;
— наличие тромбов или сгустков фибрина в мелких артериях;
— макрофаги, нагруженные гемосидерином;
— замещение собственной мышечной пластинки соединительной тканью.
При ишемических колитах страдает моторика толстой кишки: замедляется пассаж содержимого с развитием запоров, метеоризма. Возможно формирование сегментарных стенозов, стриктур толстой кишки (Коломойская М.Б. с соавт., 1986).
Единой классификации АИС не существует. Наиболее рациональна и удобна на практике классификация Л.Б. Лазебника и Л.А. Звенигородской (2003).
Хроническая ишемическая болезнь органов пищеварения
I. Ишемические гастродуоденопатии:
— атрофический гастрит, атрофический дуоденит;
— эрозивный гастрит, эрозивный дуоденит (острый, хронический);
— ишемические язвы желудка, двенадцатиперстной кишки.
Осложнения:
— хроническая ишемическая язва желудка, двенадцатиперстной кишки;
— острое желудочное кровотечение;
— пенетрирующая язва желудка, двенадцатиперстной кишки;
— прободная язва желудка, двенадцатиперстной кишки.
II. Ишемические поражения поджелудочной железы (ишемические панкреатопатии):
— острый ишемический панкреатит;
— хронический ишемический панкреатит;
— липоматоз поджелудочной железы.
Осложнения:
— секреторная и инкреторная недостаточность поджелудочной железы;
— сахарный диабет;
— киста поджелудочной железы;
— склероз поджелудочной железы;
— панкреонекроз.
III. Ишемические поражения печени (ишемические гепатопатии):
— острый ишемический гепатит;
— хронический ишемический гепатит;
— неалкогольный стеатогепатит.
Осложнения:
— фиброз печени;
— цирроз печени;
— печеночноклеточная недостаточность;
— печеночная кома.
IV. Ишемические поражения кишечника (энтероколопатии):
— ишемические энтеропатии (мезентериальная ишемия);
— ишемическая энтеропатия с синдромом нарушенного всасывания;
— хронические ишемические язвы тонкой кишки;
— ишемические колопатии с атрофией слизистой оболочки;
— ишемический колит;
— ишемические язвы толстой кишки.
Осложнения:
— стриктуры толстой кишки;
— острая кишечная непроходимость;
— острое кишечное кровотечение;
— инфаркт кишечника;
— гангрена кишечника;
— каловый перитонит.
Кроме того, выделяют функциональные классы хронической ишемической болезни органов пищеварения (Лазебник Л.Б. с соавт., 2003).
Функциональные классы хронической ишемической болезни органов пищеварения
— первый функциональный класс (ФК I) — выраженной клинической симптоматики нет; характерно отсутствие нарушения кровотока в покое и появление абдоминальной боли лишь после нагрузочной пробы;
— второй функциональный класс (ФК II) — наличие признаков расстройств кровообращения в покое и усиление их после функциональной нагрузки; выраженная клиническая симптоматика: болевой, диспептический синдромы, похудение, нарушение функции поджелудочной железы, дисфункция кишечника;
— третий функциональный класс (ФК III) — выраженные циркуляторные расстройства в покое, постоянный болевой синдром, органические изменения органов пищеварения.
— четвертый функциональный класс (ФК IV) — деструктивные изменения органов пищеварения.
Выделяют три стадии течения АИС: стадия компенсации (клинические проявления отсутствуют), субкомпенсации (симптомы появляются при приеме большого количества пищи), декомпенсации (симптомы постоянны, усиливаются после приема небольшого количества пищи) (Покровский А.В. с соавт., 1980).
Классические клинические проявления АИС складываются из трех симптомов: боли в животе, дисфункции кишечника и похудения (Коломойская М.Б. с соавт., 1986). Боли появляются или усиливаются после приема пищи, так как на высоте пищеварения органы брюшной полости нуждаются в большем притоке крови, который не может быть обеспечен при АИС. В связи с этим возникновение боли зависит не от качества, а от количества пищи, принятой пациентом. Этот момент следует учитывать при дифференциальной диагностике АИС и хронического панкреатита. Вообще, самый частый неправильный диагноз, который ставят больным с АИС, — это «хронический панкреатит», так как при этом заболевании также развиваются боли после еды, которые плохо купируются. Кроме того, диагноз хронического панкреатита сложно объективизировать. Следовательно, при наличии болей в животе после еды при отсутствии явной органической причины, выявляемой традиционными методами визуализации, обычно ставят диагноз хронического панкреатита. В дифференциальной диагностике также важно учитывать, что боли при АИС могут провоцироваться или совпадать с приступами стенокардии, эпизодами подъема или снижения артериального давления. Боли, как правило, не имеют четкой локализации. Их интенсивность может быть различной в зависимости от чувствительности органов пищеварения к ишемии и от степени нарушения кровотока. Нередко по интенсивности боли достигают характера морфинных, что является еще одной причиной сложности дифференциальной диагностики АИС с заболеваниями поджелудочной железы (например, при хроническом панкреатите и особенно при раке поджелудочной железы также имеют место интенсивные, крайне плохо купирующиеся боли). Характер боли также зависит от выраженности сосудистых нарушений (варьирует от чувства тяжести в эпигастрии до ноющих и далее — до жгучих болей) и индивидуальных особенностей висцеральной чувствительности (Калинин А.В. с соавт., 2003). Дисфункция тонкой кишки проявляется неустойчивым стулом или диареей, метеоризмом и прогрессирующей мальабсорбцией, а дисфункция толстой кишки — запорами (Покровский А.В., 1979). Похудение связано с мальабсорбцией, а также с отказом больных от пищи изза боязни появления боли (ситофобии) (Ойноткинова О.Ш. с соавт., 2001; Бураковский В.И. с соавт., 1996). Кстати, ситофобия характерна также для хронического панкреатита, что является еще одной причиной постановки этого неправильного диагноза при АИС.
При объективном исследовании симптомом, позволяющим заподозрить АИС, является систолический шум. Если он выслушивается на 2–4 см ниже мечевидного отростка по срединной линии, то речь идет об атеросклерозе брюшной аорты и/или чревного ствола. Если шум выслушивается ниже — чуть выше пупка, то следует думать о стенозе верхней брыжеечной артерии. Однако этот шум появляется лишь при сужении артерии на 80–90 %. При пальпации могут определяться пульсация и болезненность брюшной аорты (Лазебник Л.Б. с соавт., 2003; Парфенов А.И., 2002).
Рассмотрим особенности клинических проявлений ишемического поражения отдельных органов брюшной полости.
Для ишемических гастродуоденопатий характерна манифестация в виде желудочнокишечного кровотечения, в случае язвенного поражения — отсутствие сезонности обострений. Нередко язвы — гигантские (диаметр более 3 см), длительно не рубцуются (Калинин А.В. с соавт., 2003).
Симптомы ишемической гепатопатии также весьма неспецифичны: тяжесть в правом подреберье, горечь во рту, общая слабость, умеренное увеличение печени. Субиктеричность кожи и склер определяется лишь у пятой части пациентов.
При ишемическом поражении тонкой и толстой кишки чаще, чем при ишемии других органов брюшной полости, развиваются острые проявления (инфаркт, гангрена кишечника, кишечное кровотечение, кишечная непроходимость). Диагностика этих состояний разработана лучше, чем диагностика других вариантов АИС.
Острая мезентериальная ишемия (острое расстройство кровообращения в системе брыжеечных артерий) чаще связана с эмболией артерий, например, тромбом из левого предсердия при митральном стенозе или мерцательной аритмии. При этом развивается инфаркт тонкой кишки. Так, в случае отсутствия коллатерального кровообращения эмболия верхней брыжеечной артерии вызывает некроз практически всей тощей и подвздошной кишки, а также правой половины толстой кишки. Жизнеспособной остается лишь проксимальная часть тощей кишки. При инфаркте кишечника развиваются тяжелые боли в животе и шок, резко нарушается барьерная функция кишки. Развивается расширение кишки в результате увеличенной секреции и резкого ухудшения всасывания воды и электролитов, прекращается перистальтика. Вследствие накопления жидкости в кишке уменьшается объем циркулирующей крови, снижаются сердечный выброс и артериальное давление. Пищеварение и всасывание в тонкой кишке прекращаются, а ее содержимое инфицируется кишечной флорой и само становится источником выраженной интоксикации. Изза повышения проницаемости кишечной стенки жидкость из просвета кишки попадает в брюшную полость, одновременно происходит транслокация кишечной флоры, развивается перитонит (Логинов А.С. с соавт., 2000; Парфенов А.И., 2002).
Хроническая мезентериальная ишемия обычно связана с атеросклерозом верхней брыжеечной артерии и ее ветвей. Поскольку сужение просвета сосудов происходит постепенно, то развивается коллатеральный кровоток. В результате клинические проявления не столь тяжелы, как при острой мезентериальной ишемии. В клинике преобладают боли в животе, особенно на высоте пищеварения, мальабсорбция, похудение. Возможно развитие стриктуры тонкой кишки (Логинов А.С. с соавт., 2000; Парфенов А.И., 2002).
Выделяют 3 клинических варианта ишемического колита: гангренозный, транзиторный и стриктурирующий (Парфенов А.И., 2002). Гангренозная форма проявляется клиникой острого живота с каловым перитонитом, кишечным кровотечением. Транзиторная форма представлена резкими схваткообразными болями в животе с тенезмами, диареей с примесью крови. Эта ситуация может завершиться разрешением или трансформацией в стриктурирующую форму. В первом случае поверхностные эрозии и мелкие кровоизлияния в слизистой кишки исчезают до очередного ухудшения кровоснабжения. Во втором случае изменения распространяются в подслизистую, мышечный слой, затем происходит рубцевание с формированием сегментарных стриктур.
Боли при ишемическом колите чаще локализуются в гипогастрии, сопровождаются запорами, метеоризмом. Частым симптомом является наличие крови в кале. При тяжелом течении прогрессирует частичная кишечная непроходимость, присоединяются недостаточность анального сфинктера и сфинктера мочевого пузыря (Лазебник Л.Б. с соавт., 2003).
При ишемическом поражении органов пищеварения в анамнезе пациентов имеют место различные проявления атеросклероза: ИБС, нарушения мозгового кровообращения, перемежающаяся хромота; нередко пациенты страдают артериальной гипертензией, сахарным диабетом. Кроме того, АИС обычно развивается у больных старше 50 лет.
Диагностика АИС не является сложной, особенно после внедрения в клиническую практику ангиографии и допплеровского исследования сосудов. Проблема состоит в недостаточности знаний врачей об АИС и в связи с этим — с редким назначением обследования, подтверждающего наличие ишемического поражения органов брюшной полости.
Выделяют следующие группы диагностических методов в зависимости от их чувствительности при АИС (Лазебник Л.Б. с соавт., 2003):
I. Анамнез (чувствительность 78 %) — наличие сердечнососудистых заболеваний, облитерирующего эндартериита, метаболического синдрома, сахарного диабета.
II. Пальпация и аускультация брюшной аорты (чувствительность 50–60 %).
III. Инструментальные методы:
— УЗИ (чувствительность 50–75 %);
— допплеровское исследование (чувствительность 80 %);
— КТ (чувствительность 78–82 %);
— ангиография (чувствительность 90–95 %).
План обследования больного с АИС (Лазебник Л.Б. с соавт., 2003)
Оценка клиникобиохимических показателей:
— тщательный сбор анамнеза с выделением групп риска по возможному развитию атеросклеротического поражения висцеральных артерий;
— общеклинический анализ крови, мочи, кала;
— биохимическое исследование крови;
— исследование липидного спектра крови;
— исследование гормонов щитовидной железы;
— исследование ПОЛ;
— исследование показателей свертывающей системы крови.
Оценка гемодинамических показателей висцерального кровотока:
— УЗИ брюшной аорты и ее висцеральных ветвей;
— допплеровское исследование чревного ствола, селезеночной артерии, общей печеночной артерии, верхней и нижней брыжеечных артерий;
— функциональные пробы: пищевая нагрузка, велоэргометрическая проба и др;
— ангиографическое исследование брюшного отдела аорты и ее висцеральных ветвей.
Оценка функциональных и морфологических изменений органов пищеварения:
— ФЭГДС, колоноскопия;
— исследование желудочной секреции, диагностика инфекции Helicobacter pylori;
— исследование функционального состояния поджелудочной железы;
— гистологическое исследование слизистой гастродуоденальной зоны, тонкой, толстой кишки;
— пункционная биопсия печени, определение маркеров вирусной инфекции;
— морфологическое исследование брюшной аорты, чревного ствола, селезеночной артерии, общей печеночной артерии, верхней и нижней брыжеечных артерий (материал, полученный при оперативном лечении).
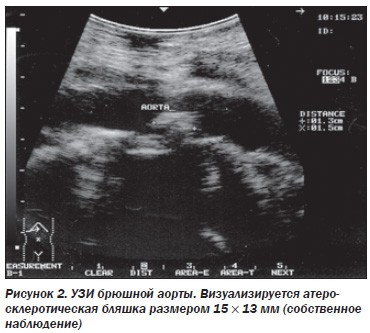
При УЗИ брюшной аорты выявляют изменение ее диаметра, атеросклеротические бляшки и кальцификаты в стенке, неровность и бугристость внутреннего контура (рис. 2).
Допплеровское исследование сосудов позволяет оценить максимальную, минимальную линейные и среднюю скорости кровотока, индексы пульсативности, резистентности, систолодиастолическое соотношение, которые изменяются при атеросклерозе соответствующих сосудов. Выявляют также качественные изменения допплерограмм: ускорение скоростных потоков в систолу и диастолу, прерывистый характер допплерографической кривой, высокие и двугорбые пики, расширенные систолические вершины и др. (Лазебник Л.Б. с соавт., 2003). Для выявления скрытых форм АИС проводят допплеровское исследование с нагрузочными пробами (велоэргометрия, пищевая нагрузка и др.).
Ангиографию следует проводить лишь в сложных случаях и для решения вопроса об оперативном лечении.
Результаты исследования структурных изменений печени, поджелудочной железы неспецифичны. У 60–80 % больных при УЗИ, КТ определяются признаки жировой дистрофии этих органов, холестероз желчного пузыря как проявления липидного дистресссиндрома, одним из компонентов которого является и сам атеросклероз (Савельев В.С. с соавт., 2002).
Особого внимания заслуживают рентгенологические симптомы ишемических поражений толстой кишки (чаще поражаются селезеночный угол и нисходящий отдел; прямая кишка поражается редко в связи с эффективным кровоснабжением из других источников) (Лазебник Л.Б. с соавт., 2003):
— дефекты наполнения различной величины, напоминающие отпечатки пальцев (ранний признак), или так называемый симптом дымящей трубы, или картина псевдополипоза;
— наличие щелевидных участков просветления между контрастным веществом и стенкой кишки, обусловленных сегментарным спазмом ишемизированных участков кишки;
— сегментарные стенозы.
При колоноскопии отмечается наличие синебагровых неправильной формы участков слизистой с отеком и контактной кровоточивостью. Слизистая толстой кишки имеет пестрый вид, определяются эрозии и геморрагии. При тяжелой ишемии формируются язвы различного размера по окружности кишки, стриктуры, особенно в зоне селезеночного угла (Парфенов А.И., 2002).
Основные методы лечения АИС — оперативные; они представлены различными операциями, обеспечивающими реваскуляризацию органов брюшной полости. Плановое хирургическое вмешательство показано при сужении хотя бы одной из висцеральных артерий на 50 % и более (Савельев В.С. с соавт., 1999).
Выделяют 3 группы плановых оперативных вмешательств при АИС (0):
— реконструктивные операции, направленные на ликвидацию окклюзии и восстановление кровотока по прежнему руслу (эндартерэктомия, резекция с протезированием, имплантация);
— операции, направленные на создание новых путей кровотока в обход пораженного участка артерии, — шунтирующие операции (аортоартериальное и межартериальное шунтирование, аортоартериальные и межартериальные анастомозы);
— чрескожная эндоваскулярная ангиопластика окклюзионностенотических поражений брюшной аорты, чревного ствола; лазерная реканализация стенозирующих и окклюзирующих поражений.
При острой мезентериальной ишемии только немедленная лапаротомия и резекция пораженной части кишки (при возможности — эмболэктомия) могут спасти жизнь больного (Лазебник Л.Б. с соавт., 2003; Парфенов А.И., 2002).
Консервативное лечение АИС направлено как на улучшение кровоснабжения органов пищеварения, так и на предотвращение осложнений и отдаление необходимости хирургического вмешательства. Основные направления консервативного лечения АИС следующие (Лазебник Л.Б. с соавт., 2003; Калинин А.В. с соавт., 2003):
— коррекция гипер и дислипидемии для уменьшения прогрессирования атеросклероза;
— антиоксидантные средства;
— антиагрегантная терапия, препараты, уменьшающие вязкость крови;
— сосудорасширяющие средства;
— гипогликемические средства при наличии сахарного диабета;
— симптоматическая терапия, направленная на уменьшение структурных изменений и улучшение функционального состояния органов пищеварения;
— лечение осложнений.
Терапия АИС начинается с лечебного питания в рамках стола № 5 (5п) по М.И. Певзнеру (в зависимости от преимущественного поражения печени или поджелудочной железы).
Рекомендации по питанию больных могут быть следующими:
— 5–6разовый прием пищи;
— ограничение или исключение высококалорийных рафинированных продуктов и блюд (сахара, кондитерских изделий, маргарина, животных жиров, мучных изделий и т.д.);
— источником углеводов должны быть овощи, в том числе немного картофеля (запеченного, отварного);
— липотропные продукты (нежирный творог, гречневая, пшеничная, овсяная каши в умеренном количестве);
— незаменимые компоненты пищи (сезонные овощи, свежие соки, зелень, отвар шиповника, аптечные дрожжи);
— продукты, содержащие полноценный белок (рыба, нежирные сорта мяса, птица, кролик, яйца, творог, молочнокислые продукты);
— продукты функционального питания и пищевые добавки (соевый лецитин, морепродукты, добавки из морских водорослей, спирулина, витаминноминеральные смеси);
— замена животных жиров (кроме рыбьего) растительными — соевым, оливковым, подсолнечным, арахисовым, кукурузным маслами;
— обогащение пищи лецитином, холином, инозитолом, магнием, йодом, витаминами А, В, С, Е;
— обогащение пищевыми волокнами, особенно пектином (хлеб из зерна грубого помола, пшено, капуста, сухофрукты, пшеничные отруби, овощи, фрукты и т.д.).
Необходимо постепенное(!) снижение массы тела у больных с избыточным питанием. Голодание с целью снижения массы тела противопоказано, так как способствует прогрессированию атеросклероза, жировой дистрофии печени (Ивашкин В.Т. с соавт., 2002). Для коррекции гиперлипидемии назначают статины (ловастатин, сумвастатин, флювастатин, оторвастатин и др.), секвестранты желчных кислот (холестирамин, квестран и др.), препараты никотиновой кислоты (ксантинола никотинат, ниацин), фибраты (гемфиброзил, ципрофибрат). При лечении статинами следует помнить об их гепатотоксичности.
Из антиагрегантов рекомендуют тиклопедин, который обладает специфическим ингибирующим действием экзогенной АТФ на тромбоциты. Для улучшения микроциркуляции показан пентоксифиллин (трентал), особенно его новая лекарственная форма — трентал 400. В качестве ангиопротектора и средства, снижающего вязкость крови, назначают доксицил (добезилат кальция). Как антиоксиданты используют токоферол, предуктал, витамины А, С, Е.
При всех вариантах АИС показаны нитраты. Одним из лучших препаратов для лечения АИС является изосорбида5мононитрат 40 или 60. В отличие от изосорбида динитрата, который метаболизируется в печени до активных действующих веществ, изосорбида5мононитрат не проходит этапа метаболизма в печени, обладает стопроцентной биодоступностью. Важно, что изосорбида5мононитрат начинает действовать быстро и в то же время имеет продолжительный эффект — 24 часа. Пролонгированное действие связано с наличием дозирующей мембраны, окружающей каждую микросферу препарата (микросферы заключены в ретардкапсулу), поэтому терапевтическая концентрация в плазме крови удерживается в течение суток. Преимуществами изосорбида5мононитрата являются также хорошая переносимость, прием один раз в сутки, высокая эффективность, минимальный риск развития толерантности, отсутствие синдрома отмены.
Патогенетически обосновано назначение препаратов эссенциальных фосфолипидов. Эссенциальные фосфолипиды тормозят одновременно несколько звеньев патогенеза АИС (Бабак О.Я., 1999; Буеверов А.О. с соавт., 2003; Дегтярева И.И. с соавт., 2002; Гундерманн К.Й., 2002; Гуревич К.Г., 2002; Игнатов В.А., 2002; Нидерау К., 1987; Подымова С.Д., 1999):
— имеют гиполипидемический и гипогликемический эффекты;
— улучшают реологические свойства крови, микроциркуляцию, уменьшают агрегацию тромбоцитов и эритроцитов;
— обеспечивают антиоксидантные свойства мембран, уменьшение образования F2изопростанов;
— защищают мембрану не только гепатоцитов, но и панкреацитов, других клеток от повреждения;
— повышают метаболический, детоксикационный, экскреторный потенциал мембран;
— защищают митохондриальные и микросомальные энзимы от повреждения токсинами;
— обеспечивают функционирование транспортных систем клетки;
— обеспечивают текучесть мембран;
— замедляют синтез коллагена и повышают активность коллагеназы; подавляют трансформацию липоцитов в фибробласты (торможение фиброгенеза);
— тормозят синтез провоспалительных цитокинов;
— имеют иммуномодулирующие свойства (регулируют продукцию антител к неоантигенам;
— влияют на клеточный цикл и клеточную дифференциацию;
— участвуют в синтезе простагландинов;
— эмульгаторы желчи, обеспечивают ее нормальное коллоидное состояние, увеличивают толерантность к пищевым нагрузкам.
Так как при АИС постепенно прогрессируют мальдигестия и мальабсорбция изза снижения желудочной и панкреатической секреции, нарушения продукции кишечных ферментов и всасывания в тонкой кишке, практически всем больным необходимы ферментные препараты для заместительной терапии. Эти препараты показаны не только при ярких клинических проявлениях АИС, но и при так называемом синдроме стареющих органов пищеварения. Этот синдром — тот же АИС, но протекающий без боли, с преобладанием постепенно нарастающего снижения функции органов пищеварения (постепенно появляются и прогрессируют метеоризм, снижение толерантности к пищевым нагрузкам, нарушения стула, дискомфорт в животе после приема пищи, похудение). Золотым стандартом ферментного препарата для заместительной терапии является креон. В зависимости от выраженности мальдигестии и мальабсорбции следует назначать креон 10 000 или креон 25 000. Креон имеет неоспоримые преимущества по сравнению с другими ферментными препаратами. Вопервых, это высокая активность липазы и амилазы при невысокой активности протеаз. Так, креон 10 000 содержит 10 000 Ед FIP липазы, 8000 Ед FIP амилазы и 600 Ед FIP протеаз. Креон 25 000 содержит 25 000 Ед FIP липазы, 18 000 Ед FIP амилазы и 1000 Ед FIP протеаз. Такой оптимальный состав препарата обеспечивается 150 мг панкреатина для креона 10 000 и 300 мг панкреатина для креона 25 000. Следует отметить, что для производства «старого» креона 8000 было необходимо 300 мг панкреатина. Низкая активность протеаз по сравнению с высокой активностью липазы целесообразна в связи с тем, что липаза может расщепляться протеазами ферментного препарата. В то же время сохранение высокой активности липазы является принципиальным для эффективной заместительной терапии (Губергриц Н.Б. с соавт., 2000; Büchler M.W. et al., 2002; Rudmann M.A., 2000).
Ферментный препарат считают эффективным, если соотношение «колипаза/липаза» выше единицы, т.к. дефицит колипазы (кофактора липазы) приводит к снижению активности самой липазы. Эталоном в этом отношении является креон, в котором соотношение «колипаза/липаза» = 1,9. В липолитическую активность ферментных препаратов вносят свой вклад карбоксилэстерлипаза и фосфолипаза А2. Креон — препарат с высоким содержанием последних двух ферментов (Rudmann M.A., 2000).
Чрезвычайно важна форма выпуска ферментных препаратов для заместительной терапии. Необходимо, чтобы препарат был двухоболочечным. При этом капсула, содержащая микросферы, растворяется в кислой среде и высвобождает эти микросферы уже в полости желудка. Этим обеспечивается хорошее смешивание с химусом уже в желудке. Принципиален малый размер микросфер, т.к. необходима их беспрепятственная эвакуация из желудка вместе с химусом. Доказано, что при диаметре микросфер более 2,5 мм микросферы задерживаются в желудке, т.е. развивается асинхронизм химуса и ферментного препарата (Губергриц Н.Б., 2001; Пчелинцев М.В., 2001; Яковенко Э.П., 1998; Bruno M.J., 1995; Büchler M.W. et al., 2002). Креон, являющийся золотым стандартом в заместительной терапии, имеет микросферы диаметром 0,7–1,6 мм, причем у 80 % из них диаметр не превышает 1,25 мм, в связи с чем микросферы креона являются минимикросферами (Rudmann M.A., 2000). Малый размер минимикросфер, кроме адекватного смешивания ферментного препарата с химусом, обеспечивает большую площадь соприкосновения ферментов с пищевым субстратом.
Минимикросферы должны иметь собственную кислотоустойчивую оболочку для сохранения активности ферментов в полости желудка (кислотоустойчивая оболочка креона обеспечивает сохранение 98,6 % активности липазы при прохождении препарата через желудок). В то же время эта оболочка должна быть энтеросолюбильной, т.е. растворяться и освобождать ферменты при рН 5,5–6,0. Именно такой показатель рН характерен для дуоденального просвета, где ферменты и должны вступать в процесс пищеварения. Важным показателем является скорость высвобождения ферментов из минимикросфер при дуоденальном рН. Так, креон обеспечивает высвобождение более 90 % ферментов при рН 5,5 и выше в течение 45 мин, в чем превосходит другие препараты (Rudmann M.A., 2000).
В связи с этими преимуществами креон справедливо признан ферментным препаратом № 1 в мире (Губергриц Н.Б., 2000, 2003; Bruno M.J., 1995; Büchler M.W. et al., 2002; Rudmann M.A., 2000).
Основная цель нашей статьи — обратить внимание практических врачей на проблему АИС, его частоту и наличие реальных возможностей верификации диагноза, назначения правильного лечения. Мы должны помнить о проблеме АИС, изучать его проявления, разрабатывать тактику эффективного лечения. Не случайно Уинстон Черчилль отмечал: «Наши проблемы не исчезнут от того, что мы закроем глаза и перестанем на них смотреть».

