Журнал «» 5 (31) 2013
Вернуться к номеру
Сравнительная эффективность олмесартана и периндоприла по влиянию на центральное артериальное давление и упруго-эластические свойства артерий у пациентов с мягкой и умеренной артериальной гипертензией
Авторы: Сиренко Ю.Н., Рековец О.Л., Кушнир С.Н. - ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины, г. Киев
Рубрики: Семейная медицина/Терапия, Кардиология
Разделы: Клинические исследования
Версия для печати
Введение. Центральное аортальное давление является жестким критерием поражения органов-мишеней и сердечно-сосудистой смертности по сравнению с давлением на плечевой артерии.
Цель. Сравнить эффективность олмесартана и периндоприла по влиянию на снижение центрального аортального давления и улучшение упруго-эластических свойств артерий у пациентов с мягкой и умеренной артериальной гипертензией.
Материалы и методы. Мы проводили наблюдение при участии 40 больных с мягкой и умеренной АГ (20 мужчин, 20 женщин). Все пациенты были разделены на 2 группы — терапии периндоприлом 4 – 8 мг/сутки (n = 20) и олмесартаном 20–40 мг/сутки (n = 20). Если не удавалось достичь целевого уровня артериального давления (АД), добавляли торасемид 5 мг/сутки. Процедура обследования в начале исследования и через 6 месяцев включала в себя измерение офисного систолического (САД) и диастолического (ДАД) артериального давления, суточное мониторирование артериального давления (СМАД), измерение центрального артериального давления, определение скорости распространения пульсовой волны (СРПВ) и оценку уровня липидного спектра крови.
Результаты. Через 6 месяцев терапии произошло значительное снижение офисного систолического и диастолического артериального давления в обеих группах на 30,05/16,25 мм рт.ст. в группе олмесартана и 30,6/16,10 мм рт.ст. в группе периндоприла. Такое выраженное снижение офисного АД можно объяснить тем, что при недостижении целевого уровня АД через 1 месяц к монотерапии добавляли торасемид.
Уровень центрального САД достоверно снизился в обеих группах, в группе олмесартана на 20,13 ± 5,89 мм рт.ст., а в группе периндоприла — на 16,15 ± 4,59 мм рт.ст. Разница в центральном САД была 4 мм рт.ст. В группе олмесартана АIх снизился на 8,13 %, а в группе периндоприла — на 2,6 % (р < 0,05). В обеих группах наблюдалось улучшение упруго-эластических свойств артерий за счет снижения СРПВ по артериям эластического типа. В группе олмесартана СРПВ по артериям эластического типа уменьшилась на 2,43 м/с, в группе периндоприла — на 1 м/с (р > 0,05 между группами, вероятно, в связи с небольшим числом наблюдений). В подгруппах с торасемидом степень снижения цСАД достоверно не отличалась, оно составило 12,43 мм рт.ст. для комбинации олмесартан + торасемид и 13,67 мм рт.ст. для комбинации периндоприл + торасемид. В подгруппе олмесартан + торасемид АIх снизился на 14,4 %, а в подгруппе периндоприл + торасемид не изменился (р < 0,05 между группами). При монотерапии олмесартаном СРПВ по артериям эластического типа снизилась на 2,72 м/с против 0,88 м/с при монотерапии периндоприлом (р < 0,05 между подгруппами).
Вывод. Центральное аортальное давление в обеих группах снизилось достоверно одинаково. При одинаковом снижении офисного АД и АД при СМАД в группе олмесартана индекс прироста АIх достоверно больше снизился как при монотерапии, так и при комбинации с торасемидом по сравнению с группой периндоприла. СРПВ снизилась в обеих группах, но при монотерапии олмесартаном это снижение было достоверно больше по сравнению с монотерапией периндоприлом.
Вступ. Центральний аортальний тиск є жорстким критерієм ураження органів-мішеней та серцево-судинної смертності порівняно з тиском на плечовій артерії.
Мета. Порівняти ефективність олмесартану та периндоприлу щодо впливу на зниження центрального аортального тиску та поліпшення пружно-еластичних властивостей артерій у пацієнтів з м’якою та помірною артеріальною гіпертензією.
Матеріали та методи. Ми проводили спостереження за участі 40 хворих з м’якою та помірною АГ (20 чоловіків, 20 жінок). Усіх пацієнтів було розділено на 2 групи — терапії периндоприлом 4–8 мг/добу (n = 20) та олмесартаном 20–40 мг/добу (n = 20). Якщо не вдавалося досягти цільового рівня артеріального тиску (АТ), додавали торасемід 5 мг/добу. Процедура обстеження на початку дослідження та через 6 місяців включала в себе вимірювання офісного систолічного (САТ) і діастолічного (ДАТ) артеріального тиску, добове моніторування артеріального тиску (ДМАТ), вимірювання центрального артеріального тиску, визначення швидкості поширення пульсової хвилі (ШППХ) та оцінку рівня ліпідного спектра крові.
Результати. Через 6 місяців терапії відбулося значне зниження офісного систолічного та діастолічного артеріального тиску в обох групах на 30,05/16,25 мм рт.ст. у групі олмесартану та 30,6/16,10 мм рт.ст. у групі периндоприлу. Таке виражене зниження офісного АТ можливо пояснити тим, що при недосягненні цільового рівня АТ через 1 місяць до монотерапії додавали торасемід.
Рівень центрального САТ достовірно знизився в обох групах, у групі олмесартану на 20,13 ± 5,89 мм рт.ст., а в групі периндоприлу — на 16,15 ± 4,59 мм рт.ст. Різниця у центральному САТ була 4 мм рт.ст. У групі олмесартану АIх знизився на 8,13 %, а в групі периндоприлу — на 2,6 % (р < 0,05). В обох групах спостерігалось поліпшення пружно-еластичних властивостей артерій за рахунок зниження ШППХ по артеріях еластичного типу. В групі олмесартану ШППХ по артеріях еластичного типу зменшилася на 2,43 м/с, в групі периндоприлу — на 1 м/с (р > 0,05 між групами, ймовірно у зв’язку з невеликим числом спостережень). У підгрупах з торасемідом ступінь зниження цСАТ достовірно не відрізнявся, воно склало 12,43 мм рт.ст. для комбінації олмесартан + торасемід та 13,67 мм рт.ст. для комбінації периндоприл + торасемід. У підгрупі олмесартан + торасемід АIх знизився на 14,4 %, а в підгрупі периндоприл + торасемід не змінився (р < 0,05 між групами). При монотерапії олмесартаном ШППХ по артеріях еластичного типу знизилася на 2,72 м/с проти 0,88 м/с при монотерапії периндоприлом (р < 0,05 між підгрупами).
Висновок. Центральний аортальний тиск в обох групах знизився достовірно однаково. При однаковому зниженні офісного АТ та АТ при ДМАТ в групі олмесартану індекс приросту АIх достовірно більше знизився як при монотерапії, так і при комбінації з торасемідом порівняно з групою периндоприлу. ШППХ знизилась в обох групах, але при монотерапії олмесартаном це зниження було достовірно більшим порівняно з монотерапією периндоприлом.
Introduction. Central aortic pressure is a precise criterion of target organ damage and cardiovascular mortality compared with brachial artery pressure.
Objective. To compare the efficacy of olmesartan and perindopril in reduction of central aortic pressure and improvement of the elastic properties of arteries in patients with mild to moderate arterial hypertension (AH).
Materials and Methods. We carried out an observation including 40 patients with mild to moderate hypertension (20 men, 20 women). All patients were divided into 2 groups — treatment with perindopril 4–8 mg/daily (n = 20) and olmesartan 20–40 mg/daily (n = 20). When the target blood pressure (BP) levels were no achieved torasemide 5 mg/daily was added. The procedure of examination at baseline and after 6 months included office systolic (SBP) and diastolic (DBP) blood pressure measurements, ambulatory blood pressure monitoring (ABPM), central blood pressure measurement, estimation of pulse wave velocity (PWV) and assess the level of blood lipids.
Results. After 6 months of therapy there was a significant reduction in office systolic and diastolic blood pressure levels in both groups by 30.05/16.25 mmHg in olmesartan group and 30.6/16.10 mmHg in perindopril group. Such significant reduction of office BP may be explained by that after 1 month of treatment, in case of target BP levels were not achieved, torasemide was added.
The level of central SBP was significantly decreased in both groups, about 20.13 ± 5.89 mmHg in the olmesartan group and 16.15 ± 4.59 mmHg in perindopril group. The difference in the central SBP levels was 4 mmHg. In olmesartan group АIх decreased by 8.13 % and by 2.6 % in perindopril group (p < 0.05). For both groups it was shown an improvement of elastic properties of arteries due to PWV reduction in elastic arteries. In olmesartan group PWV in elastic arteries decreased by 2.43 m/s and in perindopril group — by 1 m/s (p > 0.05 between groups, probably due to the small number of observations). In torasemide subgroupы сSBP decrease did not significantly differ, it was 12.43 mmHg for combination olmesartan + torasemide and 13.67 mmHg for combination perindopril + torasemide subgroups. In olmesartan + torasemide subgroup АIх decreased by 14.4 %, and in perindopril + torasemide subgroup it did not change (p < 0.05 between groups). In olmesartan monotherapy, PWV in elastic arteries decreased by 2.72 m/s compared to 0.88 m/s in perindopril monotherapy (p < 0.05 between subgroups).
Conclusion. Central aortic pressure in both groups decreased significantly equally. With the same reduction of office BP and BP in ABPM, in olmesartan group АIх decreased significantly both in monotherapy and in combination with torasemide, compared with perindopril group. PWV decreased in both groups, but in olmesartan monotherapy this decrease was significantly greater compared to perindopril monotherapy.
артериальная гипертензия, олмесартан, периндоприл, центральное аортальное давление, скорость распространения пульсовой волны.
артеріальна гіпертензія, олмесартан, периндоприл, центральний аортальний тиск, швидкість поширення пульсової хвилі.
hypertension, olmesartan, perindopril, central aortic pressure, pulse wave velocity.
Из всех существующих факторов риска контроль артериального давления (АД) является наиболее доступным способом профилактики сердечнососудистых заболеваний и смертности. Преимущества блокаторов рецепторов ангиотензина II (АТ II, БРА) в предупреждении сердечнососудистых осложнений по сравнению с другими препаратами известны из исследований LIFE, MOSES, RENAAL, IDNT [14].
Недавние клинические исследования, проведенные с олмесартаном, показали эффективность и преимущества олмесартана по сравнению с плацебо в достижении целевых уровней артериального давления, значительное и достоверное снижение систолического (САД) и диастолического АД (ДАД) как при офисном измерении, так и при суточном мониторировании. Частота побочных эффектов олмесартана в данных исследованиях была сравнима с плацебо [24]. В отличие от ингибиторов ангиотензинпревращающего фермента (АПФ), которые имеют риск развития кашля, и антагонистов кальция, которые могут вызвать периферические отеки, олмесартан практически не имел данных побочных эффектов [30, 38].
В экспериментальных исследованиях показано, что блокада рецепторов к АТ II связана с ремоделированием малых и крупных артерий. Эти эффекты осуществляются благодаря определенным механизмам — противовоспалительному эффекту и изменению связывания d51интегрина с фибронектином [12, 27]. Это приводит к уменьшению жесткости артерий независимо от влияния на АД. G.M. London et al. и E. Agabitirosei et al. в своих исследованиях показали, что блокада ангиотензина II улучшает структуру малых резистивных сосудов и уменьшает отражение пульсовой волны [6, 19]. В исследовании Y. Matsui et al. комбинация олмесартана с азелнидипином обеспечивала более выраженное уменьшение скорости распространения пульсовой волны (СРПВ) по артериям эластического типа, которое не зависело от степени снижения среднего АД по сравнению с комбинацией олмесартана с гидрохлортиазидом (ГХТ) [23]. В исследовании EXPLOR показано, что комбинация валсартана с амлодипином при одинаковом снижении АД на плечевой артерии приводила к более выраженному уменьшению центрального САД и индекса аугментации (АIx) по сравнению с комбинацией атенолола с амлодипином [10]. Эти изменения сохранялись и при стандартизации по частоте сердечных сокращений (ЧСС). Авторы объяснили эти отличия разным изменением тонуса артерий. Большая вазодилатация обеспечивала большее положительное влияние на скорость распространения пульсовой волны.
Увеличение артериальной жесткости связано с развитием и прогрессированием хронического заболевания почек [12]. Эффект олмесартана на оксидативный стресс был подтвержден в клинических исследованиях у пациентов с сахарным диабетом [14]. Недавнее исследование показало, что олмесартан уменьшает вероятность развития микроальбуминурии у пациентов с сахарным диабетом 2го типа [14]. Было проведено экспериментальное исследование, в котором показано, что антиоксидантные свойства олмесартана коррелировали с артериальной жесткостью. На фоне приема олмесартана уменьшалось общее периферическое сопротивление. Олмесартан защищает эндотелиальные клетки от повреждения окислением липопротеинов низкой плотности.
Олмесартан характеризуется быстрым и эффективным снижением АД, длительностью действия и хорошей переносимостью. Y. Chuang et al. показали, что любое АД, включая аортальное САД и ДАД и среднее аортальное давление, значительно повышено при сниженной функции почек в эксперименте на животных. Олмесартан продемонстрировал значительное снижение АД, особенно аортального. Авторы считают, что это может быть связано с вазодилатирующими свойствами олмесартана посредством влияния на рецепторы ангиотензина II 1го типа [12]. Уменьшение сердечного выброса и увеличение среднего аортального давления связано с увеличением общего периферического сопротивления в эксперименте на животных со сниженной функцией почек. Олмесартан в этом исследовании уменьшал общее периферическое сопротивление на 28,3 %.
Данные исследования Strong Heart Study подтверждают, что у пациентов с высоким риском центральное пульсовое давление (цПД) имеет преимущества над пульсовым давлением на плечевой артерии как предиктор возникновения сердечнососудистых событий. Так, цПД > 50 мм рт.ст. было независимым предиктором возникновения кардиоваскулярных событий. В исследовании EXPLOR и CAFE продемонстрированы положительные эффекты ингибиторов АПФ, блокаторов рецепторов ангиотензина II и антагонистов кальция на снижение центрального аортального давления в сравнении с атенололом [10, 39].
Согласно Европейским рекомендациям 2013 года по лечению артериальной гипертензии, одними из наиболее перспективных комбинаций являются комбинация блокаторов рецепторов АТ II с антагонистом кальция или комбинация блокаторов рецепторов АТ II с диуретиком. В большинстве исследований, в которых показана эффективность БРА, применялась именно такая комбинация [1]. В исследовании LIFE лечение комбинацией лозартана с гидрохлортиазидом в отличие от комбинации атенолола с ГХТ привело к достоверному снижению частоты возникновения первичного инсульта, кардиоваскулярных событий, смертности, частоты возникновения пароксизмов фибрилляции предсердий. Степень снижения АД в группах лечения была практически одинаковой. Был отмечен более выраженный регресс гипертрофии ЛЖ, улучшение эластических свойств артерий, уменьшение гипертрофии резистивных сосудов, улучшение функции эндотелия [14].
В исследовании Yoshio Matsui et al. было показано, что блокада ангиотензина II олмесартаном может в значительной степени способствовать независимому снижению центрального пульсового давления и жесткости аорты. Те же механизмы не наблюдались при блокаде антагонистами кальция. Так, центральное АД в группе олмесартан/азелнидипин снижалось намного лучше (со 143,8 ± 17,5 мм рт.ст. до 119,9 ± 18,4 мм рт.ст.) по сравнению с группой олмесартан/гидрохлортиазид (со 145,1 ± 19,5 мм рт.ст. до 125,1 ± 21,4 мм рт.ст., р < 0,05 между группами), несмотря на то, что не было разницы в снижении офисного АД. СРПВ в группе олмесартан/азелнидипин уменьшалась значительно больше (с 10,2 ± 2,0 мм рт.ст. до 8,9 ± 1,9 мм рт.ст., n = 103), чем в группе олмесартан/гидрохлортиазид (с 10,3 ± 2,2 мм рт.ст. до 9,7 ± 2,2 мм рт.ст., n = 104, р < 0,001 между группами). Также индекс аугментации в группе олмесартан/азелнидипин снижался более (с 31,7 ± 6,3 % до 25,4 ± 7,5 %), нежели в группе олмесартан/гидрохлортиазид (с 31,4 ± 6,8 % до 28,2 ± 7,9 %, р < 0,001 между группами) [22, 34]. Авторы показали, что снижение АIх, СРПВ играет значительную роль в снижении центрального АД в группе олмесартан/азелнидипин.
Блокада АТ II улучшала или даже нормализовала структуру мелких резистивных артерий и в то же время уменьшала давление отраженной волны, что указывает на причинноследственную связь между двумя этими факторами. Исследования на животных и людях показывают, что блокада АТ II связана с обратным ремоделированием как малых, так и крупных артерий благодаря противовоспалительному действию [2, 3, 30].
Целью нашего исследования было изучить влияние блокатора рецепторов ангиотензина II олмесартана по сравнению с ингибитором АПФ периндоприлом на упругоэластические свойства артерий и степень снижения центрального АД по сравнению с АД на плечевой артерии у пациентов с мягкой и умеренной артериальной гипертензией.
Материалы и методы
В исследование были включены 40 пациентов с мягкой и умеренной артериальной гипертензией согласно классификации ВОЗ (1999), соответствующие критериям включения.
Критерии включения пациентов в исследование: мужчины и женщины старше 18 лет; эссенциальная артериальная гипертензия — уровень офисного САД на момент включения более или равен 140 мм рт.ст. и менее 180 мм рт.ст., уровень офисного ДАД более или равен 90 мм рт.ст. и менее 110 мм рт.ст., а также отсутствие критериев исключения.
Критерии исключения: гипокалиемия менее 3,5 ммоль/л, вторичная артериальная гипертензия, острая сердечная недостаточность, нарушения ритма сердца (фибрилляция предсердий, тахикардия — ЧСС более 100 уд/мин, нарушение атриовентрикулярной проводимости, синдром слабости синусового узла), ревматические и неревматические пороки сердца, беременность и лактация, бронхиальная астма, декомпенсированные заболевания печени (АСТ, АЛТ выше верхней границы нормы в 3 раза), острая или хроническая почечная недостаточность (уровень креатинина крови ≥ 133 мкмоль/л для мужчин и 124 мкмоль/л — для женщин), инфаркт миокарда или острое нарушение мозгового кровообращения в анамнезе, сердечная недостаточность выше II функционального класса (согласно НьюЙоркской классификации), наличие стенокардии напряжения III–IV функционального класса, сахарный диабет, ожирение (индекс массы тела (ИМТ) более 35 кг/м2), состояние после хирургического вмешательства, прием стероидных и нестероидных противовоспалительных средств, невозможность отмены предыдущей антигипертензивной терапии, сколиоз, участие в другом исследовании.
Всем пациентам в начале и на этапах исследования проводили измерение офисного САД, ДАД, ЧСС, суточное мониторирование АД (СМАД), определение скорости распространения пульсовой волны по артериям мышечного типа (СРПВм) и эластического типа (СРПВэ), определение центрального САД, биохимическое исследование крови. Исследование липидного обмена включало определение общего холестерина крови (ХС), триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛПВП), холестерина липопротеидов низкой плотности (ХС ЛПНП), холестерина липопротеидов очень низкой плотности (ХС ЛПОНП), индекса атерогенности (ИА). Уровни общего ХС, ТГ, ЛПВП определяли на аппарате Еxpresspluss 550 (Bayer, Германия) с использованием реактивов PLIVALachema (Хорватия) по стандартной методике. Содержание ХС ЛПНП и ХС ЛПОНП рассчитывали по стандартной методике. Также определяли уровни глюкозы и креатинина в сыворотке крови.
Измерение офисного САД и ДАД проводили ртутным сфигмоманометром в положении сидя после 10 минут покоя три раза с интервалом 2 минуты. Определяли среднее из трех измерений. ЧСС определяли после второго измерения. Индекс массы тела определяли по формуле: ИМТ (кг/м2) = вес/(рост · рост).
Суточное мониторирование артериального давления проводилось с помощью аппаратов АВРМ04М (фирма «Медитек», Венгрия). Стандартная взрослая манжетка накладывалась на среднюю часть плеча. Монитор активировался каждые 15 мин в дневное время (06:00–22:00) и каждые 30 мин в ночное время (22:00–06:00). Анализ полученных данных с вычислением изучаемых показателей проводился с использованием программного обеспечения данного аппарата. Рассчитывались суточные показатели: среднесуточные, среднедневные и ночные САД, ДАД, среднее АД (СрАД), пульсовое АД (ПАД), ЧСС, индексы вариабельности (Ст.от.) САД, ДАД, СрАД, ЧСС, суточный индекс (СИ) САД, ДАД — процент снижения ночного АД по сравнению с дневным. Определяли временной индекс (Вр.ин.) САД, ДАД, который характеризует временную перегрузку давлением в течение суток и определяется как процент измерений АД, превышающего 140/90 мм рт.ст. днем и 120/80 мм рт.ст. в ночное время; индекс нагрузки давлением (Инд.площ.) САД, ДАД, площадь между кривой повышенного АД и линией границы нормы. Вариабельность АД вычисляли как стандартное отклонение величины АД.
СРПВ и центральное АД определяли на аппарате SphygmocorPVx (AtCor Medical SCORCvMS 8.0, Австралия). Пьезодатчик устанавливали на правой общей сонной артерии, лучевой артерии правого предплечья под визуальным (на мониторе) и автоматическим контролем качества, осуществляемым прибором. СРПВ, время запаздывания пульсовой волны, центральное АД определяли автоматически с помощью программного обеспечения прибора после введения величины расстояния между датчиками, которая измерялась сантиметровой лентой. Для оценки упругоэластических свойств артерий эластического типа СРПВэ определяли на сегменте сонная артерия — бедренная артерия, для оценки упругоэластических свойств артерий мышечного типа — на сегменте сонная артерия — лучевая артерия. Центральное АД определяли с помощью программного обеспечения прибора на основе АД на плечевой артерии и формы пульсовой волны в восходящей аорте (формула определена производителем оборудования, проведена стандартизация при интрааортальном измерении АД). Метод аппланационной тонометрии, на котором основана работа SphygmocorPVx, позволяет получить кривую периферической пульсовой волны. При анализе кривой получали центральное систолическое АД (цСАД), индекс прироста — АIх и время изгнания (ЕТ).
После семидневного периода отмены антигипертензивных препаратов и первоначального обследования методом конвертов пациенты были распределены на 2 группы в зависимости от назначенной антигипертензивной терапии.
Первая группа — пациентам назначался периндоприл в дозе 4–8 мг один раз в день.
Вторая группа — пациентам назначался олмесартан (Кардосал производства компании «БерлинХеми», Германия) в дозе 20–40 мг один раз в день.
При недостижении на протяжении первого месяца лечения целевых уровней офисного АД (< 140/90 мм рт.ст.) к терапии добавлялся торасемид (Трифас производства компании «БерлинХеми», Германия) в дозе 5 мг один раз в день.
В процессе наблюдения пациенты не меняли свой обычный режим питания и физической активности. Все вышеперечисленные исследования пациентам были проведены в начале и в конце периода наблюдения.
Статистическая обработка проведена на персональном компьютере. На основании полученных данных была создана база данных в системе Microsoft Exсel. Обработка результатов осуществлялась с помощью пакета анализа в системе Microsoft Exсel и программы SPSS 13.0. Достоверность полученных данных вычислялась методом парного двухвыборочного теста с использованием критерия t Стьюдента для средних величин или использовали двухвыборочный независимый tтест для средних величин в группах с непараметрическим распределением (метод MannWhitney) после определения характера распределения. Проводили корреляционный анализ по методу Spearmen.
Результаты
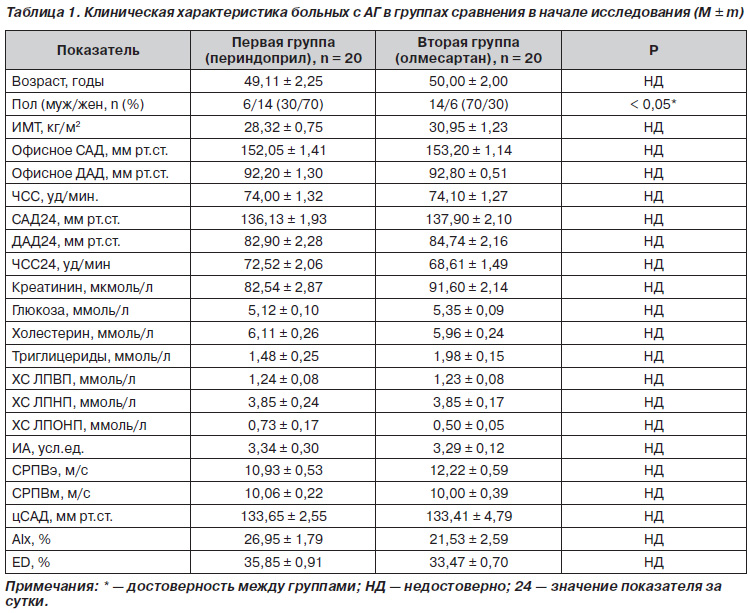
Работа основана на результатах обследования 40 пациентов с мягкой и умеренной артериальной гипертензией, из них 20 (50 %) — мужчины и 20 (50 %) — женщины, прошедшие полное первичное и повторное обследование на фоне приема терапии. В первую группу, получавшую терапию периндоприлом, вошли 20 пациентов (6 мужчин и 14 женщин). Во вторую группу, принимавшую олмесартан, вошли 20 пациентов (14 мужчин и 6 женщин). Обе группы пациентов исходно были однородными и сопоставимыми по основным клиническим, биохимическим показателям и по данным СМАД (табл. 1).
Средний возраст пациентов составил 49,22 ± 1,54 года. Средняя масса тела — 84,27 ± 2,50 кг. Средний ИМТ составил 29,60 ± 0,73 кг/м2. Средние исходные цифры офисного САД и ДАД составили 152,63 ± 0,90 мм рт.ст. и 92,50 ± 0,69 мм рт.ст. соответственно. Средняя офисная ЧСС — 74,05 ± 0,90 уд/мин. Средние цифры при амбулаторном мониторировании АД составили для САД 137,01 ± 1,41 мм рт.ст., для ДАД — 83,82 ± 1,56 мм рт.ст. Среднесуточная ЧСС — 70,57 ± 1,29 уд/мин. Исходно между группами отличалось только количество мужчин и женщин в каждой группе. Так, в группе периндоприла соотношение мужчины/женщины было 30 % мужчин и 70 % женщин, а в группе олмесартана наоборот — 70 % мужчин и 30 % женщин.
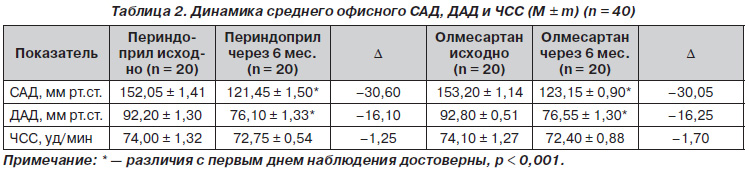
Динамика офисного АД и ЧСС представлена в табл. 2.
В обеих группах к концу периода наблюдения происходило достоверное снижение офисного САД и ДАД, которое составило 30,6/16,10 мм рт.ст. в группе периндоприла и 30,05/16,25 мм рт.ст. в группе олмесартана. Офисная ЧСС достоверно не изменилась. Такое значительное снижение офисного АД можно объяснить тем, что к монотерапии добавлялся второй препарат торасемид при недостижении целевого уровня АД через 1 месяц терапии. В обеих группах наблюдения около 30 % пациентов принимали комбинацию с торасемидом 5 мг (6 пациентов в группе периндоприла и 7 пациентов в группе олмесартана). Достижение целевых уровней АД к концу лечения составило 95 % в группе олмесартана и 85 % в группе периндоприла. Разница между группами по достижению целевых уровней АД была недостоверной. Таким образом, оба препарата были одинаково эффективны в снижении офисного АД.
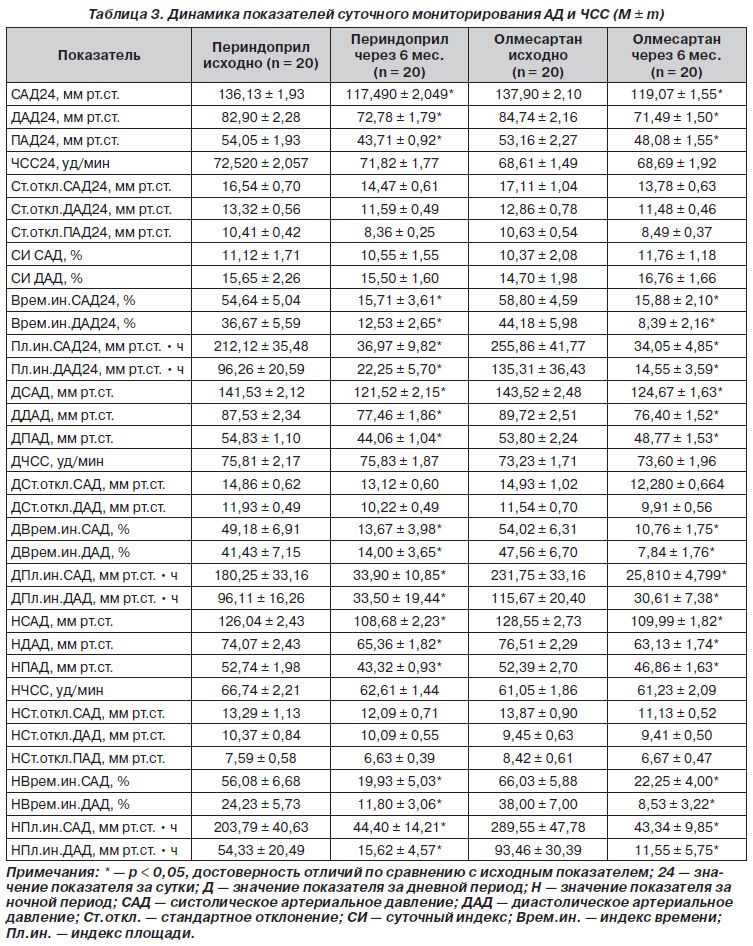
Динамика показателей 24часового амбулаторного мониторирования представлена в табл. 3. На фоне проводимой терапии происходило достоверное уменьшение среднесуточного САД на 18,64 (в группе периндоприла) и 18,82 (в группе олмесартана) мм рт.ст. и ДАД на 10,11 и 13,25 мм рт.ст. соответственно. Среднесуточная ЧСС достоверно не изменилась в группах наблюдения. Эффективность лечения в обеих группах подтверждалась достоверным снижением временного индекса для САД и ДАД, индекса нагрузки давлением для САД и ДАД. Обе схемы лечения достоверно не влияли на суточный профиль АД — СИ достоверно не изменился ни в одной группе. Дневное САД и ДАД, ночное САД и ДАД, как и САД24 и ДАД24, достоверно снизились в обеих группах через 6 месяцев терапии. Отмечалось также снижение ПАД24, ПАД за дневной и ночной периоды в обеих группах лечения. Снижение ПАД может косвенно свидетельствовать об улучшении упругоэластических свойств аорты [36].
Достижение целевых уровней АД при суточном мониторировании составило 90 % в обеих группах. Все это, а также аналогичные однонаправленные изменения соответствующих дневных и ночных показателей СМАД, динамика которых представлена в табл. 3, свидетельствовало об адекватности проводимой антигипертензивной терапии [4, 15, 33].
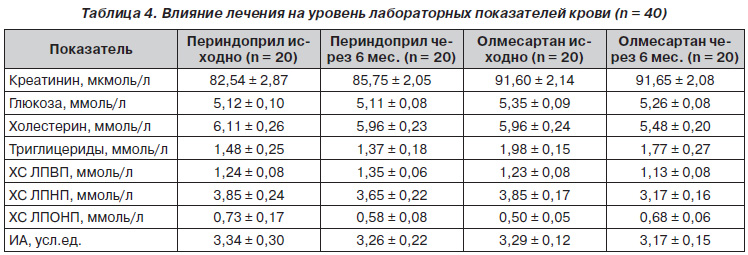
Влияние лечения на биохимические показатели представлено в табл. 4. Как видно из таблицы, нами не отмечено достоверных различий по влиянию периндоприла и олмесартана на уровни глюкозы, липидного спектра и креатинина крови.
Развитие гипертонической болезни сопровождается структурнофункциональной перестройкой сердечнососудистой системы, включая различные сегменты сосудистого русла. Наиболее простым методом оценки упругоэластических свойств артерий является определение скорости распространения пульсовой волны. СРПВ — независимый фактор риска сердечнососудистой смертности. Уменьшение СРПВ на 1 м/с приводит к снижению общей смертности на 29 % [8, 16]. Производят анализ основных показателей, характеризующих кривую пульсовой волны. Индекс прироста АIх — это один из них. Это отношение (в процентах) разности между вторым и первым систолическим пиком кривой пульсовой волны к пульсовому АД (ПАД). Оно может быть с отрицательным значением, преимущественно у молодых людей с эластичными сосудами. АIх увеличивается при повышении среднего АД, уменьшается при увеличении ЧСС, отрицательно коррелирует с ростом человека. Независимо от уровня АД индекс прироста повышается с возрастом, у пациентов с гиперхолестеринемией, сахарным диабетом 1го типа.
В связи с этим наиболее перспективным в данный момент направлением является проведение дальнейших исследований по влиянию медикаментозной терапии на показатели СРПВ, центральное пульсовое и центральное аортальное давление как с точки зрения ранней диагностики повреждения органовмишеней, так и с целью разработки в дальнейшем методов профилактики сердечнососудистых осложнений.
По данным клинических наблюдений, систолическое, диастолическое, пульсовое АД изменяется в течение жизни [9, 18]. САД и ПАД, которые определяются жесткостью крупных артерий, отражением пульсовой волны, увеличиваются с возрастом постоянно. Изменения жесткости крупных артерий и обусловливают изменения САД, ДАД и ПАД у пациентов после 50 лет. Эластичность сосудов зависит от структуры стенки и от давления растягивания, которое определяется средним АД [2, 3, 31]. Чем выше среднее АД, тем более растянуты артерии и тем меньше они могут растягиваться еще сильнее во время сердечного выброса. Исходя из данных клинических исследований, именно центральное САД и ПАД в большей мере определяют прогноз, чем АД на плечевой артерии [20, 32].
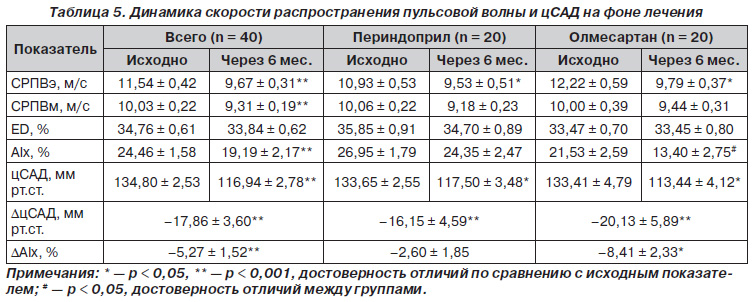
Динамика показателей центрального АД и упругоэластических свойств артерий на фоне лечения в группах больных представлена в табл. 5. В группах лечения отмечалось достоверное снижение цСАД в среднем на 17,86 ± 3,60 мм рт.ст. Уровень цСАД достоверно снизился в обеих группах, но в группе олмесартана это снижение было более выраженным, хотя и недостоверным по сравнению с группой периндоприла, и составило 20,13 ± 5,89 мм рт.ст. и 16,15 ± 4,59 мм рт.ст. соответственно. Разница в достижении цСАД составила 4,0 мм рт.ст. (р > 0,05). Недостоверность между группами, повидимому, связана с небольшим числом наблюдений.
Таким образом, при одинаковом снижении АД на плечевой артерии в обеих группах в группе олмесартана происходило большее снижение цСАД и достижение на 4,0 мм рт.ст. меньшего уровня цСАД по сравнению с группой периндоприла. В группе олмесартана отмечалось достоверное уменьшение индекса прироста АIх на 8,13 %, что достоверно отличалось от группы периндоприла, где снижение АIх составило 2,6 %, хотя и было недостоверным (повидимому, в связи с небольшим числом наблюдений). В сумме в обеих группах наблюдения снижение АIх было достоверным и составило 5,27 %.
Нами отмечено также улучшение упругоэластических свойств артерий за счет снижения СРПВ в обеих группах по артериям как эластического, так и мышечного типа. Достоверно уменьшалась СРПВ по артериям эластического типа в обеих группах наблюдения. Так, в группе олмесартана выявлено достоверное снижение СРПВ по артериям эластического типа на 2,43 м/с. В группе периндоприла снижение СРПВэ тоже наблюдалось (хоть и в меньшей степени) — на 1 м/с. Уменьшение АД снижает давление растягивания и тем самым уменьшает СРПВ, что и наблюдалось в нашем исследовании. В обеих группах СРПВ по артериям мышечного типа имела тенденцию к снижению, и, как результат, достоверное снижение наблюдалось в общем по группам за счет большего числа наблюдений. Нами не отмечено существенных отличий в динамике ED в обеих группах.
Терапия на основе олмесартана и периндоприла не потребовала отмены препарата ни в одной из групп.
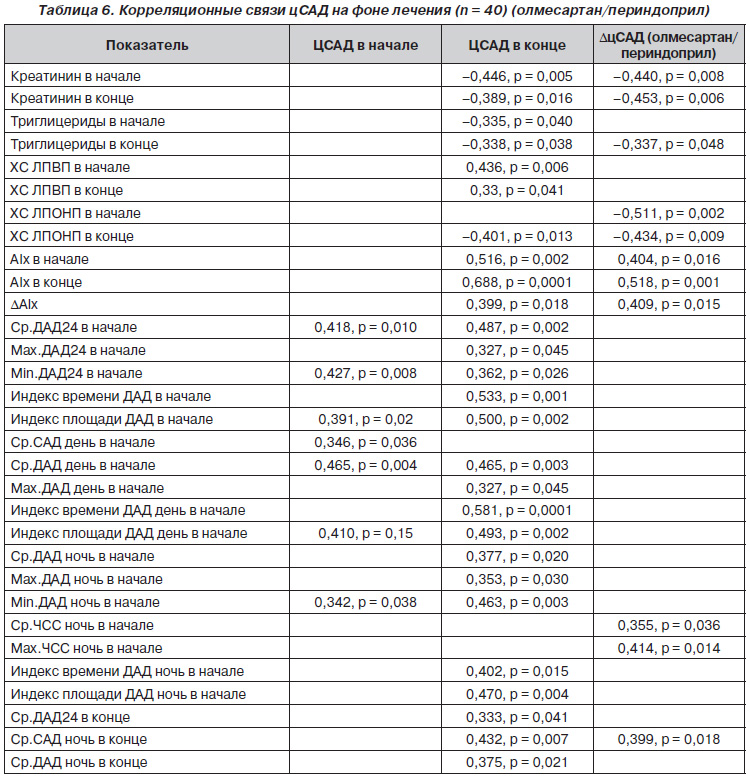
Мы попытались определить факторы, которые могут быть связаны с центральным САД и степенью его снижения в общей группе обследованных. Корреляционный анализ проводили по Spearman. Данные представлены в табл. 6.
В начале исследования цСАД высокодостоверно коррелировало с уровнем диастолического давления при суточном мониторировании. Причем эта корреляция прослеживалась как за 24часовой период, так и в дневной период. ЦСАД вначале коррелировало и с САД в дневной период. В конце исследования цСАД достоверно коррелировало с АIx в начале, в конце а также с динамикой АIx на фоне терапии, то есть с показателем, характеризующим упругоэластические свойства артерий. Кроме того, при более высоком ДАД за 24часовой период, за дневной период, за ночной период, индексе нагрузки давлением и индексе нагрузки площадью ДАД как за 24часовой период, так и за дневной и ночной периоды отмечалось и более высокое цСАД. Чем выше был ХС ЛПВП в начале и в конце исследования, тем лучше снижалось цСАД в конце исследования.
Степень снижения цСАД (цСАД) обратно коррелировала с уровнем креатинина крови в начале и в конце исследования: чем выше был креатинин, тем меньше снижалось цСАД. Чем выше был уровень триглицеридов крови, ХС ЛПОНП в начале и в конце исследования, тем меньше снижалось цСАД в конце исследования. Степень снижения цСАД обратно коррелировала с ЧСС в ночное время в начале исследования: чем большей была ЧСС в ночное время в начале исследования, тем большей была степень снижения цСАД. Что подтверждается данными исследования ASCOT. В этом исследовании выявлено, что уровень цСАД на фоне лечения связан с ЧСС: чем меньше была ЧСС, тем больше было цСАД. Уменьшение ЧСС, согласно исследованию ASCOT, на 10 уд/мин способствует повышению цСАД на 3 мм рт.ст. и АIx на 2,5 % [13].
Таким образом, цСАД связано с уровнем ДАД, САД и ЧСС, измеренными при суточном мониторировании, уровнем креатинина, триглицеридов крови, ХС ЛПОНП и АIх, характеризующим жесткость сосудов. Независимо от уровня АД индекс прироста АIх повышается с возрастом и у пациентов с гиперхолестеринемией [21, 29]. Во многих клинических проспективных исследованиях (ASCOT, SEARCH, FIELD и других) изучалось прогностическое значение АIх. Прирост величины индекса на 10 % сопровождается увеличением риска возникновения сердечнососудистых событий в 1,28 раза независимо от других факторов риска [13, 25]. При этом у пациентов с конечной стадией почечной недостаточности влияние индекса прироста на прогноз не зависело от величины СРПВ [16].
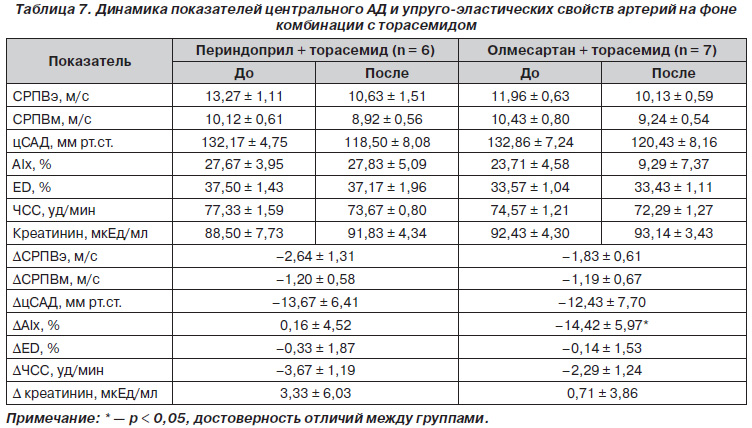
Так как наши пациенты частично были на комбинированной терапии с торасемидом, мы проанализировали эту группу пациентов в плане влияния на показатели, характеризующие упругоэластические свойства артерий. Так, динамика СРПВ как по артериям эластического типа, так и по артериям мышечного типа достоверно не отличалась между подгруппами олмесартан + торасемид и периндоприл + торасемид. Также не отличалась и степень снижения цСАД между подгруппами, она составила в подгруппе олмесартан + торасемид 12,43 мм рт.ст. и в подгруппе периндоприл + торасемид — 13,67 мм рт.ст. Однако нами отмечены достоверные отличия в динамике индекса прироста между подгруппами. Так, в подгруппе олмесартан + торасемид наблюдалось значительное уменьшение этого показателя на 14,4 %, тогда как в подгруппе периндоприл + торасемид он практически не изменился. Также не было отличий и в изменении ЧСС, креатинина, ED. Данные представлены в табл. 7.
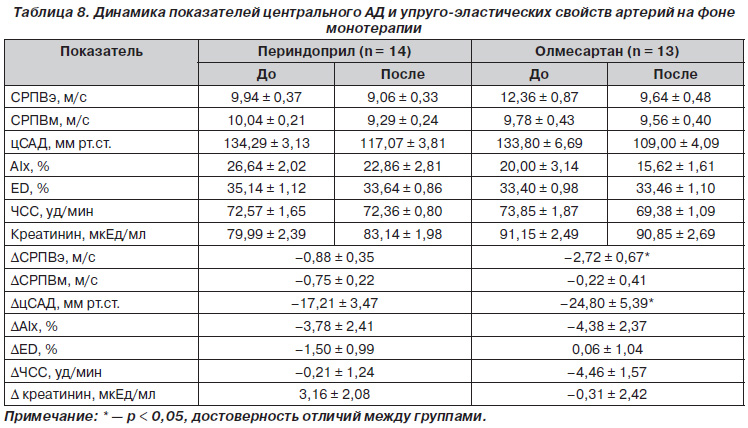
В подгруппе монотерапии олмесартаном СРПВэ более выраженно снижалась по сравнению с подгруппой периндоприла — 2,72 против 0,88 м/с, причем эта разница была достоверной. СРПВм несколько уменьшилась в обеих подгруппах. Наблюдались отличия в динамике цСАД. Так, в подгруппе олмесартана достоверно больше снижалось цСАД — на 24,80 мм рт.ст. по сравнению с подгруппой периндоприла — на 17,21 мм рт.ст., несмотря на то что уровень ЧСС на фоне монотерапии олмесартаном снизился на 4,46 уд/мин. А мы знаем, что при уменьшении ЧСС увеличивается цСАД. Таким образом, снижение ЧСС при монотерапии олмесартаном не вызвало более выраженного снижения цСАД по сравнению с терапией периндоприлом. Уровень ЧСС, креатинина, ED достоверно не изменился в обеих подгруппах. Данные представлены в табл. 8.
Почему именно торасемид был выбран в нашем исследовании в качестве второго препарата? С появлением торасемида — петлевого диуретика нового поколения с уникальным спектром фармакологических эффектов — произошло расширение перечня показаний к использованию петлевых диуретиков у больных АГ. Для терапии АГ более целесообразно использовать дозы торасемида 2,5 и 5 мг, вызывающие длительное антигипертензивное действие без заметного увеличения суточной экскреции натрия и воды с мочой. Субдиуретические дозы торасемида не вызывают феномена рикошета, практически не влияют на плазменный уровень калия, не нарушают пуриновый, углеводный и липидный метаболизм. В плацебоконтролируемом исследовании F. Kruck et al. назначение 2,5 мг/сут торасемида и 25 мг/сут хлорталидона приводило к одинаковому снижению САД и ДАД [17]. Хотя в нашей практике мы используем и дозы 10 мг торасемида, в основном для лечения пациентов с резистентной АГ. В исследовании I. Achhammer et al. у 147 больных с АГ (ДАД 95–114 мм рт.ст.) сравнивалась антигипертензивная эффективность торасемида в дозах 2,5 и 5 мг/сут и плацебо. В группе плацебо снижение ДАД менее 90 мм рт.ст. было зарегистрировано у 28 % пациентов, на фоне приема торасемида в дозе 2,5 мг/сут — у 46 % больных, на фоне приема препарата в дозе 5 мг/сут — у 50 % пациентов [5]. Снижение САД и ДАД на фоне приема низких доз торасемида составляет в среднем 15–20/10–15 мм рт.ст. Сравнение эффективности торасемида в дозе 2,5 мг/сут или гидрохлортиазида в дозе 25 мг/сут, проведенное A. Reyes et al., показало сопоставимое влияние препаратов на уровень АД. При этом у пациентов, принимавших гидрохлортиазид, наблюдалось достоверное снижение уровня калия в плазме крови с 4,4 ± 0,5 до 3,7 ± 0,4 ммоль/л и увеличение уровня глюкозы, отсутствующее в группе торасемида [28].
Важным отличием торасемида от других диуретиков является антигипертензивная эффективность, обеспечивающая постепенное стабильное снижение АД, на фоне отсутствия выраженного влияния на электролитный, пуриновый, углеводный и липидный обмен [5]. Благодаря этим качествам длительная терапия торасемидом не требует дополнительного назначения калийсберегающих препаратов или солей калия, контроля за содержанием электролитов, мочевой кислоты, глюкозы и холестерина в плазме крови. Именно поэтому применение торасемида в низких дозах в качестве монотерапии и в комбинации с другими антигипертензивными препаратами разрешено для длительного лечения АГ 6м и 7м докладами JNC (the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure) [15].
Таким образом, применение олмесартана и периндоприла как в качестве монотерапии, так и в комбинации с торасемидом у пациентов с мягкой и умеренной АГ на протяжении 6 месяцев обеспечило выраженную антигипертензивную эффективность проводимого лечения при хорошей переносимости и удобном однократном приеме. Олмесартан в монотерапии был более эффективен в плане снижения центрального АД и улучшения упругоэластических свойств артерий по сравнению с монотерапией периндоприлом.
Дискуссия
В нашем исследовании было выявлено более выраженное снижение центрального аортального давления на фоне приема олмесартана в качестве монотерапии по сравнению с монотерапией периндоприлом, хотя снижение артериального давления, измеренного на плечевой артерии, в этих группах было равнозначным. Это можно объяснить вазодилатирующими свойствами олмесартана посредством влияния на рецепторы ангиотензина II 1го типа, вследствие которого значительно снижается степень выраженности возвращенной волны и происходит снижение центрального аортального давления [23].
L. Wang et al. в 2012 году провели сравнительный метаанализ антигипертензивной эффективности олмесартана и других блокаторов рецепторов АТ II. 22 исследования (4892 пациента) были включены в анализ. Олмесартан показал большее снижение как систолического, так и диастолического АД по сравнению с лозартаном и большее снижение систолического АД по сравнению с валсартаном. Количество побочных эффектов было одинаковым в сравнении с лозартаном, валсартаном, кандесартаном и ирбесартаном [37]. В другом исследовании олмесартан снижал артериальную жесткость независимо от снижения офисного САД у пациентов с артериальной гипертензией. Так, СРПВ снизилась с 10,50 ± 1,87 м/с до 9,26 ± 1,84 м/с (n = 46) (р < 0,0001) [35]. K. Ong et al. показали, что центральное АД наиболее коррелировало с приемом ингибиторов АПФ (–0,07, р = 0,02), блокаторов рецепторов АТ II ( –0,08, р = 0,01) и антагонистов кальция (–0,15, р < 0,05) [25].
В своем исследовании Puchler с соавт. показали, что все дозы олмесартана медоксомила хорошо переносились пациентами и частота побочных эффектов была сравнима с плацебо и не зависела от дозы препарата (головная боль наблюдалась у 5,6 % пациентов, принимавших олмесартан медоксомил, и у 7,2 % — плацебо; головокружение — у 2,9 vs 1 % соответственно; гипергликемия — у 1,4 vs 3 %; бронхит — у 2 vs 1,9 %; ринит — у 1,8 vs 1,8 %; диарея — у 1,2 vs 0,8 %; боль в спине — у 1,8 vs 1,7 %; периферические отеки — у 1,1 vs 1,2 %). Большинство побочных эффектов были мягкими и умеренными. Наиболее часто встречалась головная боль, преимущественно при приеме плацебо. Не отмечено достоверных изменений по лабораторным показателям [27].
Еще одно исследование OLMEPAS было направлено на изучение эффективности олмесартана медоксомила у пациентов с АГ (11 959 пациентов) в течение 12 недель, проведенное в Германии. 20 мг олмесартана получали 70,9 % пациентов. К концу исследования снижение САД и ДАД составило 28,4 и 14,2 мм рт.ст. соответственно. В начале исследования наблюдалось 80,4 % пациентов с умеренной и тяжелой АГ, а к концу исследования — всего лишь 7,2 %. Более 80 % пациентов ответили на терапию олмесартаном. Более того, не было зафиксировано случаев гипотензии после приема первой дозы или синдрома отмены после прекращения исследования [11].
В William study эффективность олмесартана 5 мг один раз в день сравнивалась с каптоприлом 12,5 мг два раза в день у 291 пациента с мягкой и умеренной АГ (ДАД 95–114 мм рт.ст.). Доза удваивалась после 4 и 8 недель лечения, если не были достигнуты целевые уровни АД. Через 12 недель терапии олмесартан снижал офисное ДАД и САД значительно более эффективно по сравнению с каптоприлом: ДАД — на 9,9 против 6,8 мм рт.ст.; САД — на 14,7 против 7,1 мм рт.ст. Доля пациентов, ответивших на терапию, была значительно выше в группе олмесартана (53 против 38 %, р < 0,01) [33, 39].
В OLMEBEST study изучалась эффективность и переносимость олмесартана у пациентов с мягкой и умеренной АГ как в качестве монотерапии низкими дозами, так и в комбинации с ГХТ. 2306 пациентов в возрасте 18–75 лет (ДАД 90–110 мм рт.ст.) были включены в исследование: все пациенты получали олмесартан 20 мг 8 недель, если ДАД оставался > 90 мм рт.ст., то пациенты были поделены на 2 группы: одна получала олмесартан 40 мг (n = 302), другая — олмесартан 20 мг/ГХТ 12,5 мг (n = 325) еще в течение 4 недель [7]. 76 % пациентов, получающих 20 мг олмесартана, достигли снижения ДАД < 90 мм рт.ст. или >10 мм рт.ст. после 8 недель терапии. В течение рандомизации и при увеличении дозы олмесартана до 40 мг отмечалось дополнительное снижение САД/ДАД еще на 5,3/5,1 мм рт.ст., а при комбинации с ГХТ — на 10,8/7,9 мм рт.ст. Средние цифры АД на фоне монотерапии олмесартаном 40 мг составили к концу лечения 145,3/90,9 мм рт.ст., а на фоне комбинации олмесартан 20 мг/ГХТ 12,5 мг — 140,7/88,7 мм рт.ст. по сравнению с исходными цифрами АД — 160,8/100,5 мм рт.ст. Доля пациентов, у которых нормализовалось ДАД на фоне комбинированной терапии, была больше по сравнению с пациентами, получающими монотерапию 40 мг олмесартана (59 vs 47 %). Хотя монотерапия олмесартаном 40 мг ассоциировалась с меньшим числом побочных эффектов по сравнению с комбинацией с ГХТ (21,5 vs 28,3 % соответственно).
Результаты нашего исследования демонстрируют, что блокатор рецепторов АТ II олмесартан достоверно снижает центральное аортальное давление и улучшает упругоэластические свойства артерий. Таким образом, полученные результаты исследования сравнительной эффективности олмесартана и периндоприла по влиянию на центральное АД и упругоэластические свойства артерий позволяют нам косвенно говорить о лучшем влиянии олмесартана в качестве монотерапии на снижение сердечнососудистого риска.
Выводы
1. Олмесартан и периндоприл приводили к достоверному снижению офисного систолического и диастолического артериального давления на 30,05/16,25 и 30,6/16,10 мм рт.ст. соответственно у больных с мягкой и умеренной артериальной гипертензией.
2. Использование олмесартана в комбинации с торасемидом 5 мг у больных с мягкой и умеренной артериальной гипертензией обеспечивает достоверное снижение как офисного систолического и диастолического артериального давления на 30,5/15,95 мм рт.ст., так и среднего суточного систолического и диастолического артериального давления на 18,58/12,85 мм рт.ст.
3. Использование периндоприла в комбинации с торасемидом 5 мг у больных с мягкой и умеренной артериальной гипертензией обеспечивает достоверное снижение как офисного систолического и диастолического артериального давления на 30,35/17,65 мм рт.ст., так и среднего суточного систолического и диастолического артериального давления на 17,48/9,45 мм рт.ст., а также среднесуточной ЧСС на 7,23 уд/мин.
4. Монотерапия олмесартаном уменьшала центральное систолическое артериальное давление на 24,8 мм рт.ст., что достоверно больше по сравнению с группой периндоприла — 17,21 мм рт.ст. (р < 0,05 между группами), при одинаковом снижении офисных цифр артериального давления и давления при суточном мониторировании.
5. Монотерапия олмесартаном улучшала упругоэластические свойства артерий по сравнению с группой периндоприла, что проявилось в уменьшении СРПВ по артериям эластического типа на 2,72 против 0,88 м/с (р < 0,05).
6. Терапия олмесартаном и периндоприлом хорошо переносилась больными и не требовала отмены препарата.
1. Клінічні рекомендації з артеріальної гіпертензії Європейського товариства з гіпертензій (ESH) та Європейського товариства кардіологів (ESC) 2013 року / Пер. Ю.М. Сіренка // Артеріальна гіпертензія. — 2013. — № 4 .— С. 62157.
2. Маликов М. Жесткость сосудов как универсальный фактор риска у пациентов с артериальной гипертензией // Здоровье Украины. — 2012. — № 25. — С. 5253.
3. Радченко А.Д., Михеева К.В., Сиренко Ю.Н. и др. Клиническое исследование ЭЛИЗА. Результаты 6месячного наблюдения. — Донецк: Издатель Заславский А.Ю., 2011. — 64 с.
4. Cиренко Ю.Н., Рековец О.Л., Багрий А.Э., Визир В.А. Антигипертензивная эффективность фиксированной комбинации валсартана и амлодипина (препарата Эксфорж) у пациентов с артериальной гипертензией (результаты многоцентрового исследования) // Артериальная гипертензия. — 2012. — № 1. — С. 4656.
5. Achhammer I., Metz P. Low dose loop diuretics in essential hypertension. Experience with torasemide // Drugs — 1991 — Vol. 41, Suppl. 3. — P. 8091.
6. AgabitiRosei E, Rizzoni D. Regression of small resistance artery structural alterations in hypertension by appropriate antihypertensive treatment // Curr. Hypertens. Rep. — 2010. — Vol. 12. — P. 8085.
7. Barrios V., Boccanelli A., Ewald S., Girerd X., Heagerty A., Krzesinski J.M., Lins R., Rodicio J., Stefenelli T., Woittiez A., Böhm M. Efficacy and tolerability of olmesartan medoxomil in patients with mild to moderate essential hypertension: the OLMEBEST Study // Clin. Drug Investig. — 2007 — Vol. 27 — P. 545558.
8. Bavry A.A., Anderson R.D., Gong Y. et al. Outcomes Among hypertensive patients with concomitant peripheral and coronary artery disease: findings from the INternational VErapamilSR/Trandolapril STudy // Hypertension. — 2010. — Vol. 55. — P. 4853.
9. Bergmann K., Laeis P., Püchler K., Sudhop T., Schwocho L.R., Gonzalez L. Olmesartan medoxomil: influence of age, renal and hepatic function on the pharmacokinetics of lmesartan medoxomil // J. Hypertens. Suppl. — 2001. — Vol. 19 — P. S3340.
10. Boutouyrie P., Achouba A., Trunet P., Laurent S.; EXPLOR Trialist Group. Amlodipinevalsartan combination decreases central systolic blood pressure more effectively than the amlodipineatenolol combination: the EXPLOR study // Hypertension. — 2010. — Vol. 55. — P. 13141322.
11. Brunner H.R. Olmesartan medoxomil: current status of its use in monotherapy // Vasc. Health Risk Manag. — 2006. — Vol. 2. — P. 327340.
12. Chuang Y.C., Wu M.S., Su Y.K., Fang K.M. Effects of olmesartan on arterial stiffness in rats with chronic renal failure // Cardiovasc. Diabetol. — 2012. — Vol. 13. — P. 1166.
13. Gupta A.K., Nasothimiou E.G., Chang C.L., Sever P.S., Dahlöf B., Poulter N.R. Baseline predictors of resistant hypertension in the AngloScandinavian Cardiac Outcome Trial (ASCOT): a risk score to identify those at highrisk // J. Hypertens. — 2011 — Vol. 29. — P. 20042013.
14. Holtkamp F.A., de Zeeuw D., de Graeff P.A., Laverman G.D., Berl T., Remuzzi G., Packham D., Lewis J.B., Parving H.H., Lambers Heerspink H.J. Albuminuria and blood pressure, independent targets for cardioprotective therapy in patients with diabetes and nephropathy: a post hoc analysis of the combined RENAAL and IDNT trials // Eur. Heart J. — 2011. — Vol. 32. — P. 14931499.
15. Joint National Committee on Detection, Evaluation, and Treatment of High Blood Pressure. The sixth report of the Joint National Committee on Detection, Evaluation, and Treatment of High Blood Pressure (JNC VI) // Arch. Intern. Med. — 1997. — Vol. 157. — P. 24132446.
16. Kario K., Saito I., Kushiro T., Teramukai S., Mori Y., Hiramatsu K., Kobayashi F., Shimada K. Enhanced blood pressurelowering effect of olmesartan in hypertensive patients with chronic kidney diseaseassociated sympathetic hyperactivity: HONEST study // J. Clin. Hypertens (Greenwich). — 2013 — Vol. 15 — P. 555561.
17. Kruck F. Acute and longterm effects of loop diuretics in heart failure // Drugs. — 1991. — Vol. 41, Suppl. 3. — P. 6068.
18. Law M.R., Morris J.K., Wald N.J. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: metaanalysis of 147 randomised trials in the context of expectations from prospective epidemiological studies // BMJ. — 2009. — Vol. 19. — P. 338:b1665.
19. London G.M. Arterial calcification: cardiovascular function and clinical outcome // Nefrologia. — 2011. — Vol. 31. — P. 644647.
20. Mackenzie I.S., McEniery C.M., Dhakam Z. et al. Comparison of the effects of antihypertensive agents on central blood pressure and arterial stiffness in isolated systolic hypertension // Hypertension. — 2009. — Vol. 54. — P. 409413.
21. Manisty C.H., Hughes A.D. Metaanalysis of the comparative effects of different classes of antihypertensive agents on brachial and central systolic blood pressure, and augmentation index // Br. J. Clin. Pharmacol. — 2013. — Vol. 75. — P. 7992.
22. Matsui Y., O’Rourke M.F., Ishikawa J., Shimada K., Kario K. Association of changes in ambulatory arterial stiffness index and pulse wave velocity during antihypertensive treatment: the JCORE study // Am. J. Hypertens. — 2012 — Vol. 25 — P. 862868.
23. Matsui Y., Eguchi K., Michael F. O’Rourke et al. Differential Effects Between a Calcium Channel Blocker and Diuretic When Used in Combination With Angiotensin II Receptor Blocker on Central Aortic Pressure in Hypertensive Patients // Hypertension. — 2009. — Vol. 54. — P. 716723.
24. Mazzolai L., Burnier M. Comparative safety and tolerability of angiotensin II receptor antagonists // Drug Saf. — 1999. — Vol. 21. — P. 2333.
25. Ong K.T., Delerme S., Pannier B. et al. Aortic stiffness is reduced beyond blood pressure lowering by shortterm and longterm antihypertensive treatment: a metaanalysis of individual data in 294 patients // J. Hypertens. — 2011. — Vol. 29. — P. 10341042.
26. Pannier B., Guérin A.P., Marchais S.J., Safar M.E., London G.M. Central artery pulse pressure in endstage renal disease: the roles of aortic diameter, aortic stiffness and wave reflection // Blood Purif. — 2011 — Vol. 31 — P. 107112.
27. Püchler K., Laeis P., Stumpe K.O. Blood pressure response, but not adverse event incidence, correlates with dose of angiotensin II antagonist // J. Hypertens. Suppl. — 2001. — Vol. 19. — P. S4148.
28. Reyes A., Chiesa P., Santucci M. et al. Hydrochlorothiazide versus a nondiuretic dose of torasemide as. once daily antihypertensive monopharmacotherapy in elderly patients; randomized and doubleblind study // Progress in Pharmacology and Clinical Pharmacology. — GustavFischerVerlag: Stuttgart, 1990. — Vol. 8 .— P. 183209.
29. Roth E.M., Oparil S., Melino M., Lee J., Fernandez V., Heyrman R. Olmesartan/amlodipine/hydrochlorothiazide in obese participants with hypertension: a TRINITY subanalysis // J. Clin. Hypertens (Greenwich). — 2013. — Vol. 15. — P. 584592.
30. Ruilope L.M., Schaefer A. Efficacy of Sevikar® compared to the combination of perindopril plus amlodipine on central arterial blood pressure in patients with moderatetosevere hypertension: Rationale and design of the SEVITENSION study // Contemp. Clin. Trials. — 2011. — Vol. 32. — P. 710716.
31. Safar M.E. Effect of angiotensin II blockade on central blood pressure and arterial stiffness in subjects with hypertension // Int. J. Nephrol. Renovasc. Dis. — 2010. — Vol. 3. — P. 167173.
32. Sharman J.E., Marwick T.H., Abhayaratna W.P. et al. Rationale and design of a randomized study to determine the value of central Blood Pressure for GUIDing managEment of hypertension: the BP GUIDE study // Am. Heart J. — 2012. — Vol. 163. — P. 761767.
33. Stumpe K.O., Ludwig M. Antihypertensive efficacy of olmesartan compared with other antihypertensive drugs // J. Hum. Hypertens. — 2002. — Vol. 16, Suppl. 2. — S2428.
34. Takami T., Saito Y. Azelnidipine plus olmesartan versus amlodipine plus olmesartan in arterial stiffness and cardiac function in hypertensive patients: a randomized trial // Drug Des. Devel. Ther. — 2013. — Vol. 22. — P. 175183.
35. Takami T., Saito Y. Effects of Azelnidipine plus OlmesaRTAn versus amlodipine plus olmesartan on central blood pressure and left ventricular mass index: the AORTA study // Vasc. Health Risk Manag. — 2011. — Vol. 7. — P. 383390.
36. Tomlinson L.A., Selvarajah V., Wilkinson I.B. Ratelimiting step: can different effects of antihypertensives on central blood pressure be translated into outcomes? // Hypertension. — 2011. — Vol. 57. — P. 10471048.
37. Wang K.L., Cheng H.M., Chuang S.Y. et al. Central or peripheral systolic or pulse pressure: which best relates to target organs and future mortality? // J. Hypertens. — 2009. — Vol. 27. — P. 461467.
38. Wang L., Zhao J.W., Liu S. et al. Antihypertensive effects of olmesartan compared with other angiotensin receptor blockers: a metaanalysis // Am. J. Cardiovasc. Drugs. — 2012. — Vol. 1. — P. 335344.
39. Williams B., Lacy P.S., Thom S.M. et al. CAFE Investigators; AngloScandinavian Cardiac Outcomes Trial Investigators; CAFE Steering Committee and Writing Committee Differential impact of blood pressurelowering drugs on central aortic pressure and clinical outcomes: principal results of the Conduit Artery Function Evaluation (CAFE) study // Circulation. — 2006. — Vol. 113. — P. 12131225.