Журнал «» 5 (31) 2013
Вернуться к номеру
Ренальная денервация при резистентной артериальной гипертензии
Авторы: Сулимов В.А., Родионов А.В., Светанкова А.А., Денека И.Э. - Первый Московский медицинский университет им. И.М. Сеченова, Россия
Рубрики: Семейная медицина/Терапия, Кардиология, Неврология
Разделы: Справочник специалиста
Версия для печати
Рассматривается новый метод немедикаментозного лечения резистентной артериальной гипертензии — ренальная денервация. Приводятся общие сведения о резистентной артериальной гипертензии, описание метода ренальной денервации, результаты клинических исследований эффективности и безопасности, а также собственное клиническое наблюдение.
Розглядається новий метод немедикаментозного лікування резистентної артеріальної гіпертензії — ренальна денервація. Наводяться загальні відомості про резистентну артеріальну гіпертензію, опис методу ренальної денервації, результати клінічних досліджень ефективності та безпеки, а також власне клінічне спостереження.
A new method of non-drug treatment of resistant arterial hypertension — renal denervation is considered. General information about resistant arterial hypertension, method of renal denervation, the results of clinical studies on efficacy and safety, as well as own clinical case are presented.
артериальная гипертензия, резистентная артериальная гипертензия, ренальная денервация.
артеріальна гіпертензія, резистентна артеріальна гіпертензія, ренальна денервація.
arterial hypertension, resistant arterial hypertension, renal denervation.
Введение
Согласно современным представлениям под резистентной артериальной гипертензией (АГ) понимают клиническую ситуацию, в которой при одновременном назначении трех и более антигипертензивных лекарственных препаратов различных классов (один из которых — диуретик) не удается достичь целевого артериального давления (АД) (< 140/90 мм рт.ст.). При этом важно, чтобы все лекарственные препараты были назначены в оптимальных терапевтических дозах [1–3]. Обследование и ведение пациентов с резистентной АГ включает в себя не только исключение симптоматических АГ, но и ряд других этапов: исключение псевдорезистентной АГ, оптимизацию лекарственной терапии и образа жизни и др. Только после этого формулируются показания к новому немедикаментозному методу лечения — ренальной денервации.
Возможности терапии резистентной артериальной гипертензии
На сегодняшний день в арсенале кардиолога насчитывается около 40 антигипертензивных препаратов, однако и при использовании рациональных комбинаций далеко не всегда удается достичь целевого АД.
Даже на фоне рациональной фармакотерапии целевого АД удается достичь не более чем у 35 % больных. Точная распространенность резистентной АГ неизвестна. По данным крупных центров, ее частота может достигать 10–13 % [4, 5], и этот показатель остается высоким даже после исключения псевдорезистентной АГ, связанной с гипертонией «белого халата», ошибками при измерении АД и т.д.
Многие годы единственным способом нормализовать АД у больных с истинной резистентной АГ было назначение полифармакотерапии с одновременным использованием 4–6 и более препаратов. Однако такая тактика лечения нередко приводила к развитию серьезных побочных эффектов.
Как известно, симпатическая нервная система (СНС) является одним из основных прессорных механизмов, а ее активация — ключевым фактором развития эссенциальной АГ. Гиперактивация СНС и прогрессирующее повышение АД взаимно усиливают друг друга и участвуют в формировании порочного круга. Повышенная активность СНС больше всего затрагивает почки. При гиперактивации СНС в почках происходит вазоконстрикция, снижаются кровоток и фильтрация, усиливается секреция ренина, увеличивается реабсорбция натрия и воды. Афферентная импульсация от почек поступает сначала в боковые рога спинного мозга, а затем в сосудистый центр в центральной нервной системе, способствуя повышению АД. Она усиливается при растяжении механорецепторов, ишемии почек, под воздействием гипоксии [6].
Поиск немедикаментозных методов лечения АГ, позволяющих контролировать эффекты СНС и регулировать ее чрезмерную активность, ведется довольно давно. Манипуляции на симпатических нервах как один из видов лечебной тактики рассматривались еще до появления современной антигипертензивной фармакотерапии. Радикальные хирургические методы грудной, брюшной и тазовой симпатической денервации, а позднее — частичная симпатэктомия относительно успешно применялись для снижения АД у пациентов с так называемой злокачественной АГ в первой половине XX века. Однако эти операции были сопряжены с высокой смертностью и риском осложнений как непосредственно после вмешательства, так и отсроченных, включавших дисфункцию желудочнокишечного тракта и тазовые расстройства [7–9]. Неудивительно, что с появлением эффективных антигипертензивных препаратов подобные хирургические вмешательства стали весьма непривлекательными как для врачей, так и для пациентов.
В начале XXI века исследователи вновь обратились к идее воздействия на почечные симпатические нервы, но уже с применением малоинвазивных технологий.
Ренальная денервация
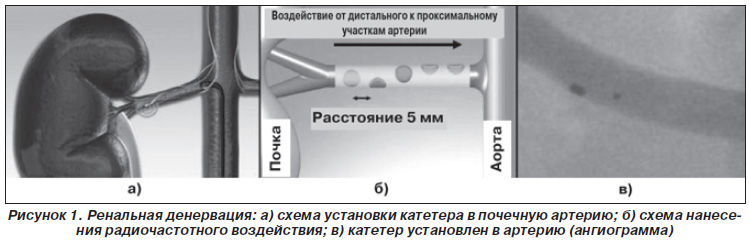
В основе современной методики, предложенной H. Levin и M. Gelfand в 2003 г., лежит термическое повреждение афферентных и эфферентных симпатических почечных нервов с помощью катетерной радиочастотной абляции (РЧА). Симпатические почечные нервы расположены в адвентиции почечных артерий на расстоянии 2–8 мм от эндотелия. Воздействие радиочастотной энергии приводит к нагреванию стенки почечной артерии до 60 °С на глубину, достаточную для повреждения симпатических нервных сплетений [6].
Первой системой для ренальной денервации, получившей практическое применение, стала Medtronic Symplicity Catheter System, которая состоит из генератора радиочастотных волн и одноразового катетера с управляемым кончиком. Генератор вырабатывает радиочастотные волны мощностью 5–8 Вт и постоянно контролирует температуру и импеданс на кончике катетера. Кончик катетера представляет собой платиновоиридиевый электрод, он рентгеноконтрастен и благодаря этому выполняет также функцию метки при катетеризации.
При эндоваскулярной почечной денервации после ангиографии почечной артерии в ее устье устанавливают направляющий катетер 6 F, затем под ангиографическим контролем катетер для РЧА проводят до уровня бифуркации и подключают к генератору. После этого с помощью специального механизма, позволяющего ориентировать катетер в нужном направлении, его перемещают проксимально (от почки к аорте). При этом выполняют 4–6 точечных радиочастотных воздействий по 2 мин с шагом не менее 5 мм и углом вращения 45° по окружности сосуда (рис. 1).
РЧА приводит к определенному повреждению эндотелия, однако, по результатам контрольных ангиограмм, клинически значимых последствий этого повреждения обычно не выявляют [10].
Исследования на животных показали, что селективная денервация почечных артерий не приводит к клинически значимому повреждению почечных артерий в период до 6 мес. после процедуры [11]. Кроме того, показано, что денервация снижает симпатическую эфферентную активность почечного нерва, что сопровождается уменьшением концентрации норадреналина в почках более чем на 85 % по сравнению с исходным и приводит к снижению активности ренина плазмы и повышению почечного кровотока [12].
В 2009 г. представлены первые одногодичные результаты Symplicity HTN1 — первого когортного нерандомизированного многоцентрового исследования эффективности и безопасности катетерной денервации почечных артерий у больных с медикаментознорезистентной АГ [13]. В исследование включены 153 пациента из 19 центров Европы, Австралии и США. Критериями включения являлись: возраст ≥ 18 лет, офисное систолическое АД ≥ 160 мм рт.ст., скорость клубочковой фильтрации (СКФ) по формуле MDRD ≥ 45 мл/мин/1,73 м2, терапия ≥ 3 антигипертензивными препаратами (включая один диуретик), отсутствие вторичных АГ, в том числе обусловленной стенозом почечных артерий. Критериями исключения были: сахарный диабет 1го типа, гемодинамически значимые пороки сердца, терапия клонидином, моксонидином, рилменидином и варфарином, наличие имплантированного кардиостимулятора (кардиовертерадефибриллятора).
Первичными конечными точками были: величина снижения АД после процедуры и ее безопасность; оценка этих показателей проводилась до вмешательства и спустя 1, 3, 6, 9 и 12 мес. после процедуры. Вторичной конечной точкой было влияние денервации на функцию почек.
Всем больным была проведена двусторонняя РЧА, в среднем выполнено по 4 аппликации с каждой стороны. Медиана времени процедуры составила 38 мин. У 97 % больных (149/153) операция прошла без осложнений. В одном случае развилась диссекция почечной артерии, успешно устраненная стентированием. В трех случаях отмечены локальные осложнения в области бедренного доступа (гематома, псевдоаневризма). Через 6 и 12 мес. после РЧА почечного нерва АД снизилось на 25/11 и 25/15 мм рт.ст. соответственно. Для сравнения: у 5 пациентов, которым операция не выполнена изза анатомических противопоказаний (удвоение почечных артерий), средняя динамика АД через 6 мес. составила +14/+9 мм рт.ст. [13].
За 12месячный период наблюдения за больными после операции расчетная СКФ снизилась лишь на 2,7 мл/мин/1,73 м2, что достоверно меньше, чем прогнозируемая динамика СКФ (–12 мл/мин/1,73 м2), которую можно было бы ожидать у больных, не получавших терапии [13].
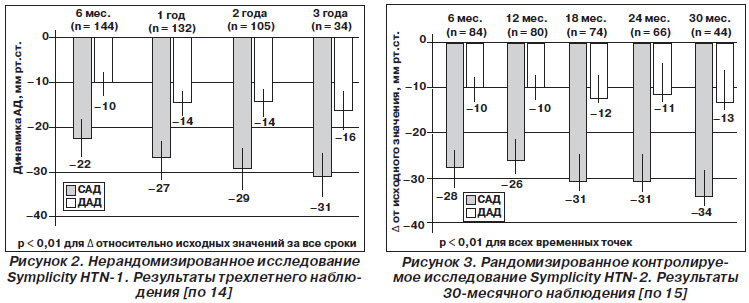
Данные трехлетнего наблюдения за когортой Symplicity HTN1 (2012) показали, что с течением времени снижение АД после денервации происходит даже у пациентов, которые исходно не реагировали на вмешательство. Из 45 пациентов, у которых непосредственно после вмешательства не наблюдалось снижения АД, у 58 % снижение было выявлено через 3 мес., у 64 % — через 1 год [14]. Трехлетние результаты исследования Symplicity HTN1 представлены на рис. 2.
Интересные результаты получены во втором многоцентровом исследовании Symplicity HTN2, которое в отличие от первого было рандомизированным. Критерии включения были аналогичны таковым в исследовании Symplicity HTN1. 106 пациентов были рандомизированы в 2 группы: в первой группе (52 пациента) планировали выполнение абляции почечного нерва, больные второй (контрольной) группы (54 пациента) получали только медикаментозную терапию. Всем больным исходно выполняли визуализацию почечных артерий (компьютерная томография, магнитнорезонансная томография, дуплексное сканирование или ангиография) для исключения гемодинамически значимых стенозов и аномалий строения. На протяжении всего исследования дозы антигипертензивных препаратов у пациентов в обеих группах не изменялись.
Первичной конечной точкой была динамика офисного систолического АД через 6 мес. Вторичными конечными точками были: непосредственная периоперационная безопасность, частота отсроченных осложнений (снижение расчетной СКФ ≥ 25 % или стеноз почечной артерии > 60 % спустя 6 мес.) и составная кардиоваскулярная конечная точка (инфаркт миокарда, инсульт, внезапная сердечная смерть и др.).
Исследование завершили 49 из 52 (94 %) пациентов из группы, в которой проводили ренальную денервацию, и 51 из 54 (94 %) в контрольной группе. В основной группе отмечено снижение АД на 32/12 мм рт.ст. при исходном среднем АД 178/96 мм рт.ст. В группе контроля динамики АД по сравнению с исходным средним АД отмечено не было. Общее количество респондеров (достижение целевого АД или снижение АД ≥ 10 мм рт.ст.) в основной группе достигло 84 % [15]. Результаты 2,5летнего наблюдения за пациентами из исследования Symplicity HTN2 [15] представлены на рис. 3.
В ходе клинических исследований оказалось, что прерывание почечных афферентных импульсов оказывает положительный эффект в отношении не только снижения АД, но и течения других патофизиологических процессов, вызванных хронической симпатической гиперактивностью. Например, было отмечено уменьшение гипертрофии левого желудочка и снижение симпатически обусловленной инсулинорезистентности после денервации, что, в свою очередь, приводит к снижению вероятности манифестации таких сердечнососудистых осложнений, как хроническая сердечная недостаточность и сахарный диабет [16, 17].
В исследовании Brandt с соавт. показано, что через 6 мес. после ренальной денервации толщина межжелудочковой перегородки уменьшилась с 14,1 ± 1,9 мм до 12,5 ± 1,4 мм (p = 0,007), а индекс массы миокарда левого желудочка — со 112,4 ± 33,9 г/м2 до 94,9 ± 29,8 г/м2 (p < 0,001) [16].
Влияние ренальной денервации на показатели углеводного обмена у пациентов с резистентной АГ подробно изучено в работе Mahfoud с соавт. [17]. Уже через 3 мес. после денервации отмечено достоверное снижение гликемии натощак (118 ± 20 мг/дл по сравнению со 106 ± 12 мг/дл), уровня инсулина натощак (20,7 ± 11,8 мЕД/л по сравнению с 11,1 ± 4,8 мЕД/л), Спептида (6,1 ± 3,6 мкг/л по сравнению с 3,1 ± 1,1 мкг/л) и индекса HOMAIR (6,1 ± 4,3 по сравнению с 2,9 ± 1,3) [17].
Весьма интересными представляются результаты исследования Е.А. Покушалова с соавт., в котором изучали частоту рецидивов фибрилляции предсердий у больных, которым одномоментно выполняли РЧА устья легочных вен и ренальную денервацию. Показано, что в группе больных, которым проводили комбинированное вмешательство, доля пациентов с рецидивами фибрилляции предсердий на протяжении 12 мес. была достоверно меньше по сравнению с контрольной группой, в которой выполняли только РЧА устья легочных вен (9/13 (69 %) по сравнению с 4/14 (29 %)) [18].
Начинаются исследования ренальной денервации у больных с хронической сердечной недостаточностью (ХСН). На данный момент представлены 6месячные результаты когортного исследования REACHPilot, которые свидетельствуют об увеличении толерантности к физической нагрузке у больных с ХСН. Показатели теста с шестиминутной ходьбой в среднем возросли на 27,1 ± 9,7 м. Особый интерес представляет тот факт, что у этих пациентов с исходно невысоким АД (среднее АД — 112/65 мм рт.ст.) после процедуры не отмечено такого выраженного дополнительного снижения АД (–7,1 ± 6,9/–0,6 ± 4,0), которое свойственно больным с резистентной АГ [19].
В работе Witkowski с соавт. показано, что ренальная денервация приводит не только к улучшению метаболических показателей и снижению инсулинорезистентности, но и к положительной динамике результатов полисомнографии у пациентов с синдромом обструктивного апноэ во сне (СОАС). У 7 из 8 пациентов с СОАС была отмечена положительная динамика. Учитывая высокую распространенность инсулинорезистентности и СОАС у больных с резистентной АГ, эти данные представляются достаточно значимыми [20].
В настоящее время продолжается набор пациентов в проспективный мультицентровой глобальный регистр ренальной денервации Symplicity, в который планируют включить 5000 чел. В рамках протокола будет изучено влияние ренальной денервации не только на АД, но и на течение таких заболеваний, как сахарный диабет, ХСН, хроническая болезнь почек, СОАС [21].
Симпатическая денервация почечных артерий пока является относительно новым методом, поэтому эксперты ESH/ESC рекомендуют прибегать к ней только при наличии строгих показаний. Показанием к процедуре является резистентная неконтролируемая эссенциальная АГ (систолическое АД при измерении у врача и самоконтроле — более 160 мм рт.ст. или 150 мм рт.ст. у больных сахарным диабетом), несмотря на проводимую трехкомпонентную терапию и удовлетворительную приверженность пациента к лечению.
Противопоказаниями к процедуре являются: диаметр почечных артерий менее 4 мм и длина менее 20 мм, манипуляции на почечных артериях (ангиопластика, стентирование) в анамнезе, стеноз почечных артерий более 50 %, почечная недостаточность (СКФ менее 45 мл/мин/1,73 м2), сосудистые события (инфаркт миокарда, эпизод нестабильной стенокардии, транзиторная ишемическая атака, инсульт) в течение 6 мес. до процедуры, любая вторичная форма АГ [22].
Ренальная денервация не позволяет полностью отказаться от антигипертензивных препаратов, но на фоне их приема можно достичь целевого АД, иногда удается уменьшить количество или дозы препаратов. Эффект процедуры нарастает с течением времени и становится максимальным через 6 мес. после вмешательства. Согласно имеющимся данным эффект денервации сохраняется по меньшей мере на протяжении 3 лет [13–15, 22].
В России ренальная денервация выполняется с середины 2012 г., и на сегодняшний день уже накоплен определенный опыт ее применения.
В качестве иллюстрации приведем собственное клиническое наблюдение.
Пациент Л., 40 лет, поступил в терапевтическое отделение 14.01.2013 г. с жалобами на повышение АД до 200/100 мм рт.ст., головную боль, общую слабость.
Из анамнеза заболевания известно, что с 16–17 лет отмечается повышение АД до 160–170/100 мм рт.ст. Неоднократно обследован с целью исключения вторичной АГ: определяли уровень ренина и альдостерона, в том числе в условиях маршевой пробы, выполняли мультиспиральную компьютерную томографию надпочечников и почечных артерий, ультразвуковое дуплексное сканирование почечных артерий. В ходе обследования данных о симптоматической АГ получено не было. В дальнейшем принимал различные комбинации 3–4 гипотензивных препаратов с недостаточным эффектом. На момент обращения в клинику получал индапамид ретард 1,5 мг/сут, дилтиазем 360 мг/сут, кандесартан 32 мг/сут, урапидил 50 мг/сут, на фоне чего АД составляло 150–160/100 мм рт.ст. С 2008 г. страдает сахарным диабетом, принимал гликлазид 60 мг/сут, акарбозу 300 мг/сут, компенсирован. Индекс курения — 20 пачколет, в течение последних 5 лет не курит.
При осмотре: ожирение (индекс массы тела — 35 кг/м2), над легкими выслушивалось везикулярное дыхание, хрипов нет. Тоны сердца ритмичные, шумов нет, ЧСС — 72 уд/мин, АД — 160/110 мм рт.ст.
Таким образом, у пациента имелись формальные критерии резистентной АГ. Несмотря на прием 4 антигипертензивных препаратов в высоких дозах, АД оставалось выше целевых значений.
В анализах крови отмечалось повышение уровня глюкозы до 6,2 ммоль/л, уровень гликозилированного гемоглобина составил 4,1 %, креатинина — 1,08 мг/дл, СКФ по MDRD — 80 мл/мин/1,73 м2. В общем анализе мочи патологических изменений не выявлено.
По данным эхокардиографии: наличие гипертрофии левого желудочка: межжелудочковая перегородка — 1,3 см, задняя стенка — 1,4 см. Фракция выброса — 70 %.
Суточное мониторирование артериального давления (на фоне терапии): среднее АД днем — 170/98 мм рт.ст., ночью — 151/77 мм рт.ст. Максимальное систолическое АД — 211 мм рт.ст., диастолическое — 119 мм рт.ст.
Мультиспиральная компьютерная томография: почки обычной формы, размеров и положения. Кортикомедуллярная дифференцировка четко выражена. Почечные артерии имеют типичное отхождение (D = S = 6 мм); от правой почечной артерии к верхнему полюсу почки отходит дополнительная гипопластичная ветвь; признаков окклюзии не выявлено. Надпочечники расположены типично, не увеличены. Магистральные сосуды обычного калибра.
Учитывая неэффективность комбинированной антигипертензивной терапии (индапамид ретард 1,5 мг, дилтиазем 180 мг 2 р/д, кандесартан 16 мг 2 р/д, урапидил 25 мг 2 р/д), больному проведена симпатическая почечная денервация.
Пациент выписан из клиники на третьи сутки после вмешательства в удовлетворительном состоянии.
К моменту написания статьи пациент наблюдается на протяжении 5 мес. после процедуры. Уже через 1 мес. на фоне продолжения прежней терапии АД стабилизировалось на уровне 120–130/80–90 мм рт.ст., при этом отменен прием урапидила, доза кандесартана снижена до 16 мг/сут, отмечено улучшение контроля гликемии.
Заключение
Ведение пациентов с резистентной АГ является одной из наиболее актуальных проблем современной кардиологии. К сожалению, в ближайшее время мы не ожидаем появления новых групп фармакотерапевтических препаратов, способных кардинальным образом изменить тактику ведения этих пациентов. В связи с этим создание и совершенствование немедикаментозных технологий представляет максимальный интерес. Ренальная денервация — одна из новых опций в комплексном лечении больных с резистентной АГ. Результаты клинических исследований, а также собственный опыт позволяют надеяться, что этот метод может занять достойное место в арсенале кардиологов и позволит улучшить результаты лечения в наиболее сложной группе пациентов с резистентной АГ.
Конфликт интересов. Все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Впервые опубликовано в журнале «Рациональная фармакотерапия в кардиологии», 2013, 9(3), с. 274279
1. Calhoun D.A., Jones D., Textor S. et al. Resistant hypertension: diagnosis, evaluation, and treatment: a scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research // Circulation. — 2008. — 117(25). — 140319.
2. Mancia G., De Backer G., Dominiczak A. et al.; ESHESC Task Force on the Management of Arterial Hypertension. 2007 ESHESC Practice Guidelines for the Management of Arterial Hypertension: ESHESC Task Force on the Management of Arterial Hypertension // J. Hypertens. — 2007. — 25(9). — 175162.
3. Mancia G., Laurent S., AgabitiRosei E. et al. European Society of Hypertension. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document // J. Hypertens. — 2009. — 27(11). — 212158.
4. Garg J.P., Elliott W.J., Folker A. et al. Resistant hypertension revisited: a comparison of two universitybased cohorts // Am. J. Hypertens. — 2005. — 18 (5, Pt. 1). — 61926.
5. Brown M.A., Buddle M.L., Martin A. Is resistant hypertension really resistant? // Am. J. Hypertens. — 2001. — 14(12). — 12639.
6. Schlaich M., Sobotka P., Krum H. et al. Renal denervation as a therapeutic approach for hypertension: novel implications for an old concept // Hypertension. — 2009. — 54. — 1195201.
7. Morrissey D.M., Brookes V.S., Cooke W.T. Sympathectomy in the treatment of hypertension; review of 122 cases // Lancet. — 1953. — 1. — 403408.
8. Allen E.V. Sympathectomy for essential hypertension // Circulation. — 1952. — 6(1). — 131140.
9. Smithweek R.H. Splanchnicectomy for essential hypertension // JAMA. — 1953. — 152(16). — 15014.
10. Symplicity™ Catheter [instructions for use]. Medtronic, Inc. — Mountain View, CA, 2010.
11. Rippy M.K., Zarins D., Barman N.C. et al. Catheterbased renal sympathetic denervation: chronic preclinical evidence for renal artery safety // Clin. Res. Cardiol. — 2011. — 100(12). — 1095101.
12. DiBona G.F. Sympathetic nervous system and the kidney in hypertension // Curr. Opin. Nephrol. Hypertens. — 2002. — 11. — 197200.
13. Krum H., Schlaich M., Whitbourn R. et al. Catheterbased renal sympathetic denervation for resistant hypertension: a multicentre safety and proofofprinciple cohort study // Lancet. — 2009. — 373(9671). — 127581.
14. Krum H., Barman N., Schlaich M. et al.; Symplicity HTN1 Investigators. Results presented at EuroPCR annual meeting 2013. 21–24 May 2013, Paris.
15. Esler M.D., Krum H., Schlaich M. et al. Renal sympathetic denervation in patients with treatment resistant hypertension (The Symplicity HTN2 Trial): a randomised controlled trial // Lancet. — 2010. — 376. — 19039.
16. Brandt M.C., Mahfoud F., Reda S. et al. Renal sympathetic denervation reduces left ventricular hypertrophy and improves cardiac function in patients with resistant hypertension // J. Am. Coll. Cardiol. — 2012. — 59(10). — 9019.
17. Mahfoud F., Schlaich M., Kindermann I. et al. Effect of renal sympathetic denervation on glucose metabolism in patients with resistant hypertension: a pilot study // Circulation. — 2011. — 123. — 194044.
18. Pokushalov E., Romanov A., Corbucci G. et al. A randomized comparison of pulmonary vein isolation with versus without concomitant renal artery denervation in patients with refractory symptomatic atrial fibrillation and resistant hypertension // J. Am. Coll. Cardiol. — 2012. — 60(13). — 116370.
19. Davies J.E., Manisty C.H., Petraco R. et al. Firstinman safety evaluation of renal denervation for chronic systolic heart failure: primary outcome from REACHPilot study // Int. J. Cardiol. — 2013. — 162(3). — 18992.
20. Witkowski A., Prejbisz A., Florczak E. et al. Effects of renal sympathetic denervation on blood pressure, sleep apnea course, and glycemic control in patients with resistant hypertension and sleep apnea // Hypertension. — 2011. — 58(4). — 55965.
21. Global SYMPLICITY Registry. http://clinicaltrials.gov/ct2/show/NCT01534299.
22. Schmieder R.E., Redon J., Grassi G. et al. ESH position paper: renal denervation — an interventional therapy of resistant hypertension // J. Hypertens. — 2012. — 30(5). — 83741.