Газета «Новости медицины и фармации» Неврология (474) 2013 (тематический номер)
Вернуться к номеру
Рекомендации по современной терапии пациентов с эпилепсией
Авторы: Даирбаева Л.О. - Центр неврологии, эпилептологии и ЭЭГ, г. Алматы, Казахстан
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Эпилепсия — это хроническое заболевание головного мозга, характеризующееся повторными приступами с потерей или без потери сознания (или различными его расстройствами), в структуре которых могут быть различные неврологические нарушения.
Заболеваемость и распространенность
Эпилепсия является одним из наиболее значимых в медицинском, психологическом и социальном плане неврологических заболеваний.
Эпилепсия является одним из наиболее распространенных нервнопсихических заболеваний. Заболеваемость эпилепсией составляет 50–70 случаев на 100 тыс. человек. Уровень заболеваемости существенно варьирует в разных возрастных группах, имея высокие показатели в раннем детстве и второй пик после 65 лет. Результаты большинства исследований подтверждают, что с большей частотой эпилепсия встречается у мужчин, чем у женщин.
Эпилепсия и судорожные синдромы занимают третье место как в структуре общей заболеваемости после сердечнососудистой патологии и сахарного диабета, так и в структуре неврологической заболеваемости — 19,9 %. Она встречается в 10 раз чаще рассеянного склероза и в 100 раз чаще болезни двигательных нейронов — бокового амиотрофического склероза [1].
Распространенность эпилепсии — 5–10 случаев на 1000 населения (0,5–1 %). В России ее распространенность составляет 3,4 на 1000 населения, в странах СНГ этой болезнью болеют 2,5 млн человек [2]; в Европе эпилепсией страдает не менее 6 млн человек, из них около 2 млн — дети [3], а в мире эта цифра превышает 50 млн [4]. Не менее одного приступа в течение жизни переносит 5 % населения, у 20–30 % больных заболевание является пожизненным. У 70 % пациентов эпилепсия дебютирует в детском и подростковом возрасте, поэтому считается одним из основных заболеваний педиатрической неврологии. И, как указывал Комитет экспертов ВОЗ, более 75 % больных эпилепсией не получают адекватного лечения (M.S. Yerby, 2000).
Частота эпилепсии, характер и диапазон медицинских проблем у людей с этим заболеванием приблизительно схожи во всех странах. Однако, несмотря на подобное сходство, имеются существенные различия в статистических показателях эпидемиологических исследований в разных странах мира, доступности и объеме специализированных исследований, медикаментозном и хирургическом лечении эпилепсии, в качестве обучения и контроля медперсонала и общих расходов на здоровье.
Именно поэтому Комиссия по европейским делам Международной лиги борьбы с эпилепсией (ILAE) сочла необходимым выработать единые требования к уровню оказания медицинской помощи больным эпилепсией, пригодные к осуществлению в любой стране, и стандартам подготовки специалистов в области эпилептологии. Основные положения по данному вопросу, согласованные в результате переговоров с Европейской консультативной группой, представляющей все европейские отделения ILAE, были одобрены Генеральной ассамблеей ILAE. Эти требования представляют собой соответствующий стандарт помощи и предназначены для всех официальных медицинских учреждений, правительственных структур, занимающихся лечением эпилепсии, а также для организаций и частных лиц, участвующих в управлении помощью людям с эпилепсией и ее финансировании [5]. Указывается, что лечение должно проводиться под наблюдением опытного врача, имеющего в практике не менее 300 пациентов с эпилепсией ежегодно.
Декларируются следующие требования, которые являются обязательными для обеспечения больных эпилепсией адекватной помощью:
— наличие региональной противоэпилептической службы;
— доступ к специализированной многопрофильной группе, включающей:
1) взрослого и детского эпилептолога;
2) специальную (патронажную) медсестру;
3) нейропсихолога;
4) социального работника;
5) специалиста по профзаболеваниям;
— возможность стационарного лечения;
— возможность высококвалифицированного нейрофизиологического обследования;
— доступ к лабораторным исследованиям и терапевтическому лекарственному мониторингу;
— доступ к методам нейровизуализации, особенно МРТ;
— доступ к программе хирургического лечения эпилепсии;
— возможность комплексного обследования и лечения;
— возможность консультаций по вопросам планирования зачатия и предстоящей беременности;
— возможность консультаций психолога;
— доступ к телефону доверия по эпилепсии и возможность контакта с добровольными общественными организациями;
— доступная и доходчиво изложенная письменная и иного вида информация о приступах, разновидностях эпилепсии, исследованиях и способах лечения.
Начало лечения
Большинство экспертов сходятся во мнении, что начинать медикаментозное лечение следует после второго неспровоцированного приступа. Этот принцип основан на известном факте: вероятность повтора после первого неспровоцированного приступа составляет около 37 %, а после второго приближается к 80 %. Однако фармакотерапия может быть назначена и после первого неспровоцированного приступа при наличии неврологического дефицита, выявлении эпилептической активности мозга на ЭЭГ, структурных изменений, соответствующих данному типу приступов, а также мнения больного или его родственников о необходимости лечения. Нужно помнить о том, что первый назначенный препарат у конкретного больного в большинстве случаев продолжает применяться в течение многих лет, поэтому сегодня широко дискутируется вопрос выбора противоэпилептического препарата (ПЭП) для начальной терапии.
Цель лечения
Сохранение качества жизни пациента, контроль эпилептических приступов и профилактика побочных эффектов лечения.
Диагноз эпилепсии (эпилептического синдрома) основан на следующих критериях:
1. Диагностика эпилепсии и эпилептического синдрома в соответствии с общепринятой Международной классификацией эпилепсий и эпилептических синдромов (1989).
2. Выделение клинической формы эпилептического приступа (уточнение клинической формы обязательно на всех этапах противосудорожной терапии).
3. Этиология (симптоматическая, идиопатическая, криптогенная).
4. Частота приступов, время их повторения, их приуроченность к определенным физиологическим циклам.
5. Провоцирующие факторы приступов (депривация сна, алкоголь, свет, звук, чтение и др.).
6. Оценка соматического статуса и физиологического состояния пациента на момент начала лечения.
Принципы терапии
1. Выбор адекватного антиэпилептического препарата (в соответствии с типом приступа, формой эпилепсии, синдромом).
2. Монотерапия является эффективной более чем у 60 % пациентов с эпилепсией.
3. Индивидуальная эффективная доза (оценка профиля эффективность/переносимость).
4. Регулярность приема — без перерывов и «каникул». Самостоятельная отмена и коррекция дозы не допускаются!
5. Длительность — прием антиэпилептического препарата продолжается в течение 2–5 лет после последнего приступа!
6. Доступность — противоэпилептические препараты включены в перечень лекарственных средств и изделий медицинского назначения для бесплатного обеспечения населения в рамках гарантированного объема бесплатной медицинской помощи на амбулаторном уровне согласно приказу МЗ РК № 786 от 04.11.2012 года.
7. Рациональная политерапия — при неэффективности монотерапии.
Выбор ПЭП основан на следующих критериях
1. Клиническая форма приступа (эпилептического синдрома).
2. Этиология (симптоматическая, идиопатическая, криптогенная).
3. Возраст, пол, вес.
4. Частота приступов.
5. Сопутствующие психические нарушения.
6. Сопутствующие соматические нарушения.
7. Лечение сопутствующих заболеваний.
8. Образ жизни.
Принцип применения ПЭП (выбор тактики ведения пациента)
1. Монотерапия — контроль приступов у 60–80 % больных, нет лекарственного взаимодействия, меньше вероятность побочных эффектов.
2. Политерапия — при неэффективности монотерапии — контроль приступов у 20 % больных, лекарственные взаимодействия и токсические эффекты.
Контроль эффективности лечения
1. Клинический — ведение дневника приступов.
2. Нейрофизиологический (ЭЭГ, видеоЭЭГмониторинг).
3. Терапевтический лекарственный мониторинг.
4. Лабораторнобиохимический мониторинг.
5. Ревизия.
6. Прогноз.
Результаты терапии
1. Полный контроль — отсутствие приступов в течение более 3 лет.
2. Неполный контроль приступов — редукция частоты приступов более чем на 50 %.
3. Неконтролируемые приступы — отсутствие эффекта лечения.
4. Аггравация приступов — это парадоксальный фармакодинамический эффект, возникающий в связи с приемом противоэпилептических препаратов, но не являющийся побочным действием препаратов или симуляцией со стороны больного. Сам факт аггравации приступов очень сложно выделить в клинической картине эпилепсии, поскольку этот феномен наблюдается даже на фоне приема больными плацебо, причем, по данным масштабных рандомизированных исследований, в 3–9 % случаев частота приступов при этом увеличивается более чем вдвое. Тем не менее сегодня можно говорить о том, что прием некоторых ПЭП характеризуются определенной вероятностью аггравации.
Единственная классификация парадоксальной аггравации под влиянием ПЭП, предложенная E. Perucca и соавт. в 1998 г., подразделяет этот феномен на два типа:
— тип А — парадоксальная интоксикация — увеличение частоты приступов как проявление чрезмерной для данного пациента лекарственной нагрузки;
— тип В — специфическая (фармакодинамическая) аггравация — специфичный для пациента или типа заболевания феномен, при котором определенные типы приступов появляются, возобновляются или учащаются под влиянием определенных ПЭП в связи с их механизмом действия.
Парадоксальная интоксикация наиболее изучена и описана для фенитоина, может встречаться при приеме вигабатрина, тиагабина, ламотриджина, топирамата, а также при политерапии. Она клинически непредсказуема, может протекать без других симптомов интоксикации, уменьшается при снижении дозы ПЭП. Специфическая аггравация более синдромоспецифична, чаще наблюдается при ИГЭ.
К факторам риска аггравации относятся:
— сочетание разных типов приступов;
— политерапия;
— умственная отсталость пациента;
— неврологические нарушения;
— высокая исходная частота приступов;
— значительные изменения ЭЭГ в дебюте заболевания.
Механизмы развития парадоксальной аггравации до конца не изучены и требуют дальнейшего уточнения. Они различаются в зависимости от типа эпилепсии и механизмов антиэпилептического действия препаратов.
Клинические рекомендации по лечению эпилепсии
В настоящее время наиболее авторитетными из подобных документов признаны рекомендации Международной противоэпилептической лиги (ILAE), консенсусы британских (NICE), шотландских (SIGN) и американских экспертов (AAN/AES).
1. ILAE (2006, 2013): доказательство эффективности монотерапии 1940–2005 50 РКИ и 7 метаанализов.
2. NICE (2004, 2012): выбор ПЭП на основании типа приступа и формы эпилепсии/синдрома.
3. SIGN (2006): диагностика и лечение эпилепсии у взрослых. Национальные клинические рекомендации.
4. AAN&AES: эффективность и переносимость ПЭП последней генерации при впервые выявленной эпилепсии и при рефрактерной эпилепсии.
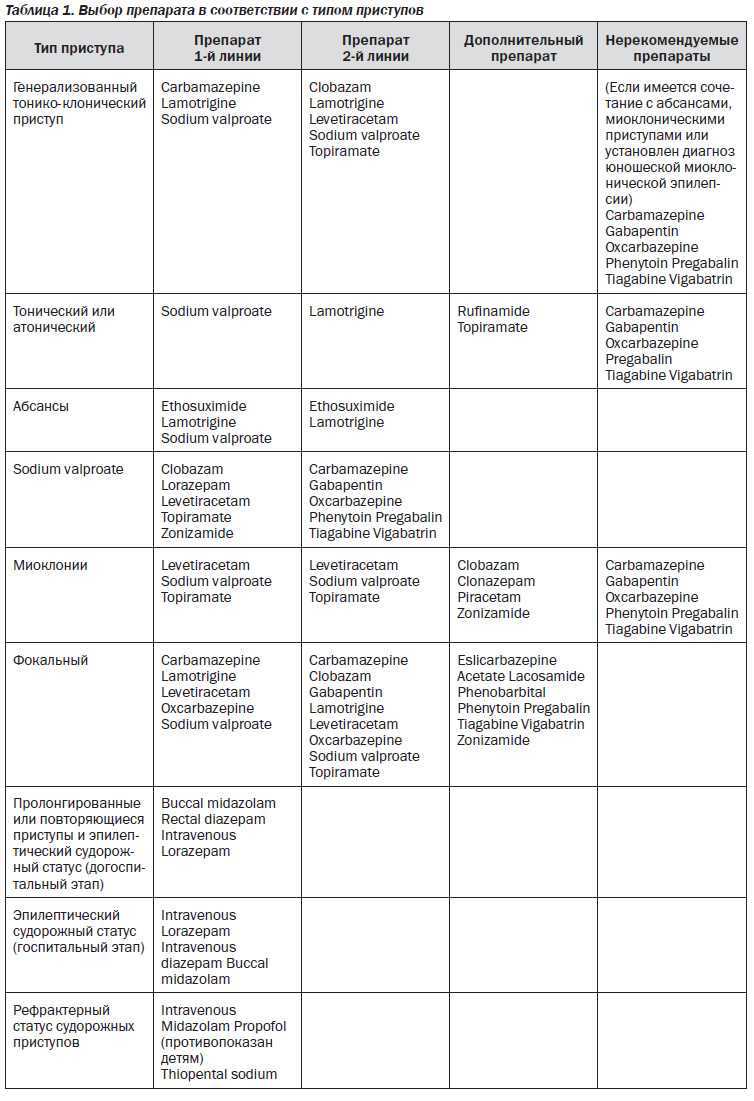
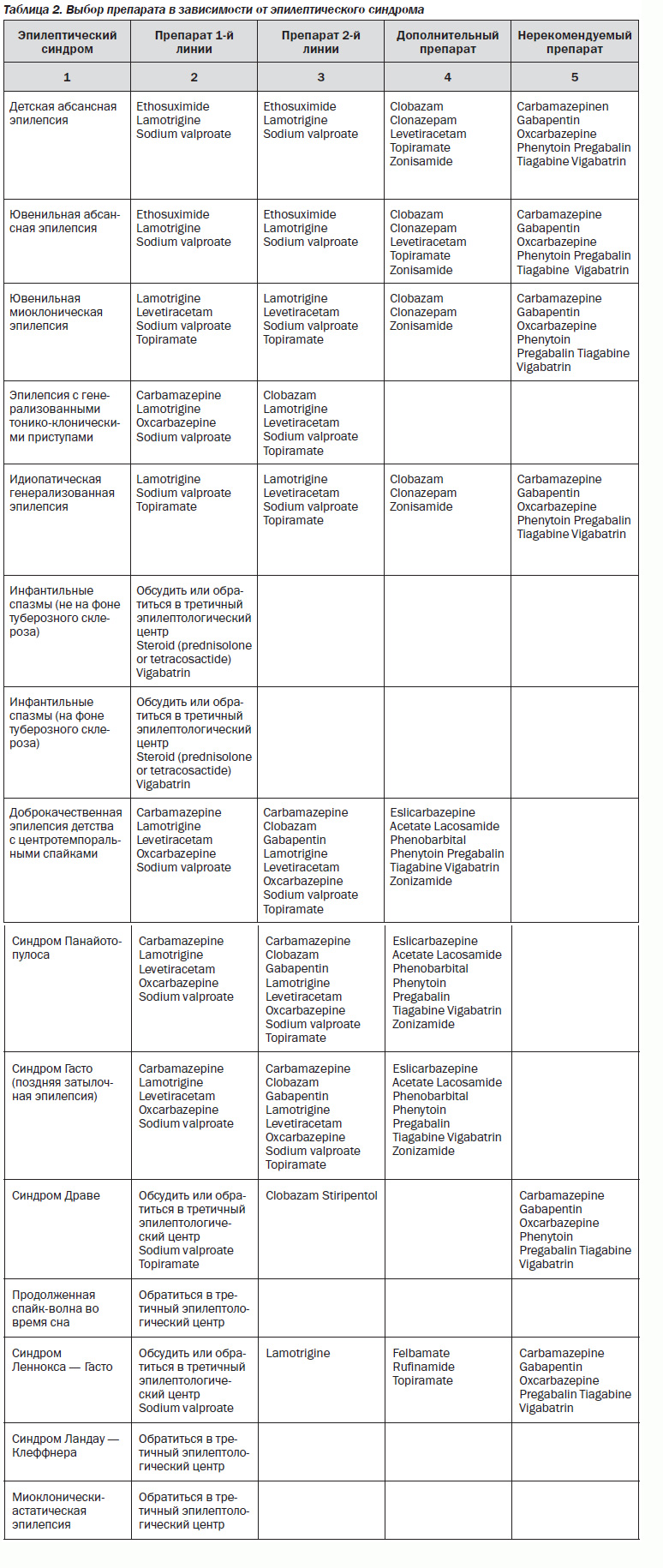
Остановимся на последнем исследовании 2012 года NICE (National Institute for Health and Clinical Exellence): The epilepsies: the diagnosis and management of the epilepsies in adults and children in primary and secondary care [6] (табл. 1, 2).
Несмотря на то, что в настоящее время специалистам предоставлен большой выбор современных высокоэффективных противоэпилептических препаратов, до сих пор не всегда удается добиться желаемого терапевтического эффекта. C одной стороны, это может быть связано с истинной резистентностью заболевания; с другой — с так называемой «псевдорезистентностью».
«Псевдорезистентность», или ятрогенная резистентность, связана с неправильным подбором самого препарата или назначением должного препарата, но в неадекватной дозе. По данным разных авторов, «псевдорезистентность» составляет до 30,5 %!
Смертность
Причины смерти приблизительно у трети пациентов непосредственно связаны с нарушениями во время приступа, и это соотношение неизменно для любой европейской страны. Внезапная, непредвиденная смерть может встречаться у молодых людей с активной формой эпилепсии, причем чаще всего, когда приступы носят конвульсивный (судорожный) характер. Немало смертных случаев происходит во время ночного сна. В этой ситуации степень риска составляет от 1,3 до 9,3 случая на 1000 пациентов.
Обоснование использования оригинального препарата по сравнению с генериками
Эпилепсия — хроническое заболевание, часто требующее длительного лечения. Эпилепсия длится в среднем около 10 лет, хотя у многих период активных приступов существенно короче (менее 2 лет у более 50 %). Около 70 % пациентов с эпилепсией достигают длительной ремиссии с помощью противоэпилептических препаратов, возвращающих их к полноценной жизни. Значительное число (20–30 %) пациентов страдает эпилепсией всю жизнь.
ПЭП относятся к препаратам с узким терапевтическим индексом (очень маленькая разница в дозе между терапевтическим и токсическим эффектом терапии), требующим тщательного титрования дозы у каждого конкретного пациента, что вызывает необходимость очень взвешенной оценки возможности генерической замены. Перевод на генерики даже с доказанной биоэквивалентностью, но не подтвержденной терапевтической эквивалентностью приводит к нестабильным концентрациям препаратов в сыворотке крови, провоцирует потерю контроля над приступами и увеличивает риск травм, инвалидизации и смерти пациентов с эпилепсией. При этом прогноз заболевания становится более неблагоприятным с каждой сменой генерического препарата. По данным многих клинических исследований, при достижении длительной ремиссии становится очень важным избегать провоцирования приступов. Появление хотя бы 1 приступа влечет за собой значимые последствия для каждого пациента и для системы здравоохранения в целом: проблемы с трудоустройством, стигматизация, риск травматизма и смерти (риск внезапной смерти при эпилепсии возрастает в 2–3 раза для пациентов с хотя бы 1 приступом в течение года по сравнению с пациентами без приступов [7]), госпитализации и т.д.
Согласно законодательству ряда европейских стран (Германия, Нидерланды) и США, ПЭП как препараты с узким терапевтическим индексом относятся к группе нерекомендуемых к необоснованной замене/переводу на генерики с позиций эффективности и безопасности.
Клинические и фармакоэкономические зарубежные исследования, в которых изучались пациенты до и после переключения на генерики, а также фармакокинетические исследования подтвердили достоверные различия между оригинальными и генерическими ПЭП[8, 9]:
1. Разная биодоступность оригинальных и генерических ПЭП.
2. Разрешенный диапазон отклонений генерика от оригинального препарата при определении биодоступности не гарантирует терапевтической эквивалентности.
3. Более высокая частота развития побочных эффектов на генериках (56 % врачей отмечают увеличение количества побочных эффектов при переключении пациентов на генерики).
4. Более высокая частота развития приступов при использовании генериков (около 68 % врачей отмечают развитие внезапного припадка после переключения с оригинальных препаратов на генерики) [10].
5. Более высокие дозы генериков, требуемые для достижения эффекта, в сочетании с большей токсичностью.
6. Более высокая частота сопутствующих назначений при терапии генериками.
7. Более высокие затраты на терапию пациента.
Таким образом, лечение эпилепсии должно быть персонифицировано, адресовано конкретному пациенту, исходя из его специфических потребностей. Также для повышения эффективности лечения эпилепсии необходимо преодоление проблем с лекарственным обеспечением, в том числе препаратами для лечения эпилептического статуса, чему может способствовать гармонизация списков лекарств по ГОБМП, а также расширение этих списков за счет наиболее эффективных современных противоэпилептических препаратов. Особенно тех, которые разрешены для применения у детей.
1. Neurological disorders. — Public Health Challenges, 2007.
2. Гехт А.Б., 2009.
3. Epilepsy care in the World, 2004.
4. Neurological disorders. — Public Health Challenges, 2007.
5. Гехт А.Б., Авакян Г.Н., Гусев Е.И. Современные стандарты диагностики и лечения эпилепсии в Европе // Журн. неврол. и психиат. — 1999. — 99, 7. — 47.
6. The epilepsies: the diagnosis and management of the epilepsies in adults and children in primary and secondary care // NICE. — 2012.
7. Paesschen W.V. et al. The use of generic medication in epilepsy: A reviewof potential issues and challenges // European journal of paediatric neurology. — 2009. — 13. — 8792.
8. Crawford P. et al. Are there potential problems with generic substitution of antiepileptic drugs? A review of issues. — British Epilepsy Association: Published by Elsevier Ltd, 2006.
9. Borgherini G. The Bioequivalence and Therapeutic Efficacy of Generic Versus BrandName Psychoactive Drugs // Clinical therapeutics. — 2003. — Vol. 25. — 6.
10. Wilner A.N. Therapeutic equivalency of generic antiepileptic drugs: results of a survey // Epilepsy & Behavior. — 2004. — 5. — 995998.