Журнал «» 6 (32) 2013
Вернуться к номеру
Питавастатин — новый ингибитор ГМГ-КоА- редуктазы: особенности клинической фармакологии и перспективы применения при лечении сердечно-сосудистых заболеваний
Авторы: Дзяк Г.В., Егоров К.Ю., Колесник Э.Л. - ГУ «Днепропетровская медицинская академия» МЗ Украины
Рубрики: Семейная медицина/Терапия, Кардиология
Разделы: Справочник специалиста
Версия для печати
В статье рассматривается проблема коррекции дислипидемий у больных с сердечно-сосудистой патологией, уделено внимание применению нового препарата класса статинов, питавастатина, у данной категории пациентов. Приведены данные международных исследований сравнительной эффективности питавастатина, показаны его преимущества и профиль безопасности.
У статті розглядається проблема корекції дисліпідемій у хворих із серцево-судинною патологією, приділено увагу застосуванню нового препарату класу статинів, пітавастатину, у цієї категорії пацієнтів. Наведено дані міжнародних досліджень порівняльної ефективності пітавастатину, показано його переваги і профіль безпеки.
The article deals with the problem of correction of dyslipidemia in patients with cardiovascular disease, the attention is paid to the use of a new drug of statins class, pitavastatin, in this group of patients. The data of the international trials on comparative effectiveness of pitavastatin are provided, its advantages and safety profile were shown.
сердечно-сосудистые заболевания, гиперхолестеринемия, дислипидемия, питавастатин.
серцево-судинні захворювання, гіперхолестеринемія, дисліпідемія, пітавастатин.
cardiovascular diseases, hypercholesterolemia, dyslipidemia, pitavastatin.
Сердечнососудистые заболевания (ССЗ) сохраняют лидирующее положение среди причин смертности в большинстве стран Восточной Европы, включая Украину. Сердечнососудистая смертность в нашей стране составляет 66,3 % от общей смертности, в структуре которой превалируют заболевания, обусловленные атеросклерозом, — инфаркт миокарда, мозговой инсульт, атеросклероз периферических артерий [1].
В исследовании «Европейская акция по первичной и вторичной профилактике с использованием вмешательств, снижающих частоту неблагоприятных событий» (European Action on Secondary и Primary Prevention by Intervention to Reduce Events — EUROASPIRE III) установлено, что за период 2006–2007 гг. в 22 странах Европы липидоснижающую терапию получали лишь 88,8 % пациентов с дислипидемией и у 43 % из них не был достигнут рекомендуемый целевой уровень общего холестерина [2].
В аналогичном исследовании «Проект по оценке липидной терапии — 2» (LTAP2 — Lipid Treatment Assessment Project) отмечено, что у 16–53 % пациентов не удалось достичь указанного национальными рекомендациями целевого уровня холестерина липопротеинов низкой плотности (ХС ЛПНП) в 9 проанализированных странах мира [3].
Одними из наиболее эффективных средств успешной профилактики ССЗ являются лекарственные препараты, понижающие содержание атерогенных липидов в крови. В соответствии с международными и национальными рекомендациями по лечению больных с дислипидемиями и атеросклерозом (ESH/ESC 2012, Ассоциация кардиологов Украины, 2012) ингибиторы 3гидрокси3метилглутарилкоэнзимАредуктазы (ГМГКоАредуктаза) (статины) являются препаратами первого выбора. Статины хорошо изучены и высокоэффективны в снижении риска сердечнососудистых осложнений (ССО) и улучшении прогноза при первичной и вторичной профилактике.
С момента первого клинического использования статинов в начале 1970х годов в мире зарегистрированы ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, розувастатин и питавастатин.
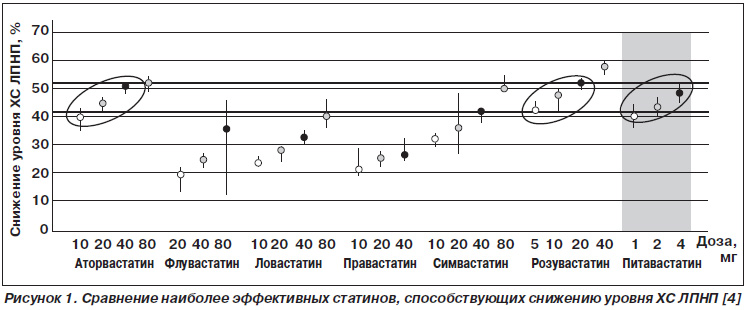
В систематическом обзоре 75 рандомизированных клинических исследований, в которых сравнивалась эффективность и безопасность статинов в различных дозах, отмечено, что при использовании аторвастатина в суточной дозе 10 мг, флувастатина — 80 мг, ловастатина — 40–80 мг и симвастатина — 20 мг уровень ХС ЛПНП снизился на 30–40 %, а флувастатина 40 мг, ловастатина — 10–20 мг, правастатина — 20–40 мг и симвастатина 10 мг — на 20–30 % [4]. Снижение уровня ХС ЛПНП более чем на 40 % достигнуто лишь при применении розувастатина в дозе 5–40 мг и аторвастатина 20–80 мг. Однако при самостоятельных исследованиях отдельных препаратов аналогичный эффект отмечен при использовании питавастатина в существенно более низких дозах 2–4 мг, что возводит этот статин в ранг самых сильнодействующих [3] (рис. 1).
Питавастатин является относительно новым членом семьи статинов [5]. Препарат впервые введен в клиническую практику в 2003 году в Японии для лечения первичной гиперлипидемии или смешанной дислипидемии. В последующем питавастатин был разрешен к применению в 13 странах мира, в том числе в США, Швейцарии, Испании и Португалии. В 2013 году питавастатин был зарегистрирован в Украине под торговым названием Ливазо (Recordati, Италия)
Клиническая фармакология питавастатина
Питавастатин представляет собой новый мощный синтетический ингибитор ГМГКоАредуктазы четвертого поколения c уникальной структурой молекулы, которая включает в себя группу циклопропила и обеспечивает улучшенную фармакокинетику, увеличение системной биодоступности [6], высокий уровень пероральной абсорбции [7, 8], эффективное снижение ЛПНП при применении низких доз и выраженное влияние на холестерин липопротеинов высокой плотности (ХС ЛПВП) [9–12].
Абсолютная биодоступность питавастатина составляет 51 %. Питавастатин быстро всасывается в верхних отделах желудочнокишечного тракта. Всасывание не зависит от приема пищи. Пиковая концентрация (Сmax) препарата в плазме крови достигается на протяжении 1 ч после приема внутрь и не зависит от времени приема препарата. В то же время Cmax питавастатина в плазме крови снижается на 43 % при применении с пищей с высоким содержанием жиров, но AUC (площадь под кривой «концентрация — время») остается неизмененной. Период полувыведения (T1/2) из плазмы крови колеблется от 5,7 ч (1 доза) до 8,9 ч (равновесное состояние), среднее геометрическое перорального клиренса составляет 43,4 л/ч после одноразовой дозы. Менее 5 % питавастатина выводится с мочой [13].
Питавастатин более чем на 99 % связывается с белками плазмы крови, в основном с альбумином и 1кислотным гликопротеином. Cредний объем распределения препарата составляет около 148 л. Питавастатин в неизмененном виде большей частью находится в плазме крови [13].
Благодаря синтетической циклопропильной группе питавастатин лишь незначительно метаболизируется в гепатоцитах по системе цитохрома P450 (CYP) 2C9, а не CYP3A4 с образованием неактивных метаболитов. В результате питавастатин выводится из организма в неизмененном виде с желчью и поглощается в тонком кишечнике, готовый к энтерогепатической рециркуляции. Этот процесс объясняет высокую биодоступность питавастатина по сравнению с большинством других ингибиторов ГМГКоАредуктазы и способствует его длительной продолжительности действия [10].
Ни питавастатин, ни его основной метаболит — неактивный лактон не оказывают ингибирующего действия на ферменты CYP, а ингибиторы CYP3A4 не влияют на концентрацию питавастатина. Более того, Ргликопротеинопосредованный транспорт не играет значительной роли в распределении препарата, а питавастатин, в свою очередь, не ингибирует активность Ргликопротеина.
Питавастатин транспортируется в печень несколькими носителями, в том числе organic anion transporting polypeptide 1B1 (OATP1B1) и OATP1B3. Однако ингибиторы OATP1B1 относительно мало влияют на концентрацию препарата в плазме по сравнению с другими статинами. В целом взаимодействие, за исключением нескольких ингибиторов печеночных транспортеров, таких как циклоспорин, не является клинически значимым. Следовательно, питавастатин имеет минимальные взаимодействия с лекарствами и продуктами питания, что особенно важно при лечении дислипидемии у пациентов, вынужденных принимать несколько препаратов одновременно [9].
Появление питавастатина в перечне доступных для назначения статинов обеспечивает врачам новый вариант лечения, который, как ожидается, имеет низкий риск развития лекарственных взаимодействий и связанных с этим классом препаратов побочных действий. Этот факт в сочетании с эффективностью питавастатина в отношении снижения ЛПНП должен помочь врачам индивидуализировать гиполипидемическую терапию, основанную на профиле пациента и приеме им сопутствующих препаратов [14].
По результатам исследования J.A. Jung et al. (2012), у здоровых мужчиндобровольцев фармакокинетические профили питавастатина и валсартана, применяемых в качестве монотерапии, были сравнимы с комбинированной терапией. Одновременное введение питавастатина и валсартана существенно не влияло на индивидуальные фармакокинетические свойства препаратов и в целом хорошо переносилось, что создает предпосылки для проведения более широкомасштабных исследований у пациентов с гипертонической болезнью с гиперлипидемией [15].
При изучении лекарственных взаимодействий между питавастатином и варфарином было показано, что фармакодинамика и фармакокинетика варфарина не отличались как при использовании варфарина в качестве монотерапии, так и при одновременном применении с питавастатином. Лекарственных взаимодействий между питавастатином и варфарином выявлено не было [16].
По данным S. Stender, возраст не оказывает клинически значимого влияния на фармакокинетику питавастатина. Препарат обеспечивает превосходную эффективность и переносимость у пожилых пациентов [17, 18]. Также не отмечено различий между фармакокинетическими профилями питавастатина у здоровых добровольцев монголоидной и европеоидной рас [19].
Согласно данным Y. Mao et al. (2012), питавастатин демонстрирует не только значимую эффективность у пациентов с гиперхолестеринемией, но и высокую безопасность [20].
У больных с тяжелой почечной недостаточностью без гемодиализа однократный прием питавастатина в дозе 4 мг продемонстрировал хорошую переносимость и отсутствие выраженных побочных реакций [21].
По результатам исследования PITCH (PITavastatin versus atorvastatin to evaluate the effect on patients with hypercholesterolemia and mild to moderate hepatic damage), обычные дозы аторвастатина и питавастатина эффективно и безопасно снижают повышенные концентрации печеночных ферментов [22].
Результаты клинических исследований
Многоцентровое рандомизированное открытое 12недельное исследование CHIBA по сравнению эффективности и безопасности питавастатина 2 мг/сут и аторвастатина 10 мг/сут у 204 японских пациентов с гиперхолестеринемией (общий холестерин 220 мг/дл или выше) показало значительное снижение ХС ЛПНП на 42,6 и 44,1 % и уровня триглицеридов (ТГ) — на 17,3 и 10,7 % в группах питавастатина и аторвастатина соответственно. При этом отмечено, что через 12 недель лечения питавастатин увеличивал содержание сывороточного ХС ЛПВП по сравнению с исходным на 3,2 % (р < 0,033) в отличие от группы аторвастатина, где изменения ХС ЛПВП носили недостоверный характер (1,7 %; р < 0,221) [23].
Результаты другого сравнительного исследования PIAT по оценке влияния питавастатина (2 мг/сут) и аторвастатина (10 мг/сут) на уровни ХС ЛПВП (первичная конечная точка) у больных с гиперхолестеринемией и нарушением толерантности к глюкозе показали, что процентное увеличение ХС ЛПВП было существенно выше в группе питавастатина по сравнению с группой аторвастатина (8,2 против 2,9 %; р = 0,031) [24].
По результатам исследования LIVES (LIVALO Effectiveness and Safety), при обследовании более 20 000 пациентов с гиперхолестеринемией, которые получали питавастатин на протяжении до 2 лет, целевой уровень ХС ЛПНП был достигнут у 88,2 % пациентов с низким уровнем риска (< 160 мг/дл), у 82,7 % пациентов со средним риском (< 140 мг/дл), у 66,5 % пациентов группы высокого риска развития ССО (< 120 мг/дл) и у 50,3 % пациентов, получавших препарат с целью вторичной профилактики (< 100 мг/дл). При этом было показано, что даже у пациентов с низким уровнем ХС ЛПВП на 104й неделе наблюдения отмечалось значительное снижение общего холестерина на 21,0 %, ХС ЛПНП — на 31,3 % и ТГ — на 6,1 % [25].
В исследовании MEGA при применении правастатина установлено снижение уровня ХС ЛПНП со 156,7 до 122,7 мг/дл. В исследовании LEM при лечении с применением флувастатина отмечено снижение уровня ХС ЛПНП со 172,5 до 123,4 мг/дл. В представленном исследовании при назначении питавастатина уровень ХС ЛПНП снижался со 162,4 до 108,5 мг/дл, что подтвердило высокую эффективность питавастатина.
Дополнительный анализ исследования LIVES у пациентов с ССЗ и хронической болезнью почек показал, что увеличение скорости клубочковой фильтрации (+5,4 мл/мин/1,73 м2) регистрировалось после 2 лет лечения питавастатином (р < 0,001). При лечении питавастатином более чем 5000 больных сахарным диабетом был также продемонстрирован положительный эффект препарата на уровень гликозилированного гемоглобина (HbA1c) у 1200 пациентов. За 2летний период лечения питавастатином HbA1c постепенно снизился на 0,28 % [25].
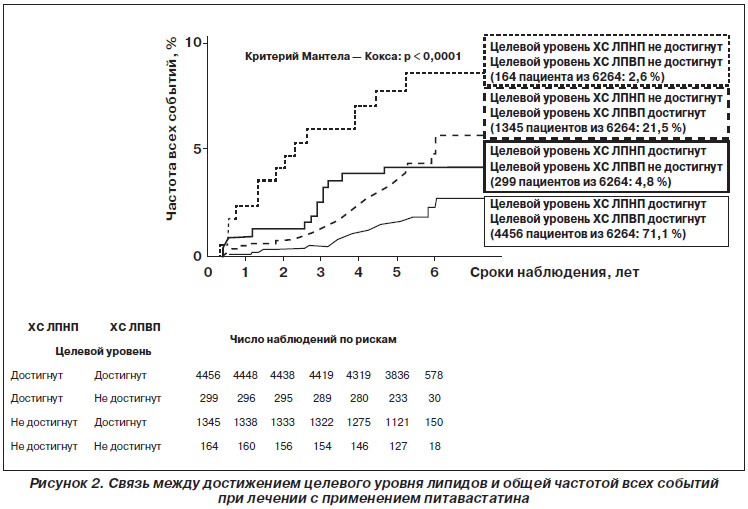
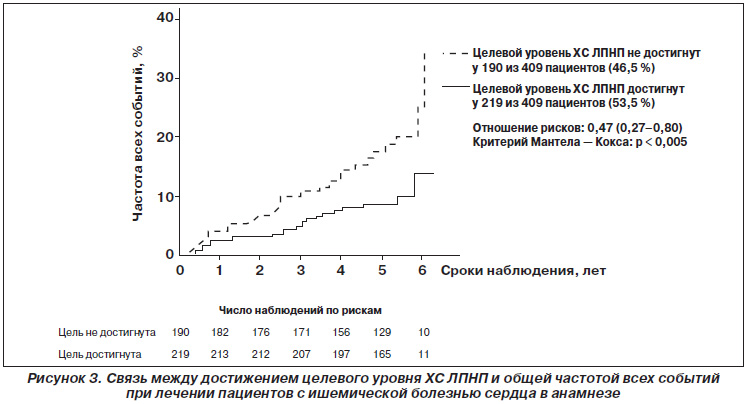
По окончании исследуемого периода была проведена дополнительная фаза исследования LIVES для изучения отдаленных результатов и частоты сердечнососудистых (ССС) и цереброваскулярных событий (ЦВС) в последующие 3 года, в которую были включены 6582 пациента [26] (рис. 2, 3).
Эти результаты свидетельствуют, вопервых, о важности контроля не только уровня ХС ЛПНП, но и ХС ЛПВП в пределах целевого диапазона и, вовторых, о том, что определение уровня ХС ЛПНП и ХС ЛПВП даже на ранних этапах применения питавастатина позволяет прогнозировать риск возникновения ССС/ЦВС при последующем лечении. Чем более выражено снижение уровня ХС ЛПНП и повышение уровня ХС ЛПВП в начале лечения, тем меньше вероятность возникновения указанных событий в последующем, что является дополнительным подтверждением длительного эффекта питавастатина.
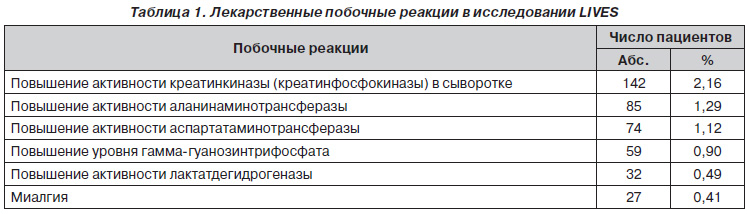
Кроме того, в этом исследовании питавастатин показал высокую безопасность и малое количество побочных реакций [26] (табл. 1).
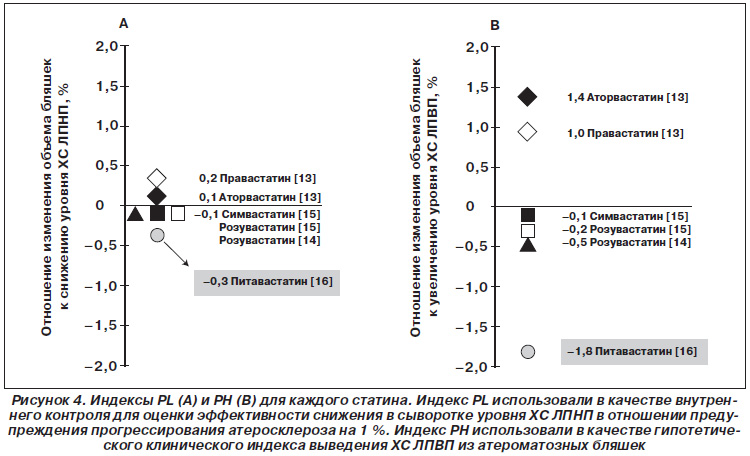
Особый научный интерес представляет исследование K. Kishida et al., в котором авторы использовали индекс РН (объема бляшек в венечных артериях/ ХС ЛПВП) в качестве гипотетического клинического индекса выведения ХС ЛПВП из атероматозных бляшек (рис. 4).
Как показал проведенный анализ, наиболее значительный регресс атеросклеротических бляшек вследствие повышения уровня ХС ЛПВП (индекс РН) отмечен при применении питавастатина по сравнению с регрессом при назначении четырех других статинов [27].
Выраженный гиполипидемический эффект и безопасное влияние питавастатина на содержание глюкозы в крови были продемонстрированы Y. Mao et al. при лечении пациентов с сахарным диабетом в сочетании с гиперхолестеринемией [28].
В исследовании JAPANACS (Japan Assessment of Pitavastatin and Atorvastatin in Acute Coronary Syndrome) оценивались эффекты питавастатина 4 мг/сут и аторвастатина 20 мг/сут на объем бляшки с помощью внутрисосудистого ультразвукового исследования у больных с острым коронарным синдромом [29].
Изменение уровня ХС ЛПНП в среднем по группам составило –36,2 ± 19,5 % в группе питавастатина и –35,8 ± 22,9 % в группе аторвастатина. У пациентов, принимавших питавастатин, изменение объема бляшек составило –16,9 ± 13,9 %, а у пациентов, принимавших аторвастатин, –18,1 ± 14,2 % (р = 0,5). Полученные данные исследования JAPANACS показали, что питавастатин и аторвастатин в равной степени влияют на уменьшение объема атеросклеротической бляшки [29].
Питавастатин оказывал благотворное влияние на диастолическую функцию левого желудочка, а также структуру и функцию левого предсердия у пожилых пациентов с артериальной гипертензией. Лечение питавастатином может быть связано с более низкой частотой развития фибрилляции предсердий [30].
Согласно современным рекомендациям, первичная и вторичная профилактика ССЗ без статинов невозможна. Адекватная терапия статинами в повседневной клинической практике — неотложная задача стратегического значения, успешное решение которой обеспечит реальную возможность снижения сердечнососудистой смертности и увеличение продолжительности жизни [31]. И среди всех статинов питавастатин выгодно отличается своими свойствами. Это эффективное и хорошо переносимое лекарственное средство для лечения пациентов с гиперхолестеринемией и дислипидемией. Питавастатин обеспечивает снижение уровня ХС ЛПНП до целевого значения, особенно при снижении уровня ХС ЛПВП. Также он обладает низкой частотой побочных реакций и низкой вероятностью взаимодействия с другими лекарственными средствами у пациентов, которым проводится комплексная терапия.
1. Динаміка стану здоров’я народу України та регіональні особливості. Аналітичностатистичний посібник / Манойленко Т.С., Кириченко А.Г., Ревенько І.Л.; За ред. В.М. Коваленка. — К.: ННЦ «Інститут кардіології імені акад. М.Д. Стражеска», 2012. — С. 53.
2. Kotseva K., Wood D., De B.G. EURROASPIRE III: a survey on the lifestyle, risk factors and use of cardioprotective drug therapies in coronary patients from 22 European countries // Eur. J. Cardivasc. Prev. Rehabil. — 2009. — Vol. 16. — P. 121137.
3. Waters D.D., Brotons C., Chiang C.W. et al. Lipid treatment assessment project 2: a multinational survey to evaluate the proportion of patients achieving lowdensity lipoprotein cholesterol goals // Circulation. — 2009. — Vol. 120. — P. 2834.
4. Weng T.C., Yang Y.H., Em S.J. et al. A systematic review and metaanalysis on the therapeutic equivalence of statins // J. Clin. Pharm. Ther. — 2010. — Vol. 35. — P. 139151.
5. Masana L. Pitavastatin in cardiometabolic disease: therapeutic profile // Cardiovasc. Diabetol. — 2013. — Vol. 12 (Suppl. 1). — S2.
6. Mukhtar R.Y., Reid J., Reckless J.P. Pitavastatin // Int. J. Clin. Pract. — 2005. — Vol. 12. — P. 239252.
7. Neuvonen P.J., Niemi M., Backman J.T. Drug interactions with lipidlowering drugs: mechanisms and clinical relevance // Clin. Pharmacol. Ther. — 2006. — Vol. 12. — P. 565581.
8. Fujino H., Yamada I., Shimada S. et al. Metabolic fate of pitavastatin (NK104), a new inhibitor of 3hydroxy3methylglutaryl coenzyme A reductase. Effects on drugmetabolizing systems in rats and humans // Arzneimittelforschung. — 2002. — Vol. 12. — P. 745753.
9. Catapano A.L. Pitavastatin — pharmacological profile from early phase studies // Atheroscler SuppI. — 2010. — Vol. 12. — P. 37.
10. Saito Y. Pitavastatin: an overview // Atheroscler. Suppl. — 2011. — Vol. 12. — P. 272276.
11. Aoki T., Nishimura H., Nakagawa S. et al. Pharmacological profile of a novel synthetic inhibitor of 3hydroxy3methylglutarylcoenzyme A reductase // Arzneimittelforschung. — 1997. — Vol. 12. — P. 904909.
12. Morikawa S., Umetani M., Nakagawa S. et al. Relative induction of mRNA for HMG CoA reductase and LDL receptor by five different HMGCoA reductase inhibitors in cultured human cells // J. Atheroscler. Thromb. — 2000. — Vol. 12. — P. 138144.
13. http://www.rxlist.com/livalodrug/clinicalpharmacology.htm
14. Corsini A., Ceska R. Drugdrug interactions with statins: will pitavastatin overcome the statins’ Achilles’ heel? // Curr. Med. Res. Opin. — 2011. — Vol. 27(8). — P. 15511162.
15. Jung J.A., Noh Y.H., Jin S. et al. Pharmacokinetic interaction between pitavastatin and valsartan: a randomized, openlabeled crossover study in healthy male Korean volunteers // Clin. Ther. — 2012. — Vol. 34(4). — P. 958965.
16. Inagaki Y., Hunt T., Arana B. et al. Drugdrug interaction study to assess the effects of multipledose pitavastatin on steadystate warfarin in healthy adult volunteers // J. Clin. Pharmacol. — 2011. — Vol. 51(9). — P. 13021309.
17. Stender S., Budinski D., Hounslow N. Pitavastatin demonstrates longterm efficacy, safety and tolerability in elderly patients with primary hypercholesterolaemia or combined (mixed) dyslipidaemia // Eur. J. Prev. Cardiol. — 2013. — Vol. 20(1). — P. 2939.
18. Stender S., Budinski D., Gosho M. et al. Pitavastatin shows greater lipidlowering efficacy over 12 weeks than pravastatin in elderly patients with primary hypercholesterolaemia or combined (mixed) dyslipidaemia // Eur. J. Prev. Cardiol. — 2013. — Vol. 20(1). — P. 4053.
19. Warrington S., Nagakawa S., Hounslow N. Comparison of the pharmacokinetics of pitavastatin by formulation and ethnic group: an openlabel, singledose, twoway crossover pharmacokinetic study in healthy Caucasian and Japanese men // Clin. Drug Investig. — 2011. — Vol. 31(10). — P. 735743.
20. Mao Y., Yu J.M., Zhan Y.Q. et al. Safety and efficacy of pitavastatin in patients with hypercholesterolemia: a multicenter study // Zhonghua Yi Xue Za Zhi. — 2012. — Vol. 92(14). — P. 968973.
21. Morgan R.E., Campbell S.E., Yu C.Y. et al. Comparison of the safety, tolerability, and pharmacokinetic profile of a single oral dose of pitavastatin 4 mg in adult subjects with severe renal impairment not on hemodialysis versus healthy adult subjects // J. Cardiovasc. Pharmacol. — 2012. — Vol. 60(1). — P. 4248.
22. Han K.H., Rha S.W., Kang H.J. et al. Evaluation of shortterm safety and efficacy of HMGCoA reductase inhibitors in hypercholesterolemic patients with elevated serum alanine transaminase concentrations: PITCH study (PITavastatin versus atorvastatin to evaluate the effect on patients with hypercholesterolemia and mild to moderate hepatic damage) // J. Clin. Lipidol. — 2012. — Vol. 6(4). — P. 340351.
23. Yokote K., Bujo H., Hanaoka H. et al. Multicenter collaborative randomized parallel group comparative study of pitavastatin and atorvastatin in Japanese hypercholesterolemic patients: collaborative study on hypercholesterolemia drug intervention and their benefits for atherosclerosis prevention (CHIBA study) // Atherosclerosis. — 2008. — Vol. 201(2). — P. 345352.
24. Sasaki J., Ikeda Y., Kuribayashi T. et al. A 52week, randomized, openlabel, parallelgroup comparison of the tolerability and effects of pitavastatin and atorvastatin on highdensity lipoprotein cholesterol levels and glucose metabolism in Japanese patients with elevated levels of lowdensity lipoprotein cholesterol and glucose intolerance // Clin. Ther. — 2008. — Vol. 30. — P. 10891101.
25. Teramato T., Shimano H., Yokote K. et al. New evidence on pitavastatin: efficacy and safety in clinical studies // Expert Opin. Pharmacother. — 2010. — Vol. 11(5). — P. 817828.
26. Teramato T., Urashima M., Shimano H. et al. A LargeScale Survey on CardioCerebrovascular Events During pitavastatin (LIVALO Tablet) Therapy in Japanese patients with Hypercholesterolemia — LIVALO Effectiveness and Safety Study Extension (LIVES Study Extension) // Jpn. Pharmacol. Ther. — 2011. — Vol. 39. — P. 789803.
27. Kishida K., Funahashi T., Shimomura I. Importance of Assessing the Effect of Statins on the Function of HighDensity Lipoproteins on Coronary Plaque // Cardiovascular & Haematological Disorders — Drug Targets. — 2012. — Vol. 12. — P. 2834.
28. Mao Y., Yu J.M., Zhang F. et al. The effect of pitavastatin on blood glucose and its efficacy in diabetic patients with hypercholesterolemia // Zhonghua Nei Ke Za Zhi. — 2012. — Vol. 51(7). — P. 508512.
29. Hiro T., Kimura T., Morimoto T. et al. Effect of intensive statin therapy on regression of coronary atherosclerosis in patients with acute coronary syndrome: a multicenter randomized trial evaluated by volumetric intravascular ultrasound using pitavastatin versus atorvastatin (JAPANACS [Japan assessment of pitavastatin and atorvastatin in acute coronary syndrome] study) // J. Am. Coll. Cardiol. — 2009. — Vol. 54. — P. 293302.
30. Warita S., Kawasaki M., Tanaka R. et al. Effects of pitavastatin on cardiac structure and function and on prevention of atrial fibrillation in elderly hypertensive patients: a prospective study of 2years’ followup // Circ. J. — 2012. — Vol. 76(12). — P. 27552762.
31. Оптимизация терапии статинами пациентов высокого и очень высокого сердечнососудистого риска // Cardio Соматика. — 2011. — № 4. — С. 8.