Международный неврологический журнал 1 (63) 2014
Вернуться к номеру
Расстройства сна у пациентов с инсультом: выявление, клиническое значение и современные подходы к лечению
Авторы: Фломин Ю.В. - Инсультный центр, МЦ «Универсальная клиника «Оберіг»; Харьковская медицинская академия последипломного образования
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Сон имеет фундаментальное значение для оптимального функционирования головного мозга и представляет собой новую терапевтическую мишень при многих неврологических расстройствах. Нарушения сна распространены при неврологических заболеваниях и ассоциируются с худшим состоянием здоровья и качеством жизни, повышенным риском травм и преждевременной смерти. Расстройства сна у пациентов с инсультом включают нарушения дыхания во сне, инсомнию, гиперсомнию, циркадианные и двигательные нарушения. За последние годы были достигнуты большие успехи в изучении причин и механизмов нарушений сна, однако основными лечебными подходами при обструктивных апноэ по-прежнему остаются устройства, обеспечивающие постоянное положительное давление в дыхательных путях, а при инсомнии — комбинация когнитивно-поведенческой психотерапии и медикаментозного лечения.
Сон має фундаментальне значення для оптимального функціонування головного мозку і являє собою нову терапевтичну мішень при багатьох неврологічних розладах. Порушення сну поширені при неврологічних захворюваннях і асоціюються з гіршим станом здоров’я та якістю життя, підвищеним ризиком травм і передчасної смерті. Розлади сну в пацієнтів з інсультом включають порушення дихання вві сні, інсомнію, гіперсомнію, циркадіанні й рухові порушення. За останні роки були досягнуті великі успіхи у вивченні причин і механізмів порушень сну, однак основними лікувальними підходами при обструктивних апное, як і раніше, залишаються пристрої, що забезпечують постійний позитивний тиск у дихальних шляхах, а при інсомнії — комбінація когнітивно-поведінкової психотерапії й медикаментозного лікування.
Sleep is of fundamental importance for the optimal functioning of the brain and is a new therapeutic target in many neurological disorders. Sleep disorders are common in neurological diseases and are associated with worse health status and quality of life, increased risk of injury and untimely death. Sleep disorders in patients with stroke include impaired breathing during sleep, insomnia, hypersomnia, circadian and movement disorders. Over recent years there have been achieved major advances in the study of the causes and mechanisms of sleep disorders, but the main therapeutic approaches for obstructive sleep apnea are still devices that provide continuous positive airway pressure, and in insomnia — a combination of cognitive-behavioral psychotherapy and drug treatment.
Статья опубликована на с. 89-100
Введение
Нормальный сон является одним из «трех китов» здоровья наряду с правильным питанием и достаточной физической активностью [19]. Большинство людей проводят во сне около трети своей жизни, однако врачи, к сожалению, редко уделяют этому достаточно внимания. Сон — важный и сложный физиологический процесс, требующий взаимодействия множества различных областей мозга. Чтобы обеспечить нормальный сон, эти структуры должны работать электрически и химически согласованно. Неврологические заболевания, поражающие данные области, могут вызывать значительные нарушения процесса сна, что ведет к целому ряду неблагоприятных последствий [62]. Нарушения сна распространены в общей популяции. Так, апноэ во сне страдает около 3 %, а синдромом беспокойных ног — до 6 % населения [11, 88]. Снижение продолжительности и/или качества сна ассоциируется с худшим состоянием здоровья и качеством жизни, повышенным риском травм и преждевременной смерти [52]. Медицина сна интенсивно развивается уже несколько десятилетий, но в последние годы интерес к проблеме сна как со стороны широкой общественности, так и со стороны врачей стал особенно высок. В настоящее время медицина сна охватывает несколько специальностей (неврологи, психиатры, пульмонологи, кардиологи, интернисты), но ключевую роль в изучении взаимо-связи между сном и мозгом, изучении расстройств сна при неврологических заболеваниях, включая инсульт, сыграли именно неврологи [62].
Среди неврологических заболеваний с инсомнией ассоциируются инсульт, болезнь Паркинсона, рассеянный склероз, деменция, черепно-мозговая травма и эпилепсия [55]. Для пациентов с инсультом, рассеянным склерозом, нервно-мышечными заболеваниями и аффективными расстройствами характерна повышенная утомляемость, которая, по крайней мере отчасти, может быть обусловлена нарушениями сна [62]. Нейродегенеративные изменения в дофаминергических и орексинергических системах нейронов могут способствовать повышенной сонливости, наблюдающейся при болезни Паркинсона [39]. Нарушения сна тесно связаны с состоянием сердечно-сосудистой системы и риском цереброваскулярных заболеваний. Например, апноэ во сне является фактором риска артериальной гипертензии и инсульта [51]. Вместе с тем многие расстройства сна поддаются лечению, что позволяет повысить качество жизни пациентов, улучшить исходы перенесенных и снизить риск новых заболеваний. Так, устранение нарушений дыхания во сне (НДС) улучшает результаты лечения инсульта и снижает риск повторного инсульта [14, 69]. Лечение других расстройств сна также предоставляет дополнительные терапевтические возможности при неврологических заболеваниях. В данном обзоре рассматриваются современные подходы к диагнос-тике и лечению нарушений сна у пациентов после инсульта, которые нашли применение в клинической практике отделения инсульта, нейрореабилитации и длительных нарушений сознания МЦ «Универсальная клиника «Оберіг».
Современные представления о механизмах сна и бодрствования
Сон можно определить как легко обратимое состояние со снижением двигательной активности и сенсорного восприятия [77]. Следует подчеркнуть, что сон является не отсутствием сознания, а активным процессом. Современная эра изучения нарушений сна восходит к Константину фон Экономо, который при эпидемии Encephalitis lethargica во время Первой мировой войны описал две категории пациентов. Одни постоянно пребывали в сонливом состоянии, в то время как другие совсем не могли спать и умирали от бессонницы [81]. Фон Экономо установил, что каждое из этих состояний было обусловлено поражением определенной области мозга, что стало первым свидетельством существования в головном мозге двух дискретных систем, одна из которых поддерживает сон, а другая — бодрствование. У пациентов с инсомнией была поражена преоптическая область гипоталамуса, а у больных с гиперсомнией — задние отделы гипоталамуса и/или ростральные отделы среднего мозга. В настоящее время принято считать, что основные пробуждающие стимулы исходят из холинергических базальных отделов переднего мозга и преимущественно монаминергических нейронов в центральной зоне ствола, которые обычно обозначают как восходящую ретикулярную активирующую систему [62].
Среди нейромедиаторов ведущую роль в поддержании бодрствования играют ацетилхолин, норадреналин, серотонин, гистамин, дофамин и орексин/гипокретин. Повреждения холинергических базальных отделов лобных долей мозга сопровождаются снижением активности коры и уровня бодрствования. Норадреналин, образующийся в locus coeruleus, стимулирует активность мозга, особенно в стрессовой ситуации. В эксперименте охлаждение голубого пятна вызывает сон, а разрушение — кому [62]. Помимо возбуждения коры, важной функцией голубого пятна является поддержание мышечного тонуса [36]. Другим важным медиатором бодрствования и тонуса мышц является серотонин, вырабатываемый ядрами дорсального шва. Угнетение продукции серотонина во время фазы сна с быстрыми движениями глаз ведет к снижению тонуса мышц и способствует апноэ [18]. Гистамин секретируется туберомамиллярным ядром гипоталамуса и также способствует поддержанию состояния бодрствования. Повышенная экспрессия генов дофаминергических нейронов каудального гипоталамуса во время бодрствования указывает на роль дофамина в активации коры [42]. Психостимулирующий эффект такого средства, как модафинил, по-видимому, реализуется через дофаминергические механизмы, поскольку блокирование дофаминовых рецепторов квинпиролом (quinpirole) приводит к исчезновению этих эффектов. Открытый недавно нейропептид орексин (также известен как гипокретин) секретируется нейронами, которые имеют множество проекций в кору и другие активирующие ядра мозга. Считается, что орексинергические нейроны играют ключевую роль в поддержании состояния бодрствования [62].
Как уже упоминалось, сон является активным процессом, что предполагает деятельность специальных центров, генерирующих сон. По сравнению с активирующей системой мозга, обеспечивающей бодрствование, ее антагонист пока изучен хуже, однако известно, что ключевую роль в обеспечении сна играет вентролатеральная преоптическая область гипоталамуса. На этот центр, по-видимому, оказывают влияние как циркадианные ритмы, так и гомеостатические процессы. Среди нейромедиаторов ведущие позиции в индукции сна принадлежат аденозину, простагландину D2, галанину и провоспалительным цитокинам, таким как интерлейкин-1 и фактор некроза опухолей [40]. Блокирование аденозиновых рецепторов такими средствами, как кофеин, уменьшает сонливость и тягу ко сну [62].
Системы мозга, обеспечивающие бодрствование и сон, находятся в реципрокных взаимоотношениях (принцип балансира). Вентролатеральная преоптическая область гипоталамуса подавляет активирующие центры мозга (туберомамиллярное ядро, голубое пятно, ядра дорсального шва и латеральный гипоталамус), а активирующие центры, напротив, ингибируют вентролатеральную преоптическую область. Данный принцип обеспечивает то, что в норме человек может легко переходить от сна к бодрствованию и, наоборот, и находиться в каком-то одном из этих состояний [62].
Распространенные расстройства сна
Инсомния
Бессонница может иметь различные проявления: трудности при засыпании или поддержании сна (частые пробуждения), ранние утренние пробуждения, низкое качество сна. Во Второй Международной классификации расстройств сна (International Classification of Sleep Disorders-2 — ICSD-2) выделены 11 подтипов инсомнии и подчеркивается, что для постановки клинического диагноза инсомнии необходимо наличие хотя бы одного из функциональных расстройств в дневное время: повышенная утомляемость, сонливость, раздражительность, снижение памяти или внимания [2]. В Международной классификации болезней 10-го пересмотра указано, что инсомния диагностируется в случае нарушений сна в течение не менее чем 3 ночей в неделю [85]. Бессонница обычно делится на первичную и вторичную, которая может быть обусловлена другим соматическим или психиатрическим заболеванием или приемом лекарств.
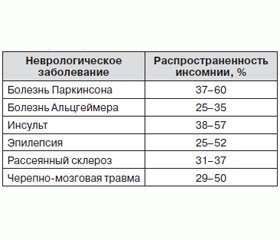
Инсомния часто встречается у пациентов с неврологическими расстройствами (табл. 1) [11].
/91/91.jpg)
При неврологических заболеваниях нарушения сна могут быть обусловлены как изменениями в головном мозге, так и другими проявлениями (боль, двигательные или аффективные расстройства) или принимаемыми лекарствами. Инсомния зачастую является хроническим расстройством, оказывающим неблагоприятное влияние на жизнедеятельность пациента. Результаты недавнего метаанализа свидетельствуют, что у пациентов с инсомнией вдвое выше риск развития депрессии [5].
Неблагоприятные последствия инсомнии:
— снижение качества жизни;
— сонливость или повышенная утомляемость днем;
— когнитивные нарушения;
— снижение работоспособности;
— временная или стойкая нетрудоспособность;
— повышенный риск травм и несчастных случаев;
— повышенный риск психических заболеваний (депрессия);
— повышенный риск сердечно-сосудистых заболеваний (гипертензия, инсульт);
— повышенный риск онкозаболеваний.
Нарушения дыхания во сне
Нарушения дыхания во сне — широкое понятие, описывающее любые проблемы с дыханием или вентиляцией легких, возникающие во время сна. НДС включают обычный храп, обструктивное апноэ во сне (ОАС) и центральное апноэ во сне (ЦАС) [83]. Обычным храпом страдает до 40 % взрослого населения. Храп в сочетании с остановками дыхания (апноэ или гипопноэ) и сонливостью в дневное время — ключевые компоненты синдрома ОАС. ОАС характеризуется периодическим частичным или полным закрытием верхних дыхательных путей с падением сатурации крови кислородом и фрагментацией сна (пробуждениями) [26]. В 1990-х гг. Young et al. сообщили, что синдром ОАС встречается у 4 % мужчин и 2 % женщин, а распространенность апноэ во сне без соответствующих жалоб в общей популяции достигает 24 % среди мужчин и 9 % среди женщин [90]. Результаты более новых эпидемиологических исследований свидетельствуют, что ОАС страдает до 17 % взрослого населения и распространенность и тяжесть данного синдрома увеличиваются с возрастом [6]. В особых популяциях, таких как люди пожилого возраста или страдающие ожирением, частота апноэ во сне составляет около 60 % [68]. Факторы риска ОАС включают ожирение, мужской пол, увеличение толщины шеи и анатомические особенности лица и черепа, которые приводят к сужению дыхательных путей [26]. Апноэ во сне, особенно его обструктивная форма, является независимым фактором риска цереброваскулярных заболеваний. Апноэ нарушает сон, ночь за ночью запуская каскад неблагоприятных событий, ведущих к разрушению физического и психического здоровья.
В норме артериальное давление (АД) ночью снижается на 10–20 % по сравнению с дневными показателями (явление диппинга — от англ. dipping). При наличии –апноэ во сне часто АД ночью снижается менее чем на 10 %, что ассоциируется с повышенным риском болезни мелких сосудов мозга и инсультом [31]. Апноэ во сне вследствие гипоксии, гиперкапнии, барорефлексов вызывает значительное увеличение симпатической активности, что сопровождается повышением АД и частоты сердечных сокращений. Стойкая симпатическая активация является связующим звеном между апноэ во сне и развитием артериальной гипертензии. Существует прямая связь между тяжестью апноэ во сне и тяжестью артериальной гипертензии, включая ее резистентность к фармакотерапии [46, 67]. Кроме повышения АД, апноэ во сне может стимулировать воспаление, оксидантный стресс и дисфункцию эндотелия. Гипоксия и воспаление взаимосвязаны на молекулярном, клеточном и клиническом уровне. Так, повторные эпизоды гипоксии ведут к повреждению эндотелия и высвобождению провоспалительных цитокинов, таких как фактор некроза опухолей альфа и интерлейкин-6 [27]. В исследованиях была выявлена сильная прямая связь между тяжелой формой апноэ во сне и риском инсульта, которая не зависела от наличия прочих факторов риска [63]. Кроме того, результаты 5-летнего наблюдения за 3542 пациентами продемонстрировали, что у испытуемых моложе 65 лет снижение сатурации кислородом ночью (по данным полисомнографии) является предиктором появления фибрилляции предсердий [25].
Длительно существующее апноэ во сне ассоциируется с когнитивными нарушениями, обусловленными хронической гипоксией и болезнью мелких сосудов мозга на фоне артериальной гипертензии [19]. Так, Yaffe et al. продемонстрировали, что у пожилых женщин, страдающих апноэ во сне, когнитивное снижение более выражено, чем у их сверстниц без апноэ. Авторы также пришли к выводу, что когнитивная дисфункция имеет более тесную связь с гипоксемией, чем с нарушением структуры сна и апноэ [89]. С другой стороны, раннее начало лечения с использованием устройств, обеспечивающих постоянное положительное давление в дыхательных путях (continuous positive airway pressure — CPAP), способствует восстановлению когнитивных функций и профилактике деменции у пациентов с апноэ во сне [54].
Нарушения сна у пациентов с инсультом
Частота, клиническое значение и возможности лечения НДС и расстройств цикла «сон — бодрствование» при инсульте недостаточно известны даже среди неврологов и специалистов по инсульту [28]. Это тем более удивительно, что данные расстройства чрезвычайно распространены (встречаются у 30–70 % пациентов) и могут быть легко распознаны на основании клинических данных [9, 41, 43].
Расстройства дыхания во сне
В остром периоде ишемического инсульта нередко нарушается церебральная вазомоторная реактивность. Alexandrov et al. обнаружили, что под действием вазодилататоров (например, углекислого газа) во внутричерепных сосудах может наблюдаться феномен «обкрадывания», который они назвали «обратным синдромом Робина Гуда» [1]. Данный синдром может быть одной из ведущих причин ухудшения состояния пациентов в раннем периоде инсульта [19].
Наиболее распространенной формой НДС является ОАС, обусловленное прекращением прохождения потока воздуха через нос вследствие спадания верхних дыхательных путей [9]. Дыхание Чейна — Стокса характеризуется циклическим чередованием центрального апноэ и гиперпноэ (паттерн «крещендо — декрещендо»). ОАС и дыхание типа Чейна — Стокса связывают с повреждением центральных вегетативных центров и их связей (например, в островке или таламусе) [76]. Выраженность НДС со временем обычно уменьшается, хотя при наличии хронической сердечной недостаточности они могут быть стойкими [64, 78]. Регрессу НДС способствуют восстановление неврологического дефицита, сокращение времени нахождения в положении лежа на спине, успешное лечение осложнений со стороны легких (пневмония) и сердца (отеки) и ранняя мобилизация пациента [28].
Апноэ во сне встречается у 50–75 % пациентов после инсульта [21]. Если в раннем периоде инсульта чаще наблюдается ЦАС, то в отдаленном периоде преобладают ОАС [66]. ЦАС характеризуется повторяющимися остановками дыхания вследствие потери вентиляционного драйва, которые длятся не менее 10 с и не сопровождаются дыхательными движениями. Выявлена связь между ЦАС, гиперинтенсивными очагами в белом веществе и прогрессированием асимптомного стеноза сонных артерий [83]. Апноэ во сне в постинсультном периоде ассоциируется с увеличением длительности пребывания в стационаре, плохим функциональным исходом, депрессивным состоянием, когнитивными нарушениями и отклонениями в поведении [15, 37].
У пациентов с повторным инсультом частота НДС выше, чем после первого инсульта. В большинстве исследований не обнаружено связи между НДС и тяжестью, локализацией или этиологией инсульта [75]. Интересно, что частота НДС после инсульта и транзиторной ишемической атаки не отличалась [56].
Нарушения бодрствования
Спектр нарушений бодрствования в постинсультном периоде довольно широк: гиперсомния (значительное увеличение продолжительности сна в течение суток), избыточная сонливость (склонность засыпать днем) и повышенная утомляемость (дефицит энергии, физическое истощение). Гиперсомния была описана при подкорковых, таламомезенцефальных, понтинных, медиальных понтомедуллярных и даже корковых инфарктах. Наиболее тяжелая гиперсомния наблюдается при парамедианных таламических инсультах [29]. Гиперсомния со временем обычно регрессирует, в то время как повышенная утомляемость может сохраняться многие месяцы и годы после инсульта [28].
Нарушения сна
Результаты исследования 277 последовательно госпитализированных пациентов с инсультом свидетельствуют, что в течение первого месяца частота инсомнии достигала 57 % (у 18 % она возникла впервые) [43]. Инсомния в раннем периоде инсульта чаще бывает вызвана осложнениями, а не самим поражением мозга. Определенную роль могут играть как средовые факторы (шум, избыточное освещение, работа мониторов), так и сопутствующие заболевания (сердечная недостаточность, НДС, тревожность, депрессия, боль).
Расстройства циркадианного ритма после инсульта
В исследованиях с 24-часовым мониторингом артериального давления было показано, что при остром инсульте у 30 % пациентов отсутствует физиологическое снижение АД в ночное время (нондиппинг), а у 58 % больных возникает повышение АД (обратный диппинг) [33]. Причины этого явления многообразны: стресс вследствие инсульта и госпитализации, активация гипофизарно-гипоталамической и ренин-ангиотензиновой систем, патобиологические процессы в головном мозге, борьба с церебральной гипоперфузией и ишемией, изменение тонуса центральных вегетативных центров и т.д. [11, 65]. Аберрантный циркадианный ритм в раннем периоде инсульта может служить предиктором плохого функционального исхода. Так, сохранение физиологического диппинга в первые сутки после инсульта ассоциируется с лучшим неврологическим восстановлением и исходом через 7 дней от начала заболевания [11].
Двигательные расстройства сна у пациентов после инсульта
При исследовании через 1 мес. после инсульта Lee et al. обнаружили возникшие de novo проявления синдрома беспокойных ног у 15 (12 %) из 137 пациентов. Данные симптомы возникали преимущественно при инфарктах в основании моста, зрительном бугре, подкорковых ганглиях и лучистом венце. Примерно в двух третях случаев нарушения были двусторонними, хотя у одной трети пациентов они наблюдались лишь контралатерально очагу [41]. Между синдромом беспокойных ног/периодическими движениями конечностей во сне, артериальной гипертензией и инсультом существует взаимосвязь, в основе которой лежит симпатическая гиперактивность [84]. Согласно результатам популяционного исследования в Швеции, в ходе которого за 5102 жителями в возрасте 30–65 лет наблюдали более 20 лет, смертность среди женщин с синдромом беспокойных ног и повышенной сонливостью в дневное время (после внесения поправок на возраст, продолжительность сна, факторы образа жизни и сопутствующие заболевания) была выше, чем у женщин без этих нарушений [40].
Влияние нарушений сна на постинсультную реабилитацию
Результаты ряда исследований указывают на то, что НДС и инсомния увеличивают длительность пребывания в стационаре и негативно влияют на ближайшие и отдаленные исходы инсульта [22, 43, 70, 75, 82]. Так, наличие НДС ассоциировалось с худшей оценкой по индексу Бартел через 6 мес. от начала заболевания [82]. По-видимому, эффекты НДС опосредованы артериальной гипертензией и связанными с ней макро- и микроангиопатией [28]. Низкое качество и/или недостаточная продолжительность сна вызывают нарушения восстановительных процессов в организме, которые происходят при нормальном сне [50]. ОАС, инсомния и синдром беспокойных ног ассоциируются с депрессивным состоянием, сонливостью в дневное время, повышенной утомляемостью и нарушениями исполнительных функций, что ограничивает возможности реабилитации [26, 28, 74]. У постинсультных пациентов с нарушениями сна снижена мотивация, они более рассеянны, менее энергичны и быстрее устают, что сказывается на результативности интенсивной стационарной реабилитации. Недавно в небольшом клиническом исследовании у пациентов после инсульта было показано, что при ОАС лечение с помощью СРАР положительно влияет на функциональное восстановление и депрессивные симптомы, но не на когнитивные нарушения [69]. Таким образом, имеющиеся на сегодняшний день данные свидетельствуют о том, что лечение нарушений сна может способствовать улучшению исходов заболевания и повышению эффективности реабилитации [83].
Выявление и оценка нарушений сна
Краеугольным камнем клинической диагностики инсомнии является тщательный сбор анамнеза. Следует выяснить, когда появились нарушения сна, в чем они состоят, как часто возникают, насколько влияют на жизнедеятельность в дневное время, от чего они усиливаются и уменьшаются, какие виды лечения применялись ранее и были ли они эффективны. Большое значение могут иметь такие факторы, как психоэмоциональный стресс, сопутствующие заболевания и используемые медикаменты, а также курение, потребление кофе и алкоголя. Следует также провести физический осмотр пациента и скрининг на аффективные расстройства [12, 16].
Анамнестические сведения, которые важны у пациентов с инсомнией:
— начало и длительность нарушений сна;
— характер нарушений сна (трудности при засыпании, ночные пробуждения, ранние утренние пробуждения);
— провоцирующие факторы (стресс, болезнь и т.д.);
— причины улучшений и ухудшений;
— дневные последствия нарушений сна;
— ранее применявшееся лечение;
— условия и соблюдение гигиены сна;
— признаки сопутствующих соматических или психических заболеваний;
— принимаемые медикаменты;
— курение, потребление алкоголя и кофеина.
Для получения более детальной субъективной и объективной информации могут использоваться специальные методы, такие как дневник сна, вопросники, актиграфия и полисомнография. Дневник сна — это инструмент для оценки нарушений сна, пациент ежедневно заносит в него информацию об особенностях своего сна. Сведения обычно включают информацию о принимаемых медикаментах, времени, когда пациент лег спать и когда уснул, о количестве ночных пробуждений, времени окончательного пробуждения, времени подъема и продолжительности дневного сна. Как правило, сведения в дневник сна заносятся не менее 1 недели. В случае инсомнии дневник помогает установить, сколько времени пациент проводит в постели или спит днем. Пример дневника сна можно найти в свободном доступе в Интернете (yoursleep.aasmnet.org/pdf/sleepdiary.pdf).
Кардинальным симптомом нарушений сна, и в частности ОАС, является сонливость или повышенная утомляемость в дневное время. Для выявления дневной сонливости широко используется шкала сонливости Эпворта (Epworth Sleepiness Scale — ESS) — вопросник, в котором пациент оценивает свою склонность засыпать в восьми типичных ситуациях: чтение сидя, просмотр телевизора, пребывание сидя в общественном месте, поездка в транспорте в качестве пассажира, отдых днем в положении лежа, разговор с кем-либо в положении сидя, отдых после обеда в положении сидя и остановка в движении при управлении автомобилем [35]. Испытуемый выбирает ответы от 0 баллов — никогда или очень редко — до 3 баллов — всегда или очень часто. Если сумма баллов ≥ 10, у пациента выражена дневная сонливость. Питтсбургский индекс качества сна (Pittsburgh Sleep Quality Index) был разработан в 1988 году как инструмент для оценки качества сна в клинической психиатрии [13]. Это заполняемый пациентом вопросник, который характеризует его сон на протяжении 1 месяца. На основании ответов на 19 вопросов рассчитываются 7 показателей: субъективное качество сна, задержка сна, продолжительность сна, удовлетворенность сном, нарушения сна, использование снотворных средств и дисфункция в дневное время. Чем выше сумма баллов, тем меньше пациент доволен своим сном, причем общий балл ≥ 6 свидетельствует о низком качестве сна. В 2001 году Morin et al. предложили индекс тяжести инсомнии (Insomnia Severity Index) — краткую шкалу для скрининга на нарушения сна и оценки эффективности лечения [10]. Шкала содержит 7 вопросов, ответы на которые оцениваются в диапазоне от 0 до 4 баллов. Сумма баллов интерпретируется следующим образом: 0–7 — отсутствие инсомнии, 8–14 — незначительная инсомния, 15–21 — умеренная инсомния, 22–28 — тяжелая инсомния. Исследования продемонстрировали надежность данного инструмента при выявлении нарушений сна и оценке изменений на фоне лечения [60].
Золотым стандартом объективной оценки сна считается полисомнография, включающая электроэнцефалографию, электроокулографию (регистрацию движений глазных яблок), регистрацию респираторных параметров (поток воздуха, сатурация кислородом), положения тела и мышечной активности. Полисомнография не рекомендуется как средство для рутинной оценки пациентов с инсомнией в клинической практике, если нет оснований подозревать коморбидные расстройства, такие как апноэ во сне или нарколепсия [16]. Существуют портативные устройства, которые позволяют осуществлять мониторинг большинства полисомнографических показателей у пациента дома. Проведение исследования дома рекомендуется при умеренной или высокой вероятности обструктивных дыхательных нарушений и отсутствии сопутствующих заболеваний, таких как заболевания легких или нервно-мышечные расстройства, которые могут вызвать гиповентиляцию. Более простым методом, позволяющим с достаточной точностью регистрировать периоды отдыха, является актиграфия — мониторинг двигательной активности с помощью акселерометра. Данные, полученные с помощью актиграфии, следует сопоставить с дневником сна пациента, что позволяет дифференцировать сон и спокойный отдых, а также сопоставить субъективную и объективную оценку продолжительности сна. Данный метод особенно полезен при циркадианных расстройствах и первичной оценке пациентов с бессонницей или гиперсомнией [58].
Лечение расстройств сна
Основными лечебными подходами при расстройствах сна являются когнитивно-поведенческая психотерапия (КПП), фармакотерапия и их комбинация. Результаты исследований свидетельствуют, что по эффективности КПП не уступает фармакотерапии, хотя специальных исследований у пациентов с инсультом пока нет [83]. При КПП в центре внимания находятся психологические, поведенческие и когнитивные факторы, способствующие инсомнии. Курс КПП обычно состоит из шести индивидуальных встреч со специально подготовленным психотерапевтом. Среди техник, используемых в рамках КПП, наиболее высокую эффективность продемонстрировали контроль стимулов и обучение релаксации, и обе эти техники настоятельно рекомендуются в действующем руководстве Американской академии медицины сна [59]. Контроль стимулов подра-зумевает восстановление связи между постелью и сном (например, избегать пребывания в постели в дневное время, не лежать в постели, когда не спишь, не спать в другом месте, соблюдать гигиену сна) [61]. Кроме того, рекомендуется разрешать пациенту проводить в постели ровно столько времени, сколько продолжается его сон. Сначала это приводит к недосыпанию, однако впоследствии повышает качество сна [59]. При обучении релаксации используются такие методы, как прогрессирующая мышечная релаксация и медитация. Пациента учат расслабляться, снимать напряжение и избавляться от тревожных мыслей, мешающих сну. Поведенческие вмешательства обычно сочетаются с когнитивной психотерапией, которая включает исправление неправильных представлений о сне и бессоннице и –изучение гигиены сна [61].
Лечение НДС
НДС обычно легко документировать с помощью полиграфии, которая включает оценку носового потока воздуха, дыхательных движений и сатурации кислородом. Такая диагностика показана всем пациентам с инсультом, у которых возможно лечение СРАР, в то время как полисомнографию следует использовать как резервное исследование в более сложных или неясных случаях [28]. Лечебная тактика при НДС включает правильное позиционирование пациента, профилактику и лечение осложнений (например, респираторных инфекций или боли) и осторожность в использовании седативных и снотворных средств [28, 83].
Лечение ЦАС, таких как дыхание Чейна — Стокса, включает использование СРАР и/или кислорода и наблюдение за пациентом для оценки эффективности проводимых вмешательств [64]. Новый метод вентиляционной поддержки — адаптивная сервовентиляция — обеспечивает максимальную поддержку при апноэ и минимальную поддержку при гиперпноэ, способствуя нормализации паттерна дыхания [83]. В случае стойкой гиповентиляции может потребоваться перевод на искусственную вентиляцию легких во вспомогательном режиме.
Лечебным вмешательством первой линии при умеренном и тяжелом ОАС является СРАР [28, 83]. Постоянное положительное давление в дыхательных путях создается специальным аппаратом, который через шланг нагнетает воздух в маску, закрепленную на лице пациента. Таким образом, СРАР работает как «пневматическая шина», поддерживающая проходимость дыхательных путей и препятствующая их спаданию. Применение СРАР ассоциируется с улучшением самочувствия, нормализацией ночных показателей АД, уменьшением выраженности депрессии и снижением риска новых сосудистых событий [7, 53, 72]. Применение СРАР, начиная с раннего периода заболевания, положительно влияет на восстановление неврологических и когнитивных функций во время реабилитации [19]. Поскольку доказательств эффективности СРАР у пациентов с инсультом пока недостаточно, ее рекомендуется использовать преимущественно при тяжелых ОАС с наличием симптомов в дневное время и явных сосудистых факторов риска (например, устойчивой к лечению гипертензии). Эффективность СРАР напрямую зависит от приверженности пациента. Так, для уменьшения дневной сонливости необходимо использовать аппарат СРАР каждую ночь в течение не менее 4 ч, а для снижения артериального давления — минимум 5–6 ч. Основной проблемой при использовании СРАР у пациентов в остром и подостром периоде инсульта является низкая приверженность, которая составляет не более 50 %. Плохая приверженность к лечению обычно обусловлена спонтанным регрессом НДС, бульбарными или психическими нарушениями [28].
Лечение расстройств циркадианного ритма после инсульта
Поскольку отклонения циркадианного паттерна АД являются установленным фактором риска инсульта и других сердечно-сосудистых событий, для оптимизации вторичной профилактики и, в частности, лечения антигипертензивными средствами необходим периодический амбулаторный суточный мониторинг АД. Результаты отдельных проспективных исследований свидетельствуют о преимуществах (снижение риска сосудистых событий и смерти) приема стандартных антигипертензивных средств вечером перед сном по сравнению с более привычным утренним приемом [30]. Поэтому при нондиппинге или обратном диппинге наряду с модификацией прочих факторов риска, по-видимому, следует внести коррективы в схему приема антигипертензивных средств.
Влияние медикаментов на сон и бодрствование
С помощью фармакологических вмешательств можно влиять на деятельность различных систем мозга, стимулируя сон или бодрствование. Катехоламинергические средства, такие как кокаин или амфетамины, способствуют бодрствованию, в то время как снижение уровня катехоламинов (например, при использовании резерпина) может вызывать сонливость. Хорошо известно седативное действие антигистаминных средств. Антидепрессанты, особенно из группы селективных ингибиторов обратного захвата серотонина, увеличивают содержание в мозге серотонина и затрудняют наступление сна [4]. Агонисты холинергических рецепторов (например, прозерин) способствуют активации психической деятельности, в то время как их антагонисты (например, атропин) вызывают сонливость. Следует подчеркнуть, что сон, вызванный лекарственными средствами, обычно существенно отличается от естественного [79].
Мишенью для большинства средств, используемых в качестве гипнотиков, служат рецепторы типа А гамма-аминомасляной кислоты (ГАМКА). Принято считать, что эти рецепторы, которые очень распространены в центральной нервной системе, ответственны за процессы торможения и изменения нейрональной активности во время сна. Многие вызывающие сон средства, включая этанол и бензодиазепины, действуют на ГАМКА [34]. Однако ГАМКергические средства наряду со снотворным имеют и ряд других, менее благоприятных эффектов. Такие побочные эффекты бензодиазепинов, как сонливость, нарушения когнитивных функций (особенно памяти) и повышенный риск падений, отрицательно влияют на функциональное состояние и делают их использование у пациентов после инсульта нежелательным [45]. Еще одним существенным недостатком ГАМКергических средств является появление или усиление ОАС, которое становится заметным, например, после приема даже небольших доз алкоголя [32].
Фармакотерапия при гиперсомнии и инсомнии
Расстройства цикла «сон — бодрствование» становятся очевидны при наблюдении за пациентом в стационаре, однако нередко на них обращают внимание лишь после выписки из больницы. Добиться улучшения при постинсультной гиперсомнии трудно. У пациентов с парамедианными таламическими инфарктами может оказаться результативным лечение бромокриптином (20–40 мг в сутки), модафинилом (200 мг в сутки) или метилфенидатом (20–50 мг в сутки) [9]. Комбинация леводопы (100 мг в сутки) и метилфенидата (5–30 мг в сутки) оказывает положительное влияние на неврологическое восстановление в раннем периоде инсульта, что отчасти может быть связано с более высоким уровнем бодрствования [44]. К сожалению, модафинил и метилфенидат пока в Украине недоступны.
Лечение инсомний включает соблюдение гигиены сна (тихое помещение, шумоизоляция, яркое освещение и физическая активность днем) и ограниченное использование гипнотиков (табл. 2).
Первой линией лекарственных средств, применяющихся для лечения инсомний, обычно являются агонисты бензодиазепиновых рецепторов [73]. Эти средства связываются с ГАМКА-рецепторами и в зависимости от структуры подразделяются на собственно бензодиазепины и небензодиазепиновые средства. Риск побочных эффектов при использовании бензодиазепинов в целом выше, чем небензодиазепиновых средств, хотя большое значение имеют доза и время полужизни препарата [27]. Буспирон (Буспирон, Сандоз) является противотревожным средством, которое может потенцировать антидепрессивные эффекты селективных ингибиторов обратного захвата серотонина, улучшать сон при тревожных расстройствах (например, при посттравматическом стрессовом расстройстве) и выгодно отличается от бензодиазепинов отсутствием выраженной седации, угнетения дыхания и мышечной релаксации, а также риска формирования зависимости [48]. Интересно, что комбинация –Буспирона с мелатонином может быть эффективна при большой депрессии (включая улучшение сна) и стимулировать появление новых нервных клеток (нейрогенез) [24]. Кроме того, Буспирон позитивно влияет на нейропсихиатрические симптомы у пациентов после инсульта, такие как агрессия и враждебность. У пациентов с легкой и умеренной тревожностью Буспирон может улучшать субъективное качество сна, при этом не вызывая сонливости в дневное время [20]. Если у пациентов с тревожными расстройствами, которые принимают Буспирон, сохраняются трудности при засыпании, к лечению следует добавить собственно снотворные средства.
Небензодиазепиновые снотворные средства включают золпидем, зопиклон и залеплон. Выбор зависит от характера нарушений сна и времени полужизни средства. Средства с коротким временем полужизни — золпидем (2,5 ч) и залеплон (1 ч) — обычно используются в случае трудностей при засыпании. Залеплон может также использоваться при ночном пробуждении, если до подъема осталось не менее 4 ч. Зопиклон, имеющий время полужизни 5–6 ч, может использоваться как при трудностях с засыпанием, так и при частых ночных пробуждениях. Ежедневное использование эсзопиклона и частое использование золпидема замедленного высвобождения в течение 6 мес. не сопровождалось ни снижением эффективности, ни феноменом рикошета после прекращения приема. Побочные эффекты данной группы средств включают седацию, головокружение, нарушение двигательного контроля, когнитивные нарушения, головную боль, амнезию и нарушения со стороны желудочно-кишечного тракта [61].
Доксепин является антидепрессантом, который при использовании в малых дозах (до 6 мг) продемонстрировал способность уменьшать частоту пробуждений среди ночи и повышать качество сна. В этих дозах (которые значительно ниже, чем при лечении депрессии) доксепин действует преимущественно как антагонист 1-гистаминовых рецепторов и почти не имеет антихолинергических побочных эффектов [27]. Другие седативные антидепрессанты, такие как миртазапин и тразодон, в небольших дозах также часто используются для лечения нарушений сна. Миртазапин может быть особенно полезен, если в основе нарушений сна лежат тревожно-депрессивные расстройства [86]. Антидепрессанты не вызывают привыкания или зависимости, что важно в случае повышенного риска злоупотребления лекарствами. Потенциальные побочные эффекты включают сонливость, головокружение, набор веса, сердечные аритмии и ортостатическую гипотензию.
Противоэпилептические средства, такие как прегабалин или габапентин, также используются для лечения инсомнии у отдельных категорий пациентов. Эти средства особенно эффективны у пациентов с генерализованным тревожным расстройством или хронической нейропатической болью [57, 71]. Потенциальные побочные эффекты включают сонливость, головокружение, когнитивные нарушения и изменения настроения.
При нарушениях сна у пациентов пожилого возраста в клинической практике иногда прибегают к атипичным нейролептикам, таким как оланзапин и кветиапин. Эти средства увеличивают продолжительность сна и повышают его качество у пациентов с шизофренией [17]. Побочные эффекты включают нарушения липидного обмена, набор веса, экстрапирамидные симптомы, повышенный риск сахарного диабета и преждевременной смерти. В связи со значительным риском побочных эффектов Американская психиатрическая ассоциация не рекомендует рутинно назначать атипичные нейролептики в качестве средств первой линии для лечения инсомнии [3].
Назначение ницерголина в качестве дополнительного лечения в постинсультном периоде способствует повышению качества жизни пациентов, включая уменьшение проявлений бессонницы и нейропсихических нарушений, таких как абулия и апатия. Ницерголин (Ницериум, Сандоз) является мультимодальным лекарственным средством, которое может способствовать нормализации цереброваскулярной реактивности и восстановлению нарушенных функций у пациентов, перенесших инсульт. В пилотном двойном слепом рандомизированном клиническом исследовании была изучена эффективность 6-месячного лечения ницерголином (60 мг в день) в постинсультном периоде. Результаты указывали на улучшение двигательных и когнитивных функций. Подобные выводы были сделаны и на основании данных, полученных в другом двойном слепом рандомизированном клиническом исследовании ницерголина (60 мг в день в течение 3 мес.) у 48 пациентов с гемипарезом [87].
Лечение двигательных расстройств сна
Стандартом лечения синдрома беспокойных ног и периодических движений конечностей во время сна являются агонисты дофаминовых рецепторов: прамипексол (0,25–1 мг в сутки), ропинирол (0,25–2 мг в сутки) или ротиготин в виде трансдермального пластыря [80]. Кроме того, могут применяться габапентин (300–1200 мг на ночь), прегабалин (150–450 мг в сутки) и Наком (125–250 мг) [28]. При синдроме беспокойных ног следует избегать кофеина, алкоголя и некоторых лекарств (блокаторы дофаминовых рецепторов, селективные ингибиторы обратного захвата серотонина, ингибиторы обратного захвата серотонина и норадреналина, трициклические антидепрессанты, метоклопрамид, литий), которые могут усугублять имеющиеся двигательные нарушения [28, 80].
Заключение
Расстройства сна очень распространены после инсульта и оказывают существенное влияние на исходы болезни, качество жизни пациентов и их близких, риск новых сосудистых событий. ОАС является независимым фактором риска повторного инсульта, но лечение с помощью СРАР позволяет снизить риск сердечно-сосудистых заболеваний. Инсомния может быть как самостоятельным расстройством, так и проявлением неврологических, соматических или психиатрических заболеваний. Устранение расстройств сна представляется потенциально эффективным терапевтическим вмешательством, поэтому их следует активно выявлять с помощью скрининговых инструментов, таких как шкала сонливости Эпворта, и проводить соответствующее лечение. Сотрудничество между специалистами по инсульту и медицине сна и дальнейшие исследования в данной области будут способствовать более глубокому пониманию взаимосвязи между сном и цереброваскулярными заболеваниями, улучшению результатов лечения инсульта и повышению эффективности реабилитации и вторичной профилактики.
1. Alexandrov A.V., Nguyen H.T., Rubiera M. et al. Prevalence and risk factors associated with reversed Robin Hood syndrome in acute ischemic stroke // Stroke. 2009; 40: 2738-42.
2. American Academy of Sleep Medicine. The international classification of sleep disorders, diagnostic and coding manual. 2nd edition. American Academy of Sleep Medicine: Westchester, IL, 2005.
3. American Psychiatric Association, 2013 (www.psychiatry.org/File %20Library/Practice/News/APA_Choosing_Wisely_-List_FINAL.pdf)
4. Armitage R. The effects of antidepressants on sleep in patients with depression // Can. J. Psychiatry. 2000; 45: 803-9.
5. Baglioni C., Battagliese G., Feige B. et al. Insomnia as a predictor of depression: a meta-analytic evaluation of longitudinal epidemiological studies // J. Affect. Disord. 2011; 135(1-3): 10-9.
6. Baldwin C.M., Ervin A.M., Mays M.Z. et al. Sleep disturbances, quality of life, and ethnicity: the Sleep Heart Health Study // J. Clin. Sleep Med. 2010; 6: 176-83.
7. Barbe F., Duran-Cantolla J., Capote F. et al. Long-term effect of continuous positive airway pressure in hypertensive patients with sleep apnea // Am. J. Respir. Crit. Care Med. 2010; 181: 718-26.
8. Bassetti C., Valko P. Poststroke hypersomnia // Sleep Med. Clinics. 2006; 1: 139-155.
9. Bassetti C.L., Milanova M., Gugger M. Sleep-disordered breathing and acute ischemic stroke: diagnosis, risk factors, treatment, evolution, and long-term clinical outcome // Stroke. 2006; 37: 967-972.
10. Bastien C.H., Vallieres A., Morin C.M. Validation of the insomnia severity index as an outcome measure for insomnia research // Sleep Med. 2001; 2(4): 297-307.
11. Bhalla A., Wolfe C.D., Rudd A.G. The effect of 24 h blood pressure levels on early neurological recovery after stroke // J. Intern. Med. 2001; 250: 121-30.
12. Buysse D.J., Ancoli-Israel S., Edinger J.D. et al. Recommendations for a standard research assessment of insomnia // Sleep. 2006; 29(9): 1155-73.
13. Buysse D.J., Reynolds C.F. 3rd, Monk T.H. et al. The Pittsburgh sleep quality index: a new instrument for psychiatric practice and research // Psychiatry Res. 1989; 28(2): 193-213.
14. Chan W., Coutts S.B., Hanly P. Sleep apnea in patients with transient ischemic attack and minor stroke: opportunity for risk reduction of recurrent stroke? // Stroke. 2010; 41: 2973-5.
15. Cherkassky T., Oksenberg A., Froom P. et al. Sleep-related breathing disorders and rehabilitation outcome of stroke patients: a prospective study // Am J. Phys. Med. Rehabil. 2003; 82(6): 452-5.
16. Chesson A. Jr., Hartse K., Anderson W.M. et al. Practice parameters for the evaluation of chronic insomnia. An American Academy of Sleep Medicine report. Standards of practice committee of the American Academy of Sleep Medicine // Sleep. 2000; 23(2): 237-41.
17. Cohrs S. Sleep disturbances in patients with schizophrenia: impact and effect of antipsychotics // CNS Drugs. 2008; 22(11): 939-62.
18. Cui L., Wang J.H., Wang M. et al. Injection of L-glutamate into the insular cortex produces sleep apnea and serotonin reduction in rats // Sleep Breath. 2012 Sep; 16(3): 845-53.
19. Culebras A. Sleep, stroke and poststroke // Neurol. Clin. 2012; 30: 1275-1284.
20. De Roeck J., Cluydts R., Schotte C., Rouckhout D., Cosyns P. Explorative single-blind study on the sedative and hypnotic effects of buspirone in anxiety patients // Acta Psychiatr. Scand. 1989 Feb; 79(2): 129-35.
21. Dyken M.E., Im K.B. Obstructive sleep apnea and stroke // Chest. 2009; 136(6): 1668-77.
22. Dziewas R., Humpert M., Hopmann B. et al. Increased prevalence of sleep apnea in patients with recurring ischemic stroke compared with first stroke victims // J. Neurol. 2005; 252: 1394-1398.
23. Eltzschig H.K., Carmeliet P. Hypoxia and inflammation // N. Engl. J. Med. 2011; 364: 656-65.
24. Fava M., Targum S.D., Nierenberg A.A. et al. An exploratory study of combination buspirone and melatonin SR in major depressive disorder (MDD): a possible role for neurogenesis in drug discovery // J. Psychiatr. Res. 2012 Dec; 46(12): 1553-63.
25. Gami A.S., Hodge D.O., Herges R.M. et al. Obstructive sleep apnea, obesity, and the risk of incident atrial fibrillation // J. Am. Coll. Cardiol. 2007; 49(5): 565-71.
26. Guilleminault C., Ramar K. Neurologic aspects of sleep apnea: is obstructive sleep apnea a neurologic disorder? // Semin. Neurol. 2009; 29: 368-71.
27. Hall-Porter J.M., Curry D.T., Walsh J.K. Pharmacologic treatment of primary insomnia // Sleep Med. Clin. 2010; 5(4): 609-25.
28. Hermann D.M., Bassetti C.L. Sleep-related breathing and sleep-wake disturbances in ischemic stroke // Neurology. 2009; 73: 1313-1322.
29. Hermann D.M., Siccoli M.M., Brugger P. et al. Evolution of neurological, neuropsychological and sleep-wake disturbances in paramedian thalamic stroke // Stroke. 2008; 39: 62-68.
30. Hermida R.C., Ayala D.E., Mojon A., Fernandez J.R. Influence of circadian time of hypertension treatment on cardiovascular risk: results of the MAPEC study // Chronobiol. Int. 2010; 27: 1629-51.
31. Hla K.M., Young T., Finn L. et al. Longitudinal association of sleep-disordered breathing and nondipping of nocturnal blood pressure in the Wisconsin Sleep Cohort Study // Sleep. 2008; 31(6): 795-800.
32. Horner R.L. The tongue and its control by sleep state-dependent modulators // Arch. Ital. Biol. 2011; 149: 406-25.
33. Jain S., Namboodri K.K., Kumari S., Prabhakar S. Loss of circadian rhythm of blood pressure following acute stroke // BMC Neurol. 2004; 4: 1-6.
34. Jia F., Chandra D., Homanics G.E. et al. Ethanol modulates synaptic and extrasynaptic GABAA receptors in the thalamus // J. Pharmacol. Exp. Ther. 2008; 326: 475-82.
35. Johns M.W. A new method for measuring daytime sleepiness: the Epworth Sleepiness Scale // Sleep. 1991; 14: 540-5.
36. Jones B.E. Modulation of cortical activation and behavioral arousal by cholinergic and orexinergic systems // Ann. N. Y. Acad. Sci. 2008; 1129: 26-34.
37. Kaneko Y., Hajek V.E., Zivanovic V. et al. Relationship of sleep apnea to functional capacity and length of hospitalization following stroke // Sleep. 2003; 26(3): 293-7.
38. Kirsch D.B. A neurologist’s guide to common subjective and objective sleep assessments // Neurol. Clin. 2012; 30: 987-1006.
39. Knie B., Mitra M.T., Logishetty K. et al. Excessive daytime sleepiness in patients with Parkinson’s disease // CNS Drugs. 2011; 25: 203-12.
40. Krueger J.M. The role of cytokines in sleep regulation // Curr. Pharm. Des. 2008; 14: 3408-16.
41. Lee S.J., Kim J.S., Song I.U., An J.Y., Kim Y.I., Lee K.S. Poststroke restless legs syndrome and lesion location: anatomical considerations // Mov. Disord. 2009; 24: 77-84.
42. Leger L., Sapin E., Goutagny R. et al. Dopaminergic neurons expressing Fos during waking and paradoxical sleep in the rat // J. Chem. Neuroanat. 2010; 39: 262-71.
43. Leppavuori A., Pohjasvaara T., Vataja R. et al. Insomnia in ischemic stroke patients // Cerebrovasc. Dis. 2002; 14: 90-97.
44. Liepert J. Pharmacotherapy in restorative neurology // Curr. Opin. Neurol. 2008; 21: 639-643.
45. Liu J., Wang L.N. Gamma aminobutyric acid (GABA) receptor agonists for acute stroke // Cochrane Database Syst. Rev. 2013 Feb 28; 2: CD009622.
46. Logan A.G., Perlikowski S.M., Mente A. et al. High prevalence of unrecognized sleep apnoea in drug-resistant hypertension // J. Hypertens. 2001; 19(12): 2271-7.
47. Lurie A. Obstructive sleep apnea in adults: epidemiology, clinical presentation, and treatment options // Adv. Cardiol. 2011; 46: 1-42.
48. Maher M.J., Rego S.A., Asnis G.M. Sleep disturbances in patients with post-traumatic stress disorder: epidemiology, impact and approaches to management // CNS Drugs. 2006; 20(7): 567-90.
49. Mallon L., Broman J.E., Hetta J. Restless legs symptoms with sleepiness in relation to mortality: 20-year follow-up study of a middle-aged Swedish population // Psychiatry Clin. Neurosci. 2008; 62: 457- 463.
50. Mansukhani M.P., Bellolio M.F., Kolla B.P., Enduri S., Somers V.K., Stead L.G. Worse outcome after stroke in patients with obstructive sleep apnea: an observational cohort study // J. Stroke Cerebrovasc. Dis. 2010; 20: 401-5.
51. Marin J.M., Carrizo S.J., Vicente E. et al. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study // Lancet. 2005; 365: 1046-53.
52. Martin J.L., Fiorentino L., Jouldjian S. et al. Sleep quality in residents of assisted living facilities: effect on quality of life, functional status, and depression // J. Am. Geriatr. Soc. 2010; 58: 829-36.
53. Martinez-Garcia M.A., Galiano-Blancart R., Roman-Sanchez P. et al. Continuous positive airway pressure treatment in sleep apnea prevents new vascular events after ischemic stroke // Chest. 2004; 128: 2123-2129.
54. Matthews E.E., Aloia M.S. Cognitive recovery following positive airway pressure (PAP) in sleep apnea // Prog. Brain Res. 2011; 190: 71-88.
55. Mayer G., Jennum P., Riemann D. et al. Insomnia in central neurologic diseases-occurrence and management // Sleep Med. Rev. 2011; 15(6): 369-78.
56. McArdle N., Riha R.L., Vennelle M. et al. Sleep-disordered breathing as a risk factor for cerebrovascular disease: a case-control study in patients with transient ischemic attacks // Stroke. 2003; 34: 2916-2921.
57. Montgomery S.A., Herman B.K., Schweizer E. et al. The efficacy of pregabalin and benzodiazepines in generalized anxiety disorder presenting with high levels of insomnia // Int. Clin. Psychopharmacol. 2009; 24(4): 214-22.
58. Morgenthaler T., Alessi C., Friedman L. et al. Practice parameters for the use of actigraphy in the assessment of sleep and sleep disorders: an update for 2007 // Sleep. 2007; 30(4): 519-29.
59. Morgenthaler T., Kramer M., Alessi C. et al. Practice parameters for the psychological and behavioral treatment of insomnia: an update. An American Academy of Sleep Medicine report // Sleep. 2006; 29(11): 1415-9.
60. Morin C.M., Belleville G., Belanger L. et al. The insomnia severity index: psychometric indicators to detect insomnia cases and evaluate treatment response // Sleep. 2011; 34(5): 601-8.
61. Morin C.M., Benca R. Chronic insomnia // Lancet. 2012; 379(9821): 1129-41.
62. Moszczynski A., Murray B.J. Neurobiological aspects of sleep physiology // Neurol. Clin. 2012; 30: 963-985
63. Munoz R., Duran-Cantolla J., Martinez-Vila E. et al. Severe sleep apnea and risk of ischemic stroke in the elderly // Stroke. 2006; 37: 2317-21.
64. Nopmaneejumruslers C., Kaneko Y., Hajek V. et al. Cheyne-Stokes respiration in stroke: relationship to hypocapnia and occult cardiac dysfunction // Am. J. Respir. Crit. Care Med. 2005; 171: 1048-1052.
65. Pandian J.D., Wong A.A., Lincoln D.J. et al. Circadian blood pressure variation after acute stroke // J. Clin. Neurosci. 2006; 13: 558-62.
66. Parra O., Arboix A., Bechich S. et al. Time course of sleep-related breathing disorders in first-ever stroke or transient ischemic attack // Am. J. Respir. Crit. Care Med. 2000; 161(2, Pt 1): 375-80.
67. Peppard P.E., Young T., Palta M. et al. Prospective study of the association between sleep-disordered breathing and hypertension // N. Engl. J. Med. 2000; 342(19): 1378-84.
68. Punjabi N.M. The epidemiology of adult obstructive sleep apnea // Proc. Am. Thorac. Soc. 2008; 5: 136-43.
69. Ryan C.M., Bayley M., Green R. et al. Influence of continuous positive airway pressure on outcomes of rehabilitation in stroke patients with obstructive sleep apnea // Stroke. 2011; 42: 1062-7.
70. Sahlin C., Sandberg O., Gustafson Y. et al. Obstructive sleep apnea is a risk factor for death in patients with stroke: a 10-year follow-up // Arch. Intern. Med. 2008; 168: 297-301.
71. Saldana M.T., Perez C., Navarro A. et al. Pain alleviation and patient-reported health outcomes following switching to pregabalin in individuals with gabapentin-refractory neuropathic pain in routine medical practice // Clin. Drug Investig. 2012; 32(6): 401-12.
72. Sandberg O., Franklin K.A., Bucht G. et al. Nasal continuous positive airway pressure in stroke patients with sleep apnoea: a randomized treatment study // Eur. Respir. J. 2001; 18: 630-634.
73. Schutte-Rodin S., Broch L., Buysse D. et al. Clinical guideline for the evaluation and management of chronic insomnia in adults // J. Clin. Sleep Med. 2008; 4(5): 487-504.
74. Scofield H., Roth T., Drake C. Periodic limb movements during sleep: population prevalence, clinical correlates, and racial differences // Sleep. 2008; 31: 1221-7.
75. Selic C., Siccoli M.M., Hermann D.M., Bassetti C.L. Blood pressure evolution after acute ischemic stroke in patients with and without sleep apnea // Stroke. 2005; 36: 2614-2618.
76. Siccoli M.M., Valko P., Hermann D.M., Bassetti C.L. Central periodic breathing during sleep in 74 patients with acute ischemic stroke: neurogenic and cardiogenic factors // J. Neurol. 2008; 255: 1687-1692.
77. Siegel J.M. Do all animals sleep? // Trends Neurosci. 2008; 31: 208-13.
78. Somers V.K., White D.P., Amin R. et al. Sleep apnea and cardiovascular disease: an American Heart Association/American College Of Cardiology Foundation Scientific Statement from the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council On Cardiovascular Nursing. In collaboration with the National Heart, Lung, and Blood Institute National Center on Sleep Disorders Research (National Institutes of Health) // Circulation. 2008; 118: 1080-111.
79. Staner L. Sleep-wake mechanisms and drug discovery: sleep EEG as a tool for the development of CNS-acting drugs // Dialogues Clin. Neurosci. 2002; 4: 342-50.
80. Trenkwalder C., Paulus W. Restless legs syndrome: pathophysiology, clinical presentation and management // Nat. Rev. Neurol. 2010; 6: 337-46.
81. Triarhou L.C. The percipient observations of Constantin von Economo on encephalitis lethargica and sleep disruption and their lasting impact on contemporary sleep research // Brain Res. Bull. 2006; 69: 244-58.
82. Turkington P.M., Allagr V., Bamford J. et al. Effect of upper airway obstruction in acute stroke on functional outcome at 6 months // Thorax. 2004; 59: 367-371.
83. Wallace D.M., Ramos A.R., Rundek T. Sleep disorders and stroke // Int. J. Stroke. 2012 April; 7(3): 231-242.
84. Walters A.S., Rye D.B. Review of the relationship of restless legs syndrome and periodic limb movements in sleep to hypertension, heart disease, and stroke // Sleep. 2009 May; 32(5): 589-97.
85. WHO. International classification of diseases (ICD-10). Geneva (Switzerland): World Health Organization, 1991.
86. Wiegand M.H. Antidepressants for the treatment of insomnia: a suitable approach? // Drugs. 2008; 68(17): 2411-7.
87. Winblad B., Fioravanti M., Dolezal T. et al. Therapeutic use of nicergoline // Clin. Drug Investig. 2008; 28(9): 533-52.
88. Winkelman J.W., Shahar E., Sharief I. et al. Association of restless legs syndrome and cardiovascular disease in the Sleep Heart Health Study // Neurology. 2008; 70: 35-42.
89. Yaffe K., Laffan A.M., Harrison S.L. et al. Sleep-disordered breathing, hypoxia, and risk of mild cognitive impairment and dementia in older women // JAMA. 2011; 306: 613-9.
90. Young T., Palta M., Dempsey J. et al. The occurrence of sleep-disordered breathing among middle-aged adults // N. Engl. J. Med. 1993; 328: 1230-5.

/96/96.jpg)