Международный неврологический журнал 1 (63) 2014
Вернуться к номеру
Аспекти використання протисудомних препаратів у лікуванні хворих, які перенесли черепно-мозкову травму
Авторы: Григорова І.А., Куфтеріна Н.С. - Харківський національний медичний університет, кафедра неврології
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Було проведено комплексне клініко-неврологічне та нейрофізіологічне обстеження 60 хворих, які перенесли закриту черепно-мозкову травму. Проаналізована динаміка клініко-неврологічних та нейрофізіологічних показників на фоні протисудомної терапії. Обґрунтовано використання протисудомних препаратів у гострому періоді черепно-мозкової травми з профілактичною метою.
Было проведено комплексное клинико-неврологическое и нейрофизиологическое обследование 60 больных, перенесших закрытую черепно-мозговую травму. Проанализирована динамика клинико-неврологических и нейрофизиологических показателей на фоне противосудорожной терапии. Обосновано использование противосудорожных препаратов в остром периоде черепно-мозговой травмы с профилактической целью.
There has been carried out a comprehensive clinical-neurological and neurophysiological examination of 60 patients who have had closed traumatic brain injury. There was analyzed the dynamics of clinical-neurological and neurophysiological indices against the use of anticonvulsant therapy. We justified the usig of anticonvulsants in acute period of traumatic brain injury as a prophylactic measure.
черепно-мозкова травма, післятравматична епілепсія, антиконвульсанти, ламотриджин.
черепно-мозговая травма, посттравматическая эпилепсия, антиконвульсанты, ламотриджин.
traumatic brain injury, post-traumatic epilepsy, anticonvulsants, lamotrigine.
Статья опубликована на с. 134-138
Протягом останніх років в Україні, як і в цілому світі, спостерігається збільшення кількості випадків побутового травматизму, стрімке зростання кількості авто- та мототранспорту, що супроводжується зростанням кількості хворих із черепно-мозковою травмою (ЧМТ) та її наслідками [9]. Порушення, що виникають у 60–85 % випадків унаслідок перенесених черепно-мозкових травм, набувають затяжного, прогредієнтного перебігу з тривалою втратою працездатності серед осіб найбільш молодого та працездатного віку [4, 7]. Статистика свідчить про те, що проблема черепно-мозкової травми та її наслідків уже давно є не тільки медичною, але й соціально-економічною, оскільки потребує значних витрат як на лікування, так і на соціальну реабілітацію [8].
Відомо, що патогенез структурно-функціональних змін у головному мозку внаслідок ЧМТ пов’язаний із механічним фактором. Під впливом травми гідродинамічні сили та лікворна хвиля впливають на лімбіко-гіпоталамо-ретикулярну ділянку, що призводить до різних нейрогуморальних обмінно-ендокринних, вегетосудинних розладів. Тому хворі після травми протягом тривалого часу відзначають різного ступеня вираженості загальномозкові симптоми, симптоми мозкової дисфункції, інтелектуально-мнестичні порушення, зміни в психоемоційній сфері [6].
При електроенцефалографічному обстеженні у хворих, які перенесли ЧМТ, реєструють дифузні порушення біоелектричної активності мозку, зниження загального рівня біопотенціалів, пароксизмальну активність, іритативні зміни, зони подразнення, ознаки дисфункції серединних структур мозку та дезорганізацію основного ритму [2, 16, 19].
Осередки крововиливів, внутрішньомозкові вогнища білого та червоного розм’якшення, асептичний лептоменінгіт, поширені судинні зміни, хронічні субдуральні гематоми, арахноїдальні кісти та рубці є морфологічним субстратом виникнення одного з найбільш поширених ускладнень черепно-мозкової травми — післятравматичної епілепсії [6].
Післятравматична епілепсія — це хронічне захворювання, що виникає внаслідок ЧМТ та проявляється повторними судомними або іншими нападами, втратою свідомості та змінами особистості [13]. За даними різних досліджень, ризик розвитку післятравматичної епілепсії сягає від 9 до 42 % [13, 15], що, в свою чергу, свідчить про значну поширеність цього ускладнення та актуальність обраної нами тематики.
Доведено, що одним із механізмів розвитку післятравматичної епілепсії є гіппокампальний склероз, що супроводжується втратою нейронів, спраутингом мшистих волокон та дисперсією грануляційних клітин. Окрема увага в розвитку епілепсії приділяється порушенням Т-клітинних імунних реакцій, а також змінам умісту нейромедіаторних амінокислот (глутамату, ГАМК та ін.) [17].
У дослідженнях L. Lorigados-Pedre було доведено, що при епілепсії спостерігається вірогідне збільшення відносного вмісту диференційованих CD8 антигенів, а також активаційних маркерів CD25 та HLA-DR периферійної крові при різній локалізації епілептогенного центру [14].
Дослідження S. Engelborghs та J. Wiseman показали збільшення при епілепсії рівня глутамату у плазмі [17], а Y. Takahashi та H. Mori довели збільшення автоантитіл проти NMDA-рецепторів [18]. Крім того, виявлено, що істотно змінюється цитокіновий профіль: збільшується вміст інтерлейкіну-6 та інтерлейкіну-1 [13].
Таким чином, проведений огляд літератури наочно демонструє, що виникнення та розвиток післятравматичної епілепсії відбувається на фоні змін Т-клітинної ланки імунітету та запуску каскаду нейромедіаторних амінокислот, тобто саме тих патологічних станів, які переважають у гострому періоді ЧМТ. Цей факт обумовив необхідність пошуку відповідного лікарського засобу, який безпосередньо впливає на вище описані патогенетичні механізми та який доцільно використовувати для профілактики та лікування післятравматичної епілепсії. У зв’язку з цим нами був обраний препарат ламотриджин (Епілептал).
Метою нашого дослідження було вивчення терапевтичних та профілактичних аспектів застосування ламотриджину (Епілепталу) в комплексній терапії хворих, які перенесли черепно-мозкову травму.
Матеріали та методи дослідження
Нами було обстежено 60 хворих, які перенесли тяжку ЧМТ та перебували на стаціонарному лікуванні в нейрохірургічних відділеннях Харківської міської клінічної лікарні швидкої та невідкладної медичної допомоги ім. проф. О.І. Мещанінова, віком від 18 до 40 років (середній вік 29,0 ± 4,7 року), серед яких було 38 чоловіків та 22 жінки. До комплексної терапії обстежених хворих входив протиепілептичний засіб Епілептал («Фармак»). Хворі основної групи були розподілені на 2 групи: 1) 30 осіб, які мали позитивну ЕЕГ та не мали епілептичних нападів в анамнезі; 2) 30 осіб, які мали епілептичні напади в анамнезі. Хворі першої групи отримували Епілептал з профілактичною метою — у перші 2 тижні пацієнти отримували Епілептал у дозі 25 мг/добу, протягом 3–4-го тижня — 50 мг/добу, за необхідності доза збільшувалася. Хворі другої групи отримували Епілептал із терапевтичною метою — у перші 2 тижні пацієнти отримували Епілептал у дозі 50 мг/добу, протягом 3–4-го тижня — 100 мг/добу, за необхідності із подальшим збільшенням дози на 100 мг/тиждень до максимальної дози 400 мг/добу. Контрольну групу становили 30 пацієнтів відповідного віку, які перенесли ЧМТ, мали позитивну ЕЕГ, але не отримували Епілептал із профілактичною метою.
Термін лікування та спостереження хворих становив 3 місяці. Контрольні обстеження хворих виконували до початку лікування, через 1 та 3 місяці після лікування. При цьому оцінювали вплив Епілепталу на частоту нападів, функціональні церебральні зміни, а також психічний стан хворих та переносимість препарату. Були використані клініко-неврологічні, нейрофізіологічні та лабораторні методики дослідження. Отримані дані оброблялись методом варіаційної статистики з використанням пакетів прикладних програм Microsoft Excel 8.0, Statistica 6.0 (Statsoft) на IBM PC.
Результати
Клінічне обстеження хворих, які перенесли ЧМТ, проводилося з використанням загальноприйнятих методик, з урахуванням рівня свідомості, оцінки скарг, анамнезу, дослідження менінгеальних синдромів, черепно-мозкових нервів, ліквородинамічних, рухових, чутливих, вестибуло-атактичних порушень, а також оцінки наявності вегетативної дисфункції, епілептичного синдрому, астенії.
У гострому періоді ЛЧМТ хворі всіх груп скаржилися переважно на загальну слабкість (96,2 %); головний біль (94,3 %); запаморочення (92,5 %); хиткість при ходьбі (78,1 %); апатію і порушення сну (76,8 %); погіршення пам’яті, уваги (50,6 %); напади невмотивованої тривоги, серцебиття, ознобоподібного тремтіння (45,6 %); зниження зору (36,5 %), слуху (34,38 %); нудоту (35,63 %); хворі 2-ї групи скаржилися на судомні напади з втратою свідомості (68,3 %) та без цього (31,7 %). Через місяць лікування кількість скарг обстежених хворих значно зменшилася та була представлена переважно порушеннями пам’яті (41,88 %), уваги (38,75 %), сонливістю (38,75 %), головним болем та загальною слабкістю (26,25 %), поодинокими нападами у пацієнтів 2-ї групи. Через 3 місяці у хворих спостерігалися скарги переважно на порушення уваги (47,5 %), пам’яті (46,25 %), головний біль (41,88 %). Розподіл скарг на судомні напади наведений на рис. 1.
/135/135.jpg)
У гострому періоді ЧМТ неврологічні синдроми були переважно представлені астенічним синдромом (96,25 %), синдромом вегетативної дисфункції (92,5 %), лікворно-гіпертензивним синдромом (83,13 %), дисомнічним синдромом (76,88 %), синдромом вестибулярної дисфункції (67,5 %) та епілептичним синдромом у пацієнтів 2-ї групи. Через місяць після ЧМТ представленість та вираженість неврологічної симптоматики була значно меншою. Найбільш вираженими були вегетативні (40,63 %) та координаторні розлади (18,13 %). Через 3 місяці після ЧМТ спостерігалося збереження вегетативних та координаторних розладів, а також виникнення епілептичного синдрому в пацієнтів контрольної групи. Розподіл частоти зустрічальності епілептичного синдрому за групами наведений на рис. 2.
Як бачимо з графіка залежності клінічних проявів від тривалості лікування, регрес симптоматики спостерігався вже через 1 місяць лікування, однак найбільший терапевтичний ефект мав місце через 3 місяці.
У пацієнтів 2-ї групи найбільш часто спостерігалися генералізовані напади. Вони були зареєстровані у 77,3 % пацієнтів. Рідше спостерігалися фокальні та недиференційовані епілептичні напади. На фоні проведеного лікування в пацієнтів ІІ групи повна терапевтична ремісія була досягнута в 68,1 % випадків; значне зниження частоти нападів (≥ 50 %) спостерігалося у 23,8 % хворих; мінімальний терапевтичний ефект або повна його відсутність була відзначена лише у 8,1 % пацієнтів.
Терапевтична ефективність Епілепталу залежала від типу епілептичного синдрому. При цьому найбільший ефект був досягнутий при лікуванні генералізованих нападів, що проявлялося наявністю повної терапевтичної ремісії в 76,3 % випадків та відсутністю випадків повної неефективності Епілепталу. При фокальному епілептичному синдромі терапевтична ефективність Епілепталу була дещо нижчою: повна ремісія була досягнута лише у 27,4 % випадків, вірогідно значиме зниження частоти нападів спостерігалося в 42,1 % пацієнтів, водночас у достатньої кількості пацієнтів терапевтичний ефект був незначним або відсутнім. Аналогічна ситуація спостерігалася з недиференційованими нападами.
Порівнюючи отримані дані з даними іноземних досліджень, відзначимо, що на відміну від даних A. Agrawal, J. Timothy et al. [13], за результатами нашого дослідження, Епілептал вірогідно зменшував частоту генералізованих судомних нападів, що розвинулися внаслідок перенесеної ЧМТ. На підтвердження даних T. Stone та ін. [19] фокальні напади виявилися найменш чутливими до терапії Епілепталом.
За даними ЕЕГ-дослідження, в усіх хворих у гострому періоді ЧМТ спостерігалися різні відхилення спонтанної біоелектричної активності головного мозку від нормальних показників. Дифузні порушення біоелектричної активності мозку були зареєстровані у 53,5 % обстежених, зниження загального рівня біопотенціалів головного мозку — у 37,9 %, пароксизмальна активність — у 26,8 %, іритативні зміни — у 18,1 %, зони подразнення — у 12,9 %, ознаки дисфункції серединних структур мозку — у 14,4 % та дезорганізація основного ритму — у 10,7 % хворих.
В обстежених спостерігалася дезорганізована та низькоамплітудна редукція альфа-ритму, зсув спектра амплітуди в бік дельта- і тета-хвиль, наявність пароксизмальної активності.
При проведенні функціональних проб зміни ЕЕГ були більш виражені незалежно від давності травми. У переважної більшості хворих спостерігали повільнохвильову високоамплітудну активність, порушення зональних відмінностей, пароксизмальні компоненти поліморфних комплексів, що складалися з піків, гострої та повільної хвиль.
Клінічна ефективність Епілепталу поєднувалася з позитивними змінами ЕЕГ (рис. 3). Зменшення вираженості або повне нівелювання епілептиформної активності на ЕЕГ, особливо помітне при генералізованому епілептичному синдромі, було зареєстроване в 59,1 % хворих. У 31,2 % пацієнтів спостерігалося зменшення індексу повільних хвиль.
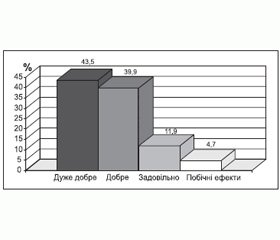
Переносимість хворими Епілепталу була дуже доброю (рис. 4). Побічні ефекти були зареєстровані у 4,7 % хворих і проявлялися алергічними реакціями та порушеннями з боку ЦНС.
/137/137.jpg)
Алергічні реакції проявлялися шкірним висипом та свербінням, локалізованим у ділянці верхніх кінцівок та грудної клітки, а також ознобоподібним станом.
Необхідності відміни Епілепталу через виявлені побічні ефекти не виникало. Побічні ефекти зникали при призначенні антигістамінної терапії та зменшенні дози препарату або були незначними та не впливали на якість життя пацієнтів, що дозволяло продовжувати курс лікування з метою досягнення бажаного терапевтичного ефекту.
Висновки
Таким чином, у результаті проведеного дослідження була продемонстрована ефективність використання Епілепталу в комплексній терапії хворих, які перенесли ЧМТ. Наведені дані обґрунтовують призначення Епілепталу з профілактичною метою хворим, які перенесли тяжку ЧМТ та мають позитивну ЕЕГ. Отримані дані довели, що Епілептал позитивно впливає на нейрофізіологічні та нейропсихологічні показники у даної категорії хворих. Цей препарат добре переноситься хворими, що дозволяє вважати Епілептал препаратом вибору в профілактиці та лікуванні ускладнень тяжкої ЧМТ.
1. Генералов В.О. Симптоматическая посттравматическая эпилепсия. Клиника, диагностика, лечение : метод. рекоменд. / Генералов В.О., Авакян Г.Н., Олейникова О.М. — М., 2004.
2. Деменко В.Д., Базарный Н.Ф., Борисенко В.В. Клинико-параклинические взаимоотношения в отдаленном периоде закрытой черепно-мозговой травмы // Украинский вестник психоневрологии. — 2001. — Т. 9, вып. 1(26). — С. 41.
3. Дзяк Л.А., Зозуля О.А. Современные представления о патофизиологии тяжелой черепно-мозговой травмы и роли прогнозирования ее исходов на этапах лечения // Нейронауки: теоретические и клинические аспекты. — 2005. — Т. 1, № 1. — С. 24–35.
4. Дзяк Л.А. Современные представления о патофизиологии тяжелой черепно-мозговой травмы и роли прогнозирования ее исходов на этапах лечения / Л.А. Дзяк, О.А. Зозуля // Нейронауки: теоретические и клинические аспекты. — 2005. — Т. 1, № 1. — С. 24–35.
5. Духовской А.Э. Симптоматические эпилепсии у детей, диагностика и лечение / А.Э. Духовской, Е.В. Варешнюк // Український вісник психоневрології. — 2006. — Т. 14, вип. 1 (46). — С. 69–72.
6. Лихтерман Л.Б. Черепно-мозговая травма / Л.Б. Лихтерман. — М.: Медицинская газета, 2003. — 356 с.
7. Клиническое руководство по черепно-мозговой травме / Под ред. акад. РАМН А.Н. Коновалова. — М.: Антидор, 2002. — Т. 1.
8. Полищук Н.Е., Рассказов С.Ю. Унификация объема диагностики и медицинской помощи больным с черепно-мозговой травмой // Украинский нейрохирургический журнал. — 2000. — № 1(9). — С. 73–77.
9. Тайцлин В.И. Закрытая черепно-мозговая травма и ее последствия // Международный медицинский журнал. — 2002. — № 1–2. — С. 58–62.
10. Трофимов А.О. Использование ламиктала у пострадавших с посттравматической эпилепсией / Трофимов А.О., Фраерман А.П., Муромская О.В. // Материалы юбилейной всероссийской науч.-практ. конф. «Поленовские чтения». — СПб., 2006. — С. 292–293.
11. Фаттахова А.Х. Молекулярно-генетические аспекты эпилепсии / Фаттахова А.Х., Карунас А.С., Хуснутдинова Э.К. // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2005. — № 6. — С. 36–39.
12. Шевага В.Н. Ранние и отдаленные последствия черепно-мозговой травмы: медико-социальные аспекты и возможности нейропротекции // Здоровье Украины. — 2009. — № 5(1). — С. 45.
13. Agrawal A., Timothy J., Pandit L., Manju M. Post-traumatic epilepsy: an overview / Agrawal A., Timothy J., Pandit L., Manju M. // Clin Neurol Neurosurg. — 2006. — 108(5). — 433–9.
14. Cao R., Hasuo H., Ooba S. et al. Facilitation of glutamatergic synaptic transmission in hippocampal CAl area of rats with traumatic brain injury / Cao R., Hasuo H., Ooba S. et al. // Neurosci Lett. — 2006. — 401(1–2). — 136–41.
15. Davidson D.L. The costs of trauma caused by seizures: can they be reduced? / D.L. Davidson, S. Macdonald // Seizure. — 2002 Jul. — ll (5). — 344–7.
16. Jordan K.G. Continuous EEG monitoring in the neuroscience intensive care unit and emergency department // J. Clin. Neurophysiology. — 1999. — Vol. 16, № 1. — P. 14–39.
17. Mircea Optica. Cytokines in the nervous system with emphasis on interleukin-1 receptor-mediated activity / Optica Mircea. — Stockholm: Karolinska university press, 2005. — P. 11–13.
18. Peltola J., Laaksonen J., Haapala A.M. et al. Indicators of inflammation after recent tonic-clonic epileptic seizures correlate with plasma interleukin–6 levels / Peltola J., Laaksonen J., Haapala A.M. et al. // Seizure. — 2002. — 11(1). — P. 44–6. — Режим доступу: http://www.medscape.com/medline
19. Stone T.W. The pharmacological manipulation of glutamate receptors and neuroprotection / T.W. Stone, J.I. Addae // Eur. J. Pharmacol. — 2002. — № 447. — Р. 285–296.
20. Voller В., Benke Т., Benedetto K., Sebnider P., Auff В., Aichner F. Neuropsychological, MRI mid EEG findings after traumatic brain injury // Brain. Inj. — 1999. — 13, 10. — P. 821–827.

/136/136.jpg)