Международный неврологический журнал 1 (63) 2014
Вернуться к номеру
Діагностика та корекція порушень церебральної гемодинаміки та ремоделювання брахіоцефальних судин у хворих на дисциркуляторну енцефалопатію II стадії
Авторы: Яркова С.В. - Навчально-науковий медичний центр «Університетська клініка» Запорізького державного медичного університету
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Обстежені 89 пацієнтів. Із них 67 хворих на дисциркуляторну енцефалопатію ІІ стадії, із яких були виділені 2 групи, що відрізнялися методами лікування — із застосуванням L-аргініну в основній групі та без його застосування в контрольній. У пацієнтів досліджувалася церебральна гемодинаміка, еластичні властивості судин шляхом проведення дуплексного сканування екстра- та інтракраніальних артерій. Отримані дані свідчать, що у хворих на дисциркуляторну енцефалопатію ІІ стадії після лікування L-аргініном відзначається вірогідне покращення показників гемодинаміки та пружно-еластичних властивостей судин.
Обследовано 89 пациентов. Из них 67 больных дисциркуляторной энцефалопатией II стадии, из которых были выделены 2 группы, отличавшиеся методами лечения — с применением L-аргинина в основной группе и без его применения в контрольной. У пациентов исследовалась церебральная гемодинамика и эластические свойства артерий путем проведения дуплексного сканирования экстра- и интракраниальных артерий. Полученные данные свидетельствуют, что у больных дисциркуляторной энцефалопатией ІІ стадии после лечения L-аргинином отмечается достоверное улучшение показателей гемодинамики и упруго-эластичных свойств артерий.
89 patients were examined. Among them 67 patients with dyscirculatory encephalopathy II stage were divided in two groups differed by treatment regimens — with use of L-arginine in the main group and without it — in the control group. In patients we studied cerebral hemodynamics and elastic properties of arteries by duplex scanning of extra- and intracranial arteries. The findings suggest that patients with dyscirculatory encephalopathy stage II after treatment with L-arginine there was a significant improvement in hemodynamics and elastic properties of the arteries.
церебральна гемодинаміка, цереброваскулярні захворювання, ендотеліальна дисфункція, артеріальна жорсткість, L-аргінін.
церебральная гемодинамика, цереброваскулярные заболевания, эндотелиальная дисфункция, артериальная жесткость, L-аргинин.
cerebral hemodynamics, cerebrovascular diseases, endothelial dysfunction, arterial stiffness, L-arginine.
Статья опубликована на с. 141-145
У даний час однією з головних проблем сучасної медицини є цереброваскулярна патологія, що обумовлено значною частотою її розвитку, великим відсотком інвалідизації та смертності. Цереброваскулярні захворювання протягом багатьох років посідають друге місце у структурі смертності населення України після ішемічної хвороби серця. В останні десятиріччя в Україні відзначається значне зростання поширеності хронічних цереброваскулярних захворювань (ЦВЗ). В Україні хронічні форми цереброваскулярної патології у структурі всіх форм ЦВЗ становлять близько 90 % [6]. Спостерігається збільшення частоти судинно-мозкової патології серед осіб працездатного віку.
Тому стає актуальним всебічне вивчення проблеми судинних захворювань головного мозку. Найактуальнішими з них є питання різноманітних механізмів, які призводять до розвитку хронічної ішемії мозку — дисциркуляторної енцефалопатії (ДЕ), а також шляхів її корекції.
Слід зазначити, що артеріальна система виконує дві важливі взаємопов’язані функції. Перша — доставка адекватної кількості крові від серця до периферичних тканин, тобто провідна функція; друга — демпфірування коливань артеріального тиску [4].
Саме тому буферна діяльність магістральних великих артерій є неодмінною умовою адекватного функціонування серцево-судинної системи і гемодинамічного забезпечення органів, тканин. Серед характеристик судинної стінки значна увага приділяється артеріальній жорсткості [11, 12]. Порушення пружно-еластичних властивостей артерій прогресує з віком або є наслідком захворювань, таких як артеріальна гіпертензія, цукровий діабет, атеросклероз та інші [1, 5]. Обговорюється роль ендотелію в регуляції локальної судинної жорсткості, головним чином вазоконстрикторні й вазодилататорні реакції судин [12]. Зниження артеріальної еластичності також є маркером збільшення ризику розвитку цереброваскулярних подій [11, 10, 14]. Є дані про наявність асоціації між тяжкістю ремоделювання брахіоцефальних артерій і зниженням регіонарного кровотоку, що відображає роль судинної стінки у підтримці адекватної авторегуляції мозкового кровообігу. Артеріальна ригідність тісно асоційована з «німим» ураженням дрібних судин головного мозку і зниженням когнітивних функцій і є незалежним предиктором прогресування когнітивної дисфункції при тривалому спостереженні [13]. Уточнення стану артеріальної жорсткості при різних формах цереброваскулярних захворювань актуальне для з’ясування основних механізмів прогресування судинного ураження мозку та його профілактики [13].
Порушення провідної функції проявляється у вигляді стенозу або оклюзії артерій. Структурні та гемодинамічні порушення в сонних артеріях потенційно пов’язані з виникненням вогнищ ішемії в пацієнтів з артеріальною гіпертензією та церебральним атеросклерозом. Зниження гемодинамічних показників приводить до гіпоперфузії і, зокрема, до хронічної ішемії головного мозку [5, 7, 8]. Останніми роками велике значення в розвитку судинної патології надається порушенням із боку ендотелію — ендотеліальній дисфункції [3, 9, 12, 15]. У нормі у відповідь на стимуляцію ендотелій реагує посиленням синтезу субстанцій, що викликають розслаблення гладких клітин судинної стінки. Найбільш значущою з цих речовин є ендотеліальний фактор релаксації — оксид азоту [3, 15]. Субстратом для синтезу NO є аргінін. L-аргінін є умовно незамінною амінокислотою [2, 3, 10]. При застосуванні L-аргініну поліпшується ендотелійзалежна вазодилатація, знижується агрегація тромбоцитів і зменшується ендотеліальна адгезія моноцитів [2, 10].
Саме тому дослідження поширеності процесу атеросклеротичного ураження судин, механічних властивостей артерій — їх пружності, розтяжності, формування їх деформацій, швидкісних порушень кровообігу, набуває останнім часом не тільки теоретичного, а й клініко-практичного значення, оскільки дозволяє проводити ранню діагностику атеросклерозу, артеріальної гіпертензії, серцево-судинного ризику, слідкувати за динамікою захворювання й моніторувати результати проведеного лікування [5, 8].
Таким чином, важливим стає пошук препарату, що впливає одночасно і на гемодинаміку, і на жорсткість судинної стінки, покращуючи цим функціональні можливості головного мозку. У зв’язку з цим застосування L-аргініну є перспективним при патологічних станах, що асоціюються з підвищенням ригідності судинної стінки, зниженням перфузії головного мозку, а саме з хронічною ішемією головного мозку.
Мета дослідження: оптимізація діагностичних та лікувальних заходів у хворих на ДЕ ІІ ст. шляхом вивчення особливостей церебральної гемодинаміки та стану васкулярного ремоделювання, а також вивчення клінічної ефективності та переносимості препарату L-аргінін.
Матеріали та методи дослідження
Для реалізації поставленої нами задачі були обстежені 89 пацієнтів. З них у 67 хворих була ДЕ ІІ стадії на тлі церебрального атеросклерозу, артеріальної гіпертензії або їх поєднання, вік пацієнтів — 44–71 рік, із них чоловіків було 26, жінок — 41. Критеріями включення вважали діагноз дисциркуляторної енцефалопатії II стадії на тлі церебрального атеросклерозу та артеріальної гіпертензії, вік — 40–74 роки, згода пацієнта на дослідження. Також обстежені 22 пацієнти відповідного віку без клінічних ознак цереброваскулярної патології (група контролю). З анамнезу стало відомо, що надмірна вага реєструвалась у 10 хворих на ДЕ ІІ стадії, паління — у 12 пацієнтів, гіподинамія — у 32 хворих, поєднання артеріальної гіпертензії з церебральним атеросклерозом — у 27 пацієнтів. Середній бал при тестуванні когнітивних порушень за шкалою МОСА становив 23,37 бала.
Серед хворих на ДЕ ІІ стадії залежно від лікування були виділені дві групи хворих: група хворих, які отримували терапію L-аргініном (20 хворих), та група контролю лікування (19 хворих), які отримували терапію згідно з клінічним протоколом, але без застосування вищезазначеного препарату. Пацієнти цих груп були порівнянними за статтю і віком. Препарат призначався у формі внутрішньовенної краплинної інфузії в дозі 4,2 грама на добу протягом 10 днів. У подальшому препарат призначався перорально в дозі 15 мл (3 грами) на добу протягом одного місяця.
Пацієнтам проведені такі дослідження: клініко-неврологічне, нейропсихологічні тести (Монреальська шкала (MОCA)), Headache impact test (HIT-6ТМ). Дослідження церебральної гемодинаміки здійснювалося за допомогою дуплексно-триплексного сканера LOGIQ C-5 Premium. Ехолокація екстракраніальних артерій проводилася лінійним датчиком з частотою 10 МГц, візуалізація інтракраніальних судин здійснювалася за допомогою транскраніальної локації фазованим датчиком з частотою 2,5 MГц. Вимірювання товщини інтима-медіального шару (ТІМШ) проводили по задній стінці загальної сонної артерії (ЗСА) на 1 см проксимальніше її біфуркації. Гемодинамічно незначущими вважали стенози сонної артерії величиною до 60 % від вихідного діаметра судини. Характеристика атером залежно від їх ехощільності й однорідності структури проводилася за класифікацією S.E. Crawford.
У даний час найдоступнішим засобом дослідження жорсткості поверхневих судин є ультразвукова діагностика. Особливий інтерес може викликати жорсткість сонних артерій через високу частоту розвитку атеросклеротичних змін. Найпоширеніший метод дослідження — це визначення швидкості поширення пульсової хвилі тиску по магістральних судинах (ШППХ). Слід зазначити, що це досить старий метод дослідження судинної системи. Ще у 1929 році в лабораторії Г.Ф. Ланга було зроблено висновок, що ШППХ є найбільш обґрунтованим і надійним показником еластичності аортальної стінки. Але в нашому дослідженні використовувався метод обчислювання деформації артерії (strain), що вважається найдоступнішим для всіх дуплексних сканерів. Показник деформації (strain) обчислюється за формулою: (Ds – Dd) • 100/Dd, де DS — систолічний діаметр артерії, Dd — діастолічний діаметр артерії.
Пацієнтам з виділених груп проводили дуплексне сканування в перший день до початку лікування, на десятий день (після закінчення курсу інфузійної терапії), а також через місяць (після курсу перорального прийому розчину L-аргініну).
Статистичну обробку даних проводили за допомогою пакета програм Statistiсa 6.0. Вірогідність різниці між групами пацієнтів і в динаміці в кожній групі за низкою показників визначали на підставі t-критерію Стьюдента. Результати аналізу вважалися статистично значущими при р < 0,05.
Результати досліджень та їх обговорення
Аналіз скарг засвідчив, що в обох групах хворих найчастіше були скарги на головний біль (88,71 %), запаморочення (74,19 %), ослаблення пам’яті на поточні події (54,84 %), стомлюваність (40,32 %), невмотивовану тривожність (43,55 %). Клінічна картина основної групи та групи контролю лікування була представлена такими синдромами: цефалічний (88,71 %), вестибулярний (74,19 %), астенічний (58,06 %), синдромами легких (30,65 %) та помірних (69,35 %) когнітивних порушень. Після прийому L-аргініну у пацієнтів значно знизилася частота та інтенсивність головного болю (у 65,00 %). Інтенсивність головного болю та його вплив на повсякденну діяльність хворого за шкалою HIT-6ТМ знизилися у середньому з 54,70 ± 7,55 бала до 49,50 ± 5,87 бала. У хворих основної групи після лікування знизилася частота запаморочень (у 80,00 %), стомлюваності (у 75,00 %). Усі хворі відзначали покращення загального самопочуття, зменшення астенічних проявів.
Під час дуплексного сканування в основній групі виявлено 8 (40 %) хворих зі стенотичними ураженнями брахіоцефальних артерій (БЦА), у групі контролю лікування — 6 (33,33 %) хворих. Середня ТІМШ в обох групах становила 0,08 ± 0,02 см. У пацієнтів зі стенотичними ураженнями БЦА середні значення ТІМШ ЗСА були вірогідно вищими, ніж у хворих без документованих атером. При дослідженні атеросклеротичних бляшок (АСБ) в основній групі виявлено 5 АСБ у загальних сонних артеріях, 11 — у внутрішніх сонних артеріях (ВСА). У групі контролю лікування виявлено 8 атеросклеротичних бляшок у ВСА. В основній групі ураження однієї артерії реєструвалось у 3 випадках, двох — у 2 випадках, трьох артерій — у 3 випадках. У групі контролю одностороннє ураження фіксувалося у 4 випадках, ураження білатеральне — у 2 випадках. Щодо якісних характеристик атеросклеротичних бляшок слід зазначити, що в основній групі бляшок високої та переважно високої щільності було 5 (31,25 % всіх АСБ). У групі контролю АСБ з такими ж якостями реєструвалися у 5 випадках (62,5 %). В обох групах мали місце стенотичні ураження від 20 до 60 % за діаметром (ESCT).
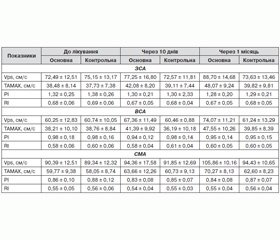
При проведенні дуплексного сканування в М-режимі вимірювалися систолічний і діастолічний діаметри та обчислювалися показники деформації. Динаміка показників деформації у ході лікування наведена у табл. 1.
При аналізі показників деформації в основній групі після лікування відзначається статистично вірогідне її підвищення. Слід зазначити, що після лікування вірогідне підвищення пружно-еластичних властивостей судин в основній групі реєструвалося порівняно з відповідними показниками до лікування, а також із групою контролю. У групі контролю також відзначалося покращення пружно-еластичних властивостей, але воно не є вірогідним. Зростання показника деформації після курсу лікування L-аргініном свідчить про покращення еластичних властивостей судинної стінки, пов’язане з цим покращення гемодинамічного забезпечення головного мозку та потенційно сприятливий вплив L-аргініну на прогноз щодо цереброваскулярних подій.
Під час дослідження швидкісних показників кровообігу оцінювалася лінійна швидкість кровообігу до лікування, після лікування L-аргініном у формі внутрішньовенних інфузій, після перорального прийому препарату. Проводилося порівняння ефекту лікування залежно від форми препарату та тривалості лікування. Отримані результати наведені у табл. 2.
При аналізі показників гемодинаміки по БЦА в основній групі після лікування відзначається статистично вірогідне підвищення лінійної швидкості кровообігу (ЛШК), зниження індексів судинного опору. Слід зазначити, що після лікування вірогідне підвищення ЛШК в основній групі реєструвалося порівняно з відповідними показниками до лікування, а також із групою контролю. У групі контролю також відзначалося покращення швидкісних показників, але воно не є вірогідним. Враховуючи важливу роль СМА у регуляції внутрішньомозкового кровообігу, дуже важливо відзначити вірогідне підвищення ЛШК у даному басейні в основній групі порівняно з відповідними показниками до лікування, а також із групою контролю. При аналізі отриманих у цьому дослідженні даних було встановлено, що при пролонгованому курсі лікування з послідовним використанням інфузійної та пероральної форм L-аргініну має місце більш значуще підвищення ЛШК порівняно з динамікою ЛШК при контролі сонографії через 10 днів лікування (при закінченні інфузійної терапії).
Таким чином, слід зазначити, що після курсового прийому L-аргініну з послідовним використанням інфузійної та пероральної форм препарату у хворих на ДЕ ІІ стадії відзначалося суб’єктивне та об’єктивне покращення у вигляді зменшення скарг на головний біль, запаморочення, стомлюваність, а також поліпшення загального самопочуття. Також звертає на себе увагу покращення пружно-еластичних властивостей судин у вигляді підвищення показників деформації та покращення показників гемодинаміки після завершення курсу терапії L-аргініном.
Висновки
Результати проведених досліджень свідчать про ефективність застосування L-аргініну у лікуванні хронічної цереброваскулярної патології. На тлі прийому L-аргініну реєструвалося покращення загального самопочуття, зменшення проявів головного болю, запаморочення. Також відзначалося покращення еластичних властивостей судинної стінки, підвищення швидкісних показників кровообігу, що обумовлено впливом препарату як на пружно-еластичні властивості судин, так і на синтез ендотелій-релаксуючого фактора. Враховуючи полімодальний вплив L-аргініну на стан церебральної гемодинаміки, препарат доцільно рекомендувати для застосування у комплексній терапії хворих на ДЕ ІІ стадії.
1. Арутюнян Н.М. Комплексное ультразвуковое исследование в диагностике клинически асимптомных ангиопатий при сахарном диабете второго типа: Автореф. дис… канд. мед. наук / Н.М. Арутюнян. — М., 2008. — 17 с.
2. Бабушкина А.В. L-аргинин с точки зрения доказательной медицины / А.В. Бабушкина // Укр. мед. часопис. — 2009. — № 6(74). — С. 43–48.
3. Волошин П.В. Эндотелиальная дисфункция при цереброваскулярной патологии / П.В. Волошин, В.А. Малахов, В.А. Завгородняя. — Харьков, 2006. — 92 с.
4. Камкин А.Г. Фундаментальная клиническая физиология / А.Г. Камкин, А.А. Каменский. — М.: Академия, 2004. — 1072 с.
5. Лелюк В.Г. Ультразвуковая ангиология / В.Г. Лелюк, С.Э. Лелюк. — Издание третье. — М.: Реальное время, 2007. — 416 с.
6. Мищенко Т.С. Достижения в области сосудистых заболеваний головного мозга за последние 2 года / Т.С. Мищенко // Здоров’я України. — 2010. — № 5. — С. 12–13.
7. Никитин Ю.М. Современные методы диагностики поражений сосудистой системы головного мозга в клинической практике / Ю.М. Никитин // Клиническая физиология кровообращения. — 2009. — № 3. — С. 68–72.
8. Суслина З.А., Варакин Ю.Я., Верещагин Н.В. Сосудистые заболевания головного мозга. — М.: МЕДпресс-информ, 2009. — 350 с.
9. Alves Pereira I., Ferreira Borba E. The role of inflammation, humoral and cell mediated autoimmunity in the pathogenesis of atherosclerosis // Swiss Med. Wkly. — 2008. — Vol. 138 (37–38). — P. 534–539.
10. Bai Y., Sun L., Yang T. et al. Increase in fasting vascular endothelial function after short-term oral L-arginine is effective when baseline flow–mediated dilation is low: a meta-analysis of randomized controlled trials // Am. J. Clin. Nutr. — 2009. — Vol. 89(1). — Р. 77–84.
11. Boutouyrie P., Pannier B. Measurement of arterial stiffness // Laurent S., Cockroft J. Central aortic blood pressure. — 2008. — Р. 41–47.
12. Henskens L.H., Kroon A.A., van Oostenbrugge R.J. et al. Increased aortic pulse wave velocity is associated with silent cerebral small-vessel disease in hypertensive patients // Hypertension. — 2008. — Vol. 52, № 6. — P. 1120–1126.
13. Jatoi N.A., Mahmud A., Benett K., Feely J. Assessment of arterial stiffness in hypertension: comparison of oscillometric (Arteriograph), piezoelectronic (Complior) and tonometric (SphygmoCor) techniques // J. Hypertens. — 2009. — Vol. 27. — Р. 2186–2191.
14. Laurent S., Katsahian S., Fassot C., Tropeano A., Gautierl Laloux B. et al. Aortic stiffness is an independent predictor of fatal stroke in essential hypertension // Stroke. — 2003. — Vol. 34. — Р. 1203–1206.
15. Vanhoutte P.M. Endothelial dysfunction: the first step toward coronary arteriosclerosis // Circ. J. — 2009. — Vol. 73(4). — P. 595–601.

/143/143.jpg)
/144/144.jpg)