Журнал «Актуальная инфектология» 2 (3) 2014
Вернуться к номеру
Особенности кишечного микробиоценоза при вирусных гепатитах и возможности его коррекции
Авторы: Ершова И.Б. - ГУ «Луганский государственный медицинский университет»
Рубрики: Инфекционные заболевания
Разделы: Клинические исследования
Версия для печати
Статья посвящена вопросам коррекции кишечного микробиоценоза у пациентов с вирусными гепатитами. Представлено исследование состояния микрофлоры кишечника у детей, перенесших вирусный гепатит А (ВГА), больных хроническим вирусным гепатитом В или С (ВГВ, ВГС). Материалы и методы. В исследовании принимали участие 39 детей: 12 человек, перенесших ВГА, 19 человек с хроническим ВГС, 8 человек с хроническим ВГВ. Все дети были рандомизированы в две группы. В первую группу вошли 18 детей, которые наряду с базисной терапией получали пробиотик Субалин, во вторую группу — 21 человек, которые получали только базисную терапию. Результаты и обсуждение. Включение в комплекс лечения пробиотика Субалина позволило купировать такие клинические симптомы, как астеновегетативный синдром, синдром хронической интоксикации, уменьшить диспептический синдром и гепатомегалию, а также восстановить микрофлору кишечника и элиминировать патогенные и условно-патогенные микроорганизмы. Отмечена хорошая переносимость Субалина и отсутствие побочных эффектов. Выводы. Применение Субалина в комплексной терапии детей с вирусными гепатитами устраняет синдром интоксикации и способствует быстрому регрессу клинических симптомов, восстановлению микрофлоры кишечника, нормализует иммунный статус.
Стаття присвячена питанням корекції кишкового мікробіоценозу в пацієнтів із вірусними гепатитами. Наведено дослідження стану мікрофлори кишечника в дітей, які перенесли вірусний гепатит А (ВГА), хворих на хронічний вірусний гепатит В або С (ВГВ, ВГС). Матеріали й методи. У дослідженні брали участь 39 дітей: 12 осіб, які перенесли ВГА, 19 осіб із хронічним ВГС, 8 осіб із хронічним ВГВ. Усі діти були рандомізовані у дві групи. До першої групи ввійшли 18 дітей, які поряд із базисною терапією одержували пробіотик Субалін, до другої групи — 21 особа, які одержували тільки базисну терапію. Результати й обговорення. Включення в комплекс лікування пробіотика Субаліну дозволило купірувати такі клінічні симптоми, як астеновегетативний синдром, синдром хронічної інтоксикації, зменшити диспептичний синдром і гепатомегалію, а також відновити мікрофлору кишечника й елімінувати патогенні й умовно-патогенні мікроорганізми. Відзначено добру переносимість Субаліну й відсутність побічних ефектів. Висновки. Застосування Субаліну в комплексній терапії дітей із вірусними гепатитами усуває синдром інтоксикації й сприяє швидкому регресу клінічних симптомів, відновленню мікрофлори кишечника, нормалізує імунний статус.
The article presents the data of studying the state of the intestinal microflora in children suffering from hepatitis A in period recovery and in patients with chronic hepatitis B and C.
By numerous researches it is revealed that the chronic persistence of hepatotropic viruses of parenteral hepatitis is followed by pathological changes in other organs of the digestive tract: stomach, pancreas, intestines. On the one hand it is related to direct damaging effect of viruses towards target organs, and on the other hand - with complex impact on habitat that is accompanied by change of a natural microbiocenosis of a digestive system, namely development of a lack of essential microorganisms and increase in a contamination of the colon. The developed conversion exacerbates a vicious chain of abnormal processes and severity of the disease, promotes accession of additional semiology, delays rehabilitation processes.
Aforesaid is explained in a way that two principal organs which are responsible for neutralizing toxic metabolic products are concurrently being hit hard: first - a liver which is carrying out protection at the expense of processes of oxidation, and secondly – gut flora which actively removes disintegration products, using for these purposes an entire cascade of biochemical processes. The microbiome generates "enterosorbent" of a huge sorption potency which collects toxins and takes them out from an organism together with intestinal contents, preventing a petting with a large quantity of pathogenic metabolites, both endogenous, and an exogenous origin.
The intestines microflora actively participates in formation of immunobiological reactions of an organism. Bacterial modulins, bifidobacteriae and lactobacillus stimulate synthesis of immunoglobulin, interferon, cytokine, increase quantity of a complement, increase activity of a lysozyme, stimulate maturing of mononuclear phagocyte system (MPS), take part in a metabolism of cholesterol and bile acids which, certainly, matters at the pathology of a liver. Materials and methods. Bacteriological research on excrement microflora of 39 children has been carried out. Among them: 12 people who have suffered viral hepatitis A (in 14 days after hospital discharge), 19 people with chronic viral hepatitis C and 8 people with chronic viral hepatitis B. The application of probiotic Subalin in complex therapy of children with chronic viral hepatitis B and C, and viral hepatitis A in recovery stage eliminates intoxication syndrome and exerts assistance for fast regression of all clinical symptoms.
Correction microbiocenosis with usage probiotic Subalin in specified group of children contributed to the restoration of the intestinal microflora, rapid regression of clinical symptoms and normalization of the immune status.
Keywords: viral hepatitis, intestinal microbiocenosis, correction, subalin.
дети, вирусные гепатиты, микрофлора, Субалин.
діти, вірусні гепатити, мікрофлора, Субалін.
children, viral hepatitis, microflora, Subalin.
Статья опубликована на с. 67-71
В многочисленных исследованиях показано, что хроническая персистенция гепатотропных вирусов при парентеральных гепатитах сопровождается патологическими изменениями в других органах пищеварительного тракта: желудке, поджелудочной железе, кишечнике. Это связано, с одной стороны, с непосредственным повреждающим действием вирусов на органы-мишени, а с другой — с комплексным воздействием на среду обитания, что сопровождается изменением естественного микробиоценоза пищеварительного тракта, а именно развитием недостатка необходимых микроорганизмов и увеличением контаминации толстого кишечника. Развившаяся конверсия усугубляет порочную цепь патологических процессов, тяжесть заболевания, способствует присоединению дополнительной симптоматики, замедляет процессы реабилитации.
Перечисленное объясняется тем, что одновременно страдает два основных органа обезвреживания токсических продуктов обмена веществ: во-первых, печень, осуществляющая защиту организма за счет процессов окисления, а во-вторых, микрофлора ЖКТ, которая активно выводит продукты распада, используя для этих целей целый каскад биохимических процессов. Микробиом создает «энтеросорбент» гигантской сорбционной способности, который собирает токсины и выносит их из организма вместе с кишечным содержимым, предотвращая контакт с огромным количеством патогенных метаболитов как эндогенного, так и экзогенного происхождения.
В настоящее время существует международный проект «Микробиом человека» (Human Microbiome Project). Он объединил около 200 ученых из 80 мультидисциплинарных исследовательских институтов. Ученые проанализировали структуру взятых из 5 тысяч образцов молекул РНК, что должно было показать генетические отношения между организмами. Кроме того, они расшифровали геномы микробов, найденных в 681 образце, и сопоставили полученные генетические последовательности с геномами известных микроорганизмов. В результате, как заявляют участники проекта, они получили самые полные на сегодняшний день данные обо всех видах микроорганизмов, населяющих человеческий организм [13]. Консорциум «Микробиом человека» опубликовал результаты многолетней работы. По предварительным итогам генетического анализа было установлено, что в организме человека обитает более сотни триллионов бактерий, более 10 тысяч видов различных микробов. По словам авторов исследования, такое обилие микробов обеспечивает жизнедеятельность человека гораздо большим количеством генов, чем может предоставить сам по себе человеческий организм. По подсчетам ученых, если в геноме человека 22 тысячи генов, кодирующих белки для обслуживания своего метаболизма, микробиом привносит около восьми миллионов уникальных кодирующих генов, иными словами, бактериальных генов в человеке в 360 раз больше, чем собственно человеческих [9]. Микробиом подразумевает совокупность не столько самих микробов, сколько всех микробных генов, оказывающих влияние на среду, в которой они существуют.
Аутофлора кишечника принимает участие в метаболизме азот- и углеродсодержащих соединений, мочевины. Регулирует обмен гистамина, билирубина, холестерина, ксенобиотиков, энтерокиназы, щелочной фосфатазы. Микробиоценоз кишечника реализует функцию гидролиза продуктов метаболизма белков, липидов, углеводов, деконъюгацию желчных и гидроксилирование жирных кислот и др. Недостаточность детоксицирующей функции аутофлоры ЖКТ при дисбиотических сдвигах повышает напряжение ферментных систем с последующими метаболическими и структурными изменениями в органах пищеварения.
Крайне важной защитной функцией микробиома кишечника является создание собственной колонизационной резистентности, обеспечивающей предотвращение заселения организма хозяина другими штаммами, подавление жизнедеятельности патогенных либо условно-патогенных микроорганизмов. Антибактериальная активность микробиома связана с образованием им антибиотикоподобных субстанций — бактериоцинов (колицинов, бифидоцинов, лактоцинов и т.д.), выработка которых контролируется специальным типом автономных плазмид, называемых Col-факторами. Бактерии, содержащие Col-фактор, называются бактериоциногенными, а само явление носительства таких факторов — бактериоциногенией. Бактериоцины неоднородны по спектру и способу действия, по химической структуре и по антигенной специфичности [7]. Благодаря этому свойству ингибируется рост целого ряда бактерий:
— Klebsiella pneumoniae;
— Proteus vulgaris;
— Pseudomonas aeruginosa;
— Pseudomonas flourescens;
— Salmonella typhosa;
— Salmonella schottmuelleri;
— Sarcina lutea;
— Shigella dysenteriae;
— Shigella paradysenteriae;
— Serratia marcescens;
— Staphylococcus aureus;
— Streptococcus faecalis;
— Streptococcus lactis;
— Vibrio comma [11].
Несмотря на защитную функцию и бактерицидное действие микробиома, некоторые патогены все же проникают в слизистый слой кишечника. На этом этапе защита реализуется за счет клеток иммунной системы.
Микрофлора кишечника активно участвует в формировании иммунобиологических реакций организма. Бактериальные модулины бифидо- и лактобактерий стимулируют синтез иммуноглобулинов, интерферонов, цитокинов, увеличивают количество комплемента, повышают активность лизоцима, стимулируют созревание макрофагально-гистиоцитарной системы, принимают участие в метаболизме холестерина и желчных кислот, что, безусловно, имеет значение при патологии печени [1].
Показано, что лактобактерии обладают свойством изменять фенотип Т-хелперов (Th) от предоминированных Тh2, участвующих в реакциях гуморального иммунитета, на Th1, участвующие в клеточном иммунитете и обеспечивающие противовирусный иммунитет. Именно участие лактобактерий в противовирусном иммунитете делает представителей, относящихся к данной микрофлоре, особенно значимыми в реализации защиты организма от гепатотропных вирусов.
Микробиом участвует в поддержании нормального витаминного баланса организма. В частности, обеспечивает синтез и всасывание витаминов группы В: В12, В9 (фолиевая кислота), В2 (рибофлавин), В5 (пантотеновая кислота). Недостаток этой группы (помимо всего прочего) приводит к ухудшению памяти и ослаблению мыслительной деятельности, расстройству внимания, вызывает излишнюю нервозность, бессонницу и тревогу. Это усугубляет депрессивный компонент, являющийся составной частью клинической симптоматики вирусных гепатитов.
Кроме того, нормофлора кишечника синтезирует никотиновую кислоту, витамины D, К, С.
Микробиом участвует в обмене железа, цинка и кобальта, аминокислот, гормонов [10, 12].
В ряде научных работ показано, что острые и хронические вирусные гепатиты сопровождаются выраженными патологическими нарушениями в микрофлоре кишечника, а именно возникновением дефицита облигатных (обязательных) микроорганизмов и ростом контаминации толстой кишки [2, 3]. Однако только в единичных исследованиях, проведенных в этом направлении, изучены возможности коррекции дисбиотических сдвигов. Эти работы касались в основном значения лакто- и бифидобактерий, роль которых, безусловно, важна. Однако важно не забывать о существовании других представителей микрофлоры, не только не уступающих последним, но и превосходящих их по антагонизму к патогенной микрофлоре. При этом введения только лакто- и бифидобактерий может быть далеко не достаточно.
К таким представителям нужно отнести Bacillus subtilis, являющуюся грамположительной аэробной бактерией, которая была впервые описана в 1835 году Эренбергом как Vibrio subtilis, а в 1872 году переименована Коном в Bacillus subtilis и стала типичным видом рода. Bacillus subtilis благодаря продуцируемым антибиотикам и способности закислять среду обитания являются антагонистами патогенных и условно-патогенных микроорганизмов, таких как сальмонелла, протей, стафилококки, стрептококки, дрожжевые грибки; продуцируют ферменты (амилазы, протеазы), удаляющие продукты гнилостного распада тканей. B.subtilis аммонифицируют белки, расщепляют крахмал, гликоген, синтезируют аминокислоты, витамины и иммуноактивные факторы.
Выраженный антагонизм к патогенной микрофлоре у Bacillus subtilis позволил отнести ее по фармакологическому указателю к группам «Противодиарейные средства» и «Другие иммуномодуляторы». Код Bacillus subtilis по АТХ — «A07FA Антидиарейные микроорганизмы».
Отсутствие патогенности у штаммов B.subtilis дало основание для присвоения им Управлением по контролю качества продовольственных и лекарственных средств США статуса GRAS (generally regarded as safe) — безопасных организмов.
В связи с изложенным целью нашего исследования стало изучение состояния микрофлоры кишечника у детей, перенесших ВГА, больных хроническим ВГВ и хроническим ВГС, а также коррекция выявленных нарушений.
Наше внимание привлек препарат Субалин, представляющий собой лиофилизированную взвесь штамма Bacillus subtilis.
От традиционных пробиотиков, содержащих лакто- и бифидобактерии, его отличают выраженный антагонизм к широкому спектру патогенной и условно-патогенной микрофлоры (Aeromonas hydrophila, Shigella, Salmonella, Esberichia coli, Klebsiella, Staphylococcus aureus, Candida tropicalis, Proteus, Shygolla sonne, Staphylococcus typhimirium, Candida albicans и др.), способность к быстрой нормализации качественного и количественного состава кишечной микрофлоры, а также антивирусная активность за счет самостоятельного продуцирования альфа-2-интерферона. Важной особенностью Субалина является его способность повышать неспецифическую и специфическую резистентность организма, а также регулировать и стимулировать пищеварение. Bacillus subtilis способствуют резкому повышению иммунного статуса и устойчивость организма к различным видам вирусных и других заболеваний. Под влиянием бацилл активно продуцируются ферменты, аминокислоты, антибиотические вещества и другие физиологически активные субстраты, дополняющие комплексное лечебно-профилактическое действие.
Bacillus subtilis отличаются высокой устойчивостью к пищеварительным сокам и ферментам желудочно-кишечного тракта, способностью быстрого заселения желудка и кишечника, хорошей приживляемостью, а споровая форма бактерии придает препарату пролонгированный эффект (до нескольких недель нахождения в желудочно-кишечном тракте). Субалин отличается отсутствием привыкания, т.к. препарат не вызывает образования резистентных штаммов. Для него характерна безвредность в концентрациях, тысячекратно превышающих рекомендуемые. Важным свойством является отсутствие каких-либо особых требований к температуре хранения и высокая долговременная стабильность.
Материалы и методы
Было проведено бактериологическое исследование на микрофлору фекалий у 39 детей. Среди них: 12 человек, перенесших вирусный гепатит А (через 14 дней после выписки из стационара), 19 человек с хроническим вирусным гепатитом С и 8 человек с хроническим вирусным гепатитом В.
Диагноз гепатита был верифицирован на основании результатов общепринятых методов клинико-параклинического обследования.
Методом рандомизации все дети были разделены на две группы. Дети І группы (18 человек) в период диспансерного наблюдения получали пробиотик Субалин (по 1 дозе 2 раза в сутки на протяжении 20 дней). Дети ІІ группы (21 человек) получали только базисную терапию.
Обсуждение полученных результатов
Обследование показало, что у всех наблюдаемых пациентов отмечались той или иной степени выраженности нарушения биоценоза толстого кишечника (табл. 1). Так, дисбиоз 1-й степени был зарегистрирован у 12 (30,8 %) детей, 2-й степени — у 23 (59,0 %), 3-й степени — у 4 (10,2 %).
/9/9.jpg)
Нарушения биоценоза у обследованных детей сопровождались уменьшением количества бифидобактерий и лактобактерий, а также увеличением содержания условно-патогенной флоры. Наблюдаемые изменения были зарегистрированы у большинства детей: у 69,2 % из них установлен недостаток бифидобактерий, у 41,0 % — лактобактерий, у 23,1 % — кишечной палочки с нормальными свойствами. Дисбаланс микрофлоры кишечника проявлялся не только дефицитом некоторых его видов, но и избытком. На фоне перечисленных изменений у 20,5 % детей увеличивалось количество клебсиелл, у 41,0 % — грибов рода Candidа.
Включение Субалина в комплексное лечение детей позволило купировать клиническую симптоматику: астеновегетативный синдром у 10 (55,6 %) и синдром хронической интоксикации – у 12 (66,7 %), уменьшить проявления диспептического синдрома — у 16 (88,9 %) и гепатомегалии — у 3 детей (16,7 %) (табл. 2).
Препарат способствовал восстановлению количественного уровня индигенной микрофлоры кишечника (бифидобактерий, лактобацилл, кишечной палочки) и элиминации из кишечника патогенных и условно-патогенных микроорганизмов — клебсиелл, дрожжеподобных грибов рода Candida (табл. 3).
Так, у детей основной группы сниженный уровень бифидобактерий был зарегистрирован только у 16,7 %, уровень лактобактерий соответствовал норме у всех, грибов рода Candida и клебсиелл — у 5,6 %.
В контрольной группе нарушения биоценоза в кишечнике сохранились такими же, как и до начала лечения.
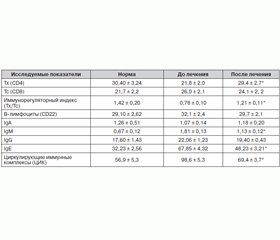
Исследование также показало иммуномодулирующий эффект Субалина. За счет повышения уровня Тх (CD4) наблюдалось восстановление иммунорегуляторного индекса (Тх/Тс) — 1,21 ± 0,11 усл.ед., который был существенно снижен до начала лечения — 0,78 ± 0,10 усл.ед. (p < 0,05).
Также отмечается и статистически достоверное снижение уровня ЦИК с 98,6 ± 5,3 до 69,4 ± 3,7 ед.экст.
Позитивная динамика наблюдается также в показателях иммуноглобулинов сыворотки крови — IgM, IgE (табл. 4).
Полученные результаты позволяют сделать следующие выводы:
1. Применение Субалина в комплексной терапии детей с хроническими вирусными гепатитами В и С, а также в стадии реконвалесценции вирусного гепатита А устраняет синдром интоксикации и способствует быстрому регрессу всех клинических симптомов.
2. Результаты исследования свидетельствуют о восстановлении состава микрофлоры кишечника.
3. Применение Субалина нормализует иммунный статус детей, в том числе с хроническими вирусными гепатитами и вирусным гепатитом А.
4. В процессе применения препарата отмечена его хорошая переносимость и отсутствие побочных эффектов.
1. Береза Н.Н. Проблемы дисбактериоза кишечника и его коррекции / Н.Н. Береза // Гастроэнтерология. — 2000. — Вып. 31. — С. 432–435.
2. Кучеренко Н.П. Мікробіоценоз товстої кишки у хворих на вірусний гепатит / Н.П. Кучеренко, А.І. Бобровицька, І.О. Верещагін // Матеріали науково-практичної конференції і пленуму Асоціації інфекціоністів України. — 2004. — С. 115–116.
3. Малий В.П. Стан мікробіоценозу товстої кишки у хворих на гострі вірусні гепатити / В.П. Малий, О.В. Гололобова, А.І. Скляр // Матеріали науково-практичної конференції і пленуму Асоціації інфекціоністів України. — 2004. — С. 129–131.
4. Сакович В.Н. Изучение эффективности применения пробиотика Субалина в комплексном лечении больных передними увеитами / В.Н. Сакович // Офтальмология. Восточная Европа. — 2013. — № 2 (17). — С. 133–138.
5. Сукачев В.С. Оценка морфофункционального состояния тонкой кишки у больных хроническим гепатитом С: Дис... канд. мед. наук. — Санкт-Петербург, 2012. — 106 с.
6. Толоконская Н.П. Оценка микробиоценоза организма в клинической диагностике острых вирусных гепатитов / Н.П. Толоконская, И.В. Покровская, Н.И. Хохлова // Бюллетень СО РАМН. — 2010. — № 1. — С. 88–95.
7. Фирсов Н.Н. Микробиология: словарь терминов / Н.Н. Фирсов. — М.: Дрофа, 2006. — 126 с.
8. Хорошилова И.А. Состояние микрофлоры кишечника у больных вирусными гепатитами В, С и микст-гепатитами В + С: Автореф. дис... канд. мед. наук. — Новосибирск, 2005.
9. Consortium Members Publish Collection of Studies Stemming from Human Microbiome Project — Genome Web, 14.06.2012.
10. Cummings J.H. Role of intestinal bacteria in nutrient metabolism / J.H. Cummings, G.T. Macfarlane // J. Parenter. Enteral. Nutr. — 1997. — № 21. — Р. 357–365.
11. Lu L. Pathologic and physiologic interactions of bacteria with the gastrointestinal epithelium / L. Lu, W.A. Walker // Am. J. Clin. Nutr. — 2001. — № 73. — Р. 11–30.
12. Metges C.C. Contribution of microbial amino acids to amino acid homeostasis of the host / C.C. Metges // J. Nutr. — 2000. — № 13. — Р. 185–186.

/10/10.jpg)
/10/10_2.jpg)