Газета «Новости медицины и фармации» 6 (495) 2014
Вернуться к номеру
Клінічні рекомендації з артеріальної гіпертензії Європейського товариства гіпертензії (ESH) та Європейського товариства кардіологів (ESC) 2013 року 2013 ESH/ESC Guidelines for the management of arterial hypertension
Авторы: Giuseppe Mancia (Chairperson) (Italy); Robert Fagard (Chairperson) (Belgium); Krzysztof Narkiewicz (Section coordinator) (Poland)
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 15-23 (Мир)
Автори/члени робочої групи: Giuseppe Mancia (Chairperson) (Italy), Robert Fagard (Chairperson) (Belgium), Krzysztof Narkiewicz (Section coordinator) (Poland), Josep Redon (Section coordinator) (Spain), Alberto Zanchetti (Section coordinator) (Italy), Michael Böhm (Germany), Thierry Christiaens (Belgium), Renata Cifkova (Czech Republic), Guy De Backer (Belgium), Anna Dominiczak (UK), Maurizio Galderisi (Italy), Diederick E. Grobbee (Netherlands), Tiny Jaarsma (Sweden), Paulus Kirchhof (Germany/UK), Sverre E. Kjeldsen (Norway), Stéphane Laurent (France), Athanasios J. Manolis (Greece), Peter M. Nilsson (Sweden), Luis Miguel Ruilope (Spain), Roland E. Schmieder (Germany), Per Anton Sirnes (Norway), Peter Sleight (UK), Margus Viigimaa (Estonia), Bernard Waeber (Switzerland), Faiez Zannad (France).
Учена рада ESH: Josep Redon (President) (Spain), Anna Dominiczak (UK), Kristoff Narkiewicz (Poland), Peter M. Nilsson (Sweden), Michel Burnier (Switzerland), Margus Viigimaa (Estonia), Ettore Ambrosioni (Italy), Mark Caufield (UK), Antonio Coca (Spain), Michael Hecht Olsen (Denmark), Roland E. Schmieder (Germany), Costas Tsioufis (Greece), Philippe van de Borne (Belgium).
Комітет ESC з практичних настанов: Jose Luis Zamorano (Chairperson) (Spain), Stephan Achenbach (Germany), Helmut Baumgartner (Germany), Jeroen J. Bax (Netherlands), Héctor Bueno (Spain), Veronica Dean (France), Christi Deaton (UK), Cetin Erol (Turkey), Robert Fagard (Belgium), Roberto Ferrari (Italy), David Hasdai (Israel), Arno W. Hoes (Netherlands), Paulus Kirchhof (Germany/UK), Juhani Knuuti (Finland), Philippe Kolh (Belgium), Patrizio Lancellotti (Belgium), Ales Linhart (Czech Republic), Petros Nihoyannopoulos (UK), Massimo F. Piepoli (Italy), Piotr Ponikowski (Poland), Per Anton Sirnes (Norway), Juan Luis Tamargo (Spain), Michal Tendera (Poland), Adam Torbicki (Poland), William Wijns (Belgium), Stephan Windecker (Switzerland).
Оглядачі документації: Denis L. Clement (ESH Review Coordinator) (Belgium), Antonio Coca (ESH Review Coordinator) (Spain), Thierry C. Gillebert (ESC Review Coordinator) (Belgium), Michal Tendera (ESC Review Coordinator) (Poland), Enrico Agabiti Rosei (Italy), Ettore Ambrosioni (Italy), Stefan D. Anker (Germany), Johann Bauersachs (Germany), Jana Brguljan Hitij (Slovenia), Mark Caulfield (UK), Marc De Buyzere (Belgium), Sabina De Geest (Switzerland), Geneviève Anne Derumeaux (France), Serap Erdine (Turkey), Csaba Farsang (Hungary), Christian Funck-Brentano (France), Vjekoslav Gerc (Bosnia & Herzegovina), Giuseppe Germano (Italy), Stephan Gielen (Germany), Herman Haller (Germany), Arno W. Hoes (Netherlands), Jens Jordan (Germany), Thomas Kahan (Sweden), Michel Komajda (France), Dragan Lovic (Serbia), Heiko Mahrholdt (Germany), Michael Hecht Olsen (Denmark), Jan Ostergren (Sweden), Gianfranco Parati (Italy), Joep Perk (Sweden), Jorge Polonia (Portugal), Bogdan A. Popescu (Romania), Željko Reiner (Croatia), Lars Ryden (Sweden), Yuriy Sirenko (Ukraine), Alice Stanton (Ireland), Harry Struijker Boudier (Netherlands), Costas Tsioufis (Greece), Phillipe Van de Borne (Belgium), Charalambos Vlachopoulos (Greece), Massimo Volpe (Italy), David A. Wood (UK).
1. Вступ
1.1. Огляд (табл. 1, 2)
1.2. Нові аспекти
Завдяки включенню нових доказових даних щодо діагностичних і терапевтичних аспектів артеріальної гіпертензії дані рекомендації багато в чому відрізняються від попередніх [2]. Деякі з найбільш важливих відмінностей наведені нижче:
1. Епідеміологічні дані щодо поширеності артеріальної гіпертензії та контролю АТ у Європі.
2. Зміцнення прогностичного значення домашнього моніторингу артеріального тиску (ДМАТ) та його ролі в діагностиці та лікуванні артеріальної гіпертензії поруч з амбулаторним моніторингом артеріального тиску (АМАТ).
3. Уточнення прогностичного значення АТ у нічний час, артеріальної гіпертензії «білого халата» і маскованої артеріальної гіпертензії.
4. Зроблено особливий акцент на доцільності інтеграції АТ, факторів серцево-судинного ризику, безсимптомного ураження органів і клінічних ускладнень для загальної оцінки серцево-судинного ризику.
5. Доповнення прогностичного значення безсимптомних уражень органів, включаючи серце, кровоносні судини, нирки, очі й мозок.
6. Перегляд ризику надмірної ваги та цільового індексу маси тіла (ІМТ) при артеріальній гіпертензії.
7. Артеріальна гіпертензія в молодому віці.
8. Початок лікування артеріальної гіпертензії. Більше науково обґрунтованих критеріїв та немедикаментозне лікування високого нормального АТ.
9. Цільовий рівень АТ при лікуванні. Більше критеріїв, заснованих на доказах, єдине цільове значення систолічного артеріального тиску (САТ) (< 140 мм рт.ст.) у групах пацієнтів як із високим, так і з низьким серцево-судинним ризиком.
10. Ліберальний підхід до початкової монотерапії без будь-якого ранжування.
11. Переглянута схема для пріоритетних двокомпонентних комбінацій.
12. Нові терапевтичні алгоритми для досягнення цільового рівня АТ.
13. Розширений розділ із терапевтичних стратегій в особливих клінічних ситуаціях.
14. Переглянуті рекомендації з лікування артеріальної гіпертензії в літніх людей.
15. Медикаментозне лікування в людей віком понад 80 років.
16. Особлива увага до резистентної артеріальної гіпертензії та нові підходи до її лікування.
17. Підвищена увага до вибору лікування з урахуванням ураження органів-мішеней.
18. Нові підходи до хронічного лікування гіпертонічної хвороби.
2. Епідеміологічні аспекти
2.1. Зв’язок рівня артеріального тиску з ураженням серцево-судинної системи та нирок
Зв’язок між значеннями АТ, серцево-судинною та нирковою захворюваністю і фатальними подіями вивчався у великій кількості обсерваційних досліджень [3]. Результати, детально наведені в рекомендаціях 2003 і 2007 років ESH/ESC [1, 2], можна підсумувати так:
1) офісний (на прийомі у лікаря) АТ демонструє незалежний та постійний зв’язок із частотою деяких серцево-судинних подій (інсульт, інфаркт міокарда, раптова смерть, серцева недостатність та захворювання периферичних артерій (ЗПА)), а також термінальною стадією хронічної ниркової недостатності (ХНН) [3–5]. Наведені дані стосуються всіх вікових категорій та етнічних груп [6, 7];
2) зв’язок з АТ простежується від високих рівнів АТ до відносно низьких значень у діапазоні 110–115 мм рт.ст. для систолічного АТ і 70–75 мм рт.ст. для діастолічного АТ. Систолічний АТ, напевно, є кращим предиктором подій, ніж діастолічний АТ, у пацієнтів віком понад 50 років [8, 9], також було показано, що в літніх осіб пульсовий тиск (різниця між систолічним і діастолічним АТ) може мати додаткову прогностичну цінність [10]. На це вказує також особливо високий серцево-судинний ризик, що спостерігається в пацієнтів із підвищеним систолічним і з нормальним або зниженим діастолічним АТ (ізольована систолічна артеріальна гіпертензія) [11];
3) постійний зв’язок із подіями також спостерігається й для позаофісних значень АТ, отриманих при АМАТ та ДМАТ (див. розділ 3.1.2);
4) зв’язок між АТ та серцево-судинною захворюваністю та смертністю модифікується наявністю інших супутніх факторів серцево-судинного ризику. Метаболічні фактори ризику (ФР) є більш поширеними при високих значеннях АТ, ніж при низьких [12, 13].
2.2. Визначення та класифікація артеріальної гіпертензії
Безперервний зв’язок між рівнем АТ та ризиком серцево–судинних і ниркових подій викликає складнощі при диференціації нормо- та гіпертензії на основі порогових значень АТ. Більше того, у загальній популяції значення систолічного та діастолічного АТ мають унімодальний розподіл [14]. На практиці, однак, порогові значення АТ використовуються універсально як для спрощення діагностичного підходу, так і для полегшення прийняття рішення щодо тактики лікування. Рекомендована класифікація залишилася незмінною порівняно з рекомендаціями ESH/ESC 2003 і 2007 років (табл. 3).
Артеріальна гіпертензія визначається при САТ ≥ 140 мм рт.ст. і/або діастолічному АТ (ДАТ) ≥ 90 мм рт.ст., виходячи з доказів, отриманих у РКД, стосовно того, що в пацієнтів із такими значеннями АТ їх зниження при лікуванні є корисним (див. розділи 4.1 і 4.2). Одна й та сама класифікація використовується для пацієнтів молодого, середнього та літнього віку, у той час як у дітей та підлітків, для яких відсутні дані з інтервенційних досліджень, прийняті диференційовані критерії на основі перцентилів. Подробиці про класифікацію АТ у хлопчиків і дівчаток залежно від їх віку і зросту можна знайти в рекомендаціях ESH із діагностики, оцінки та лікування підвищеного артеріального тиску в дітей та підлітків [15].
2.3. Поширеність артеріальної гіпертензії
Порівняльні дані щодо поширеності артеріальної гіпертензії й тенденцій зміни значень АТ у різних європейських країнах обмежені [16]. Загальна поширеність артеріальної гіпертензії вважається близькою до 30–45 % від загальної чисельності населення із різким збільшенням частоти захворювання з віком. Також спостерігаються помітні відмінності в середніх рівнях АТ у різних країнах за відсутності систематичних тенденцій до зміни АТ в останні десятиліття [17–37].
У зв’язку з труднощами отримання порівняльних результатів між країнами та часовими інтервалами було запропоновано використання сурогатного маркера гіпертензивного статусу [38]. Добрим варіантом є смертність від інсульту, оскільки артеріальна гіпертензія на сьогодні є найбільш важливою причиною смерті внаслідок цієї патології. Було повідомлено про наявність тісного взаємозв’язку між поширеністю артеріальної гіпертензії та смертності від інсульту [39]. Частота й тенденції смертності від інсульту в Європі були проаналізовані з використанням демографічної статистики ВООЗ. У західноєвропейських країнах виявляється тенденція до зниження на відміну від країн Східної Європи, які демонструють чіткий ріст смертності від інсульту [40].
2.4. Артеріальна гіпертензія та загальний серцево–судинний ризик
Протягом довгого часу рекомендації з артеріальної гіпертензії були сфокусовані на значенні АТ як єдиного або основного показника, що визначав необхідність і тип лікування. У 1994 році ЄТК, ЄТГ та Європейське товариство з атеросклерозу (European Atherosclerosis Society) розробили спільні рекомендації з профілактики ІХС у клінічній практиці [41], підкресливши, що профілактика ІХС має бути пов’язана з кількісною оцінкою загального (або глобального) серцево-судинного ризику. Цей підхід сьогодні є загальноприйнятим і був інтегрований у рекомендації ESH/ESC 2003 і 2007 років з діагностики та лікування артеріальної гіпертензії [1, 2]. Концепція заснована на тому, що тільки в невеликої частини населення з діагнозом артеріальної гіпертензії спостерігається лише підвищення АТ, у той час як у більшості наявні й інші фактори серцево-судинного ризику. Крім того, при одночасному співіснуванні АТ та інших факторів серцево–судинного ризику вони можуть підсилювати один одного, що призводить до збільшення загального серцево-судинного ризику, який перевищує суму його окремих компонентів. Нарешті, у групі пацієнтів високого ризику стратегії антигіпертензивної терапії (ініціювання та інтенсивність терапії, використання комбінації лікарських засобів тощо, див. розділи 4–7), а також інші процедури можуть відрізнятися від тих, що будуть реалізовані в групі пацієнтів із низьким ризиком. Існують докази того, що в групі високого ризику контроль АТ є більш складним і частіше вимагає комбінації антигіпертензивних препаратів разом з іншими методами лікування, такими як агресивна гіполіпідемічна терапія. Терапевтичний підхід на додаток до значень АТ повинен враховувати загальний серцево-судинний ризик із метою забезпечення максимальної економічної ефективності лікування артеріальної гіпертензії.
2.4.1. Оцінка загального серцево–судинного ризику
Оцінка загального серцево-судинного ризику не є складною в окремих підгрупах пацієнтів, особливо коли вони мають попередньо встановлений діагноз серцево-судинних захворювань, цукрового діабету, ІХС, або ж у пацієнтів із значно підвищеними окремими факторами ризику. У всіх цих умовах загальний серцево-судинний ризик є високим або дуже високим та потребує інтенсивних заходів щодо його зниження. Однак велика кількість пацієнтів з артеріальною гіпертензією не належить до жодної перерахованої вище категорії, а ідентифікація пацієнтів із низьким, середнім, високим або дуже високим ризиком вимагає використання моделі для оцінки загального серцево-судинного ризику таким чином, щоб мати можливість відповідно регулювати терапевтичний підхід.
Ризик може бути вищим від зазначеного в таблицях:
1. У пацієнтів із малорухомим способом життя, а також у пацієнтів із центральним ожирінням; збільшення відносного ризику пов’язане з надмірною вагою і більш значиме в молодих людей, ніж у літніх осіб.
2. У соціально знедолених осіб та представників етнічних меншин.
3. У пацієнтів із підвищеним рівнем глюкози натще і/або порушенням толерантності до глюкози, діагностичними критеріями цукрового діабету.
4. В осіб із підвищеними рівнями тригліцеридів, фібриногену, аполіпопротеїну В, ліпопротеїну (а) та високочутливого С-реактивного білка.
5. У пацієнтів із сімейним анамнезом передчасного розвитку серцево–судинних захворювань (віком до 55 років у чоловіків і до 65 років у жінок).
У шкалі SCORE загальний серцево-судинний ризик виражається у вигляді абсолютного ризику смерті від серцево-судинних захворювань протягом 10 років. Через високу залежність від віку в молодих пацієнтів абсолютний загальний серцево-судинний ризик може бути низьким навіть при високих значеннях АТ із додатковими факторами ризику. При недостатньому лікуванні, однак цей стан через певний період може призвести до виникнення частково необоротного високого ризику. У більш молодих пацієнтів при виборі терапії краще орієнтуватися на кількісну оцінку відносного ризику або оцінку віку серця та судин. Таблиці відносного ризику доступні в рекомендаціях Об’єднаного європейського товариства з профілактики серцево–судинних захворювань у клінічній практиці [50], які можуть бути корисними при консультуванні пацієнтів молодого віку.
Підвищена увага приділена виявленню безсимптомних уражень органів, бо пов’язані з артеріальною гіпертензією безсимптомні ураження декількох органів вказують на безперервне прогресування серцево-судинного захворювання (ССЗ), що значно збільшує його величину порівняно з рівнем ризику при простій наявності факторів ризику. Окремий розділ (розділ 3.7) присвячений виявленню безсимптомного ураження органів (УО) [51–53], у ньому обговорюються доказові дані щодо додаткового ризику, викликаного окремими субклінічними ураженнями.
Протягом більше ніж десяти років у міжнародних рекомендаціях із лікування артеріальної гіпертензії (рекомендації WHO/ISH (ВООЗ/МТАГ, Міжнародне товариство з артеріальної гіпертензії) 1999 і 2003 років, а також у рекомендаціях з артеріальної гіпертензії ЄТГ/ЄТК 2003 і 2007 років [1, 2, 54, 55]) серцево-судинний ризик був стратифікований у різні категорії відповідно до значень АТ, наявності факторів серцево-судинного ризику, безсимптомних уражень органів та цукрового діабету, серцево-судинного захворювання або симптоматичної хронічної хвороби нирок (ХХН), що також було зроблено і в рекомендаціях ЄТК із профілактики 2012 року [50]. Класифікація низького, середнього, високого та дуже високого додаткового ризику зберігається в нинішніх рекомендаціях і заснована на оцінці 10-річного ризику серцево-судинної смертності, як визначено в рекомендаціях із профілактики ESC 2012 року [50] (рис. 1).
Фактори, на яких заснована стратифікація, підсумовані в табл. 4.
2.4.3. Підсумки рекомендацій щодо оцінки загального серцево–судинного ризику
3.1.2. Позаофісний АТ
Основною перевагою моніторингу АТ поза кабінетом лікаря є те, що він забезпечує велику кількість вимірювань АТ поза медичним середовищем, що є основою більш надійної оцінки фактичних значень АТ порівняно з офісним визначенням АТ. Позаофісний АТ звичайно оцінюється при АМАТ або ДМАТ і, як правило, самостійно. Кілька загальних принципів та зауважень справедливі і для цих двох видів моніторингу на додаток до рекомендацій з офісного вимірювання АТ [64–67]:
— пацієнту слід адекватно пояснити принципи процедури, у тому числі з усними та письмовими інструкціями; крім того, самостійне вимірювання АТ вимагає відповідної підготовки під наглядом лікаря;
— при інтерпретації результатів слід враховувати, що відтворюваність даних позаофісного вимірювання АТ більш точна при вимірюванні протягом 24 годин — середні значення вдень та вночі, але менш точна при вимірюванні про–тягом коротших періодів впродовж 24 год [68] та для визначення більш складних і похідних параметрів моніторування;
— ДМАТ та АМАТ забезпечують дещо різну інформацію щодо АТ пацієнта та ризику, тож ці два методи слід розглядати як взаємодоповнюючі, а не конкурентні чи альтернативні. Відповідність значень при АМАТ та ДМАТ — від помірної до задовільної;
— значення офісного АТ, як правило, вищі, ніж значення, отримані в амбулаторних чи домашніх умовах, і різниця збільшується в міру збільшення офісного АТ. Порогові значення для визначення артеріальної гіпертензії при домашньому та амбулаторному вимірюваннях АТ відповідно до даних Робочої групи з моніторингу АТ ESH наведені в табл. 6 [64–67].
3.7. Пошук безсимптомних уражень органів
3.7.3. Нирки
Діагноз хронічного захворювання нирок, що виникло під впливом артеріальної гіпертензії, базується на виявленні зниженої функції нирок і/або виявленні підвищеної екскреції альбуміну з сечею [207]. При встановленні діагнозу ХХН її поділяють залежно від величини розрахованої швидкості клубочкової фільтрації (рШКФ), обчисленої за формулою MDRD (Modification of Diet in Renal Disease — Модифікація дієти при хворобі нирок, МДХН) [208], або за формулою Кокрофта — Голта або за формулою CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration — Товариство з епідеміології хронічної хвороби нирок) [209], що вимагають інформації щодо віку, статі, етнічної приналежності та показників креатиніну сироватки. У випадках, коли величина рШКФ менше 60 мл/хв/1,73 м2, виділяють три стадії ХХН: 3-тя стадія зі значеннями від 30 до 60 мл/хв/м2 та стадії 2 і 1 зі значеннями, нижчими від 30 і 15 мл/хв/м2 відповідно [210]. Дані формули дозволяють виявити помірні порушення функції нирок, коли рівні креатиніну сироватки ще знаходяться в межах норми [211]. Висновок про зниження функції нирок і збільшення ризику розвитку ССЗ може бути зроблений у разі підвищеного рівня цистатину С у сироватці крові [212]. Невелике збільшення креатиніну (до 20 %) у сироватці крові може іноді виникати на початку або при посиленні антигіпертензивної терапії, особливо блокаторами РАС (ренін-ангіотензинової системи), але це не слід сприймати як ознаку прогресуючого порушення ниркової функції. У нелікованих пацієнтів з артеріальною гіпертензією часто спостерігається гіперурикемія (особливо при прееклампсії), величина якої корелює зі зменшенням ниркового кровотоку та нефросклерозом [213].
Коли підвищена концентрація креатиніну в сироватці або низький рівень рШКФ вказують на зниження функції нирок, то виявлення підвищеної швидкості екскреції альбуміну або білка вказують загалом на порушення бар’єра клубочкової фільтрації. Як було показано, мікроальбумінурія прогнозує розвиток явної діабетичної нефропатії в пацієнтів, хворих на обидва типи (1 і 2) цукрового діабету [214], у той час як явна протеїнурія зазвичай, безсумнівно, вказує на наявність ниркового паренхіматозного захворювання [215]. У хворих на артеріальну гіпертензію з цукровим діабетом та без нього було продемонстровано, що наявність мікроальбумінурії, навіть нижче від порогових значень, що зазвичай розглядаються [216], є прогностичним маркером розвитку серцево-судинних подій [217–225]. Також у кількох дослідженнях був встановлений постійний зв’язок між серцево-судинною, а також не серцево-судинною смертністю та величиною співвідношення вмісту альбуміну/креатиніну у сечі: > 3,9 мг/г у чоловіків і > 7,5 мг/г у жінок [224, 226]. Як у загальній популяції, так і у хворих на цукровий діабет наявність супутнього збільшення екскреції білка з сечею і зниження рівня рШКФ вказують на більший ризик серцево-судинних та ниркових ускладнень, ніж будь-яка патологія окремо, що робить ці фактори ризику незалежними та додатковими [227, 228]. Умовне порогове значення для визначення мікроальбумінурії було встановлено на рівні 30 мг/г креатиніну [228].
Таким чином, виявлення порушення функції нирок у пацієнтів з артеріальною гіпертензією, яке виражається в будь-якому зі згаданих вище відхилень, є частим явищем та дуже потужним предиктором майбутніх серцево-судинних подій [218, 229–233]. Тому для всіх пацієнтів з артеріальною гіпертензією рекомендується визначення рівня рШКФ та проведення тесту на виявлення мікроальбумінурії в разовій порції сечі.
3.8. Пошук вторинних форм артеріальної гіпертензії
4. Підхід до лікування
4.2.7. Підсумок рекомендацій щодо ініціації антигіпертензивної терапії
Рекомендації щодо ініціації антигіпертензивної терапії підсумовані на рис. 2 та нижче.
4.3. Цільовий рівень АТ при лікуванні
4.3.4.3. Захворювання нирок
У пацієнтів із ХХН, із цукровим діабетом або без нього, існує дві мети лікування:
1) профілактика серцево-судинних подій (як найбільш частого ускладнення ХХН);
2) запобігання розвитку ниркової недостатності або уповільнення подальшого погіршення функції нирок.
На жаль, доказових даних, що стосуються цільових значень АТ, які повинні бути досягнуті в таких пацієнтів, недостатньо, до того ж бентежить невизначеність щодо відповідної ролі ефектів зниження АТ та специфічного впливу блокаторів РААС [303]. У трьох дослідженнях у хворих на ХХН майже виключно без цукрового діабету [304–306] істотної різниці щодо частоти розвитку термінальної стадії ниркової недостатності або смертності між пацієнтами, рандомізованими до більш низького цільового рівня АТ (125–130 мм рт.ст.), та пацієнтами, рандомізованими до більш високого цільового рівня АТ (< 140 мм рт.ст.), не спостерігалося. Тільки під час продовженого періоду обсерваційного спостереження у двох із цих досліджень була визначена тенденція до зниження частоти подій — більш очевидна в пацієнтів із протеїнурією [307, 308]. Два масштабних дослідження в пацієнтів із діабетичною нефропатією [309, 310] виявилися неінформативними щодо передбачуваної переваги цільового рівня АТ нижче за 130 мм рт.ст., оскільки середні значення САТ, досягнуті в групах із більш інтенсивним лікуванням, становили 140 та 143 мм рт.ст. Тільки за даними останнього кооперативного дослідження було повідомлено про зменшення частоти розвитку ниркових подій (зниження рівня розрахункової ШКФ та розвиток термінальної стадії ниркової недостатності) в дітей, рандомізованих до цільового значення АТ, нижчого порівняно з більш ніж 50-м перцентилем [311]. Однак ці дані, отримані в дітей, навряд чи можна порівнювати з результатами для дорослих. Крім того, слід враховувати, що в дослідженні ACCORD, хоча значення рШКФ на початку дослідження були в межах норми, більш інтенсивне зниження АТ (119/67 проти 134/73 мм рт.ст.) було пов’язане майже з подвоєнням кількості випадків появи величини розрахункової ШКФ < 30 мл/хв 1,73 м2 [295]. Нарешті, у нещодавніх метааналізах досліджень, які вивчали різні цільові значення АТ у хворих із ХХН, не вдалося продемонструвати чітких переваг із точки зору серцево–судинних або ниркових подій [312, 313].
5. Стратегії лікування
5.2.2. Монотерапія та комбінована терапія
6.5.3. Вагітність
Гіпертензивні розлади під час вагітності були розглянуті нещодавно в рекомендаціях ESC із лікування серцево–судинних захворювань під час вагітності [499]. За відсутності РКД рекомендації можуть ґрунтуватися лише на думці експертів. Незважаючи на існування консенсусу, що медикаментозне лікування тяжкої артеріальної гіпертензії під час вагітності (> 160 мм рт.ст. для САТ та > 110 мм рт.ст. для ДАТ) потрібне та є корисним, переваги антигіпертензивної терапії для легкого та середнього підвищення АТ при вагітності (≤ 160/110 мм рт.ст.), уже існуючого або викликаного вагітністю, залишаються не встановленими, за винятком випадків більш низького ризику розвитку тяжкої артеріальної гіпертензії [500]. Міжнародні та національні рекомендації змінюються залежно від порогових значень для початку лікування і цільових значень АТ під час вагітності. Пропозиція, що міститься в рекомендаціях ESH/ESC 2007 року [2], щодо розгляду медикаментозного лікування у всіх вагітних жінок зі стійким підвищенням АТ ≥ 150/95 мм рт.ст. підтримується останніми даними із США, які демонструють тенденцію до збільшення частоти госпіталізацій з приводу інсульту, пов’язаних із вагітністю, особливо в післяпологовому періоді, з 1994 по 2007 рік [501], а також аналізом даних від пацієнток із тяжкою прееклампсією та еклампсією [502]. Незважаючи на відсутність доказів, у 2013 році Робоча група підтверджує розгляд раннього початку антигіпертензивної терапії при значеннях АТ ≥ 140/90 мм рт.ст. у жінок:
— із гестаційною артеріальною гіпертензією (з протеїнурією або без неї);
— уже існуючою артеріальною гіпертензією з накладанням гестаційної артеріальної гіпертензії;
— артеріальною гіпертензією з безсимптомним ураженням органів або симптомами в будь–який час при вагітності.
Додаткової інформації з часу публікації попередніх рекомендацій [2] щодо антигіпертензивних препаратів, які слід використовувати у вагітних жінок з артеріальною гіпертензією, отримано не було, тому рекомендації, що стосуються використання метилдопи, лабеталолу та ніфедипіну як єдиного антагоніста кальцію, протестованих у період вагітності, можуть бути підтвердженими. Бета-блокатори (можлива затримка росту плода, якщо приймаються на ранніх термінах вагітності) та діуретики (у разі вже існуючого зниження об’єму плазми) слід використовувати з обережністю. Як згадувалося вище, слід абсолютно уникати всіх препаратів, які впливають на систему ренін-ангіотензин (інгібітори АПФ, БРА, інгібітори реніну). При невідкладних ситуаціях (прееклампсії) внутрішньовенний лабеталол є препаратом вибору; нітропрусид натрію або нітрогліцерин для внутрішньовенної інфузії є альтернативним варіантом.
Існують значні суперечності щодо ефективності низьких доз аспірину для профілактики прееклампсії. Незважаючи на дані великого метааналізу, в якому було показано невелику перевагу аспірину в профілактиці прееклампсії [503], у двох інших нещодавніх аналізах дослідники дійшли протилежних висновків. Rossi та Mullin [504] використовували об’єднані дані близько 5000 жінок із високим ризиком і 5000 із низьким ризиком прееклампсії й повідомили про відсутність ефекту низьких доз аспірину в профілактиці захворювання. Bujold et al. [505], проте узагальнили дані, отримані від більше ніж 11 000 жінок, включених у РКД ефективності низьких доз аспірину у вагітних жінок, і дійшли висновку, що жінки, які почали лікування раніше ніж на 16-му тижні вагітності, мали значне та достовірне зниження відносного ризику розвитку прееклампсії (відносний ризик 0,47) і тяжкої прееклампсії (відносний ризик 0,09) порівняно з контрольними групами [505]. З огляду на ці суперечливі дані може бути запропонована лише така порада: жінкам із високим ризиком розвитку прееклампсії (артеріальна гіпертензія при попередній вагітності, ХХН, автоімунні захворювання, такі як системний червоний вовчак або антифосфоліпідний синдром, 1-й або 2-й тип цукрового діабету, хронічна артеріальна гіпертензія) або з більше ніж одним помірним фактором ризику прееклампсії (перша вагітність, вік ≥ 40 років, інтервал між вагітностями > 10 років, ІМТ ≥ 35 кг/м2 при першому візиті, сімейний анамнез прееклампсії, а також багатоплідна вагітність) можна порадити приймати 75 мг аспірину щодня з 12-го тижня вагітності до народження дитини за умови, що вони мають низький ризик шлунково-кишкової кровотечі.
6.6.1. Підсумок рекомендацій щодо стратегії лікування хворих на цукровий діабет
6.9. Діабетична та недіабетична нефропатія
В обсерваційних дослідженнях зв’язок між АТ та прогресуванням ХХН і частотою термінальної стадії ниркової недостатності є прямим і прогресивним [530]. Більше того, у дослідженні, проведеному в Японії, у загальній чоловічій популяції нормальний високий рівень АТ був пов’язаний зі збільшенням поширеності ХХН [531]. Крім того, у метааналізі інтервенційних досліджень у пацієнтів із недіабетичною нефропатією прогресування ХНН корелювало з досягнутим АТ, найповільніше прогресування спостерігалося в пацієнтів із рівнем САТ у діапазоні 110–119 мм рт.ст., досягнутим на фоні лікування [532]. На жаль (див. розділ 4.3.4.3), дані цих спостережень не підтверджені результатами трьох досліджень [304–306], у яких пацієнти з ХХН були рандомізовані в групи нижчого (< 125–130 мм рт.ст.) або вищого (< 140 мм рт.ст.) цільового АТ: різниці в показниках ниркової недостатності або смертності між двома групами виявлено не було, за винятком пацієнтів з протеїнурією, коли в періоді продовженого спостереження після закінчення двох цих випробувань у тих, хто спочатку був рандомізований до груп нижчого АТ, спостерігалося менше випадків термінальної стадії ниркової недостатності або смерті [307, 308, 313]. У пацієнтів із діабетичною або недіабетичною хворобою нирок систолічний АТ повинен бути знижений < 140 мм рт.ст., а при очевидній наявності протеїнурії можуть бути досягнуті значення < 130 мм рт.ст. за умови, що зміни рШКФ будуть моніторуватися.
У пацієнтів із термінальною стадією ниркової недостатності, які знаходяться на діалізі, нещодавній метааналіз виявив зниження частоти серцево-судинних подій, серцево-судинної смерті та загальної смертності при зниженні систолічного/діастолічного АТ [533]; проте жодної інформації щодо абсолютних досягнутих значень АТ подано не було, а зменшення показників смертності помічене лише в пацієнтів із серцевою недостатністю. Таким чином, немає можливості подати рекомендації з точними цільовими значеннями АТ.
Зменшення протеїнурії (як мікроальбумінурії, так і явної протеїнурії) широко розглядається як терапевтична мета, оскільки за результатами аналізів даних РКД було повідомлено, що зміни екскреції білка із сечею є предикторами ниркових та серцево-судинних подій [534–536]. Ще раз повторимо, що упевнених доказів із досліджень, у яких порівнювалися серцево-судинні або ниркові події у групах, рандомізованих до більш або менш агресивного зменшення протеїнурії, недостатньо. Кілька РКД чітко продемонстрували, що блокування РАС є більш ефективним у зниженні альбумінурії, ніж плацебо або інші антигіпертензивні засоби, при діабетичній нефропатії, недіабетичній нефропатії та в пацієнтів із ССЗ [513, 537], а також є ефективним в запобіганні випадкам мікроальбумінурії [329, 538]. Жодне дослідження не мало достатньої статистичної потужності для оцінки ефекту на серцево–судинні події.
Досягнення цільового АТ зазвичай потребує комбінованої терапії, і блокатори РАС слід поєднувати з іншими анти–гіпертензивними препаратами. –Після проведення субаналізу дослідження ACCOMPLISH [539] було повідомлено, що комбінація інгібітору АПФ з антагоністом кальцію є більш ефективною, ніж із тіазидним діуретиком, у запобіганні розвитку подвоєння рівня сироваткового креатиніну й термінальної стадії ниркової недостатності, хоча й була менш ефективною в запобіганні протеїнурії. Як зазначено в розд. 6.6, поєднання двох блокаторів РАС хоча потенційно і є більш ефективним у зниженні протеїнурії, проте в цілому не рекомендується [434, 463]. Антагоністи мінералокортикоїдних рецепторів не можуть бути рекомендовані при ХХН, особливо в поєднанні з блокатором РАС, через ризик надмірного зниження функції нирок і гіперкаліємії [540]. Тіазиди слід замінити петльовими діуретиками, якщо рівень креатиніну сироватки 1,5 мг/дл або рШКФ становить < 30 мл/хв/1,73 м2.
6.9.1. Підсумок рекомендацій щодо терапевтичних стратегій у пацієнтів з артеріальною гіпертензією та нефропатією
6.9.2. Хронічна хвороба нирок, стадія 5D
Артеріальна гіпертензія є поширеною знахідкою в пацієнтів, які перебувають на гемодіалізі, і має великий вплив на виживання. Детальні поради про те, як керувати високим АТ у пацієнтів, які перебувають на гемодіалізі, подані в рекомендаціях, випущених нефрологічними науковими товариствами, а тому лише декілька загальних міркувань будуть викладені в даних рекомендаціях. Перше: точне вимірювання АТ має важливе значення для ведення пацієнтів, які перебувають на гемодіалізі. Тим не менше показання АТ безпосередньо перед гемодіалізом можуть не відповідати середньому АТ, який насправді є в пацієнта. Таким чином, питання про те, як і де необхідно проводити вимірювання АТ, має особливе значення з чіткими доказами переваги самостійного вимірювання АТ у домашніх умовах порівняно з вимірюванням АТ перед гемодіалізом. Друге: рівень, до якого слід знижувати АТ при лікуванні, у хворих, які перебувають на гемодіалізі, точно не встановлений. Додатковими труднощами також є те, що значні зміни в балансі натрію й води призводять до значної варіабельності АТ, а також те, що ступінь зниження АТ може залежати від наявності ускладнень, таких як кардіоміопатія, а не від контролю АТ під впливом препаратів.
Третє: всі антигіпертензивні препарати за винятком діуретиків можуть бути використані в пацієнтів, які перебувають на гемодіалізі, при цьому дози визначаються гемодинамічною нестабільністю й діалізною здатністю препарату. Препаратів, що заважають регулюванню параметрів гомеостазу при дефіциті рідини (які вже серйозно ослаблені при нирковій недостатності), слід уникати для мінімізації –гіпотензії під час швидкого та інтенсивного зменшення об’єму крові, пов’язаного з процедурою діалізу.
РКД за участю пацієнтів, які пере–бувають на гемодіалізі, нечисленні та в подальшому потребують заохочення щодо їх проведення. Довший або більш частий діаліз може вирішити гемодинамічні проблеми, пов’язані з обмеженням споживання солі та короткою тривалістю діалізу [541].
6.14. Резистентна артеріальна гіпертензія
Артеріальна гіпертензія визначається як резистентна до лікування, коли терапевтичні стратегії, які включають відповідні заходи з модифікації способу життя в комбінації з лікуванням діуретиком та двома іншими антигіпертензивними препаратами, що відносяться до різних класів, в адекватних дозах (але у схемі не обов’язково має бути антагоніст мінералокортикоїдних рецепторів), не забезпечують зниження САТ і ДАТ менше ніж 140 мм рт.ст. і 90 мм рт.ст. відповідно. Залежно від дослідженої популяції та застосованих медичних критеріїв, за даними різних публікацій, поширеність резистентної артеріальної гіпертензії знаходиться в межах від 5 до 30 % від загальної популяції з артеріальною гіпертензією, а показники на рівні менше ніж 10 %, ймовірно, представляють реальну поширеність резистентної артеріальної гіпертензії [597, 598]. Резистентна артеріальна гіпертензія пов’язана з високим ризиком серцево–судинних подій та ниркових ускладнень [599, 600].
Резистентна артеріальна гіпертензія може бути реальною або ж тільки здаватися такою чи бути помилковою. Частою причиною помилкового діагнозу резистентної артеріальної гіпертензії є низька прихильність до лікування, яка, як відомо, є звичайним явищем, що відповідає за низький рівень контролю АТ у популяції хворих на артеріальну гіпертензію в усьому світі. Відсутність контролю АТ, однак, може також залежати:
1) від збереження тривожної реакції пацієнта на процедуру вимірювання АТ, що веде до підвищених значень офісного АТ (при цьому підвищення рівня АТ не спостерігається при позаофісному вимірюванні);
2) використання манжети замалого розміру на великому плечі, що веде до недостатнього стиснення артерії;
3) псевдогіпертензії, що спостеріга–ється при значній жорсткості артерій (частіше зустрічається в осіб похилого віку, особливо з сильно кальцинованими артеріями), яка запобігає оклюзії плечової артерії (при вимірюванні. — Прим. наук. ред.).
Істинна резистентна артеріальна гіпертензія може виникати внаслідок:
1) чинників, пов’язаних із способом життя, таких як ожиріння або значне збільшення маси тіла, надмірне споживання алкоголю (навіть у вигляді запійного пияцтва) та надмірне споживання солі, що може протистояти антигіпертензивному ефекту препаратів через системну вазоконстрикцію, затримку натрію і води, а при ожирінні — симпатостимулюючому ефекту інсулінорезистентності та підвищеному рівню інсуліну;
2) тривалого споживання вазопресорів або натрій–затримуючих речовин;
3) обструктивного апное під час сну (зазвичай, але не завжди пов’язане з ожирінням) [521], імовірно, через те, що нічна гіпоксія, стимуляція хеморецепторів та порушення сну можуть проявлятися тривалим вазоконстрикторним ефектом;
4) невиявлених вторинних форм артеріальної гіпертензії;
5) значних та необоротних уражень органів–мішеней, зокрема у випадках, коли є порушення функції нирок, помітне збільшення співвідношення «стінка — просвіт артеріол» або зменшення еластичності великих артерій.
Коректний діагностичний підхід до резистентної артеріальної гіпертензії вимагає в рамках анамнезу пацієнта збору детальної інформації (у тому числі щодо способу життя), проведення ретельного фізикального обстеження та лабораторних досліджень для виявлення супутніх факторів ризику, ураження органів–мішеней, порушень метаболізму глюкози, а також значної дисфункції нирок, яка протистоїть через затримку натрію ефекту зниження АТ антигіпертензивними препаратами. Завжди слід розглядати можливість вторинної артеріальної гіпертензії: первинний гіперальдостеронізм може зустрічатися частіше, ніж вважалося раніше [601], а також було продемонстровано, що стеноз ниркових артерій атеросклеротичної природи є досить поширеним у літніх людей. Нарешті, слід регулярно проводити добове моніторування АТ, і не тільки для того, щоб виключити псевдорезистентність гіпертензії, але і з метою кращої кількісної оцінки ступеня підвищення АТ і в подальшому — ефекту модифікацій лікування [598, 602].
У клінічній практиці виявлення низької прихильності до лікування може становити особливі труднощі, оскільки:
1) інформація, надана пацієнтом, може бути неправдивою;
2) методи для об’єктивної оцінки прихильності до лікування мало пристосовані для рутинного використання в медичній практиці.
Нездоровий спосіб життя може бути причиною так само, як і негативне ставлення пацієнта до ліків у цілому. Зрештою, лікарям, можливо, доведеться розглядати варіант припинення прийому усіх ліків і початку терапії заново з простої схеми під ретельним медичним наглядом. Цей підхід також дозволяє уникати марного використання неефективних препаратів. Хоча госпіталізація при артеріальній гіпертензії вважається недоречною, у більшості європейських країн кілька днів стаціонарного лікування можуть виявитися необхідними для того, щоб перевірити ефект антигіпертензивних препаратів під суворим контролем.
Хоча при резистентній артеріальній гіпертензії може спостерігатися зниження АТ лише при збільшенні дози діуретика (див. нижче), більшість пацієнтів із цим станом потребують терапії більше ніж трьома препаратами. Аналізи підгруп із великомасштабних клінічних та обсерваційних досліджень продемонстрували, що всі класи препаратів із механізмами дії, що частково або повністю відрізняються від уже призначеної трикомпонентної терапії, здатні знижувати АТ принаймні в індивідуальних випадках резистентної артеріальної гіпертензії [603]. Про добру відповідь було повідомлено при використанні антагоністів мінералокортикоїдних рецепторів, тобто спіронолактону навіть у низьких дозах (25–50 мг/день), еплеренону, альфа–1–блокатора доксазозину при подальшому збільшенні дози діуретика [604–608], заміні тіазидів або хлорталідону петльовим діуретиком при значному зниженні ниркової функції. Враховуючи, що при рефрактерній артеріальній гіпертензії може підвищуватися об’єм (циркулюючої. — Прим. наук. ред.) крові [609], амілорид може посилювати ефект уже призначеного тіазиду або тіазидного діуретика, хоча його застосування може сприяти гіперкаліємії й не показане пацієнтам із вираженим зниженням рШКФ. Відповідь АТ на терапію спіронолактоном або еплереноном може бути обумовлена підвищеним рівнем альдостерону, який часто супроводжує резистентну артеріальну гіпертензію, через феномен «утікання» секреції альдостерону після періоду її зниження на фоні блокади РАС [610] або через недіагностований первинний альдостеронізм.
Згідно з неоднозначними попередніми даними [611], при резистентній артеріальній гіпертензії антагоністи ендотеліну не довели свою ефективність у зниженні офісного АТ, а їх використання також було пов’язане зі значною частотою побічних ефектів [612]. Усі нові антигіпертензивні препарати (донори оксиду азоту, антагоністи вазопресину, інгібітори нейтральної ендопептидази, інгібітори альдостеронсинтази тощо) знаходяться на ранніх етапах дослідження [613]. На сьогодні інших новаторських підходів до медикаментозного лікування пацієнтів із резистентною артеріальною гіпертензією немає.
6.14.2. Денервація нирок
Зростає популярність немедикаментозного терапевтичного підходу до лікування резистентної артеріальної гіпертензії у вигляді двосторонньої деструкції ниркових нервів, що супроводжують ниркову артерію, методом радіочастотної абляції із використанням катетерів різного дизайну, які вводяться шляхом пункції через стегнову артерію [616–621]. Обґрунтування процедури ниркової денервації пояснюється важливістю симпатичних впливів на опір ниркових судин, вивільнення реніну й реабсорбцію натрію, підвищення тонусу симпатичної нервової системи нирок та інших органів, які спостерігаються у хворих на артеріальну гіпертензію [622–624], а також пресорним ефектом аферентних волокон нирок, продемонстрованим в експериментальних тварин [625, 626]. Як було показано, процедура викликала значне зниження офісного АТ, яке, як встановлено, зберігалося протягом одного року, а в невеликої кількості пацієнтів — упродовж двох–трьох років із моменту проведення процедури денервації. Менш вражаючі дані було отримано в нечисленних дослідженнях за допомогою амбулаторного й домашнього АТ за необхідності прийому антигіпертензивних препаратів [627]. У той же час були отримані деякі докази додаткової переваги процедури, такі як зниження артеріальної жорсткості, регрес ГЛШ та діастолічної дисфункції, ренопротекція та поліпшення толерантності до глюкози [628–630]. За винятком нечисленних проблем, пов’язаних із процедурою катетеризації (локальні гематоми, розсічення судин тощо), інформації щодо жодних серйозних ускладнень або погіршення функції нирок не надходило.
На поточний момент метод ниркової денервації є перспективним, але потребує додаткових даних, отриманих у належним чином спроектованих довгострокових порівняльних дослідженнях, що дозволять точно з’ясувати його безпечність та довготривалу ефективність порівняно з можливим найкращим медикаментозним лікуванням. Розуміння того, що робить ниркову денервацію ефективною чи неефективною (особливості пацієнта або невдача в проведенні симпатектомії), також буде важливим для уникнення процедури в осіб із малою ймовірністю відповіді на процедуру. Більш детальну інформацію шукайте в позиційному документі ESH стосовно ниркової денервації [631].
6.18. Вазоренальна артеріальна гіпертензія
Стеноз ниркових судин, вторинний до атеросклерозу, спостерігається відносно часто, особливо в літніх людей, але рідко прогресує до артеріальної гіпертензії або ниркової недостатності [640]. Як і раніше, питання про те, чи отримують пацієнти зі стенозом ниркової артерії або нирковою недостатністю користь від втручань, переважно через шкірне стентування ниркових артерій, залишається суперечливим. Хоча є переконливі (однак із неконт–рольованих досліджень) доказові дані на користь даної процедури в молодих осіб (переважно жінок) із неконтрольованою артеріальною гіпертензією на фоні фібромускулярної гіперплазії (успішність 82–100 %, рестеноз — у 10–11 %) [641] (клас IIa, рівень B), тоді як при атеросклеротичній реноваскулярній артеріальній гіпертензії питання є досить спірним. У двох ретроспективних дослідженнях [642] було показано клінічне покращення (хоча й не показників смертності) в пацієнтів із двостороннім стенозом ниркових артерій, ускладненим рецидивуючими епізодами гострої серцевої недостатності. У всіх інших випадках стенозу ниркової артерії питання щодо ефективності ангіопластики й стентування залишаються спірними, незважаючи на дані кількох контрольованих досліджень. Два РКД і 21 когортне дослідження, дані яких були опубліковані до 2007 року, продемонстрували гетерогенний характер отриманих переваг. У більш новому дослідженні ASTRAL, у яке були включені 806 пацієнтів, які були рандомізовані в групи ангіопластики й стентування + медикаментозна терапія порівняно з медикаментозною монотерапією, жодних доказів клінічно значимого впливу на рівень АТ, функцію нирок або частоту серцево–судинних подій не було отримано [643]. Незважаючи на те що остаточні висновки не можуть бути зроблені на основі даних дослідження ASTRAL через деякі обмеження його дизайну (пацієнти зі строгим показанням щодо втручання були виключені з рандомізації) та відсутність статистичної потужності, на сьогодні втручання в пацієнтів з атеросклеротичним стенозом ниркової артерії не рекомендується, якщо функція нирок залишається стабільною протягом останніх 6–12 місяців, а артеріальну гіпертензію вдається контролювати за допомогою прийнятного терапевтичного режиму (клас III, рівень B). Придатні схеми лікування можуть включати блокатори РАС, за винятком випадків двостороннього стенозу ниркових артерій або одностороннього стенозу артерії з ознаками функціональної значимості при ультразвуковому дослідженні або сцинтиграфії.
6.19. Первинний гіпер–альдостеронізм
При доведеному односторонньому первинному гіперальдостеронізмі, обумов–леному або альдостерон–продукуючою аденомою, або односторонньою гіперплазією надниркової залози, методом вибору є одностороння лапароскопічна адреналектомія, тоді як терапія антагоністами мінералокортикоїдних рецепторів показана пацієнтам із двостороннім ураженням надниркових залоз (ідіопатична гіперплазія надниркових залоз та двостороння аденома). Гіперальдостеронізм, що піддається терапії глюкокортикоїдами, лікують низькими дозами глюкокортикоїдів пролонгованої дії, наприклад дексаметазоном.
Хірургічне лікування у хворих з одностороннім первинним гіперальдостеронізмом демонструє покращення показників вмісту калію в сироватці крові майже у 100 % пацієнтів після операції [644], коли діагноз та показання до адреналектомії базуються на відборі проб венозної крові надниркових залоз. Артеріальна гіпертензія виліковується (визначається як АТ < 140/90 мм рт.ст. без антигіпертензивних препаратів) приблизно в 50 % (35–60 %) пацієнтів із первинним гіперальдостеронізмом після односторонньої адреналектомії. Одужання більш імовірне в пацієнтів, які мають не більше одного родича першого ступеня з артеріальною гіпертензією, приймають у передопераційному періоді максимум два анти–гіпертензивні препарати, молодшого віку, мають меншу тривалість артеріальної гіпертензії й у яких відсутні ознаки ремоделювання судин [645, 646].
Антагоністи мінералокортикоїдних рецепторів (спіронолактон, еплеренон) показані пацієнтам із двостороннім захворюванням надниркових залоз, а також тим, кому за різними причинами не проводиться оперативне втручання з приводу первинного одностороннього гіперальдостеронізму. Початкова доза для спіронолактону має бути 12,5–25 мг на добу одноразово. Слід встановити найменшу ефективну дозу, дуже поступово титруючи її до 100 мг на день або більше. Захворюваність на гінекомастію при прийомі спіронолактону залежить від дози, у той час як точна частота порушення менструального циклу в жінок у пременопаузі під час терапії спіронолактоном невідома. Щоб уникнути прийому високих доз спіронолактону, може бути додана невелика доза тіазидного діуретика, тріамтерену або амілориду, що, однак, може викликати побічні ефекти.
Еплеренон є більш новим селективним антагоністом мінералокортикоїдних рецепторів без антиандрогенного ефекту та ефекту агоніста прогестерону, він знижує частоту побічних ефектів; препарат має 60% антагоністичну активність спіронолактону, але через його менш тривалу дію потрібне щоденне кількаразове дозування (починаючи з дози 25 мг двічі на день). У сучасному 16–тижневому подвійному сліпому рандомізованому порівняльному дослідженні антигіпертензивного ефекту еплеренону (100–300 мг один раз на день) і спіронолактону (75–225 мг один раз на день) останній значно перевершував еплеренон у зниженні АТ при первинному гіперальдостеронізмі [647].
7. Лікування супутніх факторів ризику
7.1. Гіполіпідемічні засоби
У пацієнтів з артеріальною гіпертензією й цукровим діабетом 2–го типу або метаболічним синдромом часто спостерігається атерогенна дисліпідемія, що характеризується підвищеним умістом тригліцеридів і холестерину ЛПНЩ та низькими значеннями холестерину ЛПВЩ [12, 13, 648]. Переваги додавання статинів до антигіпертензивної терапії були добре встановлені в дослідженні ASCOT–LLA [649], результати якого узагальнені в рекомендаціях ESH/ESC 2007 року [2]. Відсутність достовірної статистичної переваги в дослідженні ALLHAT [650] може бути пов’язана з недостатнім зниженням загального холестерину (11 % в ALLHAT порівняно з 20 % в ASCOT). Подальші аналізи даних ASCOT продемонстрували, що додавання статинів до антигіпертензивної терапії на основі амлодипіну може зменшити частоту первинної серцево–судинної події навіть більш помітно, ніж додавання статинів до терапії на основі атенололу [651]. Позитивний ефект використання статинів у пацієнтів без попередніх серцево–судинних подій (цільовий рівень холестерину ліпопротеїнів низької щільності < 3,0 ммоль/л (115 мг/дл)) був підтверджений результатами дослідження JUPITER [652], які продемонстрували, що зниження холестерину ліпопротеїнів низької щільності на 50 % в пацієнтів із початковими значеннями < 3,4 ммоль/л (130 мг/дл), але з підвищеним рівнем С–реактивного білка зменшувало частоту серцево–судинних подій на 44 %. Даний факт доводить доцільність використання статинів у хворих на артеріальну гіпертензію, які мають високий серцево–судинний ризик.
Як указано в недавніх рекомендаціях ESC/EAS [653], при наявності очевидної ІХС існують чіткі докази того, що статини слід призначати до досягнення значень холестерину ліпопротеїнів низької щільності < 1,8 ммоль/л (70 мг/дл) [654]. Позитивний ефект терапії статинами також був продемонстрований у пацієнтів із перенесеним інсультом, із цільовим рівнем холестерину ліпопротеїнів низької щільності звичайно нижче від 3,5 ммоль/л (135 мг/дл) [583]. Питання відносно того, чи такі пацієнти також отримають переваги при цільовому значенні < 1,8 ммоль/л (70 мг/дл), відкрите для майбутніх досліджень. Це також стосується і хворих на артеріальну гіпертензію з низьким та помірним серцево–судинним ризиком, у яких доказові дані щодо позитивного впливу статинів нечіткі [656].
7.2. Антиагрегантна терапія
Щодо вторинної серцево–судинної профілактики, дані великого метааналізу, опублікованого у 2009 році [657], показали, що терапія аспірином приводила до абсолютного зниження частоти серцево–судинних подій значно більше порівняно з абсолютним збільшенням ризику значних кровотеч. Для первинної профілактики, однак, співвідношення між користю та шкодою було іншим: абсолютне зниження частоти серцево–судинних подій незначне й лише трохи переважало абсолютне збільшення частоти значних кровотеч. Більш сприятливий баланс між користю та шкодою від терапії аспірином у первинній профілактиці вивчався в спеціальних групах пацієнтів. У дослідженнях при цукровому діабеті досі не вдалося встановити співвідношення між користю та шкодою, у той час як у субдослідженні випробування HOT, у якому хворих на артеріальну гіпертензію розділяли на основі рівня рШКФ на момент рандомізації, було продемонстровано, що призначення аспірину асоціювалося з достовірною тенденцією до прогресивного зниження частоти основних серцево–судинних подій і смерті при низькому початковому рівні рШКФ. Дане зменшення було особливо помітним у хворих на артеріальну гіпертензію з величиною рШКФ < 45 мл/хв/1,73 м2. У цій групі хворих ризик кровотеч був помірним порівняно з корисним впливом на серцево–судинні події [658]. Аспірин слід призначати тільки за умови прийнятного контролю АТ.
Отже, рекомендації ESH/ESC 2007 року [2] можуть бути підтверджені: антиагрегантну терапію, зокрема низькі дози аспірину, слід призначати пацієнтам з артеріальною гіпертензією за умови конт–рольованого АТ із попередніми серцево–судинними подіями та розглядати у хворих на артеріальну гіпертензію зі зниженою функцією нирок або високим серцево–судинним ризиком. Аспірин не рекомендується використовувати в пацієнтів з артеріальною гіпертензією з низьким та помірним ризиком, у яких абсолютна користь та шкода є еквівалентними. Варто відзначити, що недавній метааналіз продемонстрував більш низьку захворюваність на злоякісні новоутворення й смертність у групі аспірину (але не варфарину) в дослідженнях із первинної профілактики [659]. Якщо дана інформація підтвердиться, ця додаткова дія аспірину може призвести до більш ліберального перегляду його застосування. Дані щодо низьких доз аспірину в профілактиці прееклампсії подані в розділі 6.5.3.
7.3. Лікування гіперглікемії
Лікування гіперглікемії з метою профілактики серцево–судинних ускладнень у хворих на цукровий діабет вивчалося в ряді досліджень. Для пацієнтів із цукровим діабетом 1–го типу дослідження DCCT переконливо продемонструвало, що інтенсивна інсулінотерапія мала переваги в протекції судин і зниженні частоти подій порівняно зі стандартним лікуванням [660, 661]. У декількох великомасштабних дослідженнях цукрового діабету 2–го типу вивчення було спрямоване на виявлення того, чи здатен жорсткий глікемічний контроль, що базується на пероральних препаратах та/або інсуліні, мати переваги для профілактики серцево–судинних ускладнень перед менш жорстким контролем. У дослідженні UKPDS жорсткий глікемічний контроль дозволяв запобігти мікросудинним, але не макросудинним ускладненням [662], за винятком підгрупи з ожирінням та терапією метформіном [663]. Прийнятні цільові значення для глікемічного контролю вивчалися останнім часом у дослідженнях ADVANCE, ACCORD [664, 665] та VADT [666], у яких одна з груп рандомізувалася до дуже низьких цільових значень HbA1c (< 6,5 або 6,0 %). Жодне дослідження не продемонструвало значного зниження композитної кінцевої точки, яка складалась із комбінованих серцево–судинних подій, але в ряді пізніших метааналізів було підтверджено, що більш інтенсивний контроль глікемії дозволяє скоротити частоту нефатальних коронарних подій та інфаркту міокарда, а також нефропатії, але не інсульту, загальної або серцево–судинної смертності [667–669]. Однак особливо в дослідженні ACCORD у групі нижчого цільового значення HbA1c спостерігалася підвищена кількість епізодів гіпоглікемії та загальної смертності. Виходячи з цих даних, Американською асоціацією діабетології, EASD [670] та ESC спільно була прийнята раціональна позиція, згідно з якою рекомендується визначати цільові значення терапії в індивідуальному порядку та уникати надлишкового лікування пацієнтів у незадовільному стані з підвищеним ризиком, дотримуючись більш суворого контролю гіперглікемії в більш молодих пацієнтів із цукровим діабетом, що розвинувся раніше, відсутністю або незначними судинними ускладненнями та тривалим очікуваним терміном життя (цільове значення HbA1c < 7,0 %), у той же час для пацієнтів у незадовільному стані та з ускладненнями розглядаються менші значення HbA1c 7,5–8,0 % або навіть вище, особливо в літніх пацієнтів із когнітивними порушеннями й обмеженими можливостями для самообслуговування [670, 671]. Щодо лікування цукрового діабету більш детальна інформація подана в рекомендаціях ESC/EASD [672].
8.4. Продовження пошуку безсимптомного ураження органів–мішеней
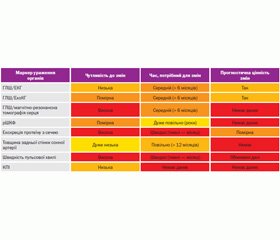
Аналіз економічної ефективності того, які саме ознаки уражень органів–мішеней слід оцінювати протягом спостереження пацієнтів з артеріальною гіпертензією, ніколи не проводився. Кількісна оцінка екскреції білка з сечею може бути надійно проведена в ранковій порції сечі й має низьку вартість, широку доступність та можливість продемонструвати викликаний лікуванням ефект протягом декількох місяців. Крім того, низька вартість і широка доступність дозволяють рекомендувати регулярний моніторинг ЕКГ, хоча виявлення змін ГЛШ є менш чутливим. Індуковані лікуванням зміни при вимірюванні ММЛШ за допомогою ехокардіографії також повільні, а сам метод має недоліки через недостатню доступність, високу вартість, необхідність додаткового часу і детальної експертизи даних для належної оцінки. Інформація щодо оцінки ураження органів під впливом антигіпертензивної терапії подана на рис. 5. Крім того, спостереження хворих має передбачати визначення ліпідного профілю, глюкози крові, креатиніну й калію в сироватці крові; незалежно від більшої або меншої здатності показників дозволяти точно та швидко виявити регрес, обумовлений лікуванням, усі заходи щодо оцінки ураження органів–мішеней можуть дати корисну інформацію щодо прогресування патологічних змін, пов’язаних з артеріальною гіпертензією, а також появи клінічних ситуацій, що потребують додаткових терапевтичних втручань, таких як аритмія, ішемія міокарда, стенозуючі бляшки й серцева недостатність.
10.1. Командний підхід у лікуванні захворювання
Існує широкий спектр варіацій організацій системи охорони здоров’я по всій Європі, але в більшості країн артеріальну гіпертензію зазвичай діагностують та лікують на рівні первинної ланки (наприклад, лікарі загальної практики). У деяких країнах більш складними обстеженнями (ультразвукова діагностика тощо) та більш складними для лікування випадками займаються практикуючі фахівці (з артеріальної гіпертензії. — Прим. наук. ред.), у той час як в інших країнах — тільки фахівці, які працюють у госпіталях (стаціонарах. — Прим. наук. ред.) та відділеннях артеріальної гіпертензії. У деяких країнах спеціально навчені медичні сестри допомагають лікарям у призначенні лікування, консультаціях, направленнях і навіть госпіталізації осіб із підвищеним АТ. У більшості країн, однак, медсестри мало впливають на процес прийняття рішень щодо ведення пацієнта або ж зовсім не відіграють жодної ролі.
Є дані кількох досліджень, які демонструють, що командний підхід у лікуванні дозволяє зменшити АТ на декілька мм рт.ст. більше, ніж звичайний підхід [724], зі значно частішим зниженням САТ більше як на 10 мм рт.ст. (медіана) та більшою частотою конт–ролю АТ — приблизно на 22 %, за даними метааналізу результатів 37 порівняльних досліджень груп, які отримували лікування на основі командного або традиційного підходів [725]. На відміну від звичайного підходу командний підхід був визнаний ефективним, якщо він передбачав залучення у процес медсестер і/або фармацевтів як у лікувальному закладі, так і в суспільстві [724]. Сприятливий ефект участі фармацевтів і медсестер у лікуванні артеріальної гіпертензії досягався при виконанні ними завдань із навчання пацієнта, консультацій щодо способу життя та медичних консультацій, оцінці прихильності до лікування та (для фармацевтів) взаємодії з лікарями в галузі заснованої на рекомендаціях терапії [724, 726, 727]. В огляді 33 РКД, опублікованих у період між 2005 і 2009 роками, цільові значення АТ частіше досягалися, коли взаємодія передбачала алгоритм покрокового лікування, що призначався медсестрою, а також залучення медсестер у процес моніторингу пацієнтів по телефону [726, 728, 729]. Очевидно, що стратегії, засновані на командному підході, пропонують важливий потенційний метод покращення антигіпертензивного лікування порівняно зі стратегіями за участю лише лікарів. Лікарі, медсестри та фармацевти — усі мають брати участь у командному підході до лікування пацієнта, а лікарі загальної практики мають взаємодіяти, коли це необхідно, із фахівцями з різних галузей, такими як терапевти, кардіологи, нефрологи, ендокринологи, дієтологи. Внесок медсестер може бути особливо важливим для реалізації змін способу життя, до яких довготривала прихильність, як відомо, вкрай низька. Докладніше про те, яким чином може бути організована робота в команді для лікування артеріальної гіпертензії, читайте в недавній публікації ESH Excellence Centers [730].
Скорочено з журналу «Артериальная
гипертензия», 2013, № 4(30)
за дозволом проф. Ю.М. Сіренка
Список літератури знаходиться в редакції

/15_m/15_m.jpg)
/16_m/16_m.jpg)
/16_m/16_m2.jpg)
/17_m/17_m2.jpg)
/17_m/17_m.jpg)
/18_m/18_m.jpg)
/19_m/19_m.jpg)
/20_m/20_m.jpg)
/20_m/20_m2.jpg)
/20_m/20_m3.jpg)
/21_m/21_m.jpg)
/23_m/23_m.jpg)