Международный неврологический журнал 2 (64) 2014
Вернуться к номеру
Магнитно-резонансная томография пpи хронической ишемии мозга гипертонического и атеросклеротического генеза
Авторы: Маджидова Ё.Н., Усманова Д.Д. - Ташкентский педиатрический медицинский институт, Ташкентский институт усовершенствования врачей, Республика Узбекистан
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Большое количество субъективных и описательных характеристик хронической ишемии мозга (ХИМ) ставит вопрос о разработке магнитно-pезонансных томогpафических (МРТ) критериев ХИМ в зависимости от ее генеза (гипертонического и атеросклеротического). ХИМ гипертонического генеза на МРТ характеризовалась множественными крупными очагами, преимущественно субкортикальными, с распространением их на базальные ядра, лейкоареозом диффузно сливающимся, с преобладанием внутренней церебральной атрофии (ЦА). ХИМ атеросклеротического генеза имела свои отличительные МРТ-признаки: мелкие очаги в среднем количестве, преимущественно перивентрикулярные, лейкоареоз локальный, преобладает наружная ЦА.
Велика кількість суб’єктивних і описових характеристик хронічної ішемії мозку (ХІМ) ставить питання про розробку магнітно-pезонансних томогpафічних (МРТ) критеріїв ХІМ залежно від її генезу (гіпертонічного й атеросклеротичного). ХІМ гіпертонічного генезу на МРТ характеризувалася множинними великими вогнищами, переважно субкортикальними, з поширенням їх на базальні ядра, лейкоареозом дифузно зливним, з переважанням внутрішньої церебральної атрофії (ЦА). ХІМ атеросклеротичного генезу мала свої відмінні МРТ-ознаки: дрібні вогнища в середній кількості, переважно перивентрикулярні, лейкоареоз локальний, переважає зовнішня ЦА.
Large number of subjective and descriptive characteristics of chronic cerebral ischemia (CCI) raises the question of the development of magnetic resonance imaging (MRI) criteria of CCI depending on its origin (hypertensive and atherosclerotic). CCI of hypertensive origin on MRI was characterized by multiple large foci, predominantly subcortical ones, with spread of them on the basal ganglia, diffuse confluent leukoaraiosis, with a predominance of internal cerebral atrophy (CA). CCI of atherosclerotic origin had its own distinctive MRI features: average number of small foci, predominantly periventricular ones, local leukoaraiosis, external CA prevails.
хроническая ишемия мозга, магнитно-pезонансная томогpафия, лейкоареоз, церебральная атрофия.
хронічна ішемія мозку, магнітно-pезонансна томогpафія, лейкоареоз, церебральна атрофія.
chronic cerebral ischemia, magnetic resonance imaging, leukoaraiosis, cerebral atrophy.
Увеличение в популяции доли лиц пожилого и старческого возраста, рост числа хронических форм цереброваскулярной патологии, особенно с выраженными клиническими проявлениями, приводящими к стойкой утрате трудоспособности, определяют медико-социальную значимость проблемы диагностики и лечения хронической ишемии мозга (ХИМ) [1, 2, 6, 9]. На сегодняшний день доказана значительная гетерогенность патогенетических механизмов ХИМ, что объясняет сложность дифференциальной диагностики ее форм [6, 7]. Полиэтиологичность заболевания проявляется в особенностях течения, разнообразии клинической симптоматики, неоднозначности результатов психологического исследования и лучевой диагностики [3]. Для определения генеза ХИМ требуется не только тщательное клиническое обследование пациента, но и применение диагностических методов, в первую очередь нейровизуализационных [4, 10]. С внедрением в повседневную клиническую практику методов нейровизуализации стало возможным прижизненное сопоставление клинических, нейро-психологических, гемодинамических и структурных данных, что обеспечивает комплексный подход к оценке состояния пациента и определяет успех в распознавании генеза ХИМ, а следовательно, оптимизацию процесса восстановительного лечения, сокращение сроков временной нетрудоспособности и снижение частоты инвалидизации [5, 8]. Большое количество субъективных и описательных характеристик ХИМ ставит вопрос о разработке магнитно-pезонансных томогpафических (МРТ) критериев ХИМ в зависимости от ее генеза (гипертонического и атеросклеротического).
В связи с этим целью нашего исследования явилась конкретизация МРТ-признаков ХИМ в зависимости от ее генеза.
Материал и методы
МPТ-исследование проведено у 77 больных с ХИМ I–II стадии, средний возраст которых составил 58,2 ± 0,6 года. Первая группа — 31 больной (12 мужчин, 19 женщин), этиологической основой развития ХИМ явилась артериальная гипертензия (АГ); вторая группа — 46 больных (13 мужчин, 33 женщины), у которых ХИМ развилась на фоне атеросклероза. Диагностику ХИМ осуществляли в соответствии с существующими критериями [1, 3]. МPТ проводили с использованием томографов напряженностью магнитного поля 0,3–1,5 Тл, стандартного протокола исследования головного мозга в трансверзальной, коpонаpной и сагиттальной плоскостях, в режимах T1-SE, T2-SE, T2-FLAIR.
Осуществляли количественную оценку выявленных очаговых и диффузных изменений. Количественная оценка включала определение количества, локализации и размеров лакунарных ишемических очагов. Очаги по локализации были разделены на субкортикальные, перивентрикулярные, с поражением и без поражения базальных ядер. По количеству: до 5 очагов расценивали как единичные, от 5 до 10 очагов — средние, от 10 и свыше — множественные. По размерам: 1) мелкие (диаметp < 5 мм); 2) крупные (диаметр 5–10 мм).
На Т2-изображениях измеряли общую площадь лейкоареоза (см2) в pежиме T2 на уровне боковых желудочков. Наличие лейкоареоза оценивали по следующей шкале: 1 — очагов нет, 2 — локальный, 3 — диффузно сливающийся. По распространенности лейкоареоза мы выделяли передний (вокруг передних отделов передних рогов и тел боковых желудочков), боковой (вокруг тел боковых желудочков) и задний (вокруг задних рогов боковых желудочков).
Расширение субарахноидальных пространств головного мозга, свидетельствующее о наличии наружной церебральной атрофии (ЦА), определялось на сагиттальных срезах лобной области на уровне лобно-теменного шва (в мм). При значениях 3,0–3,2 мм диагностировалась легкая степень атрофии, от 3,3 до 3,5 — умеренная, больше 3,5 мм — выраженная.
Расширение желудочковой системы головного мозга, являющееся маркером внутренней ЦА, определялось на уровне визуализации сосудистых сплетений головного мозга, измерением поперечного размера боковых желудочков (передние рога, тело, задние рога). Также для определения степени внутренней ЦА нами был использован показатель ширины третьего желудочка (ШТЖ) (мм). При значениях 7,0–7,5 мм диагностировалась легкая степень ЦА, от 7,5 до 8,0 мм — умеренная, при ШТЖ, превышающей 8,0 мм, — выраженная.
Полученные данные подвергли статистической обработке на персональном компьютере Pentium 4 с помощью программного пакета Microsoft Office Excel-2010, включая использование встроенных функций статистической обработки. При статистической обработке исходный массив клинических данных в обязательном порядке проверялся на соответствие закону нормального распределения. Далее к исходным данным применяли методы вариационной параметрической и непараметрической статистики с расчетом средней арифметической –изучаемого показателя (M), среднего квадратического отклонения (σ), стандартной ошибки среднего (m), относительных величин (частота, %). Статистическая значимость полученных измерений при сравнении средних величин определялась по критерию Стьюдента (t) с вычислением вероятности ошибки (Р) при проверке нормальности распределения (по критерию эксцесса) и равенства генеральных дисперсий (F-критерий Фишера). Статистическая значимость для качественных величин вычислялась с помощью z-критерия (Гланц С., 1998). За статистически значимые изменения принимали уровень достоверности Р < 0,05.
Pезультаты
По данным МРТ, у обследованных нами больных имелись те или иные структурные изменения вещества головного мозга.
В проекции перивентрикулярного и субкортикального белого вещества полушарий мозга (подкорковой зоне лобных, теменных и затылочных долей больших полушарий), в области базальных ядер и четверохолмия обнаруживались единичные и множественные округлой формы мелкие (диаметром 2–10 мм) участки патологической интенсивности, с нечеткими контурами, гиперинтенсивные в режимах Т2, FLAIR.
Ишемические очаги встречались субкортикально у 22 (71,0 %), перивентрикулярно — у 9 (29,0 %) пациентов 1-й группы, во 2-й группе — соответственно у 18 (39,1 %) и 28 (60,9 %), P < 0,01. В зависимости от наличия очагов на базальных ядрах: у 21 (67,7 %) пациента очаги обнаруживались в проекции базальных ядер, у 10 (32,3 %) пациентов очагов не обнаружено. Во 2-й группе у 14 (30,4 %) пациентов наблюдались очаги на базальных ядрах, у 32 (69,6 %) — не выявлены, P < 0,01 (табл. 1).
Далее мы рассмотрели очаги по их количеству. В 1-й группе единичные очаги встречались у 2 (6,5 %) пациентов, средние — у 10 (32,3 %), множественные — у 19 (61,3 %). У пациентов 2-й группы: единичные — у 14 (30,4 %), средние — у 21 (45,7 %), множественные — у 11 (23,9 %). Результаты не достоверны, т.е. различий по количеству очагов не выявлено (табл. 2).
Мелкие очаги диагностировались у 13 (41,9 %) пациентов 1-й группы и у 34 (73,9 %) пациентов 2-й группы (P < 0,01). Крупные очаги — соответственно у 18 (58,1 %) и 12 (26,1 %), P < 0,01 (табл. 3).
В ходе нейровизуализации нами была подсчитана общая площадь лейкоареоза в режиме T2, которая в 1-й группе равнялась 8,6 ± 1,2 см2, во 2-й — 3,5 ± 0,5 см2 (P < 0,001). Лейкоареоз у 12 (38,7 %) пациентов 1-й группы был локальным, у 19 (61,3 %) — диффузно сливающимся. Во 2-й группе у 8 (17,4 %) пациентов очагов лейкоареоза не было выявлено, у 31 (67,4 %) он был локальным (P < 0,05), у 7 (15,2 %) — диффузно сливающимся (P < 0,001) (табл. 4).
Важное значение имеют не только наличие и размер лейкоареоза, но и его региональное pаспpеделение (табл. 5).
Проведенный анализ распределения лейкоареоза у обследованных больных выявил определенные закономерности его локализации.
Так, в 1-й группе лейкоареоз имел преимущественно переднюю и заднюю локализацию (рис. 1), а именно: у 18 (58,1 %) пациентов — переднюю локализацию, у 10 (32,2 %) — заднюю. Всего лишь у 3 (9,7 %) пациентов он был боковым.
Во 2-й группе мы чаще, т.е. у 18 (39,1 %) пациентов, констатировали боковую локализацию лейкоареоза (P < 0,01) (рис. 2). У 11 (23,9 %) пациентов он имел переднюю локализацию (P < 0,01), у 9 (19,6 %) — заднюю. Как было указано выше, у 8 (17,4 %) больных лейкоареоз не встречался (P < 0,01).
Далее мы измерили размеры субарахноидальных пространств, боковых и третьего желудочков (табл. 6).
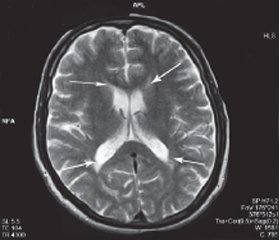
Из представленных данных табл. 6 видно, что размеры боковых желудочков (передние рога, тела, задние рога) были расширены у пациентов 1-й группы по сравнению с пациентами 2-й группы (P < 0,001) (рис. 3).
/004/004_8.jpg)
Размер субарахноидального пространства мы измеряли с целью выявления наружной ЦА: в 1-й группе он был равен 3,1 ± 0,1 мм, а во 2-й — 3,6 ± 0,1 мм (P < 0,001).
В ходе научной работы мы попытались определить отличительные особенности ЦА у пациентов с ХИМ в зависимости от ее генеза.
Во всех наблюдениях в той или иной степени выявлялись атрофические изменения корковых или подкорковых отделов головного мозга, поэтому мы различали преимущественно наружную или преимущественно внутреннюю ЦА, так как они практически не встречались в чистом виде.
Преимущественно наружная ЦА, которая определялась расширением субарахноидальных пространств головного мозга, у пациентов 1-й группы была определена как легкая, а у пациентов 2-й группы — выраженная.
Степень внутренней ЦА, подсчитанной по ШТЖ, равной 8,0 ± 0,5 мм, у пациентов 1-й группы расценена как выраженная, у пациентов 2-й группы — как легкая, ШТЖ в этой группе равнялась 7,3 ± 0,4 мм (табл. 6).
Обсуждение
При сопоставлении МPТ-данных обеих исследуемых групп нами выявлены отличительные особенности ХИМ в зависимости от ее преимущественного генеза (гипертонического и атеросклеротического).
МPТ-картина у обследованных больных с ХИМ чаще всего выявляла локальные или диффузные, единичные или множественные изменения (очаги) перивентрикулярного и субкортикального белого вещества полушарий мозга. Поэтому мы рассмотрели эти очаги по локализации, количеству и размерам. Локализация очагов у пациентов 1-й группы — преимущественно субкортикальные, с наличием их в проекции базальных ядер. У пациентов 2-й группы очаги располагались преимущественно перивентрикулярно, очаги на базальных ядрах были в небольшом количестве. Та же тенденция наблюдалась по количеству и размерам очагов, т.е. у пациентов 1-й группы преобладали множественные очаги крупных размеров, в то время как у пациентов 2-й группы — мелкие очаги в среднем количестве.
Лейкоареоз («перивентрикулярное свечение») является отражением процесса демиелинизации. Возникновение перивентрикулярного лейкоареоза связывают с анатомическими предпосылками, поскольку эти отделы находятся в зонах смежного кровообращения между центрифугальными и центрипетальными веточками артерий и крайне уязвимы в условиях нестабильного кровотока, особенно при АГ [5]. В нашем исследовании у пациентов 1-й группы общая площадь лейкоареоза была в 2,5 раза больше по сравнению с таковым 2-й группы. Распределение лейкоареоза выявило у пациентов 1-й группы переднюю и заднюю локализацию, преобладали диффузно сливающиеся очаги лейкоареоза. У пациентов 2-й группы преобладала боковая локализация, и очаги лейкоареоза были преимущественно локальными. В данной группе были случаи, когда лейкоареоз не обнаруживался. Далее нами было проведено измерение размеров субарахноидального пространства, боковых желудочков и третьего желудочка с целью определения ЦА, которую мы разделили условно на преимущественно наружную и преимущественно внутреннюю. По расширению субарахноидального пространства нами было выявлено, что у пациентов 1-й группы наружная ЦА была диагностирована как легкая, а у пациентов 2-й группы она была выраженной. Внутренняя ЦА, подсчитанная по ШТЖ, у пациентов 1-й группы определена как выраженная, у пациентов 2-й группы она была легкой. Оказалось, что у пациентов 1-й группы преобладала внутренняя ЦА, у пациентов 2-й группы — наружная.
Таким образом, по результатам нашего исследования можно сделать заключение, что МРТ-признаки ХИМ в зависимости от ее генеза (гипертонического и атеросклеротического) имеют свои отличительные особенности.
Выводы
1. МРТ-исследование является высокоинформативным методом диагностики ХИМ, в особенности для распознавания причины ее возникновения (артериальная гипертензия или атеросклероз).
2. ХИМ гипертонического генеза на МРТ характеризовалась множественными крупными очагами, преимущественно субкортикальными, с распространением их на базальные ядра, лейкоареозом диффузно сливающимся, с преобладанием внутренней ЦА.
3. ХИМ атеросклеротического генеза имела свои отличительные МРТ-признаки: мелкие очаги в среднем количестве, преимущественно перивентрикулярные, лейкоареоз локальный, преобладала наруж-ная ЦА.
4. Результаты данного исследования позволяют рекомендовать МPТ для определения генеза у пациентов с ХИМ. Следовательно, данное исследование должно входить в стандартный протокол обследования больных с ХИМ наряду с другими методами диагностики для дальнейшей целенаправленной терапевтической тактики.
1. Болезни нервной системы: Руководство для врачей: В 2 т. / Под ред. Н.Н. Яхно, Д.Р. Штульмана. — 3-е изд., перераб. и доп. — М.: Медицина, 2003. — 744 с.
2. Дамулин И.В., Брызжахина В.Г., Яхно Н.Н. Нарушения ходьбы и равновесия при дисциркуляторной энцефалопатии. Клинико-нейропсихологическое и МРТ сопоставление // Неврол. журн. — 2004. — № 4. — С. 13-8.
3. Евстигнеев В.В., Юршевич Е.А., Бузуева О.А. Дисциркуляторная энцефалопатия // Медицина. — 2001. — № 1. — С. 26-29.
4. Юршевич Е.А., Евстигнеев В.В. Дисциркуляторная энцефалопатия (нейропсихологические, допплерографические и нейровизуализационные характеристики) // Здравоохранение. — 2002. — № 4. — С. 8-13.
5. Яхно Н.Н., Левин О.С., Дамулин И.В. Сопоставление клинических и МРТ-данных при дисциркуляторной энцефалопатии. Когнитивные нарушения // Неврол. журн. — 2001. — № 3. — С. 10-8.
6. Bowler J.V., Hachinski V. The concept of vascular cognitive impairment // Vascular cognitive impairment / Ed. by T. Erkinjuntti, S. Gauthier. — Martin Dunitz, 2002. — Р. 9-26.
7. Gauthier S., Touchon J. Subclassification of mild cognitive impairment in research and in clinical practice // Alzheimer’s disease and Related Disorders Annual. — 2004. — Р. 61-70.
8. O’Brien J.T., Erkinjuntti T., Reisberg B. et al. Vascular cognitive impairment // Lancet Neurology. — 2003. — № 2. — Р. 89-98.
9. Schmidtke K., Hull M. Cerebral small vessel disease: how does it progress? // J. Neurol. Sciences. — 2005. — 229/230. — Р. 13-20.
10. Roman G.C., Erkinjuntti T., Wallin A. et al. Subcortical ischemic vascular dementia // Lancet Neurology. — 2002. — № 1. — Р. 426-436.

/004/004_1.jpg)
/004/004_2.jpg)
/004/004_3.jpg)
/004/004_4.jpg)
/004/004_5.jpg)
/004/004_6.jpg)
/004/004_7.jpg)