Журнал «» 2 (34) 2014
Вернуться к номеру
Пилотное исследование влияния резвератрола по сравнению с розувастатином и их комбинации на липидный спектр у больных с гипертонической болезнью
Авторы: Сиренко Ю.Н., Кушнир С.Н., Пономарева Г.В. - ГУ ННЦ «Институт кардиологии им. акад. Н.Д. Стражеско» НАМН Украины, г. Киев
Рубрики: Семейная медицина/Терапия, Кардиология
Разделы: Клинические исследования
Версия для печати
Цель: оценить влияние резвератрола по сравнению с розувастатином и их комбинации на липидный спектр у больных с гипертонической болезнью и дислипидемией.
Материал и методы. В исследовании приняли участие 73 пациента, которые были распределены на две группы: I группа (n = 38) в начале исследования получала розувастатин в дозе 20 мг/сут в течение месяца, затем к терапии добавляли резвератрол в дозе 50 мг/сут еще месяц; II группа (n = 35) в начале исследования получала резвератрол в дозе 50 мг/сут один месяц, затем к терапии добавляли розувастатин в дозе 20 мг/сут. В начале и через 2 месяца исследования оценивали данные лабораторных исследований: уровень ОХС, ХС ЛПВП, ХС ЛПНП, ТГ; измеряли офисное артериальное давление (АД), частоту сердечных сокращений, проводили суточное мониторирование АД.
Результаты. В конце наблюдения мы отметили общее снижение уровня ОХС в первой группе на 28,8 %, степень снижения (Δ) составила –1,7 ммоль/л, во второй группе уровень ОХС снизился на 32,4 %, (Δ = –2,2 ммоль/л). Пациенты, которые принимали в группах резвератрол, независимо от стадии лечения показывали лучшее снижение уровня ОХС. Снижение уровня ОХС наблюдалось как в первой, так и во второй группе, причем добавление второго препарата потенцировало холестеринснижающий эффект лечения. К концу периода наблюдения мы отметили достоверное снижение уровня ХС ЛПНП у пациентов обеих групп (p = 0,005/0,005): в первой группе на 27 % (Δ = –1 ммоль/л) против 25 % (Δ = –0,9 ммоль/л) во второй группе, различия недостоверны. Снижение уровня ХС ЛПНП было наиболее выражено у пациентов первой группы. Наиболее благоприятный эффект на уровень ХС ЛПВП мы отметили во второй группе: уровень ХС ЛПВП увеличился на 35,7 % (Δ = +0,5 ммоль/л) у этих пациентов, однако этот эффект был достигнут в результате значимого их увеличения после второго месяца лечения при дополнительном приеме розувастатина. Как в первой, так и во второй группе мы отметили достоверно значимое снижение ТГ, однако более выраженное снижение было в первой группе после добавления резвератрола к терапии. Следует отметить, что при меньшей степени снижения уровня ТГ (Δ –0,4/–0,2 ммоль/л в группах) и при меньшем количестве пациентов с ТГ выше 1,7 ммоль/л во второй группе мы отмечаем наибольшее уменьшение количества пациентов и степени снижения ТГ в процентном отношении. Мы выделили подгруппы пациентов Т (резвератрол), у которых уровень ТГ был выше 1,7 ммоль/л. В конце периода наблюдения уровень ТГ снизился до 1,6 ± 0,1 ммоль/л, степень снижения — –1,2 ммоль/л, в процентном отношении — 42,9 %, а количество пациентов уменьшилось до 3 человек.
Выводы. Терапия резвератролом в сочетании с розувастатином приводила к нормализации липидного спектра крови у больных ГБ с дислипидемией. Резвератрол потенцировал холестеринснижающий эффект статина. Резвератрол достоверно снижал уровень триглицеридов в крови, особенно при исходно повышенном их уровне. Терапия резвератролом была безопасной, хорошо переносилась, побочные реакции не были зафиксированы у пациентов на протяжении всего периода наблюдения.
Мета: оцінити вплив резвератролу порівняно з розувастатином та їх комбінації на ліпідний спектр у хворих на гіпертонічну хворобу (ГХ) та дисліпідемію.
Матеріал і методи. У дослідженні взяли участь 73 пацієнти, які були розподілені на дві групи: I група (n = 38) на початку дослідження отримувала розувастатин у дозі 20 мг/добу протягом місяця, потім до терапії додавали резвератрол в дозі 50 мг/добу ще місяць; II група (n = 35) на початку дослідження отримувала резвератрол у дозі 50 мг/добу один місяць, потім до терапії додавали розувастатин у дозі 20 мг/добу. На початку і через 2 місяці дослідження оцінювали дані лабораторних досліджень: рівень ЗХС, ХС ЛПВЩ, ХС ЛПНЩ, ТГ; вимірювали офісний артеріальний тиск (АТ), частоту серцевих скорочень, проводили добове моніторування АТ.
Результати. Наприкінці спостереження ми відмітили загальне зниження рівня ЗХС у першій групі на 28,8 %, ступінь зниження (Δ) — 1,7 ммоль/л, у другій групі рівень ЗХС знизився на
32,4 %, (Δ = –2,2 ммоль/л). Пацієнти, які приймали в групах резвератрол, незалежно від стадії лікування показували найкраще зниження рівня ЗХС. Зниження рівня ЗХС спостерігалося як у першій, так і в другій групі, причому додавання другого препарату потенціювало холестеринзнижуючий ефект лікування. До кінця періоду спостереження ми відзначили вірогідне зниження рівня ХС ЛПНЩ у пацієнтів обох груп (p = 0,005/0,005): у першій групі на 27 % (Δ = –1 ммоль/л) проти 25 % (Δ = –0,9 ммоль/л ) у другій групі, відмінності недостовірні. Зниження рівня ХС ЛПНЩ було найбільш вираженим у пацієнтів першої групи. Найбільш сприятливий ефект на рівень ХС ЛПВЩ ми відмітили в другій групі: рівень ХС ЛПВЩ збільшився на 35,7 % (Δ = +0,5 ммоль/л) у цих пацієнтів, однак цей ефект був досягнутий у результаті значимого їх збільшення після другого місяця лікування при додатковому прийомі розувастатину. Як у першій, так і в другій групі ми відмітили достовірно значуще зниження ТГ, однак більш виражене зниження було в першій групі після додавання резвератролу до терапії. Слід зазначити, що при меншому ступені зниження рівня ТГ (Δ –0,4/–0,2 ммоль/л у групах ) і при меншій кількості пацієнтів з ТГ вище від 1,7 ммоль/л у другій групі ми відмічаємо найбільше зменшення кількості пацієнтів і ступеня зниження ТГ у відсотковому відношенні.
Ми виділили підгрупи пацієнтів Т (резвератрол), у яких рівень ТГ був вищим за 1,7 ммоль/л. Наприкінці періоду спостереження рівень ТГ знизився до 1,6 ± 0,1 ммоль/л, ступінь зниження —
–1,2 ммоль/л, у відсотковому відношенні — 42,9 %, а кількість пацієнтів зменшилася до 3 осіб.
Висновки. Терапія резвератролом у поєднанні з розувастатином приводила до нормалізації ліпідного спектра крові у хворих на ГХ із дисліпідемією. Резвератрол потенціював холестеринзнижуючий ефект статину. Резвератрол достовірно знижував рівень тригліцеридів у крові, особливо при початково підвищеному їх рівні. Терапія резвератролом була безпечною, добре переносилася, побічні реакції не були зафіксовані у пацієнтів протягом усього періоду спостереження.
Objective: to assess the impact of resveratrol compared with rosuvastatin and their combination on lipid profile in patients with essential hypertension and dyslipidemia.
Material and Methods. The study included 73 patients divided into two groups: I group (n = 38) at baseline received rosuvastatin 20 mg/day for a month, then resveratrol 50 mg/day has been added for a month: II group (n = 35) at the beginning of the study received resveratrol in a dose of 50 mg/day for a month, then therapy was added by rosuvastatin 20 mg/day. At the baseline and after 2 months of the study we evaluated the laboratory data: the level of total cholesterol, HDL cholesterol, LDL cholesterol, triglycerides; we measured office blood pressure (BP), heart rate, carried out daily BP monitoring.
Results. At the end of the observation, we noted significant decrease in total cholesterol in the first group by 28.8 %, the degree of reduction (Δ) was –1.7 mmol/l, in the second group the level of total cholesterol decreased by 32.4 % (Δ = –2.2 mmol/l). Patients who took resveratrol, regardless of the stage of treatment showed better reduction in total cholesterol. Decrease in total cholesterol was observed in both the first and second group, and the addition of a second drug potentiated cholesterol lowering effect of treatment. By the end of the observation period, we noted a significant decrease in LDL cholesterol levels in both groups (p = 0.005/0.005): in the first group by 27 % (Δ = –1 mmol/l) versus 25 % (Δ = –0.9 mmol/l) in the second group, differences are non-significant. Reduction in LDL cholesterol was most pronounced in patients of the first group. The most beneficial effect on HDL cholesterol we noted in the second group: HDL cholesterol increased by 35.7 % (Δ = +0.5 mmol/l) in these patients, however, this effect was achieved as a result of their significant increase after the second month of treatment with additional administration of rosuvastatin. Both in the first and in the second group, we noted a significant decrease in triglycerides, but the decrease was more pronounced in the first group after the addition of resveratrol to therapy. It should be noted that when at a smaller degree of lowering in triglyceride levels (Δ –0.4/–0.2 mmol/l in groups) and at a smaller number of patients with triglycerides higher than 1.7 mmol/l in the second group, we note the greatest reduction in the number of patients and the degree of triglycerides reduction percentage wise. We have identified a subgroup of patients T (resveratrol), with triglycerides levels higher than 1.7 mmol/l. At the end of the observation period triglycerides level decreased to 1.6 ± 0.1 mmol/l, the degree of reduction — –1.2 mmol/l, percentage wise 42.9 %, and the number of patients decreased to 3 people.
Conclusions. Treatment with resveratrol in combination with rosuvastatin resulted in normalization of lipid profile in hypertensive patients with dyslipidemia. Resveratrol potentiated holesterin lowering effect of statin. Resveratrol significantly reduced the level of triglycerides in the blood, especially when it was initially elevated. Resveratrol therapy was safe, well tolerated, no adverse reactions were reported in patients over the observation period.
Статья опубликована на с. 35-44
Введение
Поиск препаратов, которые бы потенцировали липидснижающие и антиатеросклеротические свойства статинов, начался сразу же после их появления. Тем не менее доказательная медицина показала, что не всегда очевидные и легко объясняемые липидснижающие эффекты таких препаратов приводят к хорошим клиническим результатам. Так было с эзетимибом, препаратами полиненасыщенных жирных кислот, никотиновой кислотой, SERT-ингибиторами, в значительной мере — с фибратами. Поэтому поиск таких средств, которые, кроме позитивных биохимических сдвигов, обладали бы и дополнительными благоприятными эффектами на клиническое течение атеросклероза, а также модифицировали прогноз, остается по-прежнему актуальным.
Одним из таких направлений может стать использование идеи так называемого средиземноморского, или французского, парадокса. В последние годы появились данные о вазопротекторном эффекте резвератрола — вещества, с которым некоторые эксперты связывают защитные свойства умеренного употребления красного вина. Выявлено, что он содержится не только в винограде, но и в ряде растений, которые обладают повышенной способностью к выживанию в неблагоприятной окружающей среде. Он относится к группе фитоалексинов и является сильным антиоксидантом, но при этом обладает способностью активировать сиртуины, внутриядерные протеины, отвечающие за модулирование генов, регуляцию метаболизма и, возможно, продолжительность жизни.
Целью настоящего исследования явилось предварительное изучение возможности потенцирования липидснижающего эффекта статинов с помощью добавления к терапии резвератрола.
Материал и методы
В исследовании приняли участие 73 человека старше 18 лет (средний возраст 55,6 ± 1,6 года) с гипертонической болезнью (ГБ), с любым нарушением липидного спектра сыворотки крови, а именно — повышенным уровнем общего холестерина (ОХС), липопротеидов низкой плотности (ЛПНП), триглицеридов (ТГ), либо с низким уровнем липопротеидов высокой плотности (ЛПВП).
В исследование не включались пациенты, которые имели стенокардию напряжения ФК II и выше, клапанные пороки сердца, сердечную недостаточность II ФК по NYHA и более, почечную недостаточность (скорость клубочковой фильтрации < 60 мл/мин) или болезни печени (повышение аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) более чем в 3 раза), декомпенсированный сахарный диабет, заболевания щитовидной железы, страдающие хроническими неспецифическими заболеваниями легких в стадии обострения, имеющие стеноз почечных артерий, онкологические заболевания, психические заболевания, алкогольную и наркотическую зависимость, известную повышенную чувствительность к статинам или резвератролу, беременные и лактирующие.
В качестве стандартной антигипертензивной терапии 47 (64 %) пациентов получали ингибиторы ангиотензинпревращающего фермента (иАПФ) (эналоприл 20–40 мг/сут, периндоприл 5–10 мг/сут), β-адреноблокаторы принимали 37 (57 %) пациентов (бисопролол 5 мг/сут, небиволол 5 мг/сут), блокаторы рецепторов ангиотензина II (БРА) — 19 (26 %) (олмесартан 20–40 мг/сут, валсартан 160–320 мг/сут), антагонисты кальция (АК) — 38 (52 %) пациентов (амлодипин 5–10 мг/сут, лерканидипин 20 мг/сут), тиазидный диуретик — 33 (45 %) пациента (гидрохлортиазид 12,5 мг/сут), а также 67 (91,8 %) принимали ацетилсалициловую кислоту. Монотерапию принимали 15 (21 %) пациентов, а комбинированную терапию — 58 (79 %).
Все пациенты были распределены на две группы. В первую группу вошли 38 пациентов, которые в начале исследования получали розувастатин в дозе 20 мг/сут в течение месяца, затем к терапии добавляли резвератрол в дозе 50 мг/сут еще месяц; во вторую группу — 35 пациентов, которым в начале исследования назначили резвератрол в дозе 50 мг/сут один месяц, затем к терапии добавляли розувастатин в дозе 20 мг/сут. Период наблюдения составил 2 месяца. Использовали препарат резвератрола эвелор (производство Agetis Supplements Ltd, Кипр, импортер в Украине «Медокеми Лимитед») по 1 капсуле (50 мг) 1 раз в сутки. В качестве препарата розувастатина использовали мертенил (производство Gedeon Richter, Венгрия) по 20 мг 1 раз в сутки.
Все пациенты получили рекомендации по поводу модификации образа жизни: ограничение употребления в пищу продуктов, богатых жирами животного происхождения, уменьшение калорийности пищи, соблюдение режима физических нагрузок, поддержание оптимальной массы тела, отказ от табакокурения.
В начале исследования проводили сбор анамнеза заболевания, оценку антигипертензивной терапии, уточняли наличие вредных привычек. Кроме общего физикального обследования пациентам рассчитывали индекс массы тела (ИМТ) по формуле: ИМТ = масса (кг) / площадь тела (м2).
В начале и в конце исследования оценивали данные лабораторных исследований: уровень креатинина, глюкозы, мочевой кислоты, АЛТ, АСТ, С-реактивного белка (СРБ), ОХС, ХС ЛПВП, ХС ЛПНП, ТГ; измеряли офисное артериальное давление (АД), частоту сердечных сокращений (ЧСС), проводили суточное мониторирование АД (СМАД).
Биохимические анализы выполнялись на автоматическом анализаторе А25 (Испания) в ГУ ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины. Уровни ОХС, ТГ и ХС ЛПВП определяли стандартными методами на этом анализаторе, уровень ХС ЛПНП — по формуле Фридвальда: ХС ЛПНП = ОХС – ХС ЛПВП – ТГ / 5.
Офисное измерение АД осуществлялось перед приемом следующей дозы антигипертензивного препарата (между 8.00–10.00). АД измерялось в положении сидя 3 раза с интервалом 2 минуты. В протокол вносилось среднее АД. ЧСС определялась после второго измерения АД. СМАД проводили на портативном аппарате АВРМ-04 («Медитек», Венгрия). Мониторирование проводили в дневное время каждые 15 минут, ночью (22.00–6.00) — каждые 30 минут. Больные вели обычный образ жизни, выполняли обычные физические и психоэмоциональные нагрузки.
Статистическую обработку результатов проводили на персональном компьютере после создания баз данных в системе Microsoft Exсel. Средние показатели обследованных пациентов определяли с помощью пакета анализа в системе Microsoft Exсel. Для сравнения использовали критерий Стьюдента.
Результаты исследования
Клинико-демографическая характеристика пациентов представлена в табл. 1.
/37/37.jpg)
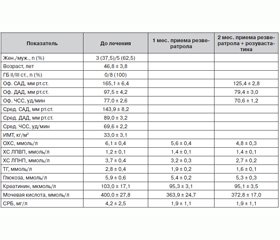
В исследовании приняли участие 73 пациента, из них 39 (53,4 %) женщин и 34 (46,6 %) мужчины, средний возраст — 55,6 ± 1,5 года. Средний уровень офисного АД в начале лечения — 161,1 ± 1,6/94,1 ± 1,0 мм рт.ст. и среднесуточного АД — 133,2 ± 1,8/80,7 ± 1,1 мм рт.ст. Из анамнеза стало известно, что 6 пациентов злоупотребляли табаком, 5 — страдали сахарным диабетом, у 59 пациентов — ГБ II ст. и у 14 — III ст. Пациенты характеризовались повышенным индексом массы тела — 29,2 ± 0,6 кг/м2, у 55 (75 %) пациентов — выше 25 кг/м2 и у 26 (35 %) — выше 30 кг/м2.
Как уже отмечалось, пациенты были разделены на две группы: I группа включала пациентов, которые принимали первым розувастатин (n = 38), и II группа — пациенты, принимавшие первым резвератрол (n = 35). Средний возраст в I группе составил 57,5 ± 1,9 года, во II — 53,5 ± 2,2 года. Пациенты I группы были старше на 4 года. По количеству женщин и мужчин, пациентов, страдающих сахарным диабетом, стадии заболевания, среднему офисному АД, уровню риска, среднему уровню глюкозы, креатинина в сыворотке крови группы были сопоставимы между собой. У пациентов II группы исходно среднесуточный уровень АД был несколько выше — на 6,8/4,1 мм рт.ст., чем у I, также ИМТ этих пациентов был больше на 1,9 кг/м2. Уровень мочевой кислоты и СРБ в обеих группах был в пределах нормы, однако в I группе уровень мочевой кислоты был выше, а уровень СРБ был выше во II. Показатели АСТ и АЛТ были в пределах нормы в течение всего периода наблюдения в обеих группах.
В данном исследовании все пациенты получали антигипертензивную терапию. На фоне проводимой терапии офисное АД снизилось до 123,3 ± 1,4/74,7 ± 1,0 мм рт.ст. в I группе и во II — до 125,7 ± 1,5/77,6 ± 1,4 мм рт.ст. Средний уровень ЧСС снизился достоверно значимо как в I группе (p = 0,0001), так и во II (p = 0,0001). Повторное суточное мониторирование АД проводилось не всем больным, поэтому результаты в рамках настоящей работы не рассмотрены. Характеристика антигипертензивной терапии в группах представлена в табл. 2. Как видно, терапия в группах принципиально не отличалась и не могла достоверно повлиять на показатели липидного обмена.
Уровень ОХC был повышен в обеих группах, но несколько выше был во второй группе. Показатель ХС ЛПВП был в пределах нормы в обеих группах. Уровень ТГ был значительно выше в первой группе, и уровень ХС ЛПНП был одинаково повышен в обеих группах.
Как видно из табл. 3, при оценке результатов в конце наблюдения мы отметили достоверное снижение уровня ОХС в обеих группах (p = 0,05/0,03). При этом большее снижение во второй группе, где исходно уровень ОХС был выше (рис. 1).
Так, общее снижение уровня ОХС в первой группе было на 28,8 %, степень снижения (Δ) составила –1,7 ммоль/л, во второй группе уровень ОХС снизился на 32,4 % (Δ = –2,2 ммоль/л). После первого месяца приема розувастатина у пациентов первой группы происходит снижение ОХС на 19 % (Δ = –1,2 ммоль/л) и дополнительное снижение на 9,8 % (Δ = –0,5 ммоль/л) после добавления к терапии резвератрола. Во второй группе после первого месяца приема резвератрола уровень ОХС снизился на 24,4 %, степень снижения составила –1,8 ммоль/л, при дополнительном приеме розувастатина на втором месяце уровень ОХС снизился еще на 8 % (Δ = –0,4 ммоль/л). Данные представлены в табл. 3 и на рис. 1.
В первой группе уровень ОХС выше 5 ммоль/л был у 35 (92,1 %) пациентов, после первого месяца лечения розувастатином количество пациентов уменьшилось до 26 (74,3 %), а после добавления к терапии резвератрола в течение второго месяца — до 11 (31,4 %). Уровень ОХС выше 5 ммоль/л во второй группе был у 27 (77 %) пациентов, после проведенного лечения резвератролом через один месяц уровень ОХС оставался повышенным у 19 (70,4 %) пациентов, после добавления к лечению розувастатина на втором месяце — у 4 (11,4 %). То есть пациенты, которые принимали в группах резвератрол, независимо от стадии лечения показывали лучшее снижение уровня ОХС. Снижение уровня ОХС наблюдалось как в первой, так и во второй группе, причем добавление второго препарата потенцировало холестеринснижающий эффект лечения.
К концу периода наблюдения мы отметили достоверное снижение уровня ХС ЛПНП у пациентов обеих групп (p = 0,005/0,005): в первой группе на 27 % (Δ = –1 ммоль/л) против 25 % (Δ = –0,9 ммоль/л) во второй группе, различия недостоверны. Наибольшая степень снижения уровня ХС ЛПНП — после первого месяца лечения как в первой группе (21,6 %; Δ = –0,8 ммоль/л), так и во второй (16,7 %; Δ = –0,6 ммоль/л), что не зависело от принимаемого препарата.
Снижение уровня ХС ЛПНП было наиболее выражено у пациентов первой группы. Так, при наибольшем количестве пациентов с ХС ЛПНП выше 3 ммоль/л — 31 (81,6 %) против 22 (62,9 %) во второй — количество пациентов уменьшилось до 11 (28,9 %) против 11 (31,4 %) во второй. Помесячное уменьшение пациентов с ХС ЛПНП выше 3 ммоль/л было одинаково в обеих группах и не зависело от принимаемого препарата, т.е. как розувастатин, так и резвератрол способствовали переходу пациентов с повышенным уровнем ХС ЛПНП в категорию пациентов с уровнем ХС ЛПНП ниже 3 ммоль/л (рис. 1).
Как указывалось выше, уровень ХС ЛПВП был в пределах нормы в обеих группах и составил в первой группе 1,30 ± 0,04 ммоль/л, а во второй — 1,40 ± 0,04 ммоль/л (табл. 4, 5).
Наиболее благоприятный эффект на уровень ХС ЛПВП мы отметили во второй группе: уровень ХС ЛПВП увеличился на 35,7 % (Δ = +0,5 ммоль/л) у этих пациентов, однако этот эффект был достигнут в результате значимого их увеличения после второго месяца лечения при дополнительном приеме розувастатина.
Что касается пациентов, у которых был нормальный уровень ХС ЛПВП, то их наибольшее количество было во второй группе, поэтому наибольшую нормализацию этого показателя мы отметили в первой группе (рис. 1).
Во второй группе, пациенты которой первым принимали резвератрол, средний уровень ТГ был в пределах нормы — 1,4 ± 0,2 ммоль/л, в отличие от пациентов первой группы, где он был несколько повышен — 1,8 ± 0,2 ммоль/л.
В первой группе мы отметили, что уровень ТГ больше 1,7 ммоль/л был у 19 (50 %) пациентов, в то время как во второй — всего у 8 (22,9 %) пациентов. Как в первой, так и во второй группе достоверно значимое снижение ТГ, однако более выраженное снижение в первой группе после добавления резвератрола к терапии, число пациентов снизилось до 7 (18,6 %) человек. Во второй группе после первого месяца терапии количество пациентов уменьшилось до 3 (8,6 %) человек и больше не уменьшалось до конца терапии.
При детальном рассмотрении второй группы мы выделили 8 (22,9 %) пациентов, у которых исходный уровень ТГ был выше 1,7 ммоль/л. В первой группе количество пациентов с нормальным уровнем ТГ и выше 1,7 ммоль/л было одинаковым — 19 (50 %)/19 (50 %). При динамическом наблюдении через один месяц приема резвератрола во второй группе мы отметили уменьшение количества пациентов с повышенным уровнем ТГ до 3 (8,6 %), степень уменьшения в процентном отношении составила 14,3 %. В первой группе мы отметили уменьшение числа таких пациентов до 14 (36,8 %), а степень уменьшения составила 13,2 %. Следует отметить, что при меньшей степени снижения уровня ТГ (Δ –0,4 /– 0,2 ммоль/л в группах) и при меньшем количестве пациентов с ТГ выше 1,7 ммоль/л во второй группе наблюдается наибольшее уменьшение количества пациентов и степени снижения ТГ в процентном отношении (рис. 1).
После двух месяцев терапии во второй группе после добавления к резвератролу розувастатина мы отметили, что количество пациентов с уровнем ТГ выше 1,7 ммоль/л не изменилось. Однако в первой группе, пациентам которой к розувастатину был добавлен резвератрол, наблюдалось дополнительное уменьшение пациентов на 18,2 % (на 7 пациентов). Таким образом, дополнительное назначение резвератрола к терапии статином приводило как к дополнительному уменьшению количества пациентов с повышенным уровнем ТГ, так и обеспечивало дополнительную степень снижения уровня ТГ (табл. 6).
Для детального анализа мы выделили подгруппы пациентов Т (резвератрол) и Н (розувастатин), у которых уровень ТГ был выше 1,7 ммоль/л (табл. 7, 8). В группе резвератрола эта подгруппа включала 8 (22,9 %) пациентов, из них 3 (37,5 %) женщины и 5 (62,5 %) мужчин, средний возраст — 46,8 ± 3,8 года, средний уровень ТГ в крови — 2,8 ± 0,4 ммоль/л.
В конце периода наблюдения уровень ТГ снизился до 1,6 ± 0,1 ммоль/л, степень снижения была 1,2 ммоль/л, в процентном отношении — 42,9 %, а количество пациентов уменьшилась до 3 человек (табл. 9).
После первого месяца приема резвератрола количество пациентов с высоким уровнем ТГ уменьшилось до 3 человек, а средний уровень ТГ достоверно снизился до 1,9 ± 0,2 ммоль/л (p = 0,01). Степень снижения ТГ — 0,9 ммоль/л, что в процентном отношении составило 32,1 % (табл. 9).
После второго месяца наблюдения при добавлении к терапии розувастатина мы не отметили уменьшения количества пациентов с высоким уровнем ТГ, однако уровень ТГ дополнительно снизился еще на 0,3 ммоль/л (10,7 %).
Таким образом, наиболее выраженный и достоверный эффект влияния на уровень ТГ в крови был отмечен у пациентов, которые с самого начала принимали резвератрол, в степени как снижения показателя, так и уменьшения количества пациентов с гипертриглицеридемией.
За период наблюдения в обеих группах уровни креатинина, АСТ, АЛТ, глюкозы в крови значимо не изменялись. Уровень мочевой кислоты в обеих группах достоверно снижался к концу периода наблюдения (p = 0,002/0,008). Мы не можем связать этот феномен с приемом ни одного из изучаемых препаратов.
Обсуждение результатов
Литературные данные свидетельствуют о многочисленных позитивных эффектах резвератрола — нормализации клеточного обмена и усилении транспорта кислорода, регуляции жирового обмена в печени, укреплении сосудистой стенки и снижении ее проницаемости, улучшении реологических показателей крови, о противоаллергическом, радиопротекторном, противовоспалительном, противораковом и сосудорасширяющем действии, о кардиопротективной и эндотелиотропной активности резвератрола в опытах in vitro [1–4]. Эндотелиотропная активность резвератрола обусловлена активацией фермента эндотелиальной NO-синтазы, которая приводит к увеличению выработки окиси азота, являющегося основным вазодилатирующим фактором эндотелия сосудов. Известно несколько краткосрочных клинических исследований, в которых изучали вазопротекторные свойства резвератрола. Так, Fujitaka и др. описали, что у 34 пациентов с метаболическим синдромом при приеме 100 мг/сут резвератрола в течение 3 месяцев улучшилась потокзависимая дилатация, однако не была проведена оценка безопасности приема препарата и не выявлено влияния резвератрола на высокочувствительный СРБ. Исследователи связывают это с малым периодом наблюдения [5]. Brasnyó и др. сообщают об улучшении чувствительности к инсулину у больных с сахарным диабетом путем активации протеинкиназы при приеме резвератрола 10 мг/сут в течение 4 недель [6]. Ранее сообщалось, что этот путь активируется статином и коррелирует со снижением PAI I [7]. Интересно то, что увеличение адипонектина активирует этот же путь [8]. Таким образом, резвератрол при совместном приеме со статинами может оказывать эффект, который выходит за рамки стандартного действия статинов. В связи с этим мы не можем исключить синергический эффект между статином и резвератролом. Ранее было показано, что сочетание правастатина и резвератрола было более эффективно, чем назначение только одного статина, в отношении предупреждения инфаркта миокарда у крыс с гиперхолестеринемией [9].
В настоящем исследовании мы отметили потенцирование снижения уровня ОХС и ХС ЛПНП при добавлении резвератрола к розувастатину. В то же время наблюдается достоверное снижение как ОХС, так и ХС ЛПНП при изолированном приеме резвератрола в течение 1 месяца. При этом добавление розувастатина усиливало холестеринснижающий эффект резвератрола и наоборот.
Общеизвестен эффект розувастатина на уровень ХС ЛПВП: это один из немногих статинов, прием которого сопровождается увеличением его уровня. Некоторые эксперты связывают выраженные антиатеросклеротические свойства розувастатина именно с данным эффектом. В нашем исследовании этот эффект розувастатина также был выражен. В то же время, обсуждая связь так называемого «французского парадокса» с наличием резвератрола в вине, следовало бы ожидать позитивных изменений в уровне ХС ЛПВП под действием этого препарата. Тем не менее в нашем исследовании мы не наблюдали изменений уровня ХС ЛПВП под действием резвератрола как при монотерапии, так и при добавлении его к розувастатину. Возможно, это связано с тем, что в нашем исследовании больных со сниженным уровнем ХС ЛПВП практически не было.
Известно влияние розувастатина на ТГ: степень снижения ТГ зависит от дозы и при приеме дозы 20 мг/сутки составляет 15–25 %, что и наблюдалось в нашем исследовании, особенно у больных с исходно высоким уровнем ТГ [10, 11]. Однако в группе, где резвератрол назначался первым, также наблюдалось достоверное снижение уровня ТГ в среднем на 14 % у больных с исходно повышенным уровнем ТГ. При этом в подгруппе, где первым назначался розувастатин, добавление резвератрола способствовало дальнейшему снижению уровня ТГ. В группе, где первым назначался резвератрол, дополнительное назначение розувастатина не вызывало дальнейшего снижения уровня ТГ.
Ограничения данного исследования: исследование было проведено в одном центре, в исследование включали больных ГБ с любыми типами нарушения липидного обмена без каких-либо специфических характеристик. В исследовании не было целевых уровней для снижения показателей липидограммы. Использовали фиксированные дозы розувастатина и резвератрола без титрации в зависимости от достигнутого эффекта.
Выводы
1. Терапия резвератролом в сочетании с розувастатином приводила к нормализации липидного спектра крови у больных ГБ с дислипидемией.
2. Резвератрол потенцировал холестеринснижающий эффект статина.
3. Резвератрол достоверно снижал уровень триглицеридов в крови, особенно при исходно повышенном их уровне.
4. Терапия резвератролом была безопасной, хорошо переносилась, побочные реакции не были зафиксированы у пациентов на протяжении всего периода наблюдения.
1. Renaud S., de Lorgeril M. Wine, alcohol, platelets, and the French paradox for coronary heart disease // Lancet. — 1992. — 339. — 1523–1526.
2. Koenig W., Sund M., Fröhlich M., Fischer H.G., Löwel H., Döring A., Hutchinson W.L., Pepys M.B. C-reactive protein, a sensitive marker of inflammation, predicts future risk of coronary heart disease in initially healthy middle-aged men: results from the MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg Cohort Study, 1984 to 1992 // Circulation. — 1999. — 99. — 237–242.
3. Bertelli A., Bertelli A.A., Gozzini A., Giovannini L. Plasma and tissue resveratrol concentrations and pharmacological activity // Drugs Exp. Clin. Res. — 1998. — 24. — 133–138.
4. Petrovski G., Gurusamy N., Das D.K. Resveratrol in cardiovascular health and disease // Ann. N. Y. Acad. Sci. — 2011. — 1215. — 22–33.
5. Fujitaka K., Otani H., Jo F., Jo H., Nomura E., Iwasaki M., Nishikawa M., Iwasaka T., Das D.K. Modified resveratrol Longevinex improves endothelial function in adults with metabolic syndrome receiving standard treatment // Nutr. Res. — 2011. — 31. — 842–847.
6. Brasnyó P., Molnár G.A., Mohás M., Markó L., Laczy B., Cseh J., Mikolás E., Szijártó I.A., Mérei A., Halmai R., Mészáros L.G., Sümegi B., Wittmann I. Resveratrol improves insulin sensitivity, reduces oxidative stress and activates the Akt pathway in type 2 diabetic patients // Br. J. Nutr. — 2011. — 106. — 383–389.
7. Kruithof E.K. Regulation of plasminogen activator inhibitor type 1 gene expression by inflammatory mediators and statins // Thromb Haemost. — 2008. — 100. — 969–975.
8. Maruyama S., Shibata R., Ohashi K., Ohashi T., Daida H., Walsh K., Murohara T., Ouchi N. Adiponectin ameliorates doxorubicin-induced cardiotoxicity through Akt protein-dependent mechanism // J. Biol. Chem. — 2011. — 286. — 32790–32800.
9. Penumathsa S.V., Thirunavukkarasu M., Koneru S., Juhasz B., Pant R., Menon V.P., Otani H., Maulik N. Statin and resveratrol in combination induces cardioprotection against myocardial infarction in hypercholesterolemic rat // J. Mol. Cell. Cardiol. — 2007. — 42. — 508–516.
10. Talavera J. A Double Blind, Randomized, Multicenter, Parallel Group, Placebo Control Trial to Evaluate the Effect of Statin Therapy on Triglycerides Levels in Mexican Hypertriglyceridemic Patients // 59th Annual Scientific Sessions of the American College of Cardiology. — March, 2010. — Abstract 1076–112.
11. Saito Y., Yamada N., Shirai K., Sasaki J., Ebihara Y., Yanase T., Fox J.C. Effect of rosuvastatin 5–20 mg on triglycerides and other lipid parameters in Japanese patients with hypertriglyceridemia // Atherosclerosis. — Oct. 2007. — Abstract 194(2). — 505–11. Epub. 2007 Jan 16.
12. Reiner Z., Catapano A.L., De Backer G., Graham I., Taskinen M.R., Wiklund O., Agewall S., Alegria E., Chapman M.J., Durrington P., Erdine S., Halcox J., Hobbs R., Kjekshus J., Filardi P.P., Riccardi G., Storey R.F., Wood D.; European Association for Cardiovascular Prevention and Rehabilitation, ESC Committee for Practice Guidelines (CPG) 2008–2010 and 2010–2012 Committees. ESC/EAS guidelines for the management of dyslipidaemias: the task force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS) // Eur. Heart J. — 2011. — 32. — 1769–1818.

/37/37_2.jpg)
/38/38.jpg)
/39/39.jpg)
/40/40.jpg)
/41/41.jpg)
/42/42.jpg)