Журнал «Здоровье ребенка» 2 (53) 2014
Вернуться к номеру
Дентальні аспекти запобігання інфекційному ендокардиту в дитячому віці
Авторы: Волосовець Т.М. - Інститут стоматології Національної медичної академії післядипломної освіти імені П.Л. Шупика, м. Київ
Рубрики: Семейная медицина/Терапия, Кардиология, Педиатрия/Неонатология, Стоматология
Разделы: Справочник специалиста
Версия для печати
У статті розглянуті сучасна парадигма запобігання інфекційному ендокардиту в дітей, що ґрунтується на світових оновлених рекомендаціях, доказовій базі, а також значення при цьому стоматологічних аспектів. Інфекційний ендокардит частіше виникає в результаті бактеріємії, пов’язаної з повсякденною активністю, ніж унаслідок стоматологічних процедур. Тому підтримання оптимального здоров’я та гігієни ротової порожнини може зменшити рівень бактеріємії, що виникає внаслідок повсякденної активності, та є надзвичайно важливим заходом для зниження ризику виникнення ендокардиту. Наведена сучасна схема антимікробної профілактики при відповідних стоматологічних втручаннях, що зачіпають ясна, періапікальну ділянку зуба або порушують цілісність слизової порожнини рота в пацієнтів високого ризику.
В статье рассмотрены современная парадигма предупреждения инфекционного эндокардита у детей, основанная на мировых обновленных рекомендациях, доказательной базе, а также значение при этом стоматологических аспектов. Инфекционный эндокардит чаще возникает в результате бактериемии, связанной с повседневной активностью, чем в результате стоматологических процедур. Поэтому поддержание оптимального здоровья и гигиены полости рта может уменьшить уровень бактериемии, возникающей вследствие повседневной активности, и является чрезвычайно важным для снижения риска возникновения эндокардита. Приведена современная схема антимикробной профилактики при соответствующих стоматологических вмешательствах, затрагивающих десны, периапикальную часть зуба или нарушающих целостность слизистой полости рта у пациентов высокого риска.
The article describes the contemporary paradigm of prevention of infective endocarditis in children, based on the world updated guidelines, evidence-based, as well as the value of dental aspects. Infective endocarditis more often occurs as a result of bacteremia associated with daily activities than as a result of dental procedures. Therefore, maintaining optimal health and oral hygiene can reduce the level of bacteremia arising as a result of daily activities, and is extremely important to reduce the risk of endocarditis. There is provided the modern scheme of antimicrobial prophylaxis in the respective dental interventions affecting the gums, periapical part of the tooth or violating the integrity of the oral mucosa in high risk patients.
інфекційний ендокардит, стоматологічні процедури, антибактеріальна терапія, діти.
инфекционный эндокардит, стоматологические процедуры, антибактериальная терапия, дети.
nflective endocarditis, dental procedures, antibacterial therapy, children.
Статья опубликована на с. 140-144
Актуальність проблеми інфекційного ендокардиту (ІЕ) в педіатрії з роками не зменшується. При цьому існуючі світові стандарти з даної проблеми не розглядають окремо педіатричні аспекти ІЕ, а надають відповідні рекомендації в контексті загальної проблеми дорослих і дітей. Однак для дітей важливо розглядати особливості етіологічного спектра ІЕ на тлі катастрофічного зростання резистентності збудників до існуючих антибіотиків, патогенезу, клінічного перебігу, лікування та профілактики.
Так, дещо змінилася сучасна парадигма щодо стратегії запобігання ІЕ — запально-інфекційного захворювання ендокарда, що характеризується локалізацією збудника на клапанах серця, рідше на пристінковому ендокарді, й супроводжується, як правило, бактеріємією з ураженням різних органів та систем. Ця ендоваскулярна інфекція уражає не тільки ендокард, один або кілька клапанів, муральний ендокард, серцеві перегородки, але й імплантовані чужорідні матеріали, такі як клапанні протези або електроди кардіостимулятора.
Епідеміологічних досліджень щодо поширеності ІЕ в дітей бракує. За даними різних дослідників, він діагностується в 1,7–6,5 випадку на 100 тис. пацієнтів на рік. Деякі автори вказують його зустрічальність 30 випадків на 1 млн населення. Однак не викликає сумніву, що це захворювання характеризується неухильним зростанням у популяції саме молодих за рахунок дітей із уродженими вадами серця (УВС). Частота ІЕ в дітей з УВС в 15–140 разів вища, ніж у загальній популяції (Youshinada N.K. et al., 2008, та ін.). У дитячому віці ІЕ діагностується приблизно в 1 випадку на 1300–2000 госпіталізацій на рік, за даними досліджень у США. На відміну від дорослих хворих, серед яких переважають особи чоловічої статі, у дітей статевих відмінностей не виявлено.
Найбільш поширені збудники інфекційного ендокардиту серед дітей з нативними клапанами серця: Streptococcus viridans (Streptococcus mutans, Streptococcus sanguinis, Streptococcus mitis) — найчастіше виділяють у дітей із вадами серця після стоматологічних процедур; Staphylococcus aureus становить до 57 % у структурі хвороби у дітей без попередніх структурних патологій серця; стрептококи групи D (Streptococcus bovis, Streptococcus faecalis) найчастіше виділяються в дітей із гастроентерологічними та урологічними маніпуляціями в анамнезі.
До менш поширених збудників відносять: Streptococcus pneumoniae, Haemophilus influenzae, Coagulase-negative staphylococci, Coxiella burnetii, Neisseria gonorrhoeae, Brucella, Chlamydia, Legionella, Bartonella та група HACEK, до якої відносяться деякі штами Haemophilus (H.paraphrophilus, H.parainfluenzae, H.aphrophilus), Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens та Kingella.
У дітей із протезованими клапанами серця актуальні такі збудники, як Staphylococcus epidermidis, Staphylococcus aureus, Streptococcus viridans, Pseudomonas aeruginosa, Serratia marcescens, Сandida albicans, Aspergillus, Pseudallescheria boydii, Histoplasma capsulatum та інші. Приблизно в 6 % випадків виділити збудник не вдається.
Доведена суттєва роль біоплівок — вони залучені у 80 % інфекцій із включенням ІЕ нативних та штучних клапанів (Miro J.M. et al., 2009; Lopez Diaz J., 2011).
Патогенетичний процес інфекційного ендокардиту можна представити у вигляді послідовності: пошкодження ендокарда, утворення вегетацій, бактеріальна колонізація. Як відомо, у нормі ендотелій судин та ендокард резистентні до розвитку інфекції. Однак при набутих і вроджених вадах серця (наприклад, тетраді Фалло), дегенеративних захворюваннях, пролапсі мітрального клапана відбувається пошкодження епітелію вихровим потоком крові, що призводить до оголення субендотеліальної сполучної тканини, відкладення фібрину та нашарування тромбоцитів.
Останнім часом у науковій літературі широко обговорюється роль тканинного фактора у вищеописаному процесі утворення вегетацій. Тканинний фактор — трансмембранний білок, що локалізується на клітинах субендотелію, він активізує зовнішню систему згортання крові, викликає утворення згустку фібрину. Таким чином, пошкодження ендотелію запускає систему коагуляції, призводить до активізації імунних сил організму.
Приєднання моноцитів до вегетацій, у свою чергу, підвищує виробництво тканинного фактора, ключову роль у цьому процесі відіграє прозапальний цитокін IL-1. На пізніших стадіях процесу IL-1 і TNF-a призводять до збільшення IL-10, що, навпаки, знижує рівень моноцитарного тканинного фактора. Отже, ріст вегетацій залежить від балансу цитокінів про- і протизапальної направленості. Зазначений процес утворення вегетацій має назву стадії небактеріального тромботичного ендокардиту. Вегетації, що містять фібрин і тромбоцити, є ідеальними умовами для адгезії мікроорганізмів, які перебувають у кров’яному руслі.
Бактеріємія розвивається внаслідок багатьох інвазивних процедур — від видалення зуба до операцій на органах черевної порожнини. Найчастіше до транзиторної бактеріємії призводять саме стоматологічні маніпуляції: видалення зуба — у 30–76 % випадків у дітей проти 58–100 % у дорослих, щелепно-лицьові операції — у 0–58 %, ортодонтичні процедури — у 0–42 %, чищення зубів призводить до бактеріємії у 0–62 % випадків, жування — у 0–17 %, використання зубочисток — у 36 %.
Тривалість бактеріємії після видалення зуба становить від 15 хвилин (80 %) до 1 години (Inmaculada Tomás-Carmona et al., 2012). Враховуючи високий ризик розвитку патології при щоденних маніпуляціях, була запропонована модель патогенезу інфекційного ендокардиту, при якій саме повторні транзиторні бактеріємії призводять до пошкодження ендотелію і потовщення стулок клапанів, і лише потім фінальна бактеріємія з тривалістю декілька годин або днів призводить до розвитку інфекційного ендокардиту (Drangsholt, 1998).
Більшість транзиторних бактеріємій є короткочасними, без наслідків для здорової людини. Частіше за все мікроорганізми видаляються шляхом активації захисних сил організму. Колонізація бактеріями вегетацій залежить від інфекційного агента, стану ендотелію, функціональної здатності тромбоцитів і моноцитів. Для міцного зціплення з ендотеліальними клітинами бактерії виробляють складні механізми.
Прикладами можуть послужити мукоїд-продукуючі штами S.aureus, декстран-продукуючі штами S.viridians, певні штами S.viridans і Enterococci, що мають FimA поверхневий адгезин, а також S.aureus, резистентний до мікробіоцидних пептидів тромбоцитів (platelets microbiocidal peptides), які здатні обмежити прогресування захворювання. Відомо, що S.aureus і S.viridians мають властивість більш міцного прикріплення до клітин ендотелію, ніж інші бактерії. Саме вони мають на своїй поверхні адгезини, які опосередковують прикріплення до білків міжклітинного матриксу — MSCRAMMs (Microbial Surface Component Reacting with Adhesive Matrix Molecules).
ІЕ залишається значущим фактором ризику високої захворюваності та смертності, тому при проведенні різноманітних медичних процедур і маніпуляцій необхідним є розгляд питання щодо проведення профілактики даної патології. Слід підкреслити, що численні протоколи антибіотикопрофілактики ІЕ постійно переглядалися та вдосконалювалися. Однак, на жаль, дотепер багато лікарів різних спеціальностей, зокрема й стоматологи, не мають чітких знань та вмінь щодо грамотного використання антибіотиків для профілактики ІЕ у дітей.
У 2007 році American Heart Association випустила оновлену версію рекомендацій з профілактики ІЕ. Внесені зміни були засновані на доказовій базі клінічних досліджень, оглядах в галузі бактеріємії та ІЕ, викликаного медичними маніпуляціями, даних про чутливість основних збудників ІЕ тощо.
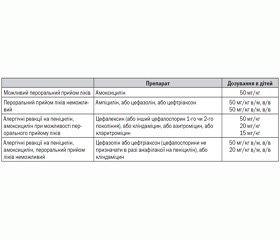
Антибіотикопрофілактика в пацієнтів високого ризику, яким проводяться стоматологічні втручання, зараз відноситься до класу рекомендацій IIа, а не I, як було раніше.
Антибіотикопрофілактика тепер не показана пацієнтам зі стенозом аорти, мітральним стенозом або пролапсом мітрального клапана, не рекомендується підліткам та особам молодого віку з істинними клапанними пороками; пацієнтам з фізіологічними шумами серця або пацієнтам з відхиленнями на ехокардіограмі без явних патологічних шумів; при виконанні рутинних анестезіологічних ін’єкцій при проколі неінфікованих тканин, при виконанні рентгенологічного дослідження зуба, при установці, видаленні або корекції положення ортодонтичних пристроїв, видаленні зубів або протезуванні, а також при кровотечі внаслідок травми губ або слизової оболонки ротової порожнини.
Інфекційний ендокардит частіше виникає в результаті бактеріємії, пов’язаної з повсякденною активністю, ніж унаслідок стоматологічних процедур. Підтримання оптимального здоров’я та гігієни ротової порожнини може знизити рівень бактеріємії, що виникає внаслідок повсякденної активності і є більш ефективним заходом для зниження ризику ІЕ, ніж антибіотикопрофілактика при стоматологічних процедурах. Автори відзначають, що рекомендації можуть суперечити більш раннім стандартам практики, але внесені зміни включають аналіз нових даних експертів з ІЕ (Nishimura R.A. et аl., 2008).
R.A. Seymour (2003) були накопичені дані, які показали, що повсякденна бактеріємія дентальною флорою закономірно розвивається при жуванні і чищенні зубів. Це призвело до того, що у вивченні причин виникнення ІЕ акцент був перенесений з бактеріємії внаслідок втручань на кумулятивну сукупну бактеріємію, котра враховує частоту і тривалість всіх епізодів бактеріємії. Теоретичні розрахунки кумулятивної бактеріємії показали, що повсякденна бактеріємія (чистка зубів, жування) протягом року перевищує бактеріємію внаслідок видалення зуба в 6 млн разів (Roberts G.J., 1999).
Незважаючи на суперечливість результатів досліджень і відсутність суворої доказової бази, беручи до уваги високий ризик несприятливого результату ІЕ в разі його розвитку, антимікробна профілактика рекомендована при стоматологічних втручаннях, які зачіпають ясна, періапікальну ділянку зуба або порушують цілісність слизової порожнини рота.
Хвороби (стани) клапанів серця, при наявності яких ризик несприятливого прогнозу при розвитку ІЕ вважається високим і призначення антибіотикопрофілактики при проведенні стоматологічних процедур є доцільним, згідно з рекомендаціями American Heart Association (за Wilson W., Taubert К.А., Gewitz М. et al., 2007)
1. Протезовані клапани серця або використання штучних матеріалів при репарації пошкоджених клапанів серця.
2. Наявність перенесеного ІЕ в анамнезі.
3. Уроджені вади серця:
— некореговані ціанотичні вади, включаючи шунти;
— повністю коригована вада серця, включаючи імплантацію штучних матеріалів або пристроїв шляхом оперативного втручання або катетеризації протягом 6 місяців (тривалість процесу ендотелізації після пошкодження);
— кориговані вади серця з наявністю залишкових дефектів в місці або поруч з місцем прикріплення імплантації.
4. Пацієнти після трансплантації серця, у яких розвинулись патології клапанів.
Антибіотикопрофілактика має проводитися лише тим хворим, у яких прогноз ІЕ в разі його розвитку є невтішним. Порівняно з попередніми рекомендаціями цей список був значно скорочений, причинами цього стали недостатня доказова база доцільності профілактики, високий процент одужання в інших пацієнтів, розвиток антибіотикорезистентності мікроорганізмів тощо.
Стоматологічні процедури, при яких здійснюється профілактика ІЕ, згідно з рекомендаціями American Heart Association, рівень доказовості С ІІа (за Wilson W., Taubert К.А., Gewitz М. et al., 2007)
— Усі процедури, при яких виконуються маніпуляції з гінгівальними тканинами, періапікальними ділянками зубів або здійснюється перфорація слизової оболонки ротової порожнини.
— Профілактика не проводиться у таких випадках: ін’єкція анестетика через неінфіковані тканини, рентгенографія, розміщення або заміна ортодонтичних чи протезувальних апаратів, їх корекція, розміщення ортодонтичних дужок, випадання молочних зубів, кровотеча при травмах губ чи слизової оболонки ротової порожнини.
Антибіотикопрофілактика проводиться лише до інвазивних процедур. Якщо доза була помилково не отримана, допустимо її введення протягом 2 годин після процедури. Якщо у хворого лихоманка чи інші прояви системної інфекції, бажано отримати зразки крові до профілактичного введення антибіотика.
За даними F.K. Gould et al. (2006), додатково для профілактики ІЕ перед стоматологічним втручанням доцільно використовувати полоскання рота антисептиком (хлоргексидином) з експозицією розчину протягом 1 хв. У разі, якщо курс лікування вимагає декількох візитів до стоматолога, бажано наступні візити здійснювати з інтервалом як мінімум 14 днів для загоєння слизової оболонки порожнини рота.
При планових операціях на серці з установкою імплантатів стоматологічні втручання також повинні проводитися як мінімум за 14 днів до кардіальної операції. При ургентних операціях на клапанах серця хворий повинен якомога раніше пройти обстеження у стоматолога з розробкою плану санації ротової порожнини. Всі планові стоматологічні втручання бажано проводити в термін не менше 3 місяців після операції на клапанах серця.
Взагалі ще більше ніж 100 років тому ротова порожнина була визнана як головне місце для стрептококової інфекції (стрептококи — найчастіші збудники ІЕ). Саме тому American Heart Association протягом останніх 50 років рекомендує проведення антибіотикопрофілактики ІЕ при операційних втручаннях, що супроводжуються бактеріемією у пацієнтів із факторами ризику. За даними узагальнення різноманітних сучасних досліджень, можна констатувати, що частота скороминущої бактеріємії після стоматологічних процедур дуже мінлива і коливається в межах від 10 до 100 %. Бактеріємія часто спостерігається в межах повсякденної активності, такої як чищення зубів, використання зубної нитки або жування.
У зв’язку з цим у хворих із незадовільним здоров’ям порожнини рота бактеріємія може спостерігатися незалежно від стоматологічних процедур, а частота постпроцедуральної бактеріємії у цій групі вища. Таким чином, ризик бактеріємій при проведенні щоденної гігієни ротової порожнини або жуванні значно менший за умови здорового стану зубів та слизової оболонки.
Обговорюючи стратегії майбутнього в запобіганні ІЕ в дітей, слід розглядати різноманітні інноваційні підходи. Це питання асептики, створення матеріалів із гідрофільною високополяризованою поверхнею для запобігання утворенню біоплівок (коли при спробі створювати колонії мікроорганізмів виникає деструкція мембрани бактеріальної клітини) тощо.
Таким чином, проблема ІЕ залишається актуальною для сучасної медицини, у тому числі педіатрії, а профілактичні аспекти її розв’язання мають бути міждисциплінарними, зокрема із залученням лікарів-стоматологів.
Безумовно, вищезазначені положення щодо антибактеріальної профілактики інфекційного ендокардиту необхідно внести до переліку питань та програм викладання профільних дисциплін на післядипломному етапі підготовки лікарів-стоматологів.
1. American Academy of Pediatrics. Red Book: 2012 Report of the Committee on Infectious Diseases / Pickering L.K. ed. — 29th ed. — Elk Grove Village, IL: American Academy of Pediatrics, 2012.
2. Bahrani-Mougeot F.K., Paster B.J., Coleman S., Ashar J., Barbuto S., Lockhart P.B. Diverse and novel oral bacterial species in blood following dental procedures // J. Clin. Microbiol. — 2008. — 46. — 2129–2132.
3. Barbara J.M. Mulder. Endocarditis in Congenital Heart Disease: Who Is at Highest Risk? // Circulation. — 2013. — 128. — 1396–1397.
4. Daniel Bernstein. Infective Endocarditis. In Nelson Textbook of Pediatrics. By Robert M. Kliegman, MD, Bonita M.D. Stanton, MD, Joseph St. Geme, Nina Schor, MD, PhD and Richard E. Behrman, MD. — 19th edition. — Saunders, Elsevier Inc., 2011. Chapter 431.
5. Daniel C. DeSimone, Imad M. Tleyjeh, Daniel D. Correa de Sa, Nandan S. Anavekar, Brian D. Lahr, Muhammad R. Sohail, James M. Steckelberg, Walter R. Wilson, and Larry M. Baddour. Incidence of Infective Endocarditis Caused by Viridans Group Streptococci Before and After Publication of the 2007 American Heart Association’s Endocarditis Prevention Guidelines/Clinical Perspective // Circulation. — 2012. — 126. — 60–64.
6. Day D.M., Gauvreau K., Shulman S., Newburger J.W. Characteristics of Children Hospitalized With Infective Endocarditis // Circulation. — 2009. — 119. — 865–870.
7. Duval X., Leport C. Prophylaxis of infective endocarditis: current tendencies, continuing controversies // Lancet Infect. Dis. — 2008. — 8. — 225–232.
8. Forner L., Larsen T., Kilian M., Holmstrup P. Incidence of bacteremia after chewing, tooth brushing and scaling in individuals with periodontal inflammation // J. Clin. Periodontol. — 2006. — 33. — 401–407.
9. Guntheroth W.G. How important are dental procedures as a cause of infective endocarditis? // Am. J. Cardiol. — 1984. — 54. — 797–801.
10. Lockhart P.B., Brennan M.T., Sasser H.C., Fox P.C., Paster B.J., Bahrani–Mougeot F.K. Bacteremia associated with toothbrushing and dental extraction // Circulation. — 2008. — 117. — 3118–3125.
11. Lockhart P.B., Brennan M.T., Thornhill M., Michalowicz B.S., Noll J., Bahrani–Mougeot F.K., Sasser H.C. Poor oral hygiene as a risk factor for infective endocarditis–related bacteremia // J. Am. Dent. Assoc. — 2009. — 140. — 1238–1244.
12. Lockhart P.B., Loven B., Brennan M.T., Fox P.C. The evidence base for the efficacy of antibiotic prophylaxis in dental practice // J. Am. Dent. Assoc. — 2007. — 138. — 458–474.
13. Lockhart P.B. The risk for endocarditis in dental practice // Periodontology. — 2000. — 23. — 127–135.
14. Lopez Diaz J. The increasing importance of healthcareassociated infective endocarditis. ESC Congress, Paris, 2011; Session № 142: 1250.
15. Miro J.M., Garcia-de-la-Maria C., Armero Y. et al. Addition gentamicin or rifampin does not enhance the effectiveness of daptomycin in the treatment of experimental endocarditis due to methicillin-resistant S. aureus. Antimicrob // Agents Chemother. — 2009. — 53(10). — 4172–4177.
16. Nishimura R.A., Carabello B.A., Faxon D.P., Freed M.D., Lytle B.W., O’Gara P.T., O’Rourke R.A., Shah P.M. ACC/AHA 2008 Guideline update on valvular heart disease: focused update on infective endocarditis: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines endorsed by the Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons // J. Am. Coll. Cardiol. — 2008. — 52(8). — 676–85.
17. Pasquali S.K., He X., Mohamad Z., McCrindle B.W., Newburger J.W., Li J.S., Shah S.S. Trends in endocarditis hospitalizations at US children’s hospitals: impact of the 2007 American Heart Association Antibiotic Prophylaxis Guidelines // Am. Heart J. — 2012 May. — 163(5). — 894–9.
18. Pharis C.S., Conway J., Warren A.E., Bullock A., Mackie A.S. The impact of 2007 infective endocarditis prophylaxis guidelines on the practice of congenital heart disease specialists // Am. Heart J. — 2011 Jan. — 161(1). — 123–9.
19. Que Y.-A., Morelion P. Infective endocarditis // Nat. Rev. Cardiol. — 2011. — 8. — 322–336.
20. Roberts G.J. Dentists are innocent! ‘Everyday’ bacteremia is the real culprit: a review and assessment of the evidence that dental surgical procedures are a principal cause of bacterial endocarditis in children // Pediatr. Cardiol. — 1999. — 20. — 317–325.
21. Rushani D., Kaufman J.S., Ionescu-Ittu R. et al. Infective endocarditis in children with congenital heart disease: cumulative incidence and predictors // Circulation. — 2013. — 128(13). — 1412–1419.
22. Strom B.L., Abrutyn E., Berlin J.A., Kinman J.L., Feldman R.S., Stolley P.D., Levison M.E., Korzeniowski O.M., Kaye D. Dental and cardiac risk factors for infective endocarditis: a population-based case-control study // Ann. Intern. Med. — 1998. — 129. — 761–769.
23. Thornhill M.H., Dayer M.J., Forde J.M., Corey G.R., Chu V.H., Couper D.J., Lockhart P.B. Impact of the NICE guideline recommending cessation of antibiotic prophylaxis for prevention of infective endocarditis: before and after study // BMJ. — 2011. — 342. — d2392.
24. Wilson W., Taubert К.А., Gewitz М. et al. Prevention of Infective Endocarditis Guidelines From the American Heart Association // Circulation. — 2007. — 116. — 1736–1754.
25. Youshinada N.K., Niwa A., Niwa A. et al. Risk factors for inhospital mortality during infective endocarditis in patients with congenital heart disease // Am. J. Cardiol. — 2008. — 101. — 114–118.

/143/143.jpg)