Журнал «Медицина неотложных состояний» 2 (57) 2014
Вернуться к номеру
Антидотна терапія та шляхи нетрадиційної фармакологічної корекції кардіотоксичних ефектів за дії фосфорорганічних сполук
Авторы: Серединська Н.М. - ДУ «Інститут фармакології та токсикології НАМН України», м. Київ
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
У статті надана інформація про експериментальне вивчення ролі гістамінергічної системи за умов уведення різних фосфорорганічних сполук (ФОС), зокрема фозалону. Отримані результати свідчать про опосередкування кардіотоксичної дії ФОС впливом не лише на холінергічну, а й на гістамінергічну медіаторну систему. Зроблено висновок про те, що ймовірно застосування модуляторів гістамінергічної передачі може бути одним із «нетрадиційних» шляхів фармакологічної корекції негативного впливу різних за токсичністю ФОС на серцево-судинну систему, що підтверджується ефективністю, зокрема, дифенгідраміну щодо усунення негативного впливу ФОС на скорочувальну функцію міокарда.
В статье представлена информация об экспериментальном изучении роли гистаминергической системы при условии введения разных фосфорорганических соединений (ФОС), в частности фозалона. Полученные результаты свидетельствуют об опосредствовании кардиотоксического воздействия ФОС влиянием не только на холинергическую, но и на гистаминергическую медиаторную систему. Сделан вывод о том, что, вероятно, применение модуляторов гистаминергической передачи может быть одним из нетрадиционных путей фармакологической коррекции отрицательного влияния разных по токсичности ФОС на сердечно-сосудистую систему, что подтверждается эффективностью, в частности, дифенгидрамина относительно устранения отрицательного влияния ФОС на сократительную функцию миокарда.
The article presents information on the experimental study of the role of the histaminergic system when injected different organophosphorus compounds (OPCs), in particular phosalone. The findings suggest about mediated cardiotoxic effects of by the influence not only on cholinergic, but also on the histaminergic mediator systems. It is concluded that, probably, the use of modulators of histaminergic transmission can be one of the innovative ways of pharmacological correction of the negative impact of different in toxicity OPC on the cardiovascular system, as evidenced by efficacy, in particular, diphenhydramine in terms of eliminating the negative impact of OPC on myocardial contractile function.
отруєння ФОС в експерименті, кардіотоксична дія, фармакологічна корекція.
отравление ФОС в эксперименте, кардиотоксическое воздействие, фармакологическая коррекция.
OPC poisoning in experiment, cardiotoxic effects, pharmacological correction.
Статья опубликована на с. 36-39
Арсенал сучасних фосфорорганічних сполук (ФОС) надзвичайно широкий, а їх застосування не обмежується лише використанням у сільському господарстві. Контакт людини з ФОС може відбуватися за виготовлення фармацевтичних продуктів, виробів косметики. Найвищу загрозу ФОС являють собою за умов їхнього можливого використання як засобів масового ураження населення, флори та фауни, а також за необережних транспортування, переробки, утилізації, що передбачаються при реалізації міжнародної конвенції щодо знищення засобів масового ураження. Суттєву загрозу ФОС складають й з огляду на можливість їхнього застосування за терористичних актів, а також із суїцидальною метою [5, 6, 9, 12].
Значний рівень небезпеки ФОС зумовлений високою токсичністю, здатністю уражувати всі органи та системи, а також призводити до припинення їхнього функціонування.
Актуальним завданням сучасної медицини є пошук засобів специфічної фармакологічної корекції порушень, що виникають за інтоксикації ФОС.
Серед таких засобів — реактиватори ацетилхолінестерази (АХЕ). Відомо, що пошук потенційних реактиваторів АХЕ триває через недостатню ефективність вже створених та впроваджених засобів. Накопичений літературний досвід свідчить про ефективність четвертинних солей піридинальдоксимів, які знайшли практичне застосування, що є обґрунтуванням перспективності пошуку реактиваторів АХЕ серед оксимів [3, 4, 11]. Для Н-оксимів характерна висока швидкість відновлення фосфорильованого фрагменту, здатність уповільнювати процес старіння АХЕ, М- та Н-холінолітична активність. На особливу увагу заслуговують біспіридинові монооксими з бутеновим містком між гетероциклічним фрагментом з оксимною групою в четвертому положенні піридинового кільця. Ці сполуки відрізняються більш простим синтезом, доступністю вітчизняної сировини, вищою стабільністю у водних розчинах, а механізм їх захисної та лікувальної дії не обмежується лише реактивацією АХЕ.
При дослідженні низки синтезованих в ДУ «Інститут фармакології та токсикології НАМН України» сполук ряду монооксимів були виділені сполуки-лідери [1, 6]. Однією з перспективних речовин із властивостями реактиватора АХЕ виявилася сполука карбоксил Х-502 (N,N-1,4-бутен-2)-4-оксимінометил-4-карбамоїлдипіридиній дибромід), вивчення профілактичної та лікувальної активності якої проведено за отруєнь метафосом, гетерофосом, фозалоном, хостаквіком. Визначено токсикометричні показники Х-502, встановлений її захисний індекс при інтоксикації зазначеними ФОС, показана її реактивуюча активність. За показником захисного індексу Х-502 при самостійному застосуванні в 1,1–1,5 раза переважає дипіроксим. Сумісне застосування оксиму Х-502 з холінолітиком атропіном перевагу нової сполуки робить ще більш значущою. Захисна дія Х-502 за профілактичного застосування на тлі інтоксикації фозалоном визначена величиною захисного індексу 1,87. Суттєва реактивуюча активність оксиму Х-502 — 28–84 % у крові, корі великих півкуль, продовгуватому мозку проявляється як за внутрішньом’язового, так і за шкірно-резорбтивного надходження токсикантів в організм. Лікувальна дія Х-502, яка посилюється холінолітиком, за умов гострого отруєння фосфорорганічними пестицидами, крім відновлення активності АХЕ, обумовлена нормалізацією міоневральної лабільності синапсу і функціонального стану периферичного нерва. Висока ефективність Х-502 зареєстрована й за інтоксикації бойовими речовинами антихолінестеразної дії.
Ще більш значущу реактивуючу активність та високу лікувальну ефективність за умов застосування з холінолітиком на тлі інтоксикації бойовими ФОС проявив синтезований потенційний реактиватор АХЕ Р-49 (1-(3-триметиламоній-2-оксимінопропіл)-4-оксіімілометил-піридиній-дибромід моногідрат). Захисний індекс за його самостійного застосування становив 1,20–3,87 за інтоксикації різними ФОС.
Однак для усунення кардіотоксичної дії ФОС застосування антидотної терапії, а саме холінолітиків та реактиваторів АХЕ, не завжди є достатньо ефективним. Дані попередніх досліджень кардіотоксичної дії ФОС дозволили отримати результати за динамічної синхронної реєстрації прямих показників скорочувальної функції міокарда та гемодинаміки на поліграфі RM-6000 (Японія) в умовах штучної вентиляції легень, відкритої грудної клітки при катетеризації порожнини лівого шлуночка серця, висхідної частини дуги аорти, коронарного синуса і електроманометричного визначення тиску крові та флоуметричного визначення об’ємної швидкості коронарного кровотоку у наркотизованих собак, які свідчили, що різні за ступенем токсичності ФОС (фозалон, 0-етил-S-(2-діізопропіламіноетил)метилтіофосфонат, 1,2,2-триметилпропілдиметилфосфонат, зокрема) за внутрішньом’язового введення у дозі 2ЛД50 призводили до гіпотензії, брадикардії, порушення ритму серцевих скорочень, пригнічення скорочувальної функції міокарда та коронарного кровотоку, розвитку передсердно-шлуночкового блоку, а за тим — тріпотіння передсердь [5, 7]. Застосування атропіну не лише не покращувало стан серцево-судинної системи, а, навпаки, призводило до значного зниження системного артеріального тиску крові (САТ, мм рт.ст.), більш суттєвого, ніж за введення власне ФОС, а також до пригнічення скорочувальної функції міокарда, що характеризувалося зниженням тиску крові у лівому шлуночку серця (лівошлуночковий тиск, ЛШТ, мм рт.ст.), зменшенням швидкості скорочення та розслаблення міокарда (dp/dtmax і dp/dtmin відповідно) та розвитком тахікардії. Не було зареєстровано належного позитивного ефекту з боку серцево-судинної системи та за застосування реактиваторів ацетилхолінестерази — дипіроксиму, будаксиму.
Свідчення літератури про опосередкування функціонування серцево-судинної системи певним балансом центрального, периферичного, нейрогуморального механізмів, певним співвідношенням активності парасимпатичної та симпатичної нервової систем, про залежність функціонування серця і судин від активності нейромедіаторних систем у фізіологічних умовах та за патологічних станів, дозволили передбачити, що за інтоксикації ФОС механізм патологічного процесу не обмежується лише взаємодією власне антихолінестеразної речовини з холінореактивними структурами. Підтвердженням існування нехолінергічних механізмів регуляції функціонування серцево-судинної системи за умов інтоксикації ФОС є й вищезазначені результати досліджень, що свідчать про недостатню ефективність холінолітиків та реактиваторів АХЕ щодо усунення або попередження кардіотоксичної дії ФОС. Дані факти дали підстави висловити припущення, що під впливом ФОС змінюється не лише вміст основних нейромедіаторів у крові, міокарді, мозку, а й співвідношення між ними, а також активність, кількість та щільність рецепторних утворень тощо.
У даному дослідженні особлива увага приділялася вивченню ролі гістамінергічної системи за умов уведення різних ФОС, зокрема фозалону. Це зумовлено значущою роллю гістаміну у регулюванні діяльності серцево-судинної системи в нормі та при патології, різноманіттям впливу цього біогенного аміну на серце та судини різних видів лабораторних тварин та людини, про що свідчать дані літератури та результати власних досліджень [2, 10].
Передбачення щодо зміни рівня гістаміну у крові, що притікає до серця та відтікає від нього, а також зміни співвідношення між гістаміном та ацетилхоліном (АХ) як основним, патогенетично значимим нейромедіатором за умов інтоксикації ФОС, окреслило мету дослідження: визначити в артеріальній крові та у крові з коронарного синуса вміст гістаміну та АХ як медіатора холінергічної передачі, роль якої незаперечна в опосередкуванні впливу ФОС, і вміст якого у крові та органах значно зростає за інтоксикації; встановити співвідношення зазначених нейромедіаторів за умов інтоксикації ФОС для обґрунтування доцільності застосування як засобів фармакологічної корекції модуляторів нейромедіаторних систем. Аналіз умісту зазначених нейромедіаторів у міокарді проведено з припущенням (передбаченням) щодо певної стабільності у співвідношенні між ними за фізіологічних умов, тобто, що між рівнем медіаторів у крові, міокарді та інших органах існує певний баланс, який порушується за патологічного процесу.
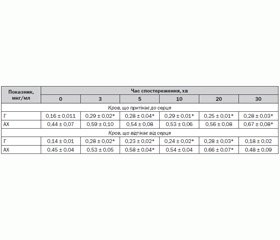
За інтоксикації фозалоном встановлено збільшення рівня АХ у крові та міокарді, що й було прогнозовано, а також рівня гістаміну у крові, що притікає до серцевого м’яза на 56–80 % щодо вихідних (0) даних, і в міокарді на 29–50 % у різні відмітки часу (табл. 1). Вірогідно, за умов уведення ФОС зростання рівня гістаміну в організмі собак обумовлене зниженням активності гістидиндекарбоксилази. Не виключено, що збільшення вмісту гістаміну може забезпечуватися викидом його з тучних клітин.
Фактично вміст АХ в артеріальній крові та у крові з коронарного синуса у 2,8 та 3,2 раза відповідно перевищує вміст гістаміну за фізіологічних умов (до введення ФОС; вихідні дані — 0). На тлі інтоксикації відбувається зміна цього співвідношення за рахунок підвищення вмісту гістаміну.
Аналізуючи отримані результати, а також дані щодо впливу власне гістаміну на серцево-судинну систему у собак (він викликав негативні іно-, хронотропний та гіпотензивний ефекти, подібно до фозалону; табл. 2), можна було прогнозувати посилення негативного впливу ФОС на скорочувальну функцію міокарда та коронарний кровотік за умов активації гістамінових рецепторів.
Однак попередня активація гістамінових рецепторів (внутрішньовенне введення гістаміну у дозі 30 мкг/кг маси тіла тварини) запобігала зниженню тиску крові в порожнині лівого шлуночка серця, сили скорочення міокарда, які викликав сам фозалон. За умов уведення ФОС на тлі активації гістамінових рецепторів реєструвався стабільний, а не прогресивно знижуваний, рівень швидкості скорочення та розслаблення міокарда протягом 30–90 хв після введення фозалону, причому dp/dtmin у деякі відмітки часу була вищою від вихідних значень (табл. 2). Водночас через 120 хв інтоксикації спостерігалося зниження швидкісних показників скорочувальної функції міокарда. Позитивна хронотропна реакція реєструвалася за ураження фозалоном на тлі активації рецепторів гістаміну, при тому що введення лише фозалону викликало різко визначену брадикардію. У той же час профілактичне введення гістаміну не запобігало розвиткові гіпотензивного ефекту: у тварин значно знижувався САТ, причому ступінь гіпотензії практично ідентичний такому, що спостерігався за введення лише фозалону.
Проведені дослідження засвідчили наявність комплементарності фозалону до рецепторів гістаміну. Аналіз стану скорочувальної функції міокарда, гемодинаміки за ураження фозалоном на тлі активації гістамінових рецепторів свідчить, що, ймовірно, існує конкурентний антагонізм за зв’язок із гістамінореактивними структурами власне серцевого м’яза між гістаміном і фозалоном, чим, певною мірою, й опосередковується негативний інотропний ефект ФОС.
Очевидно, інші взаємовідносини з рецепторами гістаміну провідної системи серця існують у досліджуваної отрути, а саме — неконкурентний антагонізм, на що вказує розвиток брадикардії за інтоксикації фозалоном та позитивний хронотропний ефект за отруєння на тлі активації гістамінових рецепторів.
Вірогідно, збільшення вмісту гістаміну у крові та міокарді можна розцінювати як компенсаторну реакцію, спрямовану на нормалізацію скорочувальної функції міокарда, коронарного кровотоку, гемодинаміки, адже певну нормалізацію показників функціонування серцево-судинної системи було зареєстровано за впливу екзогенного гістаміну на тлі інтоксикації.
Результати даної роботи свідчать про опосередкування кардіотоксичної дії ФОС впливом не лише на холінергічну, а й на гістамінергічну медіаторну систему. Очевидно, що застосування модуляторів гістамінергічної передачі може бути одним із нетрадиційних шляхів фармакологічної корекції негативного впливу різних за токсичністю ФОС на серцево-судинну систему, що підтверджується ефективністю, зокрема, дифенгідраміну щодо усунення негативного впливу ФОС на скорочувальну функцію міокарда [8].
1. Мохорт М.А., Притула Т.П., Серединська Н.М., Бобкова Л.С. Прогнозування лікувально-захисних властивостей та токсичності оксимних і безоксимних четвертинних піридинових сполук // Совр. пробл. токсикол. — 2002. — № 2. — С. 79–83.
2. Мохорт Н.А., Серединская Н.Н. Сердечно-сосудистые эффекты гистамина, опосредованные через Н1- и Н2-рецепторы // Фармакол. и токсикол. — 1988. — № 6. — С. 95–100.
3. Петров А.Н., Софронов Г.А., Нечипоренко С.П., Сомин И.Н. Антидоты фосфорорганических отравляющих веществ // Рос. хим. журн. (Журн. Рос. хим. общ-ва им. Д.И. Менделеева). — 2004. — Т. XLVIII, № 2. — С. 110–116.
4. Прозоровский В.Б., Скопичев В.Г., Панченкова О.А. Оценка реактиватора холинэстеразы карбоксима как средства профилактики отравлений фосфорорганическими ингибиторами холинэстераз // ПФБН. — 2008. — № 3–4. — С. 2457–2462.
5. Серединська Н.М. Порівняльна оцінка кардіотоксичного впливу ФОС у дослідах на наркотизованих собаках // Журн. Акад. мед. наук Украины. — 2006. — Т. 12, № 2. — C. 368–377.
6. Серединська Н.М. Кардіотоксичні ефекти при дії фосфорорганічних сполук та шляхи їх фармакологічної корекції: Дис… д-ра. мед. наук. — К., 2006. — 299 с.
7. Серединська Н.М. Токсикодинаміка антихолінестеразних речовин та роль холінергічної системи в опосередкуванні кардіотоксичної дії ФОС // Совр. проблемы токсикологии. — 2010. — № 2–3. — С. 5–12.
8. Серединська Н.М. Модуляція нейромедіаторних процесів — шлях до ефективної фармакологічної корекції серцево-судинної системи за умов патологічних станів різного ґенезу // Мат-ли IV Нац. з’їзду фармакологів України, 10–12 жовтня 2011. — С. 287–288.
9. Atropine therapy in organophosphate intoxication / Leenders M.E.C., Fijen J.W., Spoelstra F., Meulenbelt J. // J. Toxicol. Clin. Toxicol. — 2003. — Vol. 41, № 4. — P. 454–455.
10. Goot H., Timmerman H. Selective ligands as tools to study histamine receptors // Eur. J. Med. Chem. — 2000. — Vol. 35, № 1. — P. 5–20.
11. Kassa J. Review of oximes in the antidotal treatment of poisoning organophosphorus nerve agens // J. Toxicol. Clin. Toxicol. — 2002. — Vol. 40, № 6. — P. 803–816.
12. Stability of atropine sulfate prepared for mass chemical terrorism / Dix J., Weber R.J., Frye R.F. et al. // J. Toxicol. Clin. Toxicol. — 2003. — Vol. 41, № 6. — P. 771–773.

/38/38.jpg)