Журнал «Медицина неотложных состояний» 2 (57) 2014
Вернуться к номеру
Случай успешной сердечно-легочной и церебральной реанимации у больного с массивной тромбоэмболией легочной артерии
Авторы: Царев А.В., Кобеляцкий Ю.Ю., Гришин В.И., Михайлова Е.П., Григорук С.П., Шкапяк Р.А.,
Дудукина С.А., Магала Н.С., Николаенко О.В., Карпова О.Г. - Кафедра анестезиологии и интенсивной терапии ГУ «Днепропетровская медицинская академия МЗ Украины»; КУ «Областная клиническая больница им. И.И. Мечникова», г. Днепропетровск
Рубрики: Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Представлен клинический случай успешной сердечно-легочной и церебральной реанимации при массивной тромбоэмболии легочной артерии у больного с разрывом мешотчатой аневризмы сосудов головного мозга.
Наведений клінічний випадок успішної серцево-легеневої та церебральної реанімації при масивній тромбоемболії легеневої артерії у хворого з розривом мішотчатої аневризми судин головного мозку.
The article presents a clinical case of successful cardiopulmonary and cerebral resuscitation in massive pulmonary embolism in a patient with rupture of saccular aneurysm of the brain vessels.
сердечно-легочная реанимация, тромбоэмболия легочной артерии, нейрохирургия.
серцево-легенева реанімація, тромбоемболія легеневої артерії, нейрохірургія.
cardiopulmonary resuscitation, pulmonary embolism, neurosurgery.
Статья опубликована на с. 166-169
Остановка кровообращения вследствие массивной тромбоэмболии легочной артерии (ТЭЛА) характеризуется развитием фибрилляции желудочков, рефрактерной к электрической дефибрилляции либо электромеханической диссоциации, и ассоциирована с крайне низким уровнем как успеха сердечно-легочной реанимации (СЛР), так и выживаемости в постреанимационном периоде.
Необходимо напомнить, что по характеру течения ТЭЛА различают следующие формы: молниеносную (развитие клинической картины в течение минут), острую (длящуюся часы), подострую (длящуюся дни) и рецидивирующую. А по степени поражения легочного сосудистого русла выделяют: массивную ТЭЛА — при поражении более 50 % легочного сосудистого русла (перекрытие ствола и главных ветвей легочной артерии); субмассивную ТЭЛА — с признаками дисфункции правого желудочка; немассивную ТЭЛА — без изменений функции правого желудочка. Место остановки тромба в системе легочной артерии зависит от его размера, это может быть ствол, конус или бифуркация. Так, бассейн правой легочной артерии составляет 55 %, а каждая из нижнедолевых ветвей — 20–25 % малого круга кровообращения (МКК) [1]. Легкие, выполняя функцию механического фильтра организма, в случае когда эмбол перекрывает легочный сосуд, не способны немедленно лизировать слишком большой эмбол. Это приводит к запуску ряда патофизиологических сдвигов: перераспределению кровотока из зоны, которую кровоснабжал окклюзированный эмболом сосуд, в свободные зоны; выбросу эндотелиоцитами большого количества цитокинов с целью уничтожения эмбола; ретракция эмбола, в свою очередь, обеспечивает высвобождение агрессивных биоактивных продуктов [2].
Это все в конечном итоге приводит к генерализованному артериолоспазму в малом круге кровообращения, что обусловливает развитие легочной артериальной гипертензии, а также коллапсу сосудов большого круга кровообращения (БКК), вызывающего значительное снижение системного артериального давления (АД). В ответ на выброс биоактивных веществ развивается бронхиолоспазм, клинически проявляющийся развитием острой дыхательной недостаточности обструктивного типа [2]. Напряженная работа правого желудочка по преодолению высокого легочно-артериального сопротивления приводит к острой правожелудочковой недостаточности. Параллельно резко снижается выброс левого желудочка, поскольку объем поступающей в него крови ограничен непроходимостью МКК. Это, в свою очередь, усиливает коллапс в БКК и снижает коронарный кровоток, вызывая тяжелую ишемию миокарда и симулируя инфаркт миокарда и кардиогенный шок, приводя в конечном итоге к остановке кровообращения по механизму фибрилляции желудочков [1, 2].
Вышеизложенные механизмы патогенеза ТЭЛА обусловливают клиническую картину кардиопульмонального шока (острой дыхательной и сердечно-сосудистой недостаточности). Так, симптомы острой недостаточности кровообращения при ТЭЛА выражаются в нарушении сердечного ритма (чаще тахикардии), снижении артериального и повышении центрального венозного давления. При молниеносной форме больные возбуждены вследствие страха, плевритической и ангинальной боли, характерным является наличие одышки, кашля и цианоза верхней части тела. Последний симптом связан с тем, что бассейн верхней полой вены, собирающий кровь из верхней части туловища, по своей емкости меньше бассейна нижней [2].
Золотым стандартом обследования при подозрении на ТЭЛА с высокой вероятностью развития является проведение спиральной компьютерной томографии легких с контрастированием. Тест на D–димер имеет отрицательную предсказательную ценность в 95 %. То есть нормальное содержание D-димера с 95% точностью опровергает диагноз ТЭЛА. В то время как его повышенный уровень может быть вызван разными причинами (сепсис, рак, воспалительные процессы, травма и пр.). Таким образом, D-димер является высокочувствительным, но не специфичным (специфичность 40–50 %) методом исследования и имеет значение для исключения ТЭЛА с низкой или средней вероятностью [3].
Как указывалось выше, эффективность стандартной СЛР, без дополнительных терапевтических или хирургических вмешательств, при массивной ТЭЛА крайне низка. Однако компрессия грудной клетки при проведении СЛР может оказаться эффективной, так как иногда обеспечивает фрагментацию эмбола и его смещение в более дистальные отделы легочного артериального русла.
Согласно рекомендациям Европейского совета по реанимации (ERC) 2010 г., в случае если ТЭЛА является причиной остановки кровообращения, рекомендуется проведение тромболизиса [4]. В целом необходимо отметить, что в большом количестве исследований было показано, что применение тромболизиса обеспечивало только увеличение числа случаев восстановления спонтанного кровообращения в процессе проведения СЛР и повышение уровня выживаемости пациентов на момент поступления в больницу или отделение реанимации и интенсивной терапии и не влияло на уровень выживаемости с хорошим неврологическим исходом на момент выписки из больницы [4]. Только одно исследование продемонстрировало эффективность тромболизиса в отношении улучшения выживаемости и неврологического исхода у пациентов с остановкой кровообращения, вызванной ТЭЛА [5]. Рядом исследователей было замечено, что лучший уровень выживаемости и хороший неврологический исход при проведении СЛР по поводу массивной ТЭЛА с включением тромболитической терапии имели место у пациентов, которым проводилась пролонгированная СЛР (60–90 минут) [6].
Также, согласно рекомендациям ERC (2010) [4], пациентам с остановкой кровообращения, вызванной ТЭЛА, которым противопоказано проведение тромболизиса, должна быть выполнена чрескожная механическая эмболэктомия (к сожалению, эта рекомендация в подавляющем большинстве лечебных учреждений Украины не выполнима).
В нашем случае пациент Г., 1955 г.р., поступил в Днепропетровскую областную клиническую больницу им. И.И. Мечникова с диагнозом: ОНМК по геморрагическому типу. Спонтанное субарахноидальное кровоизлияние. Подозрение на разрыв артериальной аневризмы. На момент поступления пациент в сознании (оценка по шкале комы Глазго — 15 баллов), предъявляет жалобы на интенсивную головную боль; АД 140/80 мм рт.ст. Проведенная спиральная компьютерная томография головного мозга выявила кровь в базальных цистернах мозга, сильвиевых щелях, конвекситальных подоболочечных пространствах с двух сторон, а также незначительное количество крови в III и IV желудочках мозга.
/167/167.jpg)
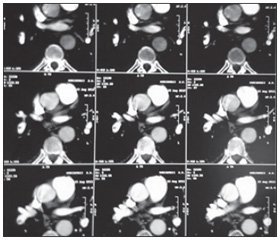
После проведения тотальной селективной церебральной ангиографии была выявлена мешотчатая аневризма передней мозговой, передней соединительной артерии с дивертикулами, передняя трифуркация слева, признаки церебрального ангиоспазма (рис. 1). Пациенту запланировано оперативное вмешательство — краниотомия, клипирование мешотчатой аневризмы в условиях общего обезболивания. На момент проведения операции состояние пациента было тяжелое стабильное, I стадия по Ханту — Хессу, очаговой неврологической симптоматики не было, цефалгия была не выражена. После индукции в наркоз (тотальная внутривенная анестезия + искусственная вентиляция легких) и обработки кожи произведен разрез, наложено 6 фрезевых отверстий и сделано три пропила кости. Через 1 ч 5 мин с момента начала операции у пациента внезапно развилась остановка кровообращения по механизму фибрилляции желудочков. Немедленно начаты реанимационные мероприятия. Появление выраженного цианоза кожных покровов головы, шеи и плечевого пояса указывало на возможную причину остановки кровообращения — развитие ТЭЛА. При проведении комплекса СЛР сохранялась рефрактерная фибрилляция желудочков в ответ на электрическую дефибрилляцию и введение амиодарона (300 мг после 3-го неэффективного разряда и 150 мг после 4-го неэффективного разряда дефибриллятора). Учитывая разрыв мешотчатой артериальной аневризмы, проведение тромболизиса было абсолютно противопоказано. На 40-й минуте СЛР после нанесения 12-го разряда дефибриллятора получено восстановление синусового ритма на кардиомониторе, а затем и самостоятельного кровообращения. Пациент переведен в ОРИТ, гемодинамика удерживалась введением вазопрессоров (мезатон 0,05 мкг/кг/мин), проводилась респираторная поддержка. При лабораторном исследовании на D-димер в раннем постреанимационном периоде получен результат 9,32 мкг/мл (норма — до 0,5 мкг/мл). Через 6 часов с момента восстановления самостоятельного кровообращения пациент понимал обращенную речь и выполнял элементарные команды. На следующие сутки была проведена спиральная компьютерная томография легких с контрастированием, в результате в нижнедолевой ветви легочной артерии справа обнаружен тромб 5 мм в диаметре и длиной около 4 см (рис. 2).
В связи с восстановлением неврологического статуса до уровня сознания, адекватного внешнего дыхания и стабилизацией гемодинамики через сутки с момента остановки кровообращения пациент был отлучен от респиратора и экстубирован. В сознании, движения в конечностях сохранены, очаговой симптоматики нет. Эйфоричен, периодически возбужден — проводилась седация введением бензодиазепинов. При проведении допплер-исследования глубоких и поверхностных вен нижних конечностей — вены проходимы с обеих сторон. Учитывая высокий риск повторного разрыва аневризмы, неблагоприятный вариант для ее транскраниального выключения, пациенту на 5-е сутки постреанимационного периода была проведена рентгенэндоваскулярная эмболизация мешотчатой аневризмы отделяемыми микроспиралями (рис. 3). На 6-е сутки постреанимационного периода пациент был переведен в отделение нейрохирургии, а на 25-е сутки — выписан из больницы под амбулаторное наблюдение. На момент выписки пациент в ясном сознании, критичен. Лицо симметрично, движения и чувствительность в конечностях сохранены в полном объеме.
Таким образом, приведенный выше клинический случай СЛР в связи с развитием интраоперационной массивной ТЭЛА, в условиях когда имеются абсолютные противопоказания к проведению тромболизиса и не возможна хирургическая эмболэктомия (т.е. невозможно использовать методики, которые потенциально могли бы улучшить исход СЛР), показывает, что адекватное проведение компрессии грудной клетки (по-видимому, обеспечившей фрагментацию и дистальное смещение эмбола), а также пролонгация реанимационных мероприятий более 30 минут позволили достигнуть успеха при проведении сердечно-легочной и церебральной реанимации.
1. Киношенко Е.И. Тромбоэмболия легочной артерии // Медицина неотложных состояний. Избранные клинические лекции / Под ред. В.В. Никонова, А.Э. Феськова. — Харьков, 2007. — Т. 1. — С. 147–165.
2. Жданов Г.Г., Зильбер А.П. Реанимация и интенсивная терапия. — М.: Академия, 2007. — 400 с.
3. Рамракха П., Мур К. Справочник по неотложным состояниям: Пер. с англ. — М.: ГЭОТАР, 2010. — 768 с.
4. Deakin C.D., Nolan J.P., Soar J., Sunde K., Koster R.W., Smith G.B., Perkins G.D. European Resuscitation Council Guidelines for Resuscitation 2010. Section 4. Adult advanced life support // Resuscitation. — 2010. — Vol. 81. — P. 1305–1352.
5. Li X., Fu Q.L., Jing X.L. et al. A meta-analysis of cardiopulmonary resuscitation with and without the administration of thrombolytic agents // Resuscitation. — 2006. — Vol. 70. — P. 31–36.
6. Spоhr F., Bоttiger B.W. Safety of thrombolysis during cardiopulmonary resuscitation // Drug Saf. — 2003. — Vol. 26. — P. 367–379.

/168/168.jpg)