Журнал «Травма» Том 15, №2, 2014
Вернуться к номеру
Характеристика биологической деградации керамического гидроксиапатита, имплантированного в костный дефект, по данным рентгеноструктурного анализа
Авторы: Лузин В.И., Петросянц С.В., Грек О.А., Бережной Е.П., Астраханцев Д.А. - ГУ «Луганский государственный медицинский университет»
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
В эксперименте на 72 белых крысах с исходной массой 130–150 г методом рентгеноструктурного анализа исследовали кристаллическую структуру регенерата при имплантации в костный дефект в зоне проксимального метафиза большеберцовой кости керамического гидроксиапатита с размером частиц менее 63 мкм.
Установили, что в керамическом гидроксиапатите размеры кристаллитов были меньше, чем в интактной кости, на 11,19–12,78 %, а коэффициент микротекстурирования, наоборот, был больше на 18,11–21,13 % при неизменных параметрах элементарных ячеек гидроксиапатита.
В группе животных, которым заполнение дефекта не проводилось, в период с 15-го по 30-й день размеры элементарных ячеек вдоль оси с и соотношение с/а превосходили таковые показатели группы интактных животных на 60-й и 90-й день. Размеры кристаллитов в группе незаполненного дефекта в течение всего периода исследования были меньше, чем аналогичные показатели в группе интактных крыс, на 2,08–9,14 %.
При имплантации керамического гидроксиапатита в зону дефекта было выявлено увеличение параметров с, а и с/а, что свидетельствует о дестабилизации элементарных ячеек гидроксиапатита костного регенерата и является следствием его биологического преобразования.
В результате биодеградации кристаллиты керамического гидроксиапатита становятся более рыхлыми, увеличиваются в размерах и, вероятно, создают препятствие для формирования однородной кристаллической решетки костного минерала, который образуется.
В експерименті на 72 білих щурах із початковою масою 130–150 г методом рентгеноструктурного аналізу досліджували кристалічну структуру регенерату при імплантації до кісткового дефекту в зоні проксимального метафізу великогомілкової кістки керамічного гідроксіапатиту з розміром часток менше за 63 мкм.
Встановили, що в керамічному гідроксіапатиті розміри кристалітів були менш, ніж в інтактній кістці, на 11,19–12,78 %, а коефіцієнт мікротекстурування, навпаки, був більше на 18,11–21,13 % при незмінних параметрах елементарних комірок гідроксіапатиту.
У групі тварин, яким заповнення дефекту не проводилося, в період з 15-го по 30-й день розміри елементарних комірок уздовж осі с і співвідношення с/а перевершували такі показники групи інтактних тварин на 60-й і 90-й день. Розміри кристалітів у групі з незаповненим дефектом протягом усього періоду дослідження були меншими, ніж аналогічні показники в групі інтактних тварин, на 2,08–9,14 %.
При імплантації керамічного гідроксіапатиту в зону дефекту було виявлено збільшення параметрів с, а і с/а, що свідчить про дестабілізацію елементарних комірок гідроксіапатиту кісткового регенерату і є наслідком його біологічного перетворення.
Внаслідок біодеградації кристаліти керамічного гідроксіапатиту стають більш пухкими, збільшуються в розмірах і, ймовірно, створюють перешкоду для формування однорідної кристалічної решітки кісткового мінералу, що утворюється.
In experiment involved 72 white rats with initial weight of 130–150 g, using X-ray diffraction analysis, we examined crystal structure of the regenerate after implantation of ceramic hydroxyapatite with a particle size less than 63 microns into the bone defect in the area of proximal tibial metaphysis.
It is found that in the ceramic hydroxyapatite crystallite sizes were smaller than in the intact bone by 11.19–12.78 %, and the microtexturing coefficient, in contrast, was higher by 18.11–21.13 % at constant parameters of the unit cells of hydroxyapatite.
In the group of animals in which we didn’t fill the defect, in the period from the 15th to the 30th day sizes of unit cells along the c axis and c/a ratio were higher than those in group of intact animals on the 60th and 90th day. The crystallite sizes in the group of unfilled defect within the whole study period were less than those in the group of intact rats by 2.08–9.14 %.
When implanting ceramic hydroxyapatite in the defect area we detected the increase of с, a and c/a parameters, which indicates the destabilization of the unit cells of hydroxyapatite of the bone regenerate and is a consequence of its biological conversion.
As a result of biodegradation, ceramic hydroxyapatite crystallites became more friable, are increased in size and would probably constitute an obstacle for the formation of uniform crystal lattice of bone mineral which is formed.
кость, репаративная регенерация, гидроксиапатит, рентгеноструктурный анализ.
кістка, репаративна регенерація, гідроксіапатит, рентгеноструктурний аналіз.
bone, reparative regeneration, hydroxyapatite, X-ray diffraction analysis.
Статья опубликована на с. 20-24
Введение
С целью замещения костных дефектов, которые образуются в результате оперативного лечения доброкачественных опухолей, опухолеподобных и диспластических заболеваний, в настоящее время широко используется гидроксиапатитная (ГАП) керамика [5, 6]. Между поверхностью керамического имплантата и окружающими тканями происходит активное взаимодействие, в результате которого имплантат подвергается биологической резорбции с формированием костной ткани [2–4]. Однако несмотря на то, что ГАП материалы близки по химическому составу минеральному веществу костной ткани, они обладают только остеокондуктивными свойствами [17].
В литературе имеется множество сведений, характеризующих биологическую деградацию ГАП керамики методами рентгенологического, гистологического, гистоморфометрического исследований как в эксперименте, так и в целом ряде клинических наблюдений [13]. Однако сведения о динамических изменениях ультраструктуры комбинированного костно-керамического регенерата, а также о его кристаллографических характеристиках в литературе практически отсутствуют.
Поэтому целью нашего исследования было экспериментальное изучение особенностей процессов репаративной регенерации костной ткани при имплантации в область дефекта ГАП керамики в виде порошка с размером частиц менее 63 мкм методом рентгеноструктурного анализа.
Материал и методы исследования
Экспериментальные исследования проведены на 72 белых крысах-самцах с исходной массой тела 130–150 г.
Все животные были разделены на три группы: первая (К-1) — интактные животные, вторая (К-2) — животные, которым были сформированы костные дефекты в проксимальном метафизе обеих большеберцовых костей (диаметр дефекта равен 2,2 мм, а глубина — 3,0 мм), в третьей группе (А) дефект заполняли порошкообразной ГАП керамикой с размером частиц менее 63 мкм (производства НПП «Кергап», Украина).
Оперативные вмешательства выполнялись под эфирным наркозом. После заполнения сформированного костного дефекта пластическими материалами соответственно группам исследования раны ушивали послойно лавсановыми нитями.
По истечении сроков эксперимента животных декапитировали под эфирным наркозом и забирали для исследования большеберцовые кости. Рентгеноструктурное исследование костного порошка, полученного в агатовой ступке из сегмента кости в области нанесенного дефекта, проводили на аппарате ДРОН-2,0 с гониометрической приставкой ГУР-5. Использовали Кa-излучение кобальта с длиной волны 0,179 нМ; напряжение и сила анодного тока составляли соответственно 30 кВ и 20 А. Дифрагированные рентгеновские лучи регистрировали в угловом диапазоне от 2° до 37° со скоростью записи 1° в 1 мин. На полученных дифрактограммах исследовали наиболее выраженные дифракционные пики, по угловому положению которых рассчитывали межплоскостные расстояния и параметры элементарной ячейки костного гидроксиапатита [10, 12]. Кроме этого, определяли размеры блоков когерентного рассеивания по уравнению Селякова — Шеррера и рассчитывали коэффициент микротекстурирования по методу соотношения рефлексов [1, 10].
Полученные цифровые данные обрабатывались методами вариационной статистики с использованием пакета программ Statistica 5.11 для Windows.
Результаты и их обсуждение
Для того чтобы иметь возможность объективно оценивать изменения имплантата, на начальных этапах представленного сложной комбинацией синтетического и биологического минералов, рентгеноструктурному анализу в первую очередь были подвергнуты образцы керамического ГАП, не имплантированные в зону дефекта (табл. 1).
По данным рентгеноструктурного анализа, размеры элементарной ячейки синтетического гидроксиапатита (производства НПП «Кергап», Украина) вдоль осей с и а составили 6,883 ± 0,002 (x 10–10 М) и 9,414 ± 0,002 (x 10–10 М) соответственно, а коэффициент с/а — 73,097 ± 0,280 усл.ед.
Размер блоков когерентного рассеивания был равен 44,68 ± 1,13 нМ, а коэффициент микротекстурирования, рассчитанный по методу соотношения рефлексов [12], составил при этом 0,497 ± 0,009 усл.ед. (табл. 2).
У интактных животных (группа К-1) размер элементарной ячейки костного ГАП вдоль оси с в динамике с 15-го по 90-й день наблюдения варьировал в пределах от 6,886 ± 0,007 (x 10–10 М) до 6,900 ± 0,003 (x 10–10 М). Размеры элементарной ячейки вдоль оси а за весь исследуемый период также колебались в пределах от 9,418 ± 0,004 (x 10–10 М) до 9,424 ± 0,001 (x 10–10 М) (табл. 1).
Коэффициент с/а, характеризующий степень симметрии элементарной ячейки костного ГАП, также достоверно не изменялся и составлял в ходе наблюдения 73,120–73,208 усл.ед.
Размеры кристаллитов и коэффициент микротекстурирования костного ГАП в данной группе также колебались в пределах от 50,39 ± 0,64 нМ до 51,0 ± 0,59 нМ и от 0,392 ± 0,009 усл.ед. до 0,407 ± 0,019 усл.ед. соответственно (табл. 2), что является свидетельством стабильности процессов костеобразования и формирования костного минерала у белых крыс репродуктивного возраста [9].
Следует отметить, что при сравнении с исходным материалом для замещения (керамический ГАП) в физиологически нормальной кости размеры блоков когерентного рассеивания были значительно больше — на 11,19–12,78 %, а коэффициент микротекстурирования, напротив, был меньше на 18,11–21,13 %. При этом параметры элементарной ячейки как керамического, так и костного ГАП достоверно друг от друга не отличались.
Это свидетельствует о том, что вследствие постоянно и одновременно происходящих процессов резорбции и минерализации костный минерал находится в более аморфном состоянии, нежели керамический [15].
В группе К-2, в которой пластику сформированного дырчатого дефекта не производили, к 15-му и 30-му дням наблюдения размеры элементарной ячейки ГАП вдоль оси с и соотношение с/а незначительно (на 0,07–0,08 %) превосходили аналогичные показатели в образцах группы К-1, что является признаком нарушения симметрии и дестабилизации кристаллической решетки [1, 10]. К 60-м и 90-м сут. эти же показатели были малодостоверно ниже контрольных на 0,09–0,13 %, что свидетельствует об интенсивных процессах нуклеации и роста элементарных ячеек вновь образованного ГАП [14]. Размеры элементарной ячейки вдоль оси а в ходе наблюдения не изменялись.
Необходимо отметить, что, хотя параметры элементарной ячейки ГАП весьма часто статистически достоверно отличались от контрольных, амплитуда отклонений составляла, как правило, не более 0,3–0,4 %. Это объясняется тем, что параметры элементарной ячейки из всех кристаллографических показателей являются наиболее стабильными и их величина определяет тип минерала [11]. Статистическая достоверность различий проявлялась за счет достаточно высокой точности измерений и значительного количества наблюдений.
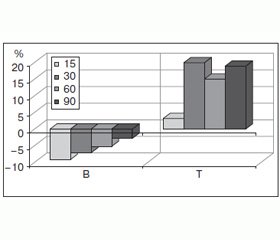
Размеры кристаллитов в группе К-2 в течение всего исследуемого периода были меньше, чем аналогичные показатели в группе К-1, на 9,14; 7,13 и 5,20 % в период с 15-го по 60-й день эксперимента (рис. 1).
/22/22.jpg)
Это свидетельствует об интенсивных процессах роста кристаллов вновь образованного костного минерала и о его большой обменной поверхности [9, 15].
Коэффициент микротекстурирования минерального компонента формирующегося регенерата кости в группе К-2 во все сроки наблюдения достоверно (р < 0,05) превышал аналогичный показатель в группе интактных крыс на 3,19–19,94 % (рис. 1). В период с 15-го по 30-й день наблюдения это связано с интенсивно текущими процессами формирования грубоволокнистой костной ткани с высокой степенью упорядоченности кристаллической решетки костного минерала [15].
Таким образом, в течение первого месяца после нанесения дефекта динамика изменений кристаллографических показателей свидетельствует о дестабилизации костного ГАП. В дальнейшем увеличивается объемная поверхность вновь образованного ГАП, возрастает степень упорядоченности его кристаллической решетки, что является проявлением интенсивно протекающих процессов минерализации костного регенерата и роста кристаллов [15].
При сравнении размеров элементарных ячеек вдоль осей с и а и отношения с/а в образцах группы А с данными контрольной группы К-2 выявлено, что к 15-му дню они превышали показатели контрольной группы на 0,05–0,13 %, что, вероятно, связано с интенсивно развивающейся в этот период биодеградацией ГАП [8].
К 30-му дню показатели с, а и с/а уже не отличались от контрольных, что, вероятно, свидетельствует о завершении биодеградации ГАП на ультраструктурном уровне (в эти же сроки при визуальной оценке при исследовании методом светооптической микроскопии гранулы ГАП выражены еще очень хорошо) [7].
В дальнейшем тенденция к увеличению параметров элементарной ячейки ГАП появляется вновь: к 60-му дню показатели с, а и с/а малодостоверно превосходили контрольные значения. В дальнейшем параметры с, а и с/а продолжали увеличиваться и к 90-му дню превышали контрольные значения уже на 0,42 % (р < 0,05), 0,31 % (р < 0,05) и 0,10 % соответственно.
Увеличение данных показателей свидетельствует о дестабилизации элементарных ячеек ГАП и является следствием интенсивно текущих процессов перестройки вновь сформированного костно-керамического регенерата [14].
Необходимо подчеркнуть, что КЕРГАП-М, не внедренный в зону дефекта, имеет несколько меньшие значения параметров с, а и с/а. Увеличение параметров с, а и с/а при внедрении КЕРГАП-М в зону дефекта свидетельствует о дестабилизации его элементарных ячеек и является следствием его биологического преобразования [15].
Исследование размеров блоков когерентного рассеивания (то есть конгломератов элементарных ячеек или кристаллитов) показало, что при внедрении в зону дефекта керамического ГАП (группа А) они были больше контрольных (K-2) во все установленные сроки эксперимента соответственно на 23,24; 13,83; 12,79 и 11,22 % (р < 0,05 во всех случаях). Это свидетельствует об увеличении степени общей аморфности костно-керамического регенерата и уменьшении общей обменной поверхности формирующейся минеральной фазы [8].
Оценка однородности расположения кристаллов ГАП в кристаллической решетке по коэффициенту микротекстурирования в группе А показала, что во все установленные сроки он был меньше контрольного на 6,43; 21,26; 21,63 и 15,67 % соответственно.
Вероятно, вследствие того, что при биодеградации кристаллиты КЕРГАП-М становятся более аморфными и увеличиваются в размерах [16], они создают препятствия для формирования однородной кристаллической решетки образующегося костного минерала.
Выводы
1. У интактных животных все исследуемые кристаллографические показатели в ходе наблюдения не изменяются, что является свидетельством стабильности процессов костеобразования и формирования костного минерала у белых крыс репродуктивного возраста.
2. При сравнении с керамическим гидроксиапатитом в физиологически нормальной кости размеры кристаллитов были значительно больше, а коэффициент микротекстурирования, напротив, понижался. Это свидетельствует о том, что вследствие одновременно происходящих процессов резорбции и кристаллизации костный минерал находится в более аморфном состоянии, нежели керамический.
3. Динамика кристаллографических показателей в течение первого месяца после нанесения дырчатого дефекта свидетельствует о дестабилизации костного гидроксиапатита, что является следствием резорбции разрушенной костной ткани. В дальнейшем объемная поверхность вновь образованного ГАП и степень упорядоченности его кристаллической решетки возрастают, что является проявлением интенсивно протекающих процессов минерализации костного регенерата и роста кристаллов.
4. Внедрение керамического порошкообразного гидроксиапатита в зону костного дефекта сопровождается увеличением размеров его элементарных ячеек, блоков когерентного рассеивания и снижением коэффициента микротекстурирования. Это свидетельствует о возрастании степени аморфности керамического гидроксиапатита вследствие его биологической резорбции.
5. Увеличение в размерах кристаллитов керамического гидроксиапатита создает препятствия для формирования однородной кристаллической решетки образующегося костного минерала.
1. Азаров Л.В. Метод порошка в рентгенографии / Азаров Л.В., Бургер М.Й. — М.: Изд-во иностранной литературы, 1961. — 363 с.
2. Гідроксиапатит та його використання в медицині / Н.В. Ульянчич, В.В. Поворознюк, О.О. Євтушенко [и др.] // Проблеми остеології. — 1999. — Т. 2, № 4. — С. 71-74.
3. Грунтовский Г.Х. Гидроксилапатитная керамика. Особенности взаимодействия с костной тканью / Г.Х. Грунтовский, С.В. Малышкина // Труды Крымского государственного медицинского университета им. С.И. Георгиевского. — Симферополь: Сонат, 1999. — Т. 135, ч. 2. — С. 127-129.
4.Експериментально-морфологічне обгрунтування застосування пористої кераміки при реконструктивно-відновних операціях на епіметафізах / В.І. Бондарчук, В.А. Попов, А.Т. Бруско [и др.] // Проблеми остеології. — 2000. — Т. 3, № 2–3. — С. 17-22.
5. Керамічний гідроксиапатит — новий імплантат для заміщення дефектів кісток у дітей / А.П. Крись-Пугач, В.А. Дубок, Р.В. Лучко [и др.] // Труды Крымского государственного медицинского университета им. С.И. Георгиевского. — Симферополь: Сонат, 1999. — Т. 135, ч. 2. — С. 133-134.
6.Крись-Пугач А.П. Кісткова пластика керамічним гідроксиапатитом в дитячій та підлітковій ортопедії / А.П. Крись-Пугач, Р.В. Лучко // Літопис травматології та ортопедії. — 1999. — Т. 2. — С. 60-63.
7.Лузин В.И. Гистоморфометрическое исследование регенерации костной ткани при имплантации порошкообразной гидроксилапатитной керамики в сочетании с деминерализованным костным матриксом / В.И. Лузин, В.В. Головченко, Е.П. Бережной // Український медичний альманах. — 2001. — № 5. — С. 81-84.
8. Лузин В.И. Рентгеноструктурное исследование процессов репаративной регенерации большеберцовой кости крыс в условиях облучения электромагнитными волнами крайне высокой частоты / В.И. Лузин // Ортопедия, травматология и протезирование. — 2000. — № 2. — С. 120-122.
9. Лузин В.И. Ультраструктура минерального компонента кости у белых крыс различного возраста при низкоинтенсивном микроволновом облучении / В.И. Лузин // Український медичний альманах. — 1999. — Т. 2, № 4. — С. 95-97.
10. Миркин Л.И. Рентгеноструктурный анализ. Индицирование рентгенограмм (Справочное руководство). — М.: Наука, 1981. — 496 с.
11. Михеев В.И. Рентгенометрический определитель минералов / В.И. Михеев. — М.: Госгеолтехиздат, 1957. — 868 с.
12. Пономарев В.В. Рентгеноструктурные методы исследования в инженерной геологии / Пономарев В.В. — М.: Недра, 1981. — 194 с.
13. Biodegradation behavior of various calcium phosphate materials in bone tissue / C.P. Klein, A.A. Driessen, K. de Groot [et al.] // J. Biomed. Mater. Res. — 1983. — Vol. 17, № 5. — Р. 769-784.
14. Boskey A.L. Amorphous calcium phosphate: the contention of bone / A.L. Boskey // J. Dent. Res. — 1997. — Vol. 76(8). — P.1433-1436.
15. Diffuse X-ray scattering from apatite crystals and its relation to amorphous bone mineral / T. Aoba, Y. Moriwaki, Y. Doi [et al.] // J. Osaka Univ. Dent. Sch. — 1980. — Vol. 20. — P. 81-90.
16. Ducheyne P. The effect of calcium-phosphate ceramic composition and structure on in vitro behavior. I. Dissolution / P. Ducheyne, S. Radin, L. King // J. Biomed. Mater. Res. — 1993. — Vol. 27, № 1. — Р. 25-34.
17. Properties of calcium phosphate ceramics in relation to their in vivo behavior / Blokhuis T.J., Termaat M.F., den Bo–er F.C. [et al.] // The Journal of Trauma. — 2000. — Vol. 48, № 1. — P. 179-186.

/21/21.jpg)
/22/22_2.jpg)