Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Перидуральна аналгезія при оперативних втручаннях в абдомінальній хірургії
Авторы: Гомон М.Л. - Вінницький національний медичний університет ім. М.І. Пирогова
Рубрики: Медицина неотложных состояний, Хирургия
Разделы: Клинические исследования
Версия для печати
Порівнювалось анестезіологічне забезпечення високотравматичних та реконструктивних оперативних втручань на органах черевної порожнини з використанням загальної анестезії в комбінації з перидуральною аналгезією шляхом інфузії стандартного розчину 0,25% лонгокаїну та болюсного введення приготовленого бупівакаїну. Встановлено, що оптимальною за перебігом та використанням засобів для наркозу є комбінація загальної анестезії з перидуральною аналгезією інфузією стандартного розчину 0,25% лонгокаїну.
Сравнивалось анестезиологическое обеспечение высокотравматичных и реконструктивных оперативных вмешательств на органах брюшной полости с использованием общей анестезии в комбинации с перидуральной аналгезией путем инфузии стандартного раствора 0,25% лонгокаина и болюсного введения приготовленного бупивакаина. Установлено, что оптимальной по течению и использованию средств для наркоза является комбинация общей анестезии с перидуральной аналгезией инфузией стандартного раствора 0,25% лонгокаина.
We compared anesthetic management for high-traumatic and reconstructive surgeries of the abdominal cavity using general anesthesia in combination with peridural analgesia by infusion of a standard solution of 0.25% longocain and bolus dosing of prepared bupivacaine. It is found that combination of general anesthesia with peridural analgesia with infusion of a standard solution of 0.25% longocain is optimal regarding the course and the use of anesthetic drugs.
перидуральна аналгезія, анестезіологічне забезпечення в абдомінальній хірургії.
перидуральная аналгезия, анестезиологическое обеспечение в абдоминальной хирургии.
peridural analgesia, anesthetic management in abdominal surgery.
Статья опубликована на с. 55-58
Діапазон хірургічних втручань в абдомінальній хірургії включає як високотравматичні за обсягом, тривалі, так і короткотривалі, малотравматичні та ендоскопічні операції. Неадекватне знеболювання під час оперативного втручання і в післяопераційному періоді обумовлює формування стрес-відповіді і може привести до дисфункції шлунково-кишкового тракту, порушень дихальної, серцево-судинної систем, сприяє формуванню синдрому хронічного болю, що значно затримує післяопераційне відновлення, подовжує період реабілітації і збільшує вартість лікування [1–4]. Ендоскопічна хірургія та малотравматичні втручання не є претензійними до сучасних можливостей анестезіологічного забезпечення. Активне впровадження в практику севофлуранового наркозу в діапазоні напівзакритого контура та низькопотокової анестезії в комбінації з внутрішньовенним компонентом гарантує достатній висококерований та безпечний діапазон анестезіологічних забезпечень оперативних втручань цієї категорії [5–7]. Разом із тим довготривалі, високотравматичні та реконструктивні оперативні втручання в абдомінальній хірургії вимагають гладкого та достатнього компонента аналгезії протягом оперативного втручання з мінімальним впливом на гемодинаміку, профілактику травматичної ішемії кишечника за рахунок маніпуляцій, терміну втручання. На відміну від короткотривалих втручань в абдомінальній хірургії довготривалі та реконструктивні операції вимагають гладкого післяопераційного знеболювання, що зменшує кількість ранніх післяопераційних ускладнень та скорочує строки стаціонарного лікування [8–14]. Крім вищевказаного, у пацієнтів, які готуються до реконструктивних, довготривалих та травматичних втручань, часто присутня супутня патологія та довготривалі розлади травлення, що знижує здатність пацієнта адаптуватися до операційної травми, перебігу післяопераційного періоду. Разом із тим слід відмітити, що далеко не всі високотравматичні оперативні втручання на органах черевної порожнини проводяться на третинному рівні. Достатньо високий відсоток операцій припадає на районні та міські лікарні, що обмежує можливість використання складних діагностичних та моніторингових методів та наркозно-дихальної апаратури нового покоління, тому потребує спрощення та доступності до можливостей анестезіологічного забезпечення цієї категорії оперативних втручань в технічно обмежених умовах [15–18].
Однією з найбільш доступних та достатньо керованих анестезіологічних методик для довготривалих втручань на органах черевної порожнини є використання комбінації загальної анестезії з перидуральною аналгезією [19–21]. Як відомо, обмеження використання спінальної та перидуральної анестезії при оперативних втручаннях в абдомінальній хірургії пов’язане з повним симпатичним блоком, що клінічно реалізується негативним впливом на гемодинаміку. Перидуральна ж аналгезія має мінімальний гіпотензивний вплив на гемодинаміку та не сприяє депонуванню крові. Саме тому перидуральна аналгезія нами використана як компонент загальної анестезії при анестезіологічних забезпеченнях реконструктивних та високотравматичних оперативних втручань в абдомінальній хірургії. Крім того, включення перидуральної аналгезії в комплекс ведення післяопераційного періоду даної категорії хворих забезпечує кращі кінцеві результати хірургічного лікування. Однак гладкість та вираженість аналгетичного компонента при перидуральній аналгезії великою мірою залежить від характеристик місцевого анестетика, його доступності та режиму введення [22].
Саме тому метою нашого дослідження було порівняння методик перидуральної аналгезії при анестезіологічному забезпеченні високотравматичних та реконструктивних оперативних втручань в абдомінальній хірургії з використанням найбільш доступних місцевих анестетиків та методик введення препарату в перидуральний простір.
Матеріали і методи
Проаналізовано ведення анестезіологічного забезпечення 45 хворих із 3-м ступенем операційного ризику за ASA, яким проводили планові високотравматичні та реконструктивні оперативні втручання на органах черевної порожнини (резекція шлунка, кишечника, гастро-ентеро-, ентеро-ентеро-, холедохо-дуоденоанастомози, резекції виразок, гігантські вентральні грижі) в умовах ВОКЛ. Хворі рандомізовані за віком, характером, обсягом, тривалістю оперативних втручань та розділені на 2 групи залежно від методики анестезіологічного забезпечення. У 1-й групі використовувалась комбінація загальної анестезії з ендотрахеальною штучною вентиляцією легень (е/т ШВЛ) та перидуральною аналгезією 0,25% розчином бупівакаїну, який отримувався шляхом розведення 0,5% стандартного розчину та вводився болюсно з розрахунку 1,7 мл на сегмент зони оперативного втручання. У 2-й групі використовувалась комбінація загальної анестезії з е/т ШВЛ та перидуральною аналгезією 0,25% стандартним розчином лонгокаїну, який на початку анестезії був введений болюсно з розрахунку 1,7 мл на сегмент зони оперативного втручання, а в подальшому — інфузійно. У післяопераційному періоді в першій групі з метою знеболювання на фоні ненаркотичних анальгетиків використовувалось болюсне введення 0,25% бупівакаїну (розведеного з 0,5% розчину); у другій групі — інфузія 0,25% стандартного розчину лонгокаїну.
Аналізувались гемодинамічні показники: динаміка середнього артеріального тиску (САТ), динаміка частоти серцевих скорочень (ЧСС), кардіогемодинамічного індексу, показників газообміну. Порівнювалась кількість використаних препаратів для наркозу, інфузійної та симптоматичної терапії. Аналізувався також перебіг післяопераційного періоду на основі гемодинамічних показників та візуальної аналогової шкали (ВАШ) болю. Матеріал оброблявся статистично.
Результати та їх обговорення
Порівняльна характеристика перебігу анестезіологічного забезпечення у пацієнтів двох груп показала більш гладкий його перебіг у пацієнтів другої групи. Так, у першій групі хворих встановлено вірогідні коливання САТ між мінімальним та максимальним показниками протягом анестезії, чого не відмічалось у другій групі (табл. 1).
У першій групі встановлено також вірогідну тенденцію до гіпокінетичного типу гемодинаміки (мін. САТ 84,0 ± 1,6 мм рт.ст.), що не спостерігалось у другій групі. Таким чином, постійна інфузія стандартизованого розчину лонгокаїну в концентрації 0,25 % менш асоційована з коливаннями гемодинаміки, ніж болюсне уведення бупівакаїну. У кінці оперативного втручання вірогідної відмінності в показниках САТ порівняно з вихідними даними в обох групах не відмічалось.
Аналогічні закономірності виявлені при аналізі динаміки показників САТ та кардіогемодинамічного індексу.
Аналіз кількості використаних препаратів для наркозу, інфузійної та симптоматичної терапії сумарно показав вірогідно меншу їх кількість у другій групі пацієнтів (табл. 2). Так, концентрація севофлурану, кількість використаного пропофолу та фентанілу в другій групі була вірогідно менша порівняно з першою групою: середня концентрація севофлурану становила в другій групі 1,2 ± 0,1 об/%, фентанілу — 3,1 ± 0,2 мкг/кг/год; пропофолу — 1,4 ± 0,1 мг/кг, колоїдів — 1,6 ± 0,1 мл/кг/год, що вірогідно менше порівняно з аналогічними показниками в першій групі.
Таким чином, використана методика інфузії стандартного 0,25% розчину лонгокаїну для перидуральної аналгезії у хворих із плановими операціями на органах черевної порожнини є найбільш збалансованою за перебігом та використанням засобів анестезіологічного забезпечення.
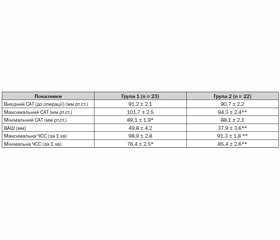
При аналізі гемодинамічних показників першої доби післяопераційного періоду встановлено, що початкові показники САТ у 1-й, 2-й групах вірогідно не відрізнялись і відповідно становили 91,2 ± 2,1 мм рт.ст. та 90,7 ± 2,2 мм рт.ст. (табл. 3). Встановлена вірогідна відмінність підвищення максимального САТ у 1-й групі хворих до 101,7 ± 2,5 мм рт.ст. порівняно з максимальним САТ у 2-й групі — 94,3 ± 2,4 мм рт.ст. Коливання між максимальним та мінімальним САТ відмічено також при використанні болюсного введення бупівакаїну і становило в першій групі: макс. САТ — 101,7 ± 2,5 мм рт.ст.; мін. САТ — 89,1 ± 1,9 мм рт.ст. При використанні інфузії лонгокаїну коливання гемодинаміки протягом першої доби були невірогідні.
Виявлені закономірності коливання артеріального тиску в першій групі корелювали з коливанням показників ВАШ болю. Так, показник ВАШ у першій групі становив 49,8 ± 4,2 мм і був вірогідно вищим за ВАШ 2-ї групи (37,9 ± 3,6 мм). Відмічені вірогідні відмінності коливання ЧСС у першій групі між мінімальним та максимальним показниками, що вірогідно відрізнялись від відповідних показників у другій групі. У другій групі при використанні інфузії лонгокаїну вірогідних відмінностей коливання ЧСС не встановлено.
Таким чином, використання інфузії 0,25% лонгокаїну забезпечує більш гемодинамічно гладкий перебіг больового синдрому в ранньому післяопераційному періоді.
Аналіз кількості використаних препаратів у першу добу післяопераційного періоду для наркозу, симпатоміметичної підтримки, інфузійної та симптоматичної терапії сумарно показав вірогідно меншу їх кількість у другій групі пацієнтів (табл. 4). Так, кількість застосовуваних нестероїдних протизапальних препаратів (НПЗП) як фонових знеболюючих засобів вірогідно менша в пацієнтів другої групи (1,0 ± 0,1 мг/кг/добу), доза використаного лонгокаїну була вірогідно меншою порівняно з бупівакаїном, частота використання інфузійних засобів у першій групі була на 8 % більшою порівняно з першою групою.
Таким чином, інфузія 0,25% лонгокаїну забезпечує більш гладкий перебіг больового синдрому в ранньому післяопераційному періоді, що корелює з використанням менших доз знеболюючих засобів.
Аналогічна закономірність використання оптимальних доз медичних засобів спостерігалась і на 2-гу та 3-тю добу післяопераційного періоду.
Аналізувались віддалені показники перебігу післяопераційного періоду та лікування. Порівнювався термін появи перистальтики та відновлення пасажу кишечника. Так, у першій та другій групах перистальтика з’являлась через 2,2 ± 0,1 та 2,0 ± 0,1 доби відповідно, що не мало вірогідної відмінності, проте відрізнялось від строків при використанні ізольованої загальної анестезії. Аналогічні закономірності отримані при оцінці строків повного відновлення пасажу по кишечнику та строків стаціонарного лікування.
Висновки
1. Використання перидуральної аналгезії інфузією 0,25% лонгокаїну під час як анестезіологічного забезпечення в абдомінальній хірургії, так і після операційного періоду забезпечує менші коливання гемодинаміки порівняно з болюсним введенням аналогічної концентрації бупівакаїну.
2. Використання фабрично приготовлених форм місцевого анестетика (у нашому дослідженні 0,25% лонгокаїну) забезпечує більш гладкий перебіг анестезіологічного забезпечення та післяопераційного періоду порівняно з розчинами бупівакаїну, приготовленими з інших концентрацій.
3. Дана методика забезпечує менше використання засобів для наркозу та сприяє гладкому перебігу післяопераційного періоду.
1. Бубало А.Ф., Мазур А.П., Шевченко В.М. и соавт. Выбор метода анестезиологического обеспечения в бариатрической хирургии // Клінічна хірургія. — 2012. — № 8. — С. 6–7.
2. Гурьянов В.А., Носенко М.М., Гаджибеков Н.Ч. и соавт. Дексмедетомидин — послеоперационное обезболивание и седация в брюшно-полостной хирургии // Анестезиология и реаниматология. — 2013. — № 6. — С. 21–24.
3. Куновський В.В., Квіт А.Д. Больовий синдром та шляхи його нівелювання в комплексному хірургічному лікуванні хворих із невідкладною абдомінальною патологією // Медицина невідкладних станів. — 2013 — № 7. — С. 106–110.
4. Потапов А.Л. Сравнительная оценка индивидуальной реакции пациентов на применение различных методов послеоперационной аналгезии // Медицина невідкладних станів. — 2013. — № 6. — С. 171–173.
5. Бондарь М.В., Вьюницкий В.П. Особенности анестезиологического обеспечения лапароскопических оперативных вмешательств. Руководство по анестезиологии / Под ред. Ф.С. Глумчера, А.И. Трещинского. — К.: Медицина, 2008. — С. 487–496.
6. Глумчер Ф.С., Мельник О.П., Кучин Ю.Л. і співавт. Застосування спінальної анестезії при ургентних лапароскопічних втручаннях на органах нижнього поверху черевної порожнини // Біль, знеболювання і інтенсивна терапія. — 2011. — № 2. — С. 28–31.
7. Колесников А.Н., Файрушин А.А., Стасюк В.А. и др. Изменение основных физиологических параметров при холецистэктомии в зависимости от вида анестезии // Біль, знеболювання і інтенсивна терапія. — 2012. — № 1. — С. 5–7.
8. Акопян Р.В. Сравнительная характеристика эпидуральной и опиоидной аналгезии на частоту возникновения паралитического илеуса у послеоперационных пациентов отделения интенсивной терапии // Анестезиология и реаниматология. — 2013. — № 6. — С. 25–28.
9. Винник Ю.А., Олексенко В.В. Пути уменьшения частоты возникновения и тяжести алиментарно-энтерального вегетативного синдрома после гастрэктомии // Клінічна хірургія. — 2013. — № 1. — С. 69–73.
10. Діброва Ю.А., Щитов О.В., Ларченко Т.Ф та ін. Хірургічна тактика при вторинних виразках шлунку // Клінічна хірургія. — 2012. — № 4. — С. 13–14.
11. Заболотских И.Б., Трембач Н.В. Влияние анестезии на частоту развития делирия после обширных абдоминальных операций у пожилых людей // Анестезиология и реаниматология. — 2013. — № 6. — С. 4–7.
12. Капшиталь А.В. Релапаротомия в структуре абдоминальных оперативных вмешательств // Клінічна хірургія. — 2012. — № 4. — С. 94.
13. Стаканов А.В., Поцелуев Е.А., Мусаева Т.С. Прогнозирование риска развития синдрома интраабдоминальной гипертензии у пациентов с острой толстокишечной непроходимостью в условиях эпидуральной анальгезии // Анестезиология и реаниматология. — 2013. — № 5. — С. 42–46.
14. Шапринський В.О., Кривецький В.Ф., Шапринський Є.В. Підходи до лікування стенозуючих захворювань стравоходу // Клінічна хірургія. — 2012. — № 10. — С. 37–40.
15. Бишовець С.М., Орел В.М., Гаєвський К.В. Стан гемодинаміки та глікемії при тотальній інтравенозній анестезії в абдомінальній хірургії // Біль, знеболювання і інтенсивна терапія. — 2013. — № 2. — С. 58–64.
16. Потапов А.Л., Кобеляцкий Ю.Ю. Обезболивание после объемных оперативных абдоминальных операций — опиаты или эпидуральная аналгезия? // Біль, знеболювання і інтенсивна терапія. — 2011. — № 4. — С. 39–42.
17. Шлапак И.П., Малыш И.Р., Згржебловская Л.В. Адреномиметическая коррекция и волемическая поддержка в комплексе интенсивной терапии тяжелой сочетанной травмы // Гострі й невідкладні стани: Мат-ли Четвертого британсько-українського симпозіуму «Анестезіологія й інтенсивна терапія: уроки минулого і погляд у майбутнє». — 2012. — С. 51–55.
18. Фесенко У.А. Опиоиды в лечении боли, что мы знаем о них сегодня? // Біль, знеболювання і інтенсивна терапія. — 2013. — № 1. — С. 34–46.
19. Борисов Д.Б., Левин А.В., Уваров Д.Н., Каланадзе Л.Г., Недашковский Э.В. Сбалансированное послеоперационное обезболивание в абдоминальной хирургии: эффективность сочетанного применения эпидуральной блокады и неопиоидных анальгетиков // Анестезиология и реаниматология. — 2009. — № 2. — С. 35–37.
20. Солярик С.О., Глумчер Ф.С., Кучин Ю.Л. Вплив контрольованої пацієнтом епідуральної аналгезії на запальну реакцію в післяопераційному періоді // Біль, знеболювання і інтенсивна терапія. — 2012. — № 2. — С. 76–79.
21. Черний В.И, Смирнова Н.Н, Егоров А.Н. и др. Полимодальная послеоперационная аналгезия акупаном, дексалгином и налбуфином при резекции легкого // Острые и неотложные состояния в практике врача. — 2013. — № 1. — С. 9–10.
22. Смирнова Л.М. Органопротективность регионарной анестезии и антиноцицептивного внутривенного наркоза // Біль, знеболювання і інтенсивна терапія. — 2012. — № 1. — С. 53–58.

/56/56.jpg)
/57/57.jpg)