Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Анти-В-клеточная терапия — новое направление в лечении АНЦА-ассоциированных системных васкулитов
Авторы: Яременко О.Б., Петелицкая Л.Б. - Национальный медицинский университет имени А.А. Богомольца, г. Киев
Рубрики: Ревматология, Медицина неотложных состояний
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 83-93
Системные васкулиты — гетерогенная группа заболеваний, основным морфологическим признаком которых является воспаление сосудистой стенки, а спектр клинических проявлений зависит от типа, размера и локализации пораженных сосудов и тяжести сопутствующих воспалительных нарушений [1]. Среди системных васкулитов выделяют группу заболеваний, характеризующихся наличием антинейтрофильных цитоплазматических аутоантител (АНЦА) и некротическим поражением сосудов среднего и малого калибра, — так называемые АНЦА-ассоциированные васкулиты. К ним относятся гранулематоз с полиангиитом (гранулематоз Вегенера, ГПА), микроскопический полиангиит (MПА) и эозинофильный гранулематоз с полиангиитом (синдром Чарджа — Стросса, ЭГПА). Эти заболевания объединяют не только сходные серологические особенности, некоторые клинические характеристики, но и близкие подходы к лечению.
АНЦА-ассоциированные васкулиты относятся к редким болезням: по усредненным оценкам, ежегодная заболеваемость в Европе составляет примерно 20 случаев на миллион населения, а наиболее распространенной нозологической формой является гранулематоз Вегенера [30]. В отдельных странах мира, таких как Япония, Китай, превалирует MПA [15]. Эти заболевания встречаются в любом возрасте, включая детский и старческий, хотя пик заболеваемости приходится на 4–6-е десятилетия жизни [40]. Этиология системных васкулитов остается неизвестной, но считается, что, как и большинство аутоиммунных заболеваний, они развиваются под воздействием факторов внешней среды у генетически предрасположенных лиц [32].
В последние годы активно обсуждаются вопросы номенклатуры и классификации системных васкулитов, главным образом в связи с получением новой информации об их патогенезе. Среди прочего в 2010 году было предложено заменить термин «гранулематоз Вегенера» на «гранулематоз с полиангиитом», что обусловлено наличием доказательств того, что доктор Фридрих Вегенер был членом нацистской партии до и во время Второй мировой войны [12]. На конференции EUVAS (Европейское общество по изучению васкулитов) в 2012 году была представлена обновленная классификация и номенклатура системных васкулитов (табл. 1), утвержденная на международной согласительной конференции в Chapel Hill (США, Северная Каролина) [19].
Для мониторинга течения и прогноза системных васкулитов используют оценку активности и степени повреждения органов по индексу клинической активности васкулита — Birmingham vasculitis activity score (BVAS) и индексу степени повреждения — Vasculitis damage index (VDI) [29].
Индекс BVAS включает в себя симптомы или признаки вовлечения в патологический процесс 9 различных систем органов. Учитывают признаки, обусловленные только васкулитом, которые присутствуют на момент осмотра, а также возникшие или усугубившиеся в течение последнего месяца.
Индекс VDI отображает наличие у больного признаков необратимых изменений в 11 системах органов, которые –обусловлены воспалительным процессом в сосудах, лечением васкулита или возникшими с момента дебюта повреждениями, не связанными с васкулитом. В динамике индекс VDI может оставаться на прежнем уровне или увеличиваться, но никогда не уменьшается.
АНЦА-ассоциированные системные васкулиты являются потенциально смертельными заболеваниями даже в условиях проведения современной терапии. Это иллюстрируют результаты проведенного под эгидой EUVAS исследования многолетней выживаемости 535 больных с АНЦА-ассоциированными васкулитами (281 — с ГПА, 254 — с МПA) [14]. В течение 5 лет наблюдения умерли 133 больных (25 %), что в 2,6 раза выше уровня общей смертности в популяции данного возраста. Наиболее высоким риск смерти был на 1-м году заболевания, среди причин смертельных исходов наибольший удельный вес имели инфекции (48 %) и активный васкулит (19 %). В последующие годы основными причинами смерти были сердечно-сосудистые заболевания (26 %), опухоли (22 %), инфекции (20 %). Негативными прогностическими факторами оказались старший возраст больных в дебюте васкулита, почечная недостаточность, высокий индекс BVAS, низкий гемоглобин и высокий уровень лейкоцитов в дебюте заболевания.
Лечение системных васкулитов включает индукцию ремиссии и поддерживающую терапию. Выбор метода лечения зависит от распространенности и тяжести васкулита, а именно от наличия у больного локализованной, ранней системной, генерализованной, тяжелой или рефрактерной формы заболевания. Категории больных с AНЦА-ассоциированными васкулитами представлены в табл. 2. Британское общество ревматологов (BSR) и Европейская антиревматическая лига (EULAR) разработали рекомендации по лечению системных васкулитов, в том числе АНЦА-ассоциированных [28]. Эти рекомендации основаны на результатах ряда рандомизированных плацебо–контролируемых исследований, проведенных под эгидой EUVAS с 1990 по 2000 год. Большинство больных с АНЦА-ассоциированными васкулитами получают глюкокортикоиды (ГК) в сочетании с циклофосфамидом (ЦФ) для индукции ремиссии и азатиоприн (АЗ) для поддерживающей терапии (табл. 3).
Комбинация метотрексата (МТ) (перорально или парентерально) и ГК рекомендована в качестве менее токсичной альтернативы ЦФ для индукции ремиссии у больных с ранним системным васкулитом, а больным с быстропрогрессирующей тяжелой почечной недостаточностью показана адъювантная терапия плазмаферезом.
Большое количество побочных эффектов ЦФ, таких как инфекции, бесплодие, геморрагический цистит, миелопролиферативные заболевания и рак мочевого пузыря [37], а также рефрактерность в ряде случаев к стандартным методам лечения явились стимулом к поиску новых терапевтических подходов. Этот поиск базировался на достижениях в области –изучения патогенеза васкулитов, в первую очередь на улучшении понимания роли иммунокомпетентных клеток, цитокинов, молекул адгезии.
Патогенез АНЦА-ассоциированных васкулитов сложный и включает в себя нарушения как клеточного, так и гуморального иммунитета. АНЦА сами по себе являются патогенными, кроме того, они вызывают дегрануляцию нейтрофилов и моноцитов, содействуя повреждению эндотелия сосудов [11].
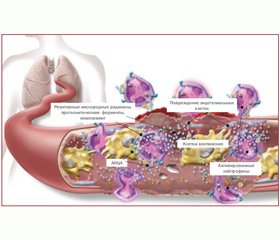
В патогенезе АНЦА-ассоциированных васкулитов выделяют два различных механизма развития (рис. 1).
Первый — классический нейтрофильный путь, вызывающий некроз и воспаление сосудов. Второй — Т-клеточный путь, главным образом ответственный за формирование гранулем и способствующий некротизирующему васкулиту, также он стимулирует продукцию антител В-клетками. Инфекция является пусковым механизмом обоих путей [41].
Инфекционный триггер активирует нейтрофилы (а), увеличивает количество молекул адгезии эндотелиальных клеток, а также количество циркулирующих эффекторных Т-клеток (b). Первая ветвь патогенеза — классический нейтрофильный, «васкулитный» путь — непосредственно связана с активацией нейтрофилов и эндотелиоцитов. Активированные нейтрофилы характеризуются повышенной экспрессией поверхностных антигенов АНЦА и молекул адгезии. Связавшиеся с нейтрофилами АНЦА активируют их несколькими путями: усилением адгезивных свойств в отношении сосудистой стенки и транспортных возможностей; синтезом и секрецией кислородных радикалов, дегрануляцией и высвобождением ферментов, в том числе миелопероксидазы (МПО) и протеиназы-3 (ПР3).
В результате связывания АНЦА с ПР3/MПO, адгезированными на эндотелиальных клетках, локально формируются транзиторные иммунные комплексы. Это приводит к активации комплемента, что способствует еще большей дегрануляции нейтрофилов. Результатом совокупного действия этих факторов является развитие некротизирующего васкулита (рис. 2).
Имеет ли место этот специфический каскад в патогенезе АНЦА-негативных васкулитов, остается неясным.
Индуцированное инфекцией размножение эффекторных Т-клеток в условиях недостаточного контроля со стороны регуляторных Т-клеток приводит к дисбалансу соотношения Т-клеток памяти и регуляторных Т-клеток в пользу первых (b). В результате взаимодействия эффекторных Т-клеток памяти и В-клеток стимулируется синтез АНЦА и продуцируются провоспалительные цитокины, которые участвуют в активации нейтрофилов.
Вторая ветвь патогенеза — гранулематозный процесс. Циркулирующие Т-клетки памяти мигрируют в органы-мишени, такие как легкие или почки. В тканях они приводят к формированию гранулем, ответственных за разрушение ткани (с). Гранулемы состоят из многочисленных типов клеток, таких как Т- и В-лимфоциты, гигантские и дендритные клетки, макрофаги. Кроме того, в гранулемах происходит синтез АНЦА. Возможно, третичные лимфоидные органы (гранулемы и скопления лимфоидных и других провоспалительных клеток в стенке сосуда) являются «местным контролером» воспаления тканей, поскольку в третичных лимфоидных органах, как полагают, происходит индукция регуляторных Т-клеток. В местах поражения формируются так называемые нейтрофильные внеклеточные ловушки как следствие апоптоза и дегрануляции нейтрофилов. В них размещаются ДНК и сериновые протеазы, которые активируют дендритные и В-клетки через Toll-подобные рецепторы. Продуцируемый дендритными клетками интерферон-b может оказывать сильное влияние на местные иммунорегуляторные процессы.
В-клетки играют важную роль в патогенезе АНЦА-ассоциированных васкулитов — в первую очередь за счет синтеза АНЦА. В-клетки могут также выступать в качестве антигенпрезентирующих клеток и взаимодействовать с Т-клетками, нарушая баланс Т-хелперов/супрессоров. Следовательно, дисфункция Т-клеточного звена у больных с АНЦА-ассоциированными васкулитами также может зависеть от B-клеток [33]. Voswinkel и соавт. [39] изучили роль В-клеток путем биопсии слизистой носа у больных ГПА и отметили, что отбор и созревание аутореактивных клеток могут начаться в гранулемах, тем самым содействуя прогрессированию заболевания от локализованных к генерализированным формам. Таким образом, В-клетки играют важную роль в патогенезе как гранулематозных, так и васкулитных проявлений АНЦА-ассоциированных васкулитов.
Изменение представлений о патогенезе системных васкулитов способствовало формированию новой терапевтической стратегии, предполагающей возможность использования иммунобиологических препаратов. Иммунобиологические агенты — медицинские препараты, получаемые методами генной инженерии, мишенями для которых являются ключевые провоспалительные цитокины, их рецепторы и иммунокомпетентные клетки. Важным достоинством иммунобиологических агентов является их безопасность при введении человеку и высокая специфичность, обеспечивающая селективность влияния на конкретные звенья иммунопатогенеза при минимальном воздействии на нормальные механизмы функционирования иммунной системы. Последнее чрезвычайно важно с точки зрения значительного снижения риска генерализованной иммуносупрессии, типичной для цитотоксических базисных препаратов и ГК [3].
Важную роль в патогенезе AНЦА-ассоциированных васкулитов играет ФНО-a. Этот цитокин активирует нейтрофилы, увеличивая их аффинность к АНЦА, вызывает продукцию других воспалительных цитокинов, стимулирует экспрессию молекул адгезии эндотелиальными клетками, а также принимает участие в формировании гранулем [16, 17]. Исходя из этого, были предприняты попытки применения ингибиторов ФНО-a (инфликсимаб, этанерцепт и адалимумаб) для лечения AНЦА-ассоциированных васкулитов.
Инфликсимаб — химерные моноклональные антитела к ФНО-a, состоящие из непосредственно связывающегося с ФНО-a мышиного компонента и фрагмента человеческого IgG. Было проведено несколько неконтролируемых [5, 7, 8, 23] и одно открытое контролируемое исследование [27] с использованием инфликсимаба у больных с ГПА/МПА. По данным неконтролируемых исследований, достижение ремиссии (BVAS < 1) отмечалось у 81 % больных с рефрактерным течением АНЦА-ассоциированных васкулитов, получавших инфликсимаб. В контролируемом исследовании Morgan и соавт. [27], в котором участвовали 33 больных с активными ГПА или МПА, дополнение инфликсимаба к стандартной терапии (ГК и ЦФ) не показало клинических преимуществ. При этом был зарегистрирован высокий риск серьезных инфекций, в том числе реактивации туберкулеза, гемофильной пневмонии, клебсиеллезной инфекции мочевыводящих путей, абсцессов кожи, вызванных золотистым стафилококком. Возможной причиной повышенной частоты серьезных инфекций могло быть использование в данном исследовании более высокой, чем при ревматоидном артрите (РА) (обычно 3 мг/кг), дозы инфликсимаба.
Этанерцепт — рекомбинантные растворимые рецепторы ФНО-a. В многоцентровом рандомизированном плацебо-контролируемом исследовании WGET (Wegener’s Granulomatosis Etanercept Trial) [36] по оценке эффективности и безопасности этанерцепта для поддержания ремиссии у 180 пациентов с ГПА не было обнаружено существенных различий между группой этанерцепта и контрольной группой (стандартная терапия) в частоте стойкой ремиссии и рецидивов. При этом в группе этанерцепта отмечено развитие солидных форм рака у 6 больных по сравнению с отсутствием его в контрольной группе (p = 0,01). Результаты данного исследования исключают возможность использования этанерцепта в качестве дополнения к традиционной терапии для поддержания ремиссии у больных ГПА.
Адалимумаб — полностью человеческие рекомбинантные моноклональные антитела к ФНО-a. Эффективность этого ингибитора ФНО-a изучалась в открытом проспективном исследовании, которое включало 14 больных с АНЦА-ассоциированным васкулитом с поражением почек как первым проявлением заболевания или проявлением рецидива [24]. Авторы исследования сделали вывод, что добавление адалимумаба к ГК и ЦФ в лечении тяжелых АНЦА-ассоциированных васкулитов имеет одинаковый уровень ответа и побочных явлений в сравнении со стандартной терапией, хотя уменьшает экспозицию преднизолона.
В целом ингибиторы ФНО не продемонстрировали значимых преимуществ в лечении системных васкулитов. Таким образом, роль анти-ФНО препаратов в лечении АНЦА-ассоциированных васкулитов является неопределенной и требует дальнейшего изучения.
Более богатым и успешным в сравнении с ингибиторами ФНО-a является опыт применения в лечении системных некротизирующих васкулитов анти-В-клеточной терапии, а именно РТ.
Ритуксимаб — это химерные анти-СD20 моноклональные антитела, которые связываются с антигеном СD20 на поверхности В-клеток, что приводит к истощению популяции В-клеток в периферической крови [25]. Первоначально препарат был одобрен для пациентов с неходжкинскими лимфомами, а с 2006 года — для лечения ревматоидного артрита. Целесообразность его применения у больных с системными некротизирующими васкулитами вытекает из особенностей патогенеза, а именно вклада в него В-лимфоцитов, которые являются антигенпрезентирующими клетками, предшественниками продуцирующих антитела плазматических клеток, поставщиками цитокинов и хемокинов, активаторами Т-лимфоцитов [32].
Несколько небольших исследований с использованием РТ для лечения рефрактерных форм ГПА и MПA продемонстрировали перспективные данные с частотой индукции ремиссии около 80 % [6, 9, 10, 13, 21, 22, 31, 34, 35, 38]. Дальнейшие подтверждения эффективности РТ для индукции ремиссии у больных системными васкулитами были получены в рандомизированных плацебо-контролируемых исследованиях RAVE (Rituximab versus Cyclophosphamide for ANCA–Associated Vasculitis) и RITUXVAS (Rituximab versus Cyclophosphamide in ANCA-Associated Renal Vasculitis) [20, 37].
Исследование RAVE включало 197 больных с активным (BVAS ≥ 3) впервые диагностированным или рецидивирующим АНЦА-ассоциированным васкулитом (ГПА : МПА = 3 : 1). Критериями исключения являлись наличие кровохарканья или повышение креатинина более 4 мг/дл. В этом исследовании больные были рандомизированы на две группы для получения или РТ в виде четырех инфузий по 375 мг/м2 с интервалом в 7 дней плюс плацебо-ЦФ, или ЦФ в дозе 2 мг/кг в сутки per os плюс плацебо-РТ. Существенных отличий в базовых демографических и клинических характеристиках между группами не было. Пациенты наблюдались в течение 18 месяцев. При достижении ремиссии ЦФ был заменен на АЗ в дозе 2 мг/кг в сутки, который больные продолжали принимать до 18-го месяца. В группе РТ пациенты получали плацебо-АЗ. Всем больным проводили пульс-терапию ГК (метилпреднизолон в дозе 1000 мг внутривенно № 1–3) с последующей поддерживающей дозой ГК 1 мг/кг в сутки и постепенным уменьшением дозы до полной отмены ГК к 6-му месяцу. Первичные конечные точки: достижение ремиссии (BVAS = 0) и полная отмена ГК до 6-го месяца. Вторичными конечными точками были ремиссия (BVAS = 0) у больных, которые получали ГК в дозе не более 10 мг/кг в сутки, частота обострений (повышение BVAS > 1 балла), кумулятивная доза ГК. Вторичные конечные точки оценивались через 18 мес.
По результатам данного исследования, 64 % больных группы РТ и 53 % группы ЦФ достигли первичной конечной точки на 6-м месяце (p < 0,001). На 12-м и 18-м месяце 42 и 36 % больных в группе РТ по сравнению с 38 и 31 % в группе ЦФ оставались в ремиссии без глюкокортикоидной терапии (рис. 3).
Частота рецидивов была одинаковой в группе РТ и контрольной группе (рецидивы встречались чаще у больных с наличием антител к ПР3). Средняя кумулятивная доза ГК была значительно ниже в группе РТ (3270 против 3678 мг, р = 0,031) на 12-м мес., но выровнялась к 18-му мес. Побочные эффекты в обеих группах не отличались. Вторичная конечная точка была достигнута у 71 % больных группы РТ и у 62 % больных контрольной группы (р = 0,10).
При анализе подгрупп больных с впервые установленным диагнозом и рецидивом продемонстрировано преимущество РТ перед ЦФ в частоте индукции ремиссии в подгруппе больных с рецидивирующим течением АНЦА-ассоциированного васкулита (рис. 4).
В отношении уровня CD19+ В-клеток на фоне проводимой терапии отмечены следующие закономерности: у больных в группе РТ после двух инфузий препарата В-клетки практически не определялись (их уровень снизился ниже 10 клеток/мм3) и у большинства больных сохранялись на том же уровне на протяжении 6 месяцев; в группе ЦФ уровень В-клеток снижался незначительно, не ниже 10 клеток/мм3. Также не было обнаружено никакой разницы в уровнях B-клеток у больных с наличием антител к ПР3 и МПО (рис. 5).
Следовательно, по результатам исследования RAVE РТ, не уступает ЦФ в индукции ремиссии у больных с активным АНЦА-ассоциированным васкулитом. Эффективность анти-В-клеточной терапии в первые 6 месяцев достоверно выше по сравнению с ЦФ, однако при длительном наблюдении (12–18 месяцев) разницы в поддержании ремиссии между группами не обнаружено.
Многоцентровое рандомизированное плацебо-контролируемое исследование RITUXVAS (Rituximab versus Cyclophosphamide in ANCA-Associate Renal Vasculitis) сравнивало эффективность РТ в виде четырех инфузий по 375 мг/м2 с интервалом в 7 дней плюс ЦФ в дозе 15 мг/кг внутривенно во время первой и третьей инфузий РТ с ЦФ в дозе 15 мг/кг внутривенно длительностью 3–6 месяцев с переходом на АЗ у 44 больных с впервые диагностированным АНЦА-ассоциированным васкулитом c поражением почек (МПА : ГПА = 1 : 1). Все больные получали пульс-терапию ГК (метилпреднизолон в дозе 1000 мг внутривенно № 1–3) с последующей поддерживающей дозой ГК 1 мг/кг в сутки и постепенным уменьшением дозы до 5 мг к 6-му месяцу. Первичная конечная точка — поддержание ремиссии (BVAS = 0) на протяжении не менее 6 месяцев. Наблюдение за больными проводили в течение 12 месяцев.
По результатам данного исследования, 76 % больных группы РТ плюс ЦФ и 83 % группы ЦФ достигли первичной конечной точки на 12-м месяце (р = 0,68). Побочные эффекты отмечались у 42 % больных группы РТ и у 36 % больных контрольной группы (p = 0,77). Частота смертности в обеих группах не отличалась и составляла 18 %. Среднее увеличение СКФ с 0–го до 12–го месяца составило 19 мл/мин в группе РТ и 15 мл/мин в контрольной группе (р = 0,14) (рис. 6).
/89/89_2.jpg)
Таким образом, у больных с АНЦА-ассоциированными васкулитами с поражением почек терапия РТ не превосходит по эффективности стандартный режим внутривенного введения ЦФ. В обеих группах частота достигнутой ремиссии была высокой. Использование РТ не ассоциировалось с сокращением тяжелых побочных эффектов стандартной терапии.
Еще одно интересное ретроспективное исследование проведено J.U. Holle et al. [18] относительно сравнения влияния РТ на гранулематозные и васкулитные проявления у 59 больных с рефрактерным течением ГПА со средним значением BVAS до использования анти-В-клеточной терапии 16 баллов. Все больные до назначения РТ получали ЦФ, около 30 % проходили лечение ингибиторами ФНО-a или МТ, 18 % — ингибиторами ФНО-a плюс ЦФ. Во втором курсе РТ нуждались 12 человек, в третьем — только 4 человека.
Полная ремиссия была достигнута у 9,3 % больных. Ответ на лечение зафиксирован у 61,3 % (улучшение — у 52 %, отсутствие изменений активности заболевания — у 9,3 %), 26,7 % имели рефрактерное течение болезни. Индекс BVAS, уровень СОЭ, С-реактивного белка и доза преднизолона значительно снизились. У всех больных отмечали деплецию B-клеток. Такие гранулематозные проявления, как орбитальные гранулемы и пахименингит, были чаще рефрактерны к терапии РТ в сравнении с васкулитными или другими гранулематозными проявлениями (рис. 7). Так, например, полная ремиссия/улучшение была обнаружена у 89,2 % больных с заболеваниями почек и только у 44,4 % — с орбитальными массами (р = 0,003).Частота рецидивов в данном исследовании составляла 44,4 %, в среднем через 13,5 месяца.
Данное неконтролируемое ретроспективное исследование подтверждает хорошую общую эффективность РТ у больных с рефрактерным ГПА (у 61,3 % — полная ремиссия или улучшение, 9,3 % — стабилизация заболевания, 26,7 % — рефрактерное течение). Однако есть существенные различия во влиянии РТ на васкулитные и гранулематозные проявления. Последние, особенно орбитальные массы, значительно хуже поддаются лечению.
В апреле 2011 года РТ был одобрен FDA для лечения АНЦА-ассоциированных васкулитов. В настоящее время препарат зарегистрирован для лечения ГПА и МПА и в Украине.
В 2011 году группа экспертов в области ревматологии из Европы разработала Рекомендации (консенсус) по применению РТ при АНЦА-ассоциированных васкулитах [26], основные положения которых приведены в табл. 4.
В качестве иллюстрации приводим собственное клиническое наблюдение применения РТ у больной с рефрактерным течением ГПА.
Больная Т., 54 лет, заболела 3 года назад, когда впервые появились отек и боль в мелких суставах кистей, был установлен диагноз ревматоидного артрита. С того времени принимала плаквенил в дозе 200 мг в сутки. На фоне приема плаквенила сохранялся суставной синдром. Через 6 месяцев у больной возникли ринит, синусит, пульмонит, эписклерит и сохранялся полиартрит. Лабораторно, кроме повышения острофазовых показателей (скорости оседания эритроцитов — до 44 мм/ч, С-реактивного белка — до 96 мг/дл), умеренного лейкоцитоза и анемии, были обнаружены высокие титры антител к ПР3 (ц-AНЦА) при нормальных значениях антител к МП (п-АНЦА), что в совокупности с клиническими данными послужило основанием для установления диагноза гранулематоза Вегенера. Активность заболевания была оценена в 13 баллов по шкале клинической активности васкулита BVAS, и назначены ЦФ по 200 мг внутримышечно 2 раза в неделю и ГК в дозе 30 мг/сут по преднизолону перорально с положительным эффектом.
Однако в августе 2011 года после инсоляции на фоне снижения дозы ГК (до 15 мг/сут) у больной повысилась температура тела до 38,3 °С, появились кашель и одышка при малейшей нагрузке, на рентгенограмме органов грудной клетки — признаки недеструктивного пульмонита в нижних долях легких. Кроме того, возобновились полиартралгии, симптомы ринита, синусита и ларингита (без визуализируемой деструкции), впервые возникли геморрагическинекротические папулезные высыпания на коже (разгибательные поверхности локтевых суставов и кисти), анемия и микрогематурия. Индекс BVAS составил 19 баллов. Больной была проведена пульстерапия солу-медролом по 500 мг в сутки внутривенно в течение 5 дней с переходом на пероральный прием преднизолона в дозе 45 мг. Все это время больная продолжала терапию ЦФ, проводились повторные курсы лечения бисептолом. После проведения пульс-терапии отмечалось быстрое и выраженное улучшение с регрессом всех клинических симптомов и лабораторных отклонений.
Через 3 месяца на фоне снижения дозы ГК (до 20 мг/сут) появилась гематурия при отсутствии других клинико-лабораторных признаков обострения заболевания, что потребовало исключения частого осложнения, возникающего при лечении ЦФ, — геморрагического цистита. Был назначен уромитексан (антидот метаболита ЦФ, оказывающего раздражающее действие на слизистую оболочку мочевого пузыря) в дозе 200 мг внутривенно струйно в дни приема ЦФ. Однако гематурия нарастала, при проведении цистоскопии патологических изменений слизистой мочевого пузыря не было обнаружено. В течение 2 недель у больной развернулась симптоматика обострения заболевания, проявлявшегося лихорадкой, пульмонитом, геморрагически-некротическими высыпаниями на коже, ринитом, синуситом, ларингитом, эписклеритом, гематурическим гломерулонефритом, анемией, впервые возникли сенсорная нейропатия большеберцового нерва справа и язва слизистой оболочки рта на границе твердого и мягкого неба. На это время BVAS составил 28 баллов.
Учитывая невозможность добиться стойкой ремиссии при лечении ЦФ и ГК, развитие обострений при каждой попытке снижения дозы ГК до приемлемой поддерживающей, увеличение частоты обострений с вовлечением новых органов и систем, в т.ч. угрожающее жизни поражение почек, после получения информированного согласия больной провели лечение РТ. Противопоказаний к назначению РТ (активная инфекция, тяжелая сердечная недостаточность) у больной не было. Схема назначения РТ: 2 инфузии по 500 и 1000 мг с интервалом в 2 недели. Для предотвращения развития синдрома высвобождения цитокинов за 30–60 мин до каждого введения РТ проводилась премедикация солу-медролом 125 мг внутривенно струйно и 1 мл 2% раствора супрастина внутримышечно. Кроме этого, больная продолжала получать ЦФ (в той же дозе) и ГК. Количественную оценку состояния больной проводили с использованием индексов BVAS и VDI.
Улучшение состояния больной (нормализация температуры тела, анализов мочи и крови, эпителизация язвы слизистой ротовой полости, полное обратное развитие проявлений со стороны кожи, легких и верхних дыхательных путей) отмечалось сразу после второй инфузии РТ и сохранялось в дальнейшем в течение полугода. Динамика лабораторных показателей и изменения фоновой терапии ГК отражены в табл. 5.
Среди побочных эффектов зафиксирован лишь эпизод активации хронической герпетической инфекции (H.zoster), с чем и было связано временное повышение СОЭ на 5-м месяце после первого курса РТ. Максимальное снижение уровня В-клеток (0,15 %) было зафиксировано через 3 мес. после начала лечения РТ, в тот же временной промежуток (3–5 мес.) регистрировался самый низкий уровень ц-AНЦА, п-AНЦA до и после лечения РТ не выявлялись.
По истечении 6,5 месяца после проведения первого курса лечения РТ у больной появились энантема с мелким очагом некроза на твердом небе, инъецированность сосудов слизистой оболочки глаз, единичные геморрагические папулы на локтях и эритроцитурия (10–12 в поле зрения). Индекс BVAS увеличился с 0 до 11 баллов. По времени это совпало с восстановлением уровня В-клеток (табл. 5). Отметим, что достигаемое одним курсом РТ истощение пула В-клеток сохраняется в среднем около 6 месяцев, поэтому инструкция по применению препарата при РА предполагает проведение двух курсов лечения в течение года. Вместе с тем у больной с РА после одного курса лечения мы наблюдали почти полное отсутствие клеток CD19+ и сохранение клинико-лабораторно-рентгенологической ремиссии в течение 2 лет [2, 4].
Описанная ситуация была расценена как начало рецидива ГПА, что послужило основанием для проведения повторного курса лечения РТ. Было проведено 2 инфузии РТ по 1000 мг с интервалом в 2 недели. После проведенного лечения снова достигнута клинико-лабораторная ремиссия со стойким исчезновением гематурии и клинических проявлений обострения васкулита. Через 2 месяца зарегистрированы наименьший за все время наблюдения уровень ц-АНЦА и полное отсутствие в периферической крови клеток CD19+ (табл. 6).
Как видно из динамики индекса BVAS (рис. 8), с первого месяца после начала иммунобиологической терапии и до развития рецидива, а также после второго курса лечения РТ состояние больной соответствовало критериям ремиссии (BVAS = 0). Нарастание количества обусловленных васкулитом необратимых повреждений (рост индекса VDI) наблюдалось только до начала иммунобиологической терапии, в дальнейшем не прослеживалось вовлечения новых органов и систем.
Уровень ц-АНЦА (рис. 9) имел тенденцию к снижению как на фоне базисной терапии ЦФ и ГК, так и на фоне добавления РТ. Однако только после второго цикла РТ отмечалась полная нормализация уровня ц-АНЦА.
При проведении второго курса анти-В-клеточной терапии плановая доза ГК не повышалась (за исключением периинфузионного периода), продолжено ее снижение. Более чем 2-летнее наблюдение за больной давало основания усомниться в эффективности и целесообразности дальнейшего применения ЦФ, в связи с чем его доза была сначала снижена на 50 %, а через 3 месяца препарат отменен. В дальнейшем в течение уже 1,5 года у больной сохраняется полная клинико-лабораторная ремиссия на фоне приема 4 мг медрола.
Таким образом, имеется достаточно патогенетических оснований для изучения эффективности применения иммунобио–логических препаратов при системных васкулитах. Ингибиторы ФНО не продемонстрировали значимых результатов при этих заболеваниях. Единственным препаратом с доказанной эффективностью при системных АНЦА-ассоциированных васкулитах является РТ. Основными достоинствами РТ являются следующие: при впервые диагностированном васкулите по способности индуцировать ремиссию не уступает ЦФ; в сравнении с ЦФ имеет лучший профиль безопасности; эффективен у больных с рефрактерными к традиционной терапии васкулитами.
Хотя еще не получены долгосрочные результаты иммунобиологической терапии системных васкулитов, имеющихся в настоящее время данных вполне достаточно для того, чтобы рассматривать применение РТ как оптимистичную альтернативу традиционной фармакотерапии АНЦА-ассоциированных васкулитов с тяжелым, рецидивирующим течением.
1. Насонов Е.Л. Васкулиты и васкулопатии / Е.Л. Насонов, А.А. Баранов, Н.П. Шилкина. — Ярославль: Верхняя Волга, 1999. — С. 611.
2. Яременко О.Б. Ефективність і переносимість імунобіологічної терапії у пацієнтів із ревматоїдним артритом / О.Б. Яременко, О.І. Івашківський, Д.Л. Федьков // Укр. ревматол. журн. — 2012. — № 1 (47). — С. 76–82.
3. Яременко О.Б. Иммунобиологическая терапия при ревматоидном артрите: новые технологии — новые возможности / О.Б. Яременко // Здоров’я України. — 2009. — № 10. — С. 57–59.
4. Яременко О.Б. Ревматоидный артрит: эра иммунобиологической терапии // Науковий вісник Національного медичного університету імені О.О. Богомольця. — 2009. — № 25. — С. 325–336.
5. Bartolucci P. Efficacy of the anti-TNF-alpha antibody infliximab against refractory systemic vasculitides: an open pilot study on 10 patients / P. Bartolucci, J. Ramanoelina, P. Cohen, A. Mahr, P. Godmer, C. Le Hello et al. // Rheumatology (Oxf). — 2002. — Vol. 1170. — P. 1126–1132.
6. Brihaye B. Adjunction of rituximab to steroids and immunosuppressants for refractory/relapsing Wegener’s granulomatosis: a study on 8 patients / B. Brihaye, A. Aouba, C. Pagnoux et al. // Clin. Exp. Rheumatol. — 2007. — Vol. 120. — P. 23–27.
7. Booth A. Prospective study of TNF alpha blockade with infliximab in anti-neutrophil cytoplasmic antibody-associated systemic vasculitis / A. Booth, L. Harper, T. Hammad, P. Bacon, M. Griffith, J. Levy et al. // J. Am. Soc. Nephrol. — 2004. — Vol. 820. — P. 717–721.
8. Booth A.D. Safety and efficacy of TNFalpha blockade in relapsing vasculitis / A.D. Booth, H.J. Jefferson, W. Ayliffe, P.A. Andrews, D.R. Jayne // Ann. Rheum. Dis. — 2002. — Vol. 720. — P. 559.
9. Brihaye B. Adjunction of rituximab to steroids and immunosuppressants for refractory/relapsing Wegener’s granulomatosis: a study on 10 patients / B. Brihaye, A. Aouba, C. Pagnoux et al. // Clin. Exp. Rheumatol. — 2009. — Vol. 134. — P. 28–30.
10. Eriksson P. Nine patients with anti–neutrophil cytoplasmic antibody-positive vasculitis successfully treated with rituximab / P. Eriksson // J. Intern. Med. — 2005. — Vol. 650. — P. 540–548.
11. Falk R.J. Anti-neutrophil cytoplasmic autoantibodies induce neutrophils to degranulate and produce oxygen radicals in vitro / R.J. Falk, R.S. Terrell, L.A. Charles, J.C. Jennette // Proc. Natl. Acad. Sci. — 1990. — Vol. 87. — P. 4115–4119.
12. Falk R.J. Granulomatosis with Polyangiitis (Wegener’s): An alternative name for Wegener’s Granulomatosis / R.J. Falk, W.L. Gross, L. Guillevin, G.S. Hoffman et al. // Arthritis. Rheum. — 2011. — Vol. 1120. — P. 863–864.
13. Ferraro A.J. Effective therapeutic use of rituximab in refractory Wegener’s granulomatosis / A.J. Ferraro, C.J. Day, M.T. Drayson, C.O. Savage // Nephrol. Dial. Transpl. — 2005. — Vol. 700. — P. 622–625.
14. Flossman O. Long term patient survival in ANCA associated vasculitis / O. Flossman, A. Berden, K. de Groot et al. // Ann. Rheum. Dis. — 2011. — Vol. 750. — P. 488–494.
15. Fujimoto S. Comparison of the epidemiology of antineutrophil cytoplasmic antibody (ANCA)–associated vasculitis between Japan and UK / S. Fujimoto, R.A. Watts, S. Kobayashi, K. Suzuki, D.R.W. Jayne, G.D.I. Scott, H. Hashimoto, H. Nunoi // Rheumatology. — 2011. — Vol. 2010. — P. 1916–1920.
16. Gross W.L. Immunopathology and newtherapeutic considerations in ANCA-associated vasculitides / Gross W.L. // Autoimmun. Rev. — 2004. — Vol. 120. — P. 47–48.
17. Harper L. Pathogenesis of ANCA-associated systemic vasculitis / L. Harper, С. Savage // J. Pathol. — 2000. — Vol. 190. — P. 149–59.
18. Holle J.U. Rituximab for refractory granulomatosis with polyangiitis (Wegener’s granulomatosis): comparison of efficacy in granulomatous versus vasculitic manifestations / J.U. Holle, C. Dubrau, K. Herlyn et al. // Ann. Rheum. Dis. — 2012. — Vol. 71. — P. 327–333.
19. Jennette J.C. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides / J.C. Jennette, R.J. Falk, P.A. Bacon et al. // Arthritis & Rheumatism. — 2013. — Vol. 65. — P. 1–11.
20. Jones R.B. Rituximab versus cyclophosphamide in ANCA–associated renal vasculitis / R.B. Jones, J.W. Tervaert, T. Hauser et al. // N. Engl. J. Med. — 2010. — Vol. 363. — P. 211–220.
21. Keogh K.A. Induction of remission by B lymphocyte depletion in eleven patients with refractory antineutrophil cytoplasmic antibody-associated vasculitis / K.A. Keogh, M.E. Wylam, J.H. Stone, U. Specks // Arthritis Rheum. — 2005. — Vol. 352. — P. 262–268.
22. Keogh K.A. Rituximab for refractory Wegener’s granulomatosis: report of a prospective, open-label pilot trial / K.A. Keogh, S.R. Ytterberg, F.C. Fervenza et al. // Am. J. Respir. Crit. Care Med. — 2006. — Vol. 193. — P. 180–187.
23. Lamprecht P. Effectiveness of TNF-alpha blockade with infliximab in refractory Wegener’s granulomatosis / P. Lamprecht, J. Voswinkel, T. Lilienthal, B. Nolle, M. Heller, W.L. Gross et al. // Rheumatology (Oxf). — 2002. — Vol. 1500. — P. 1303–1307.
24. Laurino S. Prospective study of TNFalpha blockade with adalimumab in ANCA-associated systemic vasculitis with renal involvement / S. Laurino, A. Chaudhry, A. Booth, G. Conte, D. Jayne // Nephrol. Dial. Transpl. — 2010. — Vol. 360. — P. 307–314.
25. Maloney D. IDEC-C2B8 (Rituximab) anti-CD20 monoclonal antibody therapy in patients with relapsed low-grade non-Hodgkin’s lymphoma / D.G. Maloney, A.J. Grillo-Lopez, C.A. White et al. // Blood. — 1997. — Vol. 3200. — P. 2188–2195.
26. Guerry M.-J.C.J. Recommendations for the use of rituximab in anti-neutrophil cytoplasm antibody-associated vasculitis / P. Brogan et al. // Rheumatology (Oxford). — 2011. — Vol. 680. — P. 634–643.
27. Morgan M.D. Addition of infliximab to standard therapy for ANCA-associated vasculitis / M.D. Morgan, M.T. Drayson, C.O. Savage, L. Harper // Nephron. Clin. Pract. — 2011. — Vol. 117. — P. 89–97.
28. Mukhtyar C. EULAR recommendations for the management of primary small and medium vasculitis / C. Mukhtyar, L. Guillevin, M. Cid et al. // Ann. Rheum. Dis. — 2009. — Vol. 750. — P. 307–310.
29. Mukhtyar C. Modification and validation of the Birmingham vasculitis activity score (Version 3) / C. Mukhtyar, R. Lee, D. Brown et al. // Ann. Rheum. Dis. — 2009. — Vol. 68. — P. 1827–1832.
30. Ntatsaki E. Epidemiology of ANCA-associated vasculitis / E. Ntatsaki, R.A. Watts, D.G. Scott // Rheum. Dis. Clin. North Am. — 2010. — Vol. 565. — P. 447–461.
31. Omdal R. Anti-CD20 therapy of treatment-resistant Wegener’s granulomatosis: favourable but temporary response / R. Omdal, K. Wildhagen, T. Hansen, R. Gunnarsson, G. Kristoffersen // Scand. J. Rheumatol. — 2005. — Vol. 285. — P. 229–232.
32. Savage C.O. Pathogenesis of anti–neutrophil cytoplasmic autoantibody (ANCA)-associated vasculitis / C.O. Savage // Clin. Exp. Immunol. — 2011. — Vol. 164. — P. 23–26.
33. Shlomchik M.J. From T to B and back again: positive feedback in systemic autoimmune disease / M.J. Shlomchik, J.E. Craft, M.J. Mamula // Nat. Rev. Immunol. — 2001. — Vol. 200. — P. 147–153.
34. Smith K.G. et al. Long–term comparison of rituximab treatment for refractory systemic lupus erythematosus and vasculitis: remission, relapse, and re- treatment / K.G. Smith, R.B. Jones, S.M. Burns, D.R. Jayne // Arthritis Rheum. — 2006. — Vol. 3000. — P. 2970–2982.
35. Stasi R. Long-term observations of patients with anti-neutrophil cytoplasmic antibody–associated vasculitis treated with rituximab / R. Stasi, E. Stipa, G. Del Poeta, S. Amadori, A.C. Newland // Rheumatology (Oxf). — 2006. — Vol. 1500. — P. 1432–1436.
36. Stone J.H. Etanercept plus standard therapy for Wegener’s granulomatosis / Stone J.H. et al. The Wegener’s Granulomatosis Etanercept (WGET) Research Group // N. Engl. J. Med. — 2005. — Vol. 380. — P. 351–361.
37. Stone J.H. Rituximab versus cyclophosphamide for ANCA-associated vasculitis / J.H. Stone, P.A. Merkel, R. Spiera et al. // N. Engl. J. Med. — 2010. — Vol. 363. — P. 221–232.
38. Tamura N. Two cases of refractory Wegener’s granulomatosis successfully treated with rituximab / N. Tamura, R. Matsudaira, M. Hirashima et al. // Intern. Med. — 2007. — Vol. 46. — P. 40.
39. Voswinkel J. B lymphocyte maturation in Wegener’s granulomatosis: a comparative analysis of VH genes from endonasal lesions / J. Voswinkel, A. Mueller, J.A. Kraemer, P. Lamprecht, K. Herlyn, K. Holl-Ulrich, A.C. Feller, S. Pitann, A. Gause, W.L. Gross // Ann. Rheum. Dis. — 2006. — Vol. 1200. — P. 859–864.
40. Watts R.A. Epidemiology of vasculitis / R.A. Watts, D.G.I. Scott // Vasculitis. 2nd ed. — Oxford: Oxford University Press, 2008. — P. 7–22.
41. Wilde B. New pathophysiological insights and treatment of ANCA-associated vasculitis / B. Wilde, P. Paassen, O. Witzke, J. Tervaert // Kidney International. — 2011. — Vol. 59. — P. 599–612.

/84/84.jpg)
/85/85.jpg)
/85/85_2.jpg)
/86/86.jpg)
/88/88.jpg)
/89/89.jpg)
/90/90.jpg)
/92/92_2.jpg)
/92/92.jpg)