Журнал «Медицина неотложных состояний» 3 (58) 2014
Вернуться к номеру
Антибактеріальна терапія госпітальних пневмоній
Авторы: Недашківський С.М. - Національна медична академія післядипломної освіти імені П.Л. Шупика; Бабак С.І. - Комунальний заклад Київської обласної ради «Київська обласна клінічна лікарня»; Галушко О.А. - Національна медична академія післядипломної освіти імені П.Л. Шупика
Рубрики: Семейная медицина/Терапия, Медицина неотложных состояний, Пульмонология
Разделы: Клинические исследования
Версия для печати
З метою аналізу ефективності й безпечності лінезоліду при лікуванні госпітальної пневмонії було проведено дослідження, що охопило загалом 32 пацієнти, у яких перебіг захворювання давав підстави підозрювати одним із можливих збудників MRSA. Залежно від застосованої антибактеріальної пневмонії пацієнти були рандомізовані на дві групи: 1-ша — 16 пацієнтів, які отримували внутрішньовенно лінезолід 600 мг кожні 12 годин. У цих пацієнтів використовували препарат українського виробництва — Лінелід®; 2-га — 16 пацієнтів, які отримували ванкоміцин 15 мг/кг кожні 12 год. Було встановлено, що застосування лінезоліду у хворих на госпітальну пневмонію, викликану MRSA, сприяло більш вираженому клінічному покращенню та більш швидкому поліпшенню стану хворих порівняно з ванкоміцином. Використання Лінеліду® виявилось ефективним і не супроводжувалося виникненням клінічно значущих побічних реакцій.
С целью анализа эффективности и безопасности линезолида при лечении госпитальной пневмонии было проведено исследование, охватившее в целом 32 пациента, у которых лечение заболевания давало основания подозревать в качестве одного из возможных возбудителей MRSA. В зависимости от применяемой антибактериальной пневмонии пациенты были рандомизированы на две группы: 1-я — 16 пациентов, которые получали внутривенно линезолид 600 мг каждые 12 часов. У этих пациентов использовали препарат линезолида украинского производства — Линелид®; 2-я — 16 пациентов, которые получали ванкомицин 15 мг/кг каждые 12 ч. Было установлено, что применение линезолида у больных госпитальной пневмонией, вызванной MRSA, способствовало более выраженному клиническому улучшению и более быстрому улучшению состояния больных в сравнении с ванкомицином. Использование Линелида® оказалось эффективным и не сопровождалось возникновением клинически значимых побочных реакций.
To analyze the efficacy and safety of linezolid in the treatment of nosocomial pneumonia there was conducted a study involved 32 patients as a whole, in which treatment of the disease gave reason to suspect MRSA as one of the possible pathogens. Depending on the applied antibiotic therapy patients were randomized into two groups: 1st one — 16 patients who received intravenous linezolid 600 mg every 12 hours. In these patients we used the linezolid preparation of Ukrainian production — Linelid; 2nd one — 16 patients who received vancomycin 15 mg/kg every 12 hours. It is found that the use of linezolid in patients with nosocomial pneumonia, caused by MRSA, promotes more pronounced clinical improvement and a more rapid improvement of the patients’ state compared with vancomycin. Use of Linelid was effective and was not accompanied by clinically significant adverse reactions.
пневмонія госпітальна, MRSA, ванкоміцин, лінезолід, Лінелід®.
пневмония госпитальная, MRSA, ванкомицин, линезолид, Линелид®.
nosocomial pneumonia, MRSA, vancomycin, linezolid, Linelid.
Статья опубликована на с. 121-125
Госпітальна (нозокоміальна) пневмонія (ГП) — захворювання, що характеризується появою на рентгенограмі нових вогнищево–інфільтративних змін у легенях через 48 год і більше після госпіталізації в поєднанні з клінічною симптоматикою, яка підтверджує їх інфекційну природу (нова хвиля лихоманки, гнійне харкотиння або гнійне виділення із трахеобронхіального дерева, лейкоцитоз тощо), при виключенні інфекцій, що знаходилися в інкубаційному періоді на момент надходження хворого до стаціонару.
Критерієм класифікації ГП є термін розвитку захворювання, наявність чи відсутність факторів ризику її розвитку. За цією класифікацією виділяють такі види ГП:
— рання ГП виникає протягом перших 5 днів з моменту госпіталізації й зумовлена збудниками, які були у хворого ще до надходження до стаціонару, та іншими представники нормальної мікрофлори порожнини ротоглотки. Найчастіше ці збудники є чутливими до антимікробних препаратів, що традиційно використовуються, а пневмонія має сприятливіший прогноз;
— пізня ГП розвивається не раніше 6-го дня госпіталізації і спричинена власне госпітальною мікрофлорою з більш високим ризиком наявності високовірулентних і полірезистентних збудників. Така ГП характеризується менш сприятливим прогнозом.
До числа формалізованих діагностичних критеріїв ГП відносять:
а) появу на рентгенограмі нових вогнищево-інфільтративних змін у легенях;
б) дві з наведених нижче ознак:
— температура тіла вище від 38,3 °C;
— бронхіальна гіперсекреція;
— PaO2/FiO2 менше від 240;
— кашель, тахіпное, локальна крепітація, вологі хрипи, бронхіальне дихання;
— кількість лейкоцитів у крові менше від 4,0 • 109/л чи більше від 12,0 • 109/л, паличко-ядерний зсув більше ніж 10 %;
— гнійне мокротиння/бронхіальний секрет (більше ніж 25 поліморфноядерних лейкоцитів у полі зору при мікроскопії з малим збільшенням).
Особливості ГП із різними причинами розвитку:
— інфекційне ураження легень, що виникає й розвивається під час перебування хворих у стаціонарах з іншого приводу протягом 48 год після їх госпіталізації; вони становлять близько 15–18 % від усіх нозокоміальних інфекцій; смертність дуже висока і становить 50–70 %;
— вентилятор-асоційована пневмонія, що розвивається через ≥ 48 год після проведення штучної вентиляції легень (ШВЛ), є частим ускладненням цього виду терапії;
— пневмонії виникають також у разі внутрішньолікарняного інфікування при інтубації трахеї, тривалому лікуванні антибіотиками, оперативних втручаннях, хірургічних, урологічних, стоматологічних маніпуляціях. При цьому пацієнти, ослаблені внаслідок основного захворювання, інфікуються малопатогенною для здорових людей інфекцією;
— домінуючими етіологічними факторами ГП є стафілокок та грамнегативні мікроорганізми (клебсієла, протей, ентеробактерії, псевдомонас, кишкова паличка), а також грибкова флора;
— джерелами інфікування у стаціонарі можуть бути: повітря (аспергіли), вода (легіонела), бактеріоносійство медичного персоналу (стафілокок), медичні інструменти та устаткування (катетери, бронхоскопи, ендотрахеальні трубки, лікарняне сміття) [3].
Діагноз ГП — безумовне показання для застосування антибіотиків, які є основою лікування у таких хворих. Антибактеріальне лікування необхідно починати одразу після встановлення діагнозу. Абсолютно неприйнятним є зволікання з терміновим призначенням антибіотиків пацієнтам із тяжким перебігом захворювання через відсутність результатів бактеріоскопії й засіву мокротиння, оскільки затримка введення першої дози антибіотика на 4 год зумовлює значне підвищення ризику смерті таких хворих. Найважливішим фактором підвищення виживання хворих на ГП є своєчасне призначення адекватної антибіотикотерапії.
Найбільш виправданим підходом до емпіричної антибіотикотерапії хворих на ГП є лікування залежно від термінів виникнення пневмонії (рання, пізня) та наявності модифікуючих факторів ризику інфікування полірезистентними штамами мікроорганізмів.
У хворих на ранню ГП без факторів ризику наявності полірезистентних штамів збудників найбільш ймовірними збудниками захворювання можуть бути S.pneumoniae, H.influenzae, S.aureus (MSSA), грамнегативні бактерії кишкової групи зі звичайною чутливістю до антибіотиків: E.coli, K.pneumoniae, Enterobacter spp. Proteus spp., S.marcescens. Для лікування цих хворих використовують: цефтріаксон, або фторхінолон III–IV покоління, або ампіцилін/сульбактам, або меропенем.
У хворих на ранню ГП із факторами ризику наявності полірезистентних штамів збудників та пізню ГП найбільш ймовірними збудниками захворювання можуть бути грамнегативні бактерії (P.aeruginosa, K.pneumoniae (продуценти ESBL), Acinetobacter spp. L.pneumophila) або грампозитивні коки, резистентні до метициліну, — S.aureus (MRSA). Для лікування цих хворих використовують: цефалоспорини з антисиньогнійною активністю (цефепім, цефтазидим), або карбапенеми (іміпенем, меропенем), або захищені бета-лактами (піперацилін/тазобактам) у поєднанні з фторхінолоном з антисиньогнійною активністю або аміноглікозидом (амікацин, гентаміцин, тобраміцин), а також із лінезолідом або ванкоміцином (за наявності факторів ризику MRSA чи високої частоти нозокоміальних інфекцій у даному стаціонарі).
Принципи емпіричної антибактеріальної терапії госпітальної пневмонії
При виборі стартового режиму антибактеріальної терапії ГП слід враховувати:
а) ступінь тяжкості пневмонії, що оцінюється залежно від об’єму ураження легеневої тканини й наявності ускладнень. Критеріями тяжкого перебігу ГП вважають:
— дихальну недостатність, що потребує проведення ШВЛ;
— швидке прогресування пневмонії за даними рентгенологічного дослідження;
— багаточасточкове ураження або деструкцію;
— тяжкий сепсис із розвитком шоку або з проявами дисфункції (недостатності) органів та систем [7];
б) стан макроорганізму, що визначає ефективність реагування на інфекцію і значною мірою впливає на наслідки захворювання.
При виборі режиму емпіричної антибактеріальної терапії необхідно враховувати фактори, що збільшують ризик несприятливого (летального) наслідку ГП [4]. До них відносять:
— тяжкий, ускладнений перебіг пневмонії;
— прихований та малосимптомний варіанти перебігу ГП;
— значні зміни в легенях, обумовлені основним і супутніми захворюваннями;
— набряк легень;
— лихоманка вище від 38 °С на фоні антибактеріальної терапії;
— застосування глюкокортикоїдів на фоні пневмонії;
— гемоглобін нижче від 115 г/л;
— загальний білок нижче від 60 г/л;
— кровоточивість або ДВЗ-синдром;
— інфекційно-токсичний шок;
— сепсис;
— ниркова недостатність;
— порушення свідомості.
У хворих із наявністю факторів, що збільшують ризик інфікування резистентною мікрофлорою та ризик летального наслідку, для терапії ГП доцільно одразу використовувати найбільш інтенсивні режими антибактеріальної терапії.
При тяжкому перебігу ГП Американське торакальне товариство [7] рекомендує у стартову антибактеріальну терапію включати аміноглікозиди або фторхінолони ІІІ–ІV поколінь + один з указаних нижче препаратів: антисиньогнійні пеніциліни, інгібіторзахищені пеніциліни, карбапенеми, азтреонам. До даної комбінації з 2 антибіотиків може бути одразу доданий ванкоміцин (при підозрі на MRSA).
При високій вірогідності етіологічної ролі MRSA або при неефективності зазначеної вище терапії додаються оксазолідинони, головним представником яких є лінезолід.
Лінезолід є синтетичним антибіотиком, що був упроваджений у клінічну практику у 2000 році для лікування інфекцій, викликаних резистентними грампозитивними мікроорганізмами, тобто MRSA, пеніцилінрезистентним пневмококом та VRE (ванкоміцин-резистентним ентеробактером) [2]. Він належить до нового класу протимікробних препаратів — оксазолідинонів. In vitro активний проти аеробних грампозитивних, деяких грамнегативних бактерій та анаеробних мікроорганізмів.
Лінезолід селективно пригнічує синтез білків у бактеріальних клітинах шляхом унікального механізму дії. Зокрема, він зв’язується з ділянкою на бактеріальній рибосомі (23S субодиниця з 50S) та перешкоджає утворенню функціонального 70S ініціюючого комплексу, який є важливим компонентом процесу трансляції.
До лінезоліду чутливі такі мікроорганізми: грампозитивні аероби — Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus; коагулазонегативні стафілококи — Streptococcus agalactiae, Streptococcus pneumoniae, Streptococcus pyogenes, стрептококи групи С, стрептококи групи G; грампозитивні анаероби — Clostridium perfringens, Peptostreptococcus anaerobius, Peptostreptococcus sрp. тощо.
Хоча він призначений для випадків, коли неефективний ванкоміцин, лінезолід останнім часом розглядається як можлива заміна ванкоміцину. В оксазолідинонів такий же спектр дії, як у ванкоміцину. Доведено, що вони є ефективними для лікування MRSA-інфекцій. Крім того, до переваг лінезоліду слід віднести те, що він проникає у харкотиння, а ванкоміцин — ні [1].
Мета дослідження — проаналізувати ефективність і безпечність лінезоліду порівняно з ванкоміцином при лікуванні госпітальної пневмонії.
Матеріал та методи
У дослідження були включені 32 пацієнти, із них 19 чоловіків та 13 жінок, віком від 18 до 64 років (середній вік — 48,5 ± 3,6 року), з документованим діагнозом госпітальної пневмонії, які знаходились на стаціонарному лікуванні у відділенні інтенсивної терапії КЗ КОР «Київська обласна клінічна лікарня». Діагноз встановлювали на підставі результатів клінічного обстеження, даних рентгенографії органів грудної клітки, загальноклінічних та біохімічних аналізів крові з урахуванням критеріїв і рекомендацій Наказу МОЗ № 128 від 19.03.2007 [5]. У всіх пацієнтів перебіг захворювань давав підстави підозрювати одним із можливих збудників MRSA.
Залежно від застосованої антибактеріальної пневмонії пацієнти були рандомізовані на дві групи. До першої ввійшли 16 пацієнтів, які отримували внутрішньовенно лінезолід 600 мг кожні 12 годин. У цих пацієнтів ми використовували вітчизняний препарат лінезоліду — Лінелід®. У 2-гу — 16 пацієнтів, які отримували ванкоміцин 15 мг/кг кожні 12 год. Тривалість антибактеріальної терапії в обох групах становила 7–14 днів.
У комплексному лікуванні застосовували також муколітичні, відхаркувальні засоби, протизапальну та інфузійну детоксикаційну терапію, за потреби — респіраторну підтримку.
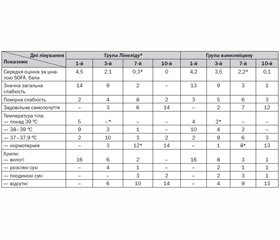
Ефективність лікування оцінювали за динамікою клінічних показників: стійка нормалізація температури тіла протягом 3–4 днів, зникнення клінічної та/або відчутна регресія рентгенологічної симптоматики, зниження вираженості ознак системної запальної відповіді. Для оцінки динаміки та вираженості ознак поліорганної дисфункції, пов’язаної з інфекційним процесом, використовували бальну оцінку за шкалою Sepsis-related Organ Failure Assessment score — SOFA (табл. 1).
Результати та їх обговорення
У більшості пацієнтів обох груп дослідження досягнуто покращення клініко–біохімічних показників протягом лікування. Так, у 14 пацієнтів із 16 у групі Лінеліду® (87,5 %) та в 11 пацієнтів із 16 у групі ванкоміцину (68,75 %) було досягнуто клінічне покращення на момент завершення дослідження (різниця між групами виявилася вірогідною, р = 0,037). Динаміка основних клінічних показників на етапах лікування відображена у табл. 2.
Мікробіологічні результати відповідали клінічним ефектам, ерадикація MRSA на момент закінчення лікування лінезолідом спостерігалася на 26 % частіше, ніж при лікуванні ванкоміцином. Нефротоксичність у групі ванкоміцину реєструвалася частіше, ніж при використанні лінезоліду (18,75 проти 6,25 % відповідно, p < 0,01).
На 10-й день хворим проводили повторні рентгенологічні дослідження. У 30 пацієнтів (93,75 %) обох груп інфільтративних змін в легенях не виявлено, у 2 хворих із тяжким перебігом ГП ознаки інфільтрації залишались і зникли лише через 21 день після початку лікування.
Переносимість лікування обома препаратами була задовільною, у жодного пацієнта групи Лінеліду® не виявлено побічних реакцій, які зумовили б необхідність зміни препарату.
В обговоренні результатів дослідження слід додати, що високий ризик розвитку ниркової недостатності при лікуванні ванкоміцином є вагомим аргументом на користь призначення лінезоліду, враховуючи також продемонстровану під час проведеного дослідження високу клінічну та мікробіологічну ефективність лінезоліду. Крім того, слід врахувати, що значна кількість пацієнтів із ГП та вентилятор-асоційованою пневмонією отримують аміноглікозиди як емпіричну або етіотропну терапію, що також може привести до розвитку ниркової недостатності. Сучасні рекомендації Американського товариства з інфекційних хвороб та Американського торакального товариства урівнюють лінезолід і ванкоміцин за ефективністю, однак перевага віддається лінезоліду у випадках вже наявної ниркової недостатності або у випадку резистентності збудників до ванкоміцину. Враховуючи викладене вище та результати проведеного дослідження, можемо констатувати, що застосування лінезоліду має переваги перед використанням ванкоміцину у деяких клінічних ситуаціях при лікуванні хворих на госпітальну пневмонію.
Висновки
1. Застосування лінезоліду у хворих на госпітальну пневмонію, викликану MRSA, сприяло більш вираженому клінічному покращенню та більш швидкому поліпшенню стану хворих порівняно з ванкоміцином.
2. Використання Лінеліду® (лінезолід виробництва фармацевтичної корпорації «Юрія-Фарм») виявилось ефективним і не супроводжувалося виникненням клінічно значущих побічних реакцій.
1. Марино Пол Л. Интенсивная терапия: Пер. с англ. / Под общ. ред. А.П. Зильбера. — М.: ГЭОТАР–Медиа, 2010. — 768 с.
2. Birmingham M.C. et al. Linezolid for the treatment of multidrug-resistant gram-positive infections: experience from a compassionate use program // Clin. Infect. Dis. — 2003. — Vol. 36. — Р. 159–164.
3. Денисюк В.І., Денисюк О.В. Пневмонії: сучасні стандарти діагностики та лікування // Укр. мед. часопис. — 2010. — 3(77). — С. 75–80.
4. Сидоренко С.В. Эмпирическая терапия госпитальных инфекций: желания и возможности // Клиническая фармакология и терапия. — 1998. — 2. — 11–13.
5. МОЗ України. Наказ № 128 від 19.03.2007 р. «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Пульмонологія». — Київ, 2007. — 36 с.
6. Яковлев С.В., Яковлев В.П. Современная антимикробная терапия // Consilium medicum. — 2005. — 1. — 50–70.
7. Hospital-acquired pneumonia in adults: diagnosis, assessment of severity, initial antimicrobial therapy, and preventive strategies. A consensus statement // Am. J. Respir. Crit. Care Med. — 1995. — 153. — 1711–1725.

/123/123.jpg)
/124/124.jpg)