Журнал «Здоровье ребенка» 3 (54) 2014
Вернуться к номеру
Роль TLR4, NLRC1/NOD1 та NF-κB у розвитку запалення слизової оболонки шлунка при хелікобактерній інфекції у дітей
Авторы: Абатуров О.Є., Герасименко О.М. - Державний заклад «Дніпропетровська медична академія Міністерства охорони здоров’я України»
Рубрики: Гастроэнтерология, Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Метою дослідження було вивчення ролі TLR4, NLRC1/NOD1 та NF-κB у розвитку запалення слизової оболонки шлунка (СОШ) у дітей, хворих на хронічні запальні Н.pylori-асоційовані захворювання гастродуоденального відділу травного тракту.
Методи. Під спостереженням перебувало 128 дітей із хронічними гастродуоденальними захворюваннями в стадії загострення: 70 (54,7 %) дітей (середній вік 14,04 ± 0,34 року), які інфіковані Н.pylori, та 58 (45,3 %) пацієнтів, у яких Н.pylori був відсутнім (середній вік 14,12 ± 0,43 року). Використовувались молекулярно-генетичні методи для визначення рівня експресії TLR4, NLRC1/NOD1 у біоптаті СОШ та NF-κB у лімфоцитах периферичної крові.
Результати. Доведено, що у пацієнтів, інфікованих Н.pylori, відзначається підвищення рівня експресії як гена TLR4, так і гена NLRC1/NOD1 в біоптаті СОШ при зниженні активності експресії фактора транскрипції NF-κB у лімфоцитах на відміну від дітей, захворювання яких не було пов''язане з інфікуванням Н.pylori. Показано, що у дітей, інфікованих CagA(+)-штамами Н.pylori, реєструвалась вірогідно більш низька активність експресії тільки фактора транскрипції NF-κB у лімфоцитах периферичної крові. Запропоновано модель участі неспецифічних механізмів уродженого імунітету у розвитку хронічного запального процесу слизової оболонки гастродуоденального відділу травного тракту у дітей при інфікуванні CagA(+)- і CagA(–)-штамами Н.pylori.
Целью исследования было изучение роли TLR4, NLRC1/NOD1 и NF-κB в развитии воспаления слизистой оболочки желудка (СОЖ) у детей с хроническими воспалительными Н.pylori-ассоциированными заболеваниями гастродуоденального отдела пищеварительного тракта.
Методы. Под наблюдением находилось 128 детей с хроническими гастродуоденальными заболеваниями в стадии обострения: 70 (54,7 %) детей (средний возраст 14,04 ± 0,34 года), инфицированных Н.pylori, и 58 (45,3 %) пациентов, у которых Н.pylori не определялся (средний возраст 14,12 ± 0,43 года). Использовались молекулярно-генетические методы для определения уровня экспрессии TLR4, NLRC1/NOD1 в биоптате СОЖ и NF-κB в лимфоцитах периферической крови.
Результаты. Показано, что у пациентов, инфицированных Н.pylori, отмечается повышение уровня экспрессии как гена TLR4, так и гена NLRC1/NOD1 в биоптате СОЖ при снижении активности экспрессии фактора транскрипции NF-κB в лимфоцитах в отличие от детей, заболевание которых не было связано с инфицированием Н.pylori. У детей, инфицированных CagA(+)-штаммами Н.pylori, регистрировалась достоверно более низкая активность экспрессии только фактора транскрипции NF-κB в лимфоцитах периферической крови. Предложена модель участия неспецифических механизмов врожденного иммунитета в развитии хронического воспалительного процесса слизистой оболочки гастродуоденального отдела пищеварительного тракта у детей при инфицировании CagA(+)- и CagA(–)-штаммами Н.pylori.
The aim of the work was to study the role of TLR4, NLRC1/NOD1 and NF-κB in inflammation of gastric mucosa (GM) in children with chronic inflammatory H.pylori-associated gastroduodenal diseases of the intestinal tract.
Methods. We observed 128 children with chronic gastroduodenal diseases in the acute stage: 70 (54.7 %) children (mean age 14.04 ± 0.34 years) infected with H.pylori, and 58 (45.3 %) — in which H.pylori was not detected (mean age 14.12 ± 0.43 years). We used molecular genetic methods to determine the level of TLR4, NLRC1/NOD1 expression if biopsy material of GM and NF-κB in peripheral blood lymphocytes.
Results. It is shown that patients infected with H.pylori show increased level of both TLR4 gene and NLRC1/NOD1 expression in biopsy material of GM at reducing activity of transcription factor NF-κB expression in lymphocytes, unlike children, whose disease was not associated with H.pylori infection. In children infected with CagA(+)-strains of H.pylori we detected significantly lower activity of expression only of the transcription NF-κB in peripheral blood lymphocytes. We propose a model of participation of non-specific mechanisms of innate immunity in the development of chronic inflammation of the gastric mucosa of gasrtoduodenal part of the intestinal tract in children infected with CagA(+)- and CagA(–)-strains of H.pylori.
Helicobacter pylori, вроджений імунітет, TLR4, NLRC1/NOD1, NF-κB, діти.
Helicobacter pylori, врожденный иммунитет, TLR4, NLRC1/NOD1, NF-κB, дети.
Helicobacter pylori, innate immunity, TLR4, NLRC1/NOD1, NF-κB, children.
Статья опубликована на с. 74-79
Вступ
Імунна система реалізує реакцію макроорганізму на впровадження інфекційних агентів, використовуючи вроджені й адаптивні механізми захисту. Еволюційно більш давні вроджені механізми захисту макроорганізму відрізняються швидкою, але неспецифічною відповіддю на дію патогенів. Адаптивні механізми захисту розпізнають специфічні антигени патогену і характеризуються наявністю імунологічної пам’яті.
При інфікуванні Helicobacter pylori (H.pylori) реакція вродженої та адаптивної імунної систем призводить до розвитку процесу запалення СОШ і ерадикації збудника [6]. Неспецифічні механізми вродженої імунної системи є визначальною ланкою захисту макроорганізму від H.pylori [2, 5]. Індуковані H.pylori-інфекцією модуляції експресії генів пов'язані з активацією образ-розпізнавальних рецепторів (pattern-recognition receptors, PRR), насамперед Toll-подібних (Toll-like-receptor, TLR) і NOD-подібних (Nod-like-receptor, NLR, NLR/NOD) рецепторів, а також сигнальних шляхів, що призводять до активації факторів транскрипції (у тому числі ядерного фактора транскрипції kB (nuclear factor kappa-light-chain-enhancer of activated B cells, NF-kB) [14].
Саме адекватна дія PRR обумовлює ефективну ерадикацію H.pylori, репарацію пошкоджених тканин, одужання пацієнта, тоді як дефіцитне збудження PRR може зумовити розвиток хронізації запалення, а надмірне — виникнення автоімунного процесу [1]. Одними з основних складових уродженої імунної відповіді на інфекцію H.pylori, що лежать у молекулярній основі запалення й морфологічних змін епітеліоцитів слизової оболонки, є TLR4, NOD-подібний протеїн субсімейства CARD NLRC1/NOD1, ядерний фактор транскрипції –NF-kB.
У зв’язку з цим розуміння молекулярних механізмів захисту неспецифічного вродженого імунітету, зокрема, ролі TLR4, NLRC1/NOD1, фактора транскрипції NF-kB — найважливіша умова для подальшого удосконалення методів лікування та профілактики хронічних хелікобактер-асоційованих захворювань гастродуоденальної зони травного тракту у дітей.
Метою дослідження було вивчення ролі TLR4, NLRC1/NOD1 та NF-kB у розвитку запалення СОШ у дітей, хворих на хронічні запальні Н.pylori-асоційовані захворювання гастродуоденального відділу травного тракту.
Матеріали та методи дослідження
Під спостереженням перебували 128 дітей віком від 7 до 17 років із хронічними захворюваннями гастродуоденального відділу травного тракту в стадії загострення, які знаходилися на обстеженні й лікуванні в спеціалізованому дитячому гастроентерологічному відділенні Комунального закладу «Дніпропетровська дитяча міська клінічна лікарня № 1» Дніпропетровської обласної ради». Пацієнти залежно від наявності Н.pylori були розділені на дві групи. До першої (основної) групи увійшли 70 (54,7 %) пацієнтів, інфікованих Н.pylori, до другої (порівняння) — діти, у яких Н.pylori був відсутнім, — 58 (45,3 %). Середній вік дітей у першій групі був 14,04 ± 0,34 року, у другій групі — 14,12 ± 0,43 року. Хлопчики в групі дітей, інфікованих Н.pylori, становили 67,1 % (47 дітей), у другій групі — 70,7 % (41); дівчатка — відповідно 32,9 % (23) і 29,3 % (17). Тривалість захворювання (міс.) у групах була відповідно 29,22 ± 3,72 та 25,30 ± 3,25.
За нозологічною формою захворювання розподіл дітей у групах був таким (табл. 1).
Усім дітям проведено фізикальне та загальноклінічне лабораторне обстеження, ендоскопічне дослідження стравоходу, шлунка і дванадцятипалої кишки (ФЕГДС, Pentax FG-15W (Японія)), визначення кислото- та секретоутворюючої функції, УЗД органів черевної порожнини. Для ідентифікації H.pylori використовували: швидкий уреазний тест Хелпіл-тест (ТОВ «АМА», Росія, Санкт-Петербург); дихальний Хелік-тест з використанням індикаторних трубок (ТОВ «АМА», Росія, Санкт-Петербург); визначення в сироватці венозної крові сумарних імуноглобулінів (IgM, IgA, IgG) до Ag СаgА білка H.pylori методом ІФА («ХелікоБест-антитіла», «Вектор-Бест», Росія).
Визначення рівня експресії гена NLRC1/NOD1 проводили методом полімеразної ланцюгової реакції (ПЛР) у реальному часі. Загальну РНК виділяли з біоптатів шлунка за допомогою комплекту реагентів «РИБО-золь-В» (AmpliSens, Росія). Для отримання кДНК у реакції оберненої транскрипції використовували праймер оліго(dT)18 та обернену транскриптазу M-MuLV (SibEnzyme, Росія). Аналізували експресію гена NLRC1/NOD1 методом полімеразної ланцюгової реакції у реальному часі з використанням детектувального ампліфікатора ДТ-322 («ДНК-Технология», Росія) при забарвленні SYBR Green I шляхом відносного аналізу. Реакцію ампліфікації проводили зі специфічними олігонуклеотидними праймерами до кДНК NLRC1/NOD1 людини — NLRC1/NOD1-forw: CTT CTG GTC ACT CAC ATC CGC A, NLRC1/NOD1-rev: TGG GCA TAG CAC AGC ACG AAC. Температура відпалу праймерів 62 °С. Як референтний використовували ген GAPDH. Для аналізу даних застосовували пороговий Сt-метод з розрахунком за формулою: 2-∆Сt (або геометричний Cp-метод з розрахунком за формулою: ∆Сp = Cp (NLRC1/NOD1) — Cp (GAPDH)).
Рівень експресії гена TLR4 визначався методом полімеразної ланцюгової реакції (PCR) у режимі реального часу (Real-time). Виділення загальної РНК з клітин СОШ проводили за допомогою комплекту реагентів «РИБО-золь-В» (AmpliSens, Росія). Для отримання кДНК у реакції оберненої транскрипції використовували праймер оліго(dT)18. Аналізували експресію гена Toll-подібного рецептора TLR4-методом ПЛР у реальному часі при забарвленні SYBR Green I, шляхом відносного кількісного аналізу. Як референтний використовували ген b-актину. Для аналізу даних застосовували відносний Ср-метод із розрахунком за формулою: ∆Ср = Ср (TLR4) – Ср (b-актину).
Для визначення експресії NF-kB СD40+-клітинами суспензію мононуклеарів периферичної крові інкубували з моноклональними антитілами (мкАТ ) до поверхневих антигенів CD40. До 50 мкл суспензії (105 клітин) додавали 5 мкл мкАТ, мічених FITC, проти CD40 (Caltag, США) й інкубували 20 хв при 4 °С. Потім клітини відмивали шляхом центрифугування з 1 мл фосфатно-сольового буфера (ФСБ) при 1500 об/хв протягом 5 хв. Ресуспендовані клітини фіксували розчином (Caltag, США) 20 хв при 4 °С. Пермеабілізацію проводили при мкАТ проти субодиниці р65 молекули NF-kB (BD Biosciences Pharmingen, США) протягом 40 хв при 4 °С. Після одноразового відмивання до ресуспендованих клітин додавали інші мкАТ, мічені РЕ (Caltag, США). Після 20-хвилинної інкубації клітини відмивали, додавали 0,5 мл ФСБ та аналізували проби на проточному цитофлуориметрі EPIX LX-MCL (Beckman Coulter, США), використовуючи програму System IITM software. Для збудження флуоресценції використовували аргоновий лазер із хвилею завдовжки 488 нм. Додатково до флуоресцентних параметрів проводили реєстрацію прямого та бокового світорозсіювання клітин, що дозволяло виключати з аналізу конгломерати клітин, їх уламки.
Визначення експресії NF-kB у лімфоцитах та експресії генів TLR4 і NLRC1/NOD1 у біоптаті СОШ проводилося в НДІ генетичних та імунних основ розвитку патології та фармакогенетики ВДНЗУ «Українська медична стоматологічна академія», м. Полтава.
Дослідження було проведено відповідно до етичних принципів GCP («Якісна клінічна практика») щодо медичного дослідження. На участь у науковому дослідженні, що проводили з дозволу локальної комісії з біоетики ДЗ «ДМА МОЗ України», було отримано інформовану згоду батьків пацієнтів.
Статистичну обробку отриманих результатів проведено за допомогою пакетів комп’ютерних статистичних програм Statgraf, Matstat, Statistica 10,0. При вивченні значущості відмінностей статистичних вибірок використовувались пара- і непараметричні критерії. Вірогідність розходжень при розподілі, відмінному від нормального, оцінювалася за допомогою U-критерію Манна — Уїтні, для даних із нормальним розподілом — t-критерію Стьюдента. Статистично значущими вважали відмінності при р < 0,05.
Результати дослідження та їх обговорення
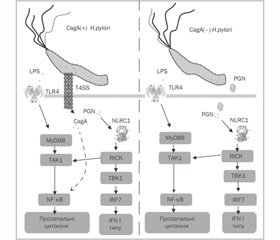
Нами проаналізовано особливості експресії TLR4, NLRC1/NOD1 у біоптаті СОШ і ядерного фактора kB (NF-kB) у лімфоцитах периферичної крові пацієнтів залежно від інфікування Н.pylori (рис. 1).
/76/76.jpg)
Проведені нами молекулярно-генетичні дослідження показали, що у дітей, інфікованих Н.pylori, відзначається підвищення рівня експресії як гена TLR4, так і гена NLRC1/NOD1 (Р = 0,01) у біоптаті СОШ при зниженні активності експресії ядерного фактора NF-kB у лімфоцитах на відміну від пацієнтів, захворювання яких не було пов’язане з інфікуванням Н.pylori (Р = 0,01). За допомогою кореляційного аналізу виявлено прямий взаємозв’язок між експресією генів NLRC1/NOD1 і TLR4 у біоптаті СОШ пацієнтів із хелікобактерною інфекцією (r = 0,36), у пацієнтів із Н.pylori-негативним статусом такий взаємозв’язок практично відсутній (r = 0,14). Н.pylori-індуковане підвищення експресії генів TLR4, NLRC1/NOD1 у СОШ хворих на хронічні гастрити було продемонстровано й іншими авторами [7, 10, 11, 12] Проте у дітей досліджено зміни експресії тільки TLR. Так, Hugo Lagunes-Servin і співавт. [8] показали, що у дітей, інфікованих Н.pylori, спостерігається посилення експресії TLR епітеліоцитів СОШ, яке супроводжується продук–цією прозапальних цитокінів IL-8, IL-10 і TNF-a. Однак малоймовірно, що така виражена прозапальна відповідь епітеліоцитів СОШ може бути обумовлена виключно індукцією TLR лігандами Н.pylori, оскільки мікроорганізми Н.pylori виявляють здатність інгібувати наявність TLR на цитоплазматичній мембрані епітеліоцитів [4].
Виявлене нами підвищення активності експресії гена NLRC1/NOD1 у СОШ дітей, інфікованих Н.pylori, свідчить про те, що H.pylori викликає реакцію неспецифічних механізмів захисту СОШ, використовуючи внутрішньоклітинні цитоплазматичні рецептори прозапальних сигнальних шляхів епітеліоцитів. Можливість проникнення пептидогліканів (PGN) у цитоплазму епітеліоцитів СОШ обумовлена наявністю в H.pylori системи секреції IV типу (T4SS) [9]. Взаємодія PGN із NLRC1/NOD1 індукує продукцію дефензинів і IFN I типу, що зумовлює розвиток захисної Th1-асоційованої відповіді [13]. Одночасне підвищення активності експресії мембранних TLR4, що беруть участь у розпізнаванні LPS, і цитоплазматичних NLRC1/NOD1, що взаємодіють із PGN збудника, які проникли в цитоплазму епітеліоцитів, передбачає необхідність їх синергічного впливу на прозапальні внутрішньоклітинні сигнальні шляхи і, можливо, наявність додаткових альтернативних шляхів для кожного типу образ-розпізнавальних рецепторів.
Нами встановлено, що у дітей високий рівень експресії як гена TLR4 (рівень активності 1,9–2,8), так і гена NLRC1/NOD1 (рівень активності ≥ 4,2) у біоптаті СОШ асоційований з ризиком розвитку ускладненого перебігу хронічної гастродуоденальної патології (ВР = 2,6; ДК = 4,2 і ВР = 3,8; ДК = 5,8 відповідно). Враховуючи той факт, що TLR4 і NLRC1/NOD1 пов'язані з прозапальними внутрішньоклітинними сигнальними каскадами, підвищення активності їх експресії можна вважати предиктором ураження СОШ і ранньою прогностичною ознакою несприятливого перебігу Н.pylori-асоційованого запалення гастродуоденального відділу травного тракту.
Особливий патогенетичний інтерес становить зафіксований нами вірогідно нижчий рівень експресії фактора транскрипції NF-kB у лімфоцитах периферичної крові пацієнтів, інфікованих Н.pylori, ніж у дітей, не інфікованих Н.pylori, при, згідно з даними ендоскопічного дослідження, візуально порівнянному ступені запального ураження СОШ. Цілком імовірно, що активність фактора транскрипції NF-kB інгібується деякими продуктами Н.pylori для створення умов персистенції збудника.
Так само нами проведено дослідження експресії компонентів неспецифічних механізмів захисту залежно від наявності фактора цитотоксичності CagA у причинно-значущих штамів Н.pylori. Характеристика експресії TLR4, NLRC1/NOD1 у біоптаті СОШ і NF-kB у лімфоцитах периферичної крові пацієнтів, інфікованих цитотоксичними CagА-позитивними штамами Н.pylori, наведена в табл. 2.
Таким чином, враховуючи особливості розвитку запального процесу слизової оболонки при інфікуванні CagA(+)-штамами Н.pylori, ми вважаємо, що проведення ерадикаційної терапії необхідно поєднувати з призначенням препаратів, які пригнічують активність молекулярних компонентів неспецифічних механізмів захисту і мають прозапальну активність.
Висновки
1. У пацієнтів, інфікованих Н.pylori, відзначається підвищення рівня експресії як гена TLR4, так і гена NLRC1/NOD1 у біоптаті СОШ при зниженні активності експресії ядерного фактора NF-kB у лімфоцитах на відміну від дітей, захворювання яких не було пов’язане з інфікуванням Н.pylori.
2. Зміни активності компонентів неспецифічного захисту, таких як експресія TLR4, NLRC1/NOD1 і NF-kB, у дітей із хронічною патологією гастродуоденального відділу травного тракту при інфікуванні цитотоксичними CagA(+)-штамами Н.pylori відрізнялися від їхньої реакції при інфікуванні нецитотоксичними CagA(–)-штамами Н.pylori тільки вірогідно більш низькою активністю фактора транс–крипції NF-kB у лімфоцитах периферичної крові.
3. Запропоновано модель участі неспецифічних механізмів уродженого імунітету в розвитку хронічного запального процесу слизової оболонки гастродуоденального відділу травного тракту у дітей при інфікуванні CagA(+)- і CagA(–)-штамами Н.pylori.
1. Абатуров А.Е., Волосовец А.П., Юлиш Е.И. Инициация воспалительного процесса при вирусных и бактериальных заболеваниях, возможности и перспективы медикаментозного управления. — Харьков: Новое слово, 2011. — 344 с.
2. Every A.L. Key host-pathogen interactions for designing novel interventions against Helicobacter pylori // Trends Microbiol. — 2013. — 21(5). — 253-9. doi:10.1016/j.tim.2013.02.007.
3. Ferrand J., Ferrero R.L. Recognition of Extracellular Bacteria by NLRs and Its Role in the Development of Adaptive Immunity // Front Immunol. — 2013. — 4. — 344. doi:10.3389/fimmu.2013.00344.
4. Ferrero R.L. Innate immune recognition of the extracellular mucosal pathogen, Helicobacter pylori // Mol. Immunol. — 2005. — 42(8). — 879-85. doi.org/10.1016/j.molimm.2004.12.001.
5. He C. Helicobacter pylori-related host gene polymorphisms associated with susceptibility of gastric carcinogenesis: a two-stage case-control study in Chinese / C. He, H. Tu, L. Sun, Q. Xu, P. Li, Y. Gong, N. Dong, Y. Yuan // Carcinogenesis. — 2013. — 34(7). — 1450-7. doi:10.1093/carcin/bgt079.
6. Ihan A., Pinchuk I.V., Beswick E.J. Inflammation, immunity, and vaccines for Helicobacter pylori infection // Helicobacter. — 2012. — 17 Suppl. 1. — 16-21. doi: 10.1111/j.1523-5378.2012.00977.x.
7. Kim E.J. Association between genetic polymorphisms of NOD 1 and Helicobacter pylori-induced gastric mucosal inflammation in healthy Korean population / E.J. Kim, J.R. Lee, W.C. Chung, S.H. Jung, H.J. Sung, Y.W. Lee, Y.S. Oh, S.B. Kim, C.N. Paik, K.M. Lee, S.J. Noh // Helicobacter. — 2013. — 18(2). — 143-50. doi: 10.1111/hel.12020.
8. Lagunes-Servin H. Toll-like receptors and cytokines are upregulated during Helicobacter pylori infection in children / H. Lagunes-Servin, J. Torres, C. Maldonado-Bernal, M. Pérez-Rodríguez, S. Huerta-Yépez, A. Madrazo de la Garza, L. Muñoz-Pérez, L. Flores-Luna, G. Ramón-García, M. Camorlinga-Ponce // Helicobacter. — 2013. — 18(6). — 423-32. doi: 10.1111/hel.12067.
9. Posselt G., Backert S., Wessler S. The functional interplay of Helicobacter pylori factors with gastric epithelial cells induces a multi-step process in pathogenesis // Cell Commun Signal. — 2013. — 11. — 77. doi: 10.1186/1478-811X-11-77.
10. Sánchez-Zauco N.A., Giono-Cerezo S., Maldonado-Bernal C. Receptores tipo Toll, patogénesis y respuesta inmune a Helicobacter pylori // Salud. Publica Mex. — 2010. — 52(5). — 447-54. doi.org/10.1590/S0036-36342010000500012.
11. Schmausser B. Expression and subcellular distribution of toll-like receptors TLR4, TLR5 and TLR9 on the gastric epithelium in Helicobacter pylori infection / B. Schmausser, M. Andrulis, S. Endrich, S.K. Lee, C. Josenhans, H.K. Müller-Hermelink, M. Eck // Clin. Exp. Immunol. — 2004. — 136(3). — 521-6. doi:10.1111/j.1365-2249.2004.02464.x.
12. Smith M.F. Toll-like receptor (TLR) 2 and TLR5, but not TLR4, are required for Helicobacter pylori-induced NF-kappa B activation and chemokine expression by epithelial cells / M.F. Smith Jr, A. Mitchell, G. Li, S. Ding, A.M. Fitzmaurice, K. Ryan, S. Crowe, J.B. Goldberg // J. Biol. Chem. — 2003 Aug 29. — 278(35). — 32552-60.
13. Watanabe T. Activation of type I IFN signaling by NLRC1/NOD1 mediates mucosal host defense against Helicobacter pylori infection / T. Watanabe, N. Asano, A. Kitani, I.J. Fuss, T. Chiba, W. Strober // Gut Microbes. — 2011. — 2(1). — 61-5. doi:10.4161/gmic.2.1.15162.
14. Yang Z.M., Chen W.W., Wang Y.F. Gene expression profiling in gastric mucosa from Helicobacter pylori-infected and uninfected patients undergoing chronic superficial gastritis // PLoS One. — 2012. — 7(3). — e33030. doi:10.1371/journal.pone.0033030.

/75/75.jpg)
/77/77.jpg)
/78/78.jpg)