Журнал «» 3 (35) 2014
Вернуться к номеру
Випадок реноваскулярної артеріальної гіпертензії, зумовленої фібром’язовою дисплазією ниркових артерій
Авторы: Радченко Г.Д., Крушинська Н.А., Сіренко Ю.М., Граніч В.М. - ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України, м. Київ
Рубрики: Семейная медицина/Терапия, Кардиология
Разделы: Справочник специалиста
Версия для печати
Серед причин реноваскулярної артеріальної гіпертензії друге місце за частотою посідає фібром’язова дисплазія ниркових артерій — 10–15 % випадків. Наводимо власне спостереження випадку вазоренальної артеріальної гіпертензії у жінки 25 років, спричиненої фібром’язовою дисплазією ниркових артерій.
Среди причин вазоренальной артериальной гипертензии фибромышечная дисплазия почечных артерий занимает второе место по частоте — 10–15 % случаев. Приводим собственное наблюдение случая вазоренальной артериальной гипертензии у женщины 25 лет, вызванной фибромышечной дисплазией почечных артерий.
Among the causes of renovascular hypertension, fibromuscular dysplasia of the renal arteries has the second highest rate — 10–15 % of cases. We describe our own case report of renovascular hypertension in 25-year-old women caused by renal artery stenosis associated with fibromuscular dysplasia.
реноваскулярна артеріальна гіпертензія, фібром’язова дисплазія, клінічний випадок.
реноваскулярная артериальная гипертензия, фибромышечная дисплазия, клинический случай.
renovascular hypertension, fibromuscular dysplasia, clinical case.
Статья опубликована на с. 12-18
За статистикою, пацієнти зі вторинною артеріальною гіпертензією (АГ) становлять 5–10 % від усіх хворих із підвищеним артеріальним тиском (АТ). Поширеність реноваскулярної АГ в популяції хворих з АГ становить 1–5 %. Серед осіб із рівнем діастолічного АТ ≥ 125 мм рт.ст. і наявністю ретинопатії ІІІ–ІV ступеня реноваскулярна АГ може виявлятися у 30 % випадків. Вважається, що ця патологія розвивається за наявності функціонально значимого стенозу ниркової артерії, при виникненні ішемії нирок. Гемодинамічно значимим вважають стеноз, при якому зменшення просвіту артерії в ділянці ураження сягає 50–70 %. До формування реноваскулярної АГ призводять такі захворювання, як:
— атеросклероз (поширеність росте з віком);
— фібром’язова дисплазія (ФМД);
— системні васкуліти (артеріїт Такаясу, вузликовий поліартеріїт);
— аневризми ниркових артерій;
— тиск ззовні (кістами, пухлинами, гематомами, при ретроперитонеальному фіброзі та ін.);
— тромбози при антипроліферативному синдромі, пухлинах та ін.;
— патологічно рухомі нирки;
— гіпоплазія головних ниркових артерій;
— пошкодження судин нирок (травми при літотрипсії, трансплантації нирки, опромінення та ін.);
— артеріовенозні мальформації або фістули та деякі інші рідкісні причини.
Фібром’язова дисплазія — неатеросклеротичне незапальне стенозуюче захворювання невідомої етіології (у 10 % хворих констатують генетичну схильність з автосомно-домінантним типом успадкування), що характеризується фіброзуванням і/або надлишковою проліферацією клітин артеріальної стінки. Звуження просвіту судини відбувається в результаті концентричного або ексцентричного відкладання колагену в просвіті судини. На додаток до звужень у судинній стінці утворюються слабкі місця, в яких виявляють аневризматичні розширення з можливим їх розшаруванням. Найчастіше вражаються ниркові (до 75 % усіх випадків ФМД), сонні та хребтові артерії, рідше — мезентеріальні, плечові, клубові. Близько 1/3 осіб із ФМД мають ураження більше ніж одного судинного басейну. Зміни венозних та лімфатичних судин при ФМД відсутні. Поширеність АГ при ФМД становить 10–15 %. Середній вік встановлення діагнозу ФМД, за даними реєстру США, становить близько 50 років, але часто (особливо за наявності раннього початку АГ) діагноз встановлюють у молодих дорослих чи у дітей. На ФМД частіше хворіють молоді жінки. Клінічна картина варіабельна: у частини пацієнтів ФМД має безсимптомний перебіг, в інших випадках симптоматика зумовлюється локалізацією й особливостями судинного ураження. В осіб із ФМД ниркових артерій стенози частіше локалізуються в середніх і дистальних відділах, прогресування відзначається у 30–60 % пацієнтів упродовж 5 років.
Першими цю хворобу описали Leadbetter та Burkland у 1938 р., які спостерігали 5-річного хлопчика з гіпертензією й атрофією правої нирки. Патологічні зміни виявилися стенозом ниркових артерій унаслідок «відкладання субінтимальних мас у гладеньком’язових клітинах» із потоншенням артеріальної стінки та дистальними ушкодженнями. Термін «фібром’язова гіперплазія» запропонували в 1958 році McCormac і співавт., які протягом 20 років роботи спостерігали 4 випадки фібром’язової гіперплазії і вперше докладно описали суть патологічних змін. Тільки після введення ангіографії у практику цю хворобу стали діагностувати значно частіше.
Наводимо власне спостереження випадку вторинної (реноваскулярної) артеріальної гіпертензії, викликаної стенозом ниркової артерії при фібром’язовій дисплазії.
Хвора О., 25 років, звернулась в ДУ «ННЦ «Інститут кардіології ім. акад. М.Д.Стражеска» НАМН України зі скаргами на підвищення артеріального тиску до 230/150 мм рт.ст.
Про підвищений АТ знає з 11-річного віку, коли при профілактичному огляді було виявлено АТ 180/100 мм рт.ст. При повторних обстеженнях фіксували цифри АТ 180–190/100–110 мм рт.ст. Хвора почувалась задовільно, суб’єктивних скарг не пред’являла, підвищення АТ не відчувала. У підлітковому віці пройшла загальноклінічне обстеження в педіатричному відділенні за місцем проживання, після чого хворій було рекомендовано дообстеження з проведенням ангіографії ниркових судин із контрастуванням, але воно не було виконано.
З анамнезу життя: тубінфікування у віці 7 років, проводилась хіміотерапія ізоніазидом. В підлітковому віці відзначався епізод захворювання нирок, лікувалась фурагіном. Близькі родичі пацієнтки підвищеного АТ не мають. Менструальний цикл регулярний; 2 вагітності було штучно перервано через високий АТ.
24 січня 2014 року на тлі підвищення АТ до 230/150 мм рт.ст. відчула головний біль, нудоту. Каретою швидкої допомоги доставлена в терапевтичне відділення міської лікарні, де хворій було надано невідкладну допомогу, АТ знижено до 170/130 мм рт.ст., але, незважаючи на призначену антигіпертензивну терапію, у наступні дні АТ тримався на рівні 200–210/140–150 мм рт.ст. У зв’язку з неефективністю антигіпертензивної терапії хвору було направлено в ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України.
При госпіталізації: пацієнтка нормостенічної будови тіла, шкірні покриви тілесного кольору. М’язова система розвинена задовільно, кісткова система — без деформацій. Набряків немає. АТ — 215/150 мм рт.ст., гомілково–плечовий індекс праворуч — 1,21, ліворуч — 1,13. Частота пульсу — 88 ударів за хвилину, ритмічний. Верхівковий поштовх — розлитий, в V міжребер’ї. Межі серця дещо розширені вліво. Аускультативно: тони серця ясні, ритмічні, систолічний шум у точці Боткіна. Дихання везикулярне. Живіт м’який, безболісний при пальпації, печінка — по краю реберної дуги.
При загальноклінічному аналізі крові: лейкоцити — 4,9 · 109/л, лімфоцити — 30,5 %, моноцити — 14,8 %, гранулоцити — 54,7 %, еритроцити — 4,69 · 1012/л, Hb — 161 г/л, Тц — 379 · 109/л, ШОЕ — 6 мм/год.
При біохімічному дослідженні крові: K — 4,65 ммоль/л, Na — 143 ммоль/л, білірубін загальний — 15 мкмоль/л, креатинін — 74 мкмоль/л, швидкість клубочкової фільтрації, розрахована за формулою CKD–EPI, — 97 мл/хв, сечова кислота — 236 ммоль/л, АСТ — 19 од/л, глюкоза — 5,1 ммоль/л, загальний холестерин — 5 ммоль/л, тригліцериди — 0,94 ммоль/л.
При загальному аналізі сечі: колір солом’яно-жовтий, прозора, реакція — 5,0, питома вага — 1025; білок, глюкоза не виявлені, лейкоцити — 1–2 у п/з, клітини епітелію в незначній кількості. В аналізі сечі за Нечипоренком: лейкоцити — 0,50 · 106/л.
Ультразвукове дослідження органів черевної порожнини: печінка — права частка 120 мм, ліва частка 80 мм, паренхіма нормальної ехогенності. Селезінка 97 x 45 мм. Підшлункова залоза без особливостей; ліва нирка 100 x 43 мм, паренхіма 11 мм; права нирка 120 x 52 мм, паренхіма 13 мм. Звертає на себе увагу значне зменшення розмірів лівої нирки (різниця в розмірах нирок 2 см).
Офтальмоскопія: артерії звужені, нерівномірні, напружені, звиті. Вени звужені, звиті. Висновок: гіпертонічна ангіопатія сітківки з частковим порушенням мікроциркуляції крові (салюс ІІ–ІІІ).
Ехокардіографічні дані: аорта — 28 мм, ліве передсердя — 31 мм, кінцево-систолічний розмір — 32 мм, кінцево-діастолічний розмір — 47,5 мм, міжшлуночкова перегородка — 12,5 мм, задня стінка лівого шлуночка — 12 мм, кінцево-систолічний об’єм — 41 мл, кінцево-діастолічний об’єм — 102,4 мл, фракція викиду — 60 %, індекс маси міокарда лівого шлуночка — 149 г/м2. Гемодинамічно незначимий пролапс передньої стулки мітрального клапана.
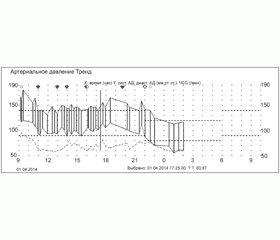
Дані добового моніторування артеріального тиску (ДМАТ) наведено на рис. 1.
Як видно на рис. 1, протягом періоду дослідження реєструються високі цифри АТ як у денний, так і в нічний час із середніми значеннями систолічного АТ (САТ) — 161,73 мм рт.ст. та діастолічного АТ (ДАТ) — 111,30 мм рт.ст., із нічним зниженням на фоні одноразового прийому каптопресу ввечері.
Враховуючи ранній розвиток артеріальної гіпертензії, високий рівень АТ, наявність ураження органів-мішеней (гіпертонічна ангіопатія сітківки, гіпертрофія лівого шлуночка), у хворої було запідозрено вторинну артеріальну гіпертензію. З метою виявлення можливої причини підвищення АТ було проведено ряд досліджень:
— тиреотропний гормон 0,627 мкОд/мл (норма 0,4–4,0 мкОд/мл);
— метанефрини загальні (сеча) 142,3 мкг/24 год (норма 25–312 мкг/24 год);
— ренін активний 48,70 нг/л (норма 7,54–42,3 — вертикальне положення, 4,66–31,9 — лежаче положення), альдостерон 30,4 нг/дл (норма 7–30 нг/дл), альдостерон-ренінове співвідношення 0,63 (норма 3,8–7,7);
— сомнологічне обстеження: АНІ (індекс апное-гіпопное) 3,4/год (норма < 5/год).
Дані дуплексного сканування ниркових артерій наведено у табл. 1.
Як видно з табл. 1, при дуплексному скануванні ниркових артерій спостерігалося значне зниження кровотоку по лівій нирковій артерії, про що свідчить зменшення показників індексу резистивності на 19 (головна ниркова артерія) та 14 (сегментарна артерія) лівої ниркової артерії порівняно з правою. Індекс резистивності — показник, який дозволяє непрямо судити про величину периферичного опору. У нормі для ниркових артерій він становить 60–100. Зменшення цього показника вказує на підвищення периферичного опору і, відповідно, звуження просвіту судини. Визначення різниці індексу резистивності в обох нирках (граничне значення різниці становить 5) є максимально ефективним при діагностиці стенозу > 50 % [5]. Згідно з Рекомендаціями Американської колегії кардіологів/Американської асоціації серця з нагляду за пацієнтами з ураженням периферичних артерій (2011 р.), дуплексна ультрасонографія ниркових судин — це скринінговий тест, що дозволяє оцінити розміри нирок, функціональний резерв кровотоку й розрахувати резистивний індекс; при оцінці гемодинамічно значимого (суттєвого) стенозу чутливість методу становить 92 %, специфічність — 85 %.
Враховуючи відсутність даних за ендокринологічну патологію, дані УЗД нирок (зменшення розмірів лівої нирки) та дуплексного сканування ниркових артерій (ознаки звуження лівої ниркової артерії), у нашої хворої була запідозрена реноваскулярна АГ.
Згідно з чинними Рекомендаціями Американської колегії кардіологів/Американської асоціації серця з нагляду за пацієнтами з ураженням периферичних артерій (2011 р.), при підозрі на вазоренальну АГ необхідно виконати такі обстеження:
— комп’ютерно-томографічна ангіографія — скринінговий тест; зважаючи на ризик розвитку контраст-індукованої нефропатії (особливо при значному зниженні функції нирок), проведення його потребує обережності; чутливість для діагностики стенозу ниркових артерій — до 94 %, специфічність — 60–90 %;
— магнітно-резонансна ангіографія — скринінговий тест; застосовується з обережністю з огляду на ризик нефротоксичної дії гадоліній-утримуючого контрасту у хворих із помірним/тяжким зниженням функції нирок; протипоказанням для застосування є імплантовані прилади різного роду (штучні водії ритму, кардіостимулятори та ін.); чутливість та специфічність в діагностиці стенозу ниркових артерій досягають 90–100 %;
— за недостатньої інформативності перелічених неінвазивних тестів та високої ймовірності стенозу — катетерна ангіографія ниркових артерій.
Не рекомендується використовувати як скринінгові тести для діагностики стенозу ниркових артерій:
— каптоприловий тест із скануванням нирок;
— селективне визначення активності реніну в крові, що відтікає від ниркових вен;
— активність реніну плазми;
— каптоприловий тест з оцінкою активності реніну плазми після прийому каптоприлу.
Обстеження з метою виявлення клінічно значимого стенозу ниркових артерій показане в першу чергу таким категоріям хворих на АГ:
— розвиток АГ у віці до 30 років;
— розвиток тяжкої АГ, що визначають як рівні систолічного АТ > 160 мм рт.ст. та/або діастолічного АТ > 110 мм рт.ст. у віці 55 років і більше;
— раптове та стійке погіршення контролю АТ, який раніше добре піддавався лікуванню;
— резистентна АГ;
— злоякісна АГ;
— значне погіршення функції нирок на тлі прийому інгібіторів АПФ або сартанів;
— зменшення розміру нирки (атрофія), а також різниця в розмірах нирок, що перевищує 1,5 см;
— епізоди раптового набряку легенів неясної етіології, особливо у хворого зі зниженою функцією нирок.
Пацієнтам зі встановленим діагнозом ФМД однієї локалізації рекомендується неінвазивне обстеження інших судинних басейнів на предмет мультифокального артеріального ураження.
Для верифікації діагнозу нашій хворій було проведено спіральну комп’ютерну томографію органів черевної порожнини з контрастуванням ниркових артерій, за допомогою якої виявлено аномалію розвитку лівої ниркової артерії. Результати наведено на рис. 2.
Така ангіографічна картина, що нагадує чотки або намисто з перлів, є типовою для ФМД.
На підставі отриманих даних хворій було встановлено клінічний діагноз: вторинна (реноваскулярна) артеріальна гіпертензія ІІ ст., 3-го ст. Стеноз лівої ниркової артерії (фібром’язова дисплазія). Гіпертрофія лівого шлуночка. СН-0. Ризик 3. Гіпертонічна ангіопатія сітківки.
Згідно зі статистичними даними, природний перебіг ФМД переважно доброякісний. Достатньо довго захворювання перебігає безсимптомно. Типовим проявом хвороби є розвиток реноваскулярної АГ. У подальшому в клінічній картині домінують симптоми АГ, а також її ускладнень. Рідко першим виявленим симптомом може бути прояв ниркової недостатності. При цьому до даного стану може призвести неправильний прийом деяких лікарських препаратів: інгібіторів АПФ, антагоністів ангіотензинових рецепторів, стероїдних та нестероїдних протизапальних препаратів.
Лікування патології ниркових артерій повинно бути спрямоване на контроль АТ і збереження функції нирок. Воно включає медикаментозне лікування та хірургічне проведення реваскуляризації. При медикаментозному лікуванні слід пам’ятати, що інгібітори АПФ та блокатори рецепторів ангіотензину ІІ протипоказані за наявності двосторонніх стенозів ниркових артерій або при виникненні одностороннього стенозу ниркової артерії єдиної функціонуючої нирки. Проте в інших випадках наявності стенозу ниркових артерій інгібітори АПФ і блокатори кальцієвих каналів ефективні в лікуванні АГ і дозволяють уповільнити прогресування хвороби нирок. Більшість пацієнтів із гемодинамічно значимими стенозами добре переносять блокатори ренін-ангіотензинової системи. Але інгібітори АПФ можуть зменшити капілярний гідростатичний тиск у клубочках настільки, щоб викликати транзиторне зниження ШКФ і підвищення креатиніну сироватки крові, що вимагає обережності і ретельного спостереження. Існують докази і того, що тіазиди, гідралазин і бета-адреноблокатори також ефективні в досягненні цільового рівня АТ в осіб зі стенозом ниркових артерій.
Рішення про необхідність проведення реваскуляризації повинно базуватись на індивідуальних показниках пацієнта, таких як вік, супутні захворювання, рівень контролю АТ та функція нирок. Рекомендованою тактикою в разі необхідності при фібром’язовій дисплазії є балонна ангіопластика (розширення стенозованої ділянки ниркової артерії за допомогою дилатаційних балонних катетерів) з постановкою стента. Досі не було обрано відповідної лікувальної тактики стентування при стенозі ниркових артерій у пацієнтів з ФМД. Балонна ангіопластика, звичайні стенти, покриті стенти та елютинг-стенти все ще досліджуються. Переваги даного методу — низька травматичність, менша тривалість перебування хворого у стаціонарі, можливість використання у тяжкого контингенту хворих. Питання про хірургічну реваскуляризацію слід розглядати у пацієнтів зі складною анатомією ниркових артерій або у разі попередньої невдалої ендоваскулярної процедури.
Згідно зі статистичними даними, при своєчасній діагностиці виконання інтервенційного або хірургічного лікування призводить до нормалізації АТ приблизно у 50 % хворих, покращення перебігу АГ — у 40 % хворих та є неефективною у 10 % хворих. Таким чином, більшість хворих має сприятливий прогноз, а близько 50 % таких хворих можуть повністю відмовитись від прийому антигіпертензивних препаратів.
Наша хвора була направлена на консультацію до судинного хірурга, їй було рекомендовано проведення ангіопластики. З метою передопераційної підготовки нами призначено антигіпертензивну терапію: бісопролол 5 мг вранці, амлодипін 10 мг ввечері, арифон ретард 1,5 мг вранці. На фоні прийому препаратів офісний АТ знизився до 150/100–160/100 мм рт.ст. Незважаючи на однобічний стеноз ниркової артерії, хворій не призначались блокатори РААС через бажання завагітніти в найближчому майбутньому.
Хворій було успішно виконано балонну ангіопластику лівої ниркової артерії.
Пацієнтка була нами оглянута на 5-й день та через 4 тижні після інтервенційного втручання. Офісний АТ на 5-й день після ангіопластики становив 140/100 мм рт.ст. (на фоні прийому 5 мг бісопрололу на добу). У хворої не відбулось повної нормалізації офісного АТ, незважаючи на те, що показники дуплексного сканування ниркових артерій значно покращились, що свідчить про ефективність виконаної ангіопластики в усуненні стенозу (табл. 2).
Як видно з табл. 2, при повторному дуплексному скануванні ниркових артерій відзначається підвищення індексу резистивності лівої ниркової артерії, що свідчить про зменшення периферичного опору і покращення кровопостачання нирки.
Через 4 тижні після ангіопластики проведене повторне ДМАТ, що здійснювалось на фоні прийому 5 мг бісопрололу на добу. Дані ДМАТ наведено на рис. 3 та в табл. 3, з них видно, що повної нормалізації АТ не відбулося і необхідно посилити антигіпертензивну терапію, що і було зроблено нами: пацієнтці рекомендовано до бісопрололу додати амлодипін 5 мг на добу. Вибір препаратів обумовлено тим, що найближчому майбутньому (але не раніше ніж через рік після проведення ангіопластики) пацієнтка мала намір завагітніти, що виключає прийом блокаторів ренін-ангіотензинової системи та діуретиків.
Ми продовжуємо спостерігати хвору. За результатами повторного ДМАТ пацієнтці скориговано антигіпертензивну терапію, призначено: бісопролол 5 мг вранці, амлодипін 5 мг ввечері. Через 6 та 12 місяців після ангіопластики планується повторне дуплексне сканування ниркових артерій, через 12 місяців — повторне ангіографічне дослідження.
Нормалізація АТ або покращення перебігу артеріальної гіпертензії впродовж року після ангіопластики дозволить вирішувати питання планування, визначення тактики ведення вагітності та пологів під наглядом гінеколога, кардіолога (спеціаліста з артеріальних гіпертензій) та за потреби судинного хірурга.
Особливості даного випадку
1. При стійкому підвищенні АТ в осіб молодого віку, особливо жіночої статі, завжди потрібно думати про наявність реноваскулярної АГ і проводити діагностичні процедури з метою її вчасної діагностики.
2. У нашої хворої мало місце підвищення АТ до високого рівня з дитячого віку, пацієнтка знаходилась під диспансерним наглядом педіатра та кардіолога за місцем проживання, але жоден лікар не наполіг на обстеженні дівчинки для виявлення причини АГ, що свідчить про наявність лікарської інерції. АГ у пацієнтки не супроводжувалась суб’єктивними клінічними проявами до 25-річного віку, але спричинила значне ураження органів-мішеней (ретинопатія, гіпертрофія лівого шлуночка), чому можна було запобігти при своєчасній діагностиці причини та лікуванні АГ.
3. Анатомічні особливості стенозованої артерії дозволити провести балонну ангіопластику ураженої артерії, що призвело до зниження офісного АТ та дозволило зменшити кількість антигіпертензивних препаратів і їх дози. Але повного видужання не відбулось, отриманий антигіпертензивний ефект є недостатнім, можливо, через пізню діагностику та склеротичні зміни судин при тривалому існуванні високого АТ.
Надалі ми будемо інформувати наших читачів про подальшу долю пацієнтки в міру надходження інформації.
1. Настанова та клінічний протокол надання медичної допомоги «Артеріальна гіпертензія», затверджений Наказом МОЗ № 384 від 24.05.2012. — К., 2012. — 108 с.
2. Клінічні рекомендації з артеріальної гіпертензії Європейського товариства гіпертензії (ESH) та Європейського товариства кардіологів (ESC) 2013 року // Артериальная гипертензия. — 2013. — № 4(30). — С. 61–157.
3. Кузик Ю.І. Фібромускулярна дисплазія судин // Серце і судини. — 2006. — 4. — С. 101–106.
4. Сіренко Ю.М. Гіпертонічна хвороба і артеріальні гіпертензії. — Донецьк, 2009. — 288 с.
5. Ультразвуковая диагностика (практическое руководство) / Под ред. В.В. Митькова. — М., 1999.
6. Функція нирок у хворих з артеріальною гіпертензією: методи дослідження та стратегія корекції порушень. Методичні рекомендації МОЗ та АМН України. — К., 2006. — 38 с.
7. ACC/AHA 2005 Practice Guidelines for the Management of Patients With Peripheral Arterial Disease (Lower Extremity, Renal, Mesenteric, and Abdominal Aortic). A Collaborative Report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines(Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease) // Circulation. — 2006. — Vol. 113. — P. 91–107.
8. Canzanello V.J. Medical management of renovascular hypertension // Secondary Hypertension / Ed. by G.A. Mansoor. — New Jersy: Humana Press, Totowa, 2004. — P. 91–107.
9. Leadbetter W.F., Burkland C.E. Hypertension in unilateral renal disease // J. Urol. — 1938. — Vol. 39. — P. 611–626.
10. Mansoor G. Interventional treatments for renal artery stenosis // Secondary Hypertension / Ed. by G.A. Mansoor. — New Jersy: Humana Press, Totowa, 2004. — P. 83–90.
11. McCormac L.J., Hazard J.B., Poutasse E.F. Obstructive lesions of the renal artery associated with remediable hypertension // Am. J. Pathol. — 1958. — Vol. 34. — P. 582–582.
12. Meyers K., Sharma N. Fibromuscular dysplasia in children and adolescents // Cath. Lab. Digest. — 2007. — Vol. 15. — P. 11–13.
13. National Kidney Foundation. Kidney Disease Outcomes Initiative. K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease // Am. J. Kidney Dis. — 2004. — Vol. 43. — P. 1–290.
14. Stenley J.C., Ernst C.B., Fry W.J. Renovascular hypertension. — Philadelphia; London; Toronto; Mexico; Rio de Janeiro; Sydney; Tokyo: Saunders W.B. Co., 1984. — 384 р.
15. Tavarajah S., White W. Diagnostic evaluation for patients with endovascular hypertension // Secondary Hypertension / Ed. by G.A. Mansoor // New Jersy: Humana Press, Totowa, 2004. — P. 63–82.
16. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. US Department of Health and Human Service // NIH Publication No. 03–5233. — 2003. — 34 р.
17. WHO — ISH guidelines for the management of hypertension // J. Hypertension. — 1999. — Vol. 11. — P. 905–916.

/13/13.jpg)
/14/14.jpg)
/15/15.jpg)
/15/15_2.jpg)
/16/16.jpg)
/16/16_2.jpg)